El signo del halo consiste en un área circular de atenuación en vidrio deslustrado que rodea un nódulo pulmonar. Aunque la causa más frecuente es la hemorragia pulmonar, dicho signo se asocia a numerosas entidades, que corresponden a diferentes procesos anatomopatológicos: nódulos hemorrágicos de etiología infecciosa (aspergilosis invasiva —la causa más frecuente de nódulos pulmonares con halo—, mucormicosis, candidiasis, tuberculosis, neumonías víricas), nódulos hemorrágicos de etiología no infecciosa (gra-nulomatosis de Wegener, sarcoma de Kaposi, metástasis hemorrágicas), nódulos con halo debido a infiltración de células neoplásicas (carcinoma bronquioloalveolar, linfoma, metástasis con crecimiento tumoral intraalveolar) y nódulos con halo debido a lesiones inflamatorias no hemorrágicas (sarcoidosis, neumonía organizada). Por lo tanto, el diagnóstico debe realizarse integrando todos los hallazgos de la tomografía computarizada de tórax en el contexto clínico del paciente. El objetivo de la presente revisión es describir e ilustrar enfermedades que pueden manifestarse como nódulos pulmonares con el signo del halo, analizando su utilidad diagnóstica y discutiendo su correlación radiopatológica.
The halo sign is a circular area of ground-glass attenuation that is seen around pulmonary nodules at computed tomography (CT). Although the sign is most often an indication of pulmonary hemorrhage, it may also accompany other lesions associated with different disease processes. Examples are hemorrhagic nodules of infectious origin (mucormycosis, candidiasis, tuberculosis, viral pneumonia, and invasive aspergillosis—the last being the most common cause of the CT halo sign); hemorrhagic nodules of noninfectious origin (Wegener granulomatosis, Kaposi sarcoma, and hemorrhagic metastases); tumor cell infiltration (bronchioloalveolar carcinoma, lymphoma, and metastasis with intra-alveolar tumor growth); and nonhemorrhagic lesions (sarcoidosis and organizing pneumonia). Diagnosis must therefore be based on careful consideration of all the CT chest findings within the context of the patient’s clinical state. The aim of this review was to describe and illustrate different disease processes that appear as a halo sign on CT scans, to analyze the value of this diagnostic tool, and to assess its correlation with pathology findings.
El signo del halo en la tomografía computarizada (TC) de tórax consiste en la presencia de un área de atenuación en vidrio deslustrado que rodea un nódulo o masa pulmonar central de atenuación en partes blandas. Kuhlman et al1 lo describieron por primera vez en pacientes con nódulos hemorrágicos y aspergilosis pulmonar invasiva. Tras esta primera descripción se pensó que el signo del halo representaba siempre la presencia de nódulos pulmonares hemorrágicos2. Los mecanismos fisiopatológicos por los que un nódulo pulmonar puede presentar una hemorragia dependen de la causa subyacente, pero entre ellos figuran vasculitis, fragilidad de tejido neovascular, infarto pulmonar hemorrágico, necrosis, fístula broncoarterial e incluso tras biopsia transbronquial2-4. Sin embargo, numerosos autores han comprobado que, aunque más raramente, el signo del halo puede estar asociado a múltiples procesos anatomopatológicos, como infiltración por células tumorales o inflamatorias sin hemorragia (tabla I).
Etiologías de nódulos pulmonares con signo del halo
| Infecciones |
| Hongos: aspergilosis invasiva, Mucor, Candida, Cryptococcus, Coccidioides |
| Virus: herpes simple, citomegalovirus, varicela zóster, mixovirus |
| Bacterias: neumonías bacterianas de resolución lenta, fiebre Q, Actinomyces |
| Micobacterias: Mycobacterium tuberculosis, Mycobacterium avium intracellulare |
| Parásitos: Paragonimus, Schistosoma |
| Neoplasias |
| Carcinoma bronquioloalveolar |
| Enfermedad linfoproliferativa |
| Metástasis hemorrágicas de angiosarcoma, coriocarcinoma, melanoma, osteosarcoma, carcinoma de células renales |
| Metástasis no hemorrágicas de adenocarcinomas del tubo digestivo, páncreas, pulmón |
| Sarcoma de Kaposi |
| Angiosarcoma primario |
| Enfermedades inflamatorias no infecciosas |
| Granulomatosis de Wegener |
| Sarcoidosis |
| Neumonía organizada |
| Enfermedades eosinofílicas |
| Miscelánea |
| Endometriosis |
| Biopsia transbronquial en trasplante pulmonar |
| Amiloidosis |
| Toxicidad por amiodarona |
El objetivo de esta revisión es describir e ilustrar enfermedades que pueden manifestarse como nódulos pulmonares con el signo del halo en la TC torácica, analizando su utilidad y correlación radiopatológica, básica para su comprensión.
Enfermedades infecciosasLas enfermedades infecciosas son la causa más frecuente del signo del halo en pacientes inmunocomprometidos. En la mayoría de los casos se corresponden con nódulos hemorrágicos, aunque no siempre.
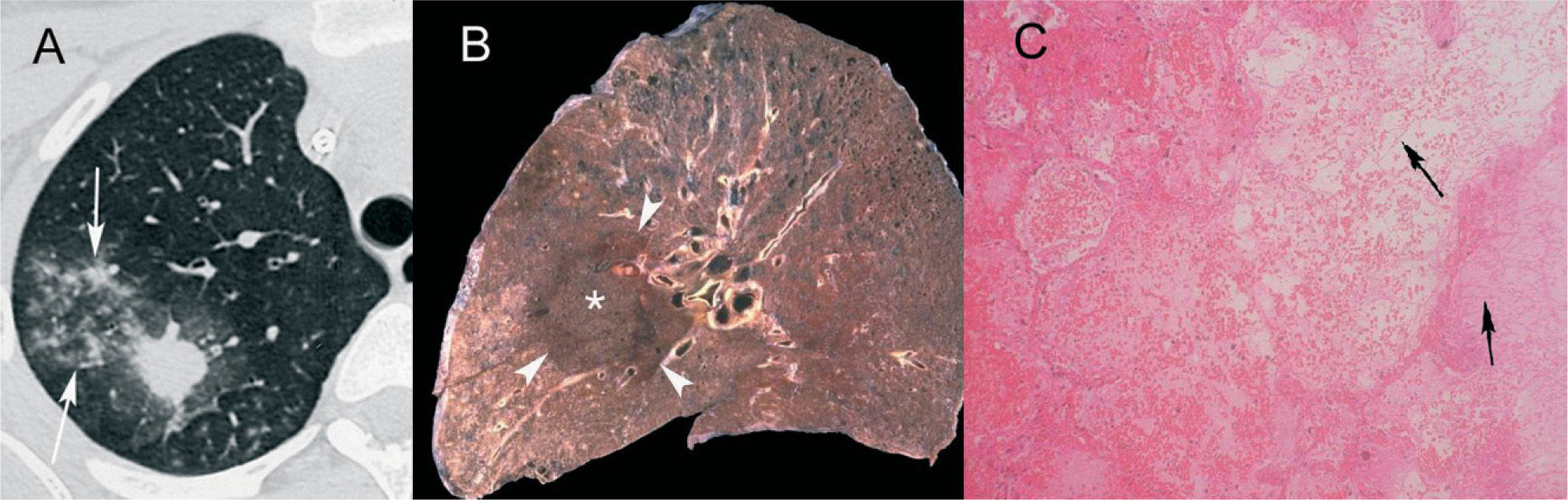
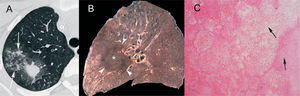
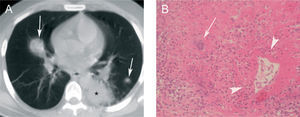
HongosAspergilosis. El signo del halo se describió en pacientes con leucemia aguda y aspergilosis invasiva1, que es la causa más frecuente de nódulos con halo en pacientes inmunocomprometidos5. La aspergilosis pulmonar es un espectro clínico de enfermedad causada por el hongo Aspergillus fumigatus, que incluye el aspergiloma, la aspergilosis broncopulmonar alérgica, la aspergilosis necrosante crónica, la aspergilosis invasiva de la vía aérea y la aspergilosis pulmonar invasiva (API). La API afecta a pacientes inmunodeprimidos, generalmente con intensa neutropenia, y sus manifestaciones clínicas son bastante inespecíficas, como tos, dolor torácico o hemoptisis. En un paciente gravemente inmunocomprometido con fiebre, las infecciones fúngicas deben considerarse en el diagnóstico diferencial. Dada la alta tasa de mortalidad de la API, es muy importante establecer un diagnóstico de sospecha precoz y un tratamiento inmediato y agresivo. Hay varios hallazgos típicos en la TC torácica, como la cavitación o el signo del aire creciente, pero se dan de manera tardía en el curso de la infección6, 7. Sin embargo, el signo del halo aparece en estadios iniciales, por lo que, en el contexto clínico apropiado, puede utilizarse en el diagnóstico precoz de la API1, 8 (fig. 1A).
Aspergilosis pulmonar invasiva. A: paciente neutropénico con leucemia linfoide aguda. Se observa un nodulo en el lóbulo superior derecho con signo del halo, así como afectación acinar adyacente (flechas). En la tomografía computarizada de control (no mostrada), realizada después de 3 semanas de tratamiento con anfotericina B, el nódulo aparecía cavitado y el signo del halo, por el contrario, había desaparecido. B: corte macroscópico sagital de pulmón de otro paciente. Lesión necrótica redondeada (asterisco), rodeada de un halo hemorrágico (puntas de flecha), correspondiente a una aspergilosis pulmonar invasiva. C: imagen microscópica del borde de la lesión descrita en B. Se observa la necrosis pulmonar con hemorragia. También pueden apreciarse las hifas de Aspergillus (flechas), que son de calibre homogéneo, septadas, y que dicotomizan en ángulo agudo (hematoxilina-eosina).
La invasión de los vasos pulmonares de pequeño o mediano calibre por Aspergillus produce trombosis y causa infartos hemorrágicos. El nódulo central que se observa en la TC torácica se debe al área central de necrosis y a las hifas del hongo, que pueden identificarse morfológicamente por ser de calibre regular, septadas y ramificadas en ángulos agudos. El halo corresponde a la necrosis hemorrágica2, 9, 10 (figs. 1B y C).
Otros hongos. Además de la API, hay otras neumonías micóticas con tropismo vascular, como la infección por Mucor spp. Este hongo oportunista puede producir enfermedad, con frecuencia de consecuencias fatales, en pacientes inmunocomprometidos o diabéticos. Entre los hallazgos radiológicos figuran consolidación lobular o multilobular y masas o nódulos solitarios o múltiples. La mucormicosis se caracteriza, desde el punto de vista histopatológico, por la gran tendencia a la angioinvasión de las hifas de Mucor (de calibre irregular, no septadas y ramificadas en ángulo recto), que produce en el pulmón invasión tisular, trombosis e infartos pulmonares hemorrágicos, al igual que la API, lo que justifica su presentación como nódulos pulmonares con halo10, 11.
El signo del halo también puede estar presente en la infección pulmonar por Candida spp.2, 8. La candidiasis pulmonar por diseminación hematógena produce microabscesos, con vasculitis, trombos infecciosos y áreas de infarto hemorrágico3.
También las infecciones por Cryptococcus spp. y Coccidioides spp. pueden tener de masa excepcional esta forma de presentación2, 8, 12.
VirusLas neumonías víricas son más frecuentes y de peor pronóstico en los pacientes inmunocomprometidos. Los hallazgos en la TC son variables: nódulos centrilobulillares, consolidaciones segmentarias, áreas de atenuación en vidrio deslustrado, con o sin engrosamiento de los septos interlobulillares, y nódulos pulmonares13. El número de virus que pueden producir infección pulmonar es muy alto, pero los que con mayor frecuencia se asocian a nódulos con halo son el virus herpes simple, el citomegalovirus, el virus varicela zóster y los mixovirus2, 8, 14. Desde el punto histopatológico, el halo en la TC se corresponde básicamente con hemorragia intraalveolar13.
MicobacteriasTanto la infección por Mycobacterium tuberculosis como la producida por Mycobacterium avium intracellulare se han descrito como causas de nódulos con signo del halo14-17. El origen del halo no está claro, ya que puede deberse tanto a la presencia de hemorragia alveolar como a reacción granulomatosa sin hemorragia alveolar15, 17.
Otras enfermedades infecciosas que rara vez pueden manifestarse con el signo del halo son la fiebre Q por Coxiella burnetii, parasitosis como la paragonimiasis o la esquistosomiasis, neumonías bacterianas de resolución lenta, las embolias sépticas y la actinomicosis3, 18, 19. El halo de atenuación en vidrio deslustrado es el resultado de la infiltración pulmonar por células y exudados inflamatorios.
Enfermedades neoplásicasLa atenuación en vidrio deslustrado que rodea un nódulo neoplásico pulmonar puede deberse a hemorragia de éste o a infiltración del parénquima pulmonar adyacente por células tumorales.
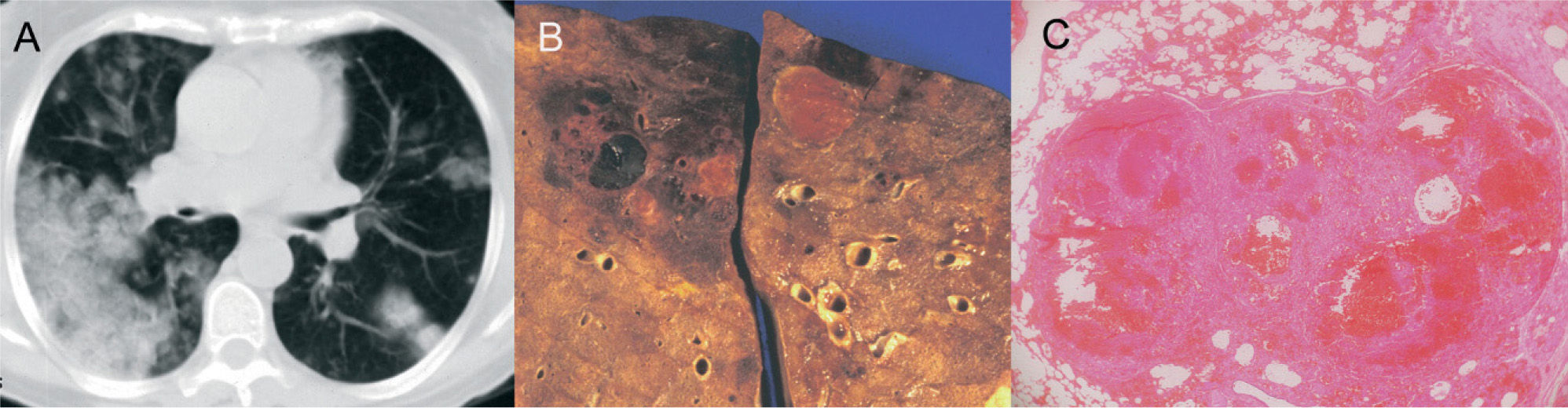
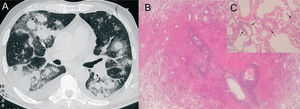
Nódulos tumorales hemorrágicosVarios procesos neoplásicos pulmonares pueden producir hemorragia que se manifieste en la TC torácica como halo en torno a un nódulo pulmonar. Generalmente, son tumores hipervasculares, con un tejido neovascular frágil, cuya rotura produce hemorragia pulmonar2. Entre ellos se encuentran las metástasis de angiosarcoma, coriocarcinoma, melanoma, osteosarcoma y carcinoma de células renales2, 3, 14, 20, 21. En el coriocarcinoma la hemorragia se debe a la característica capacidad de las células tumorales de erosionar los vasos sanguíneos3 (fig. 2).
Metástasis hemorrágicas en un paciente con un coriocarcinoma que acudió por hemoptisis masiva. A: en la tomografía computarizada de tórax se observan múltiples nódulos pulmonares hemorrágicos con el signo del halo, que coalescen en los segmentos posteriores del pulmón derecho. B: corte macroscópico de pulmón, donde se observan varias lesiones hemorrágicas de morfología redondeada. C: imagen microscópica de los nódulos, constituidos por áreas hemorrágicas, fibrina y células tumorales.
También algunos tumores pulmonares primarios pueden manifestarse como nódulos pulmonares hemorrágicos, como el angiosarcoma pulmonar primario y el sarcoma de Kaposi2, 22. El sarcoma de Kaposi primario es más frecuente en varones homosexuales con infección por el virus de la inmunodeficiencia humana, y en su biopatología parecen estar implicados factores inmunológicos e infecciosos, como la coinfección por el virus del herpes simple tipo 8. Por lo general la TC de estos pacientes muestra unos nódulos de distribución predominantemente peribroncovascular, mal definidos y en ocasiones con signo del halo5. Histológicamente se caracteriza por espacios vasculares de paredes finas, con hematíes extravasados por la rotura de las mismas. Es esta hemorragia la que es perceptible como halo en la TC torácica23.
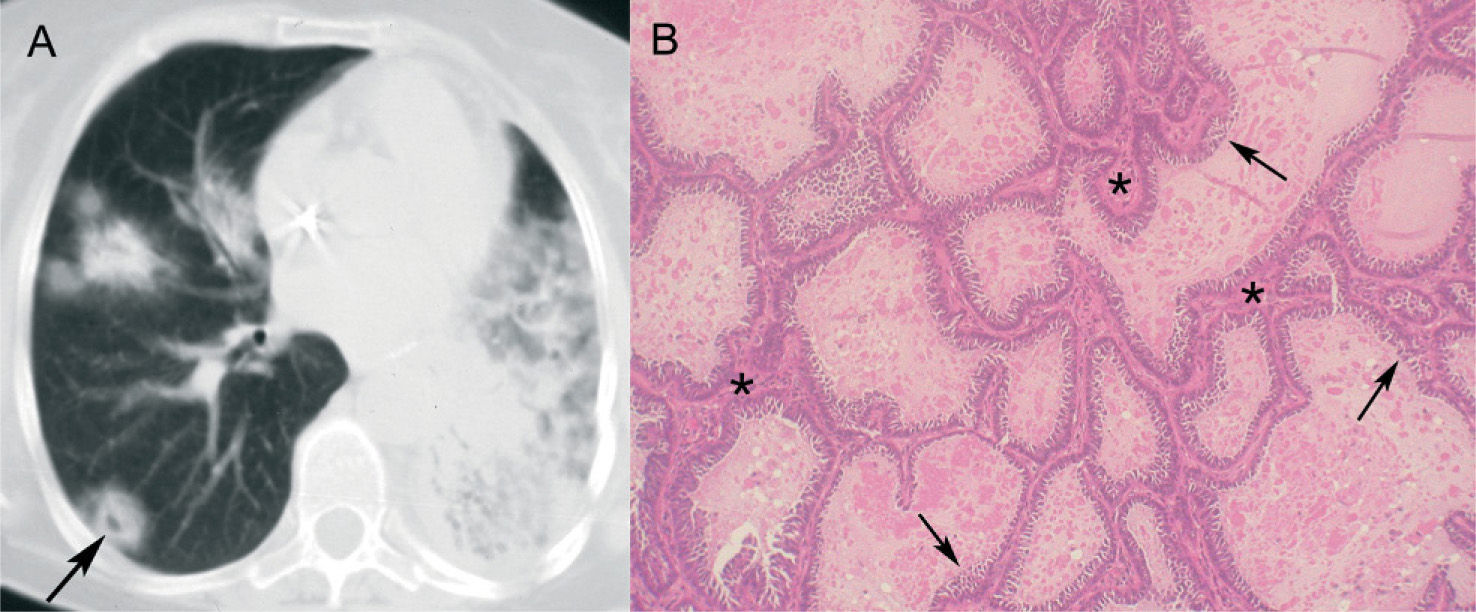
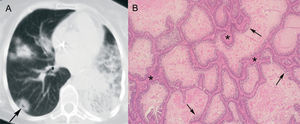
Nódulos tumorales con halo por infiltración por células tumoralesEl área de atenuación en vidrio deslustrado que rodea un nódulo tumoral también puede representar infiltración por células tumorales. Se han descrito 2 formas básicas de crecimiento tumoral en el pulmón: en la mayoría de los casos la proliferación tumoral infiltra des truyendo el pulmón (crecimiento expansivo), pero en otras ocasiones las células tumorales se extienden respetando la arquitectura histológica pulmonar y recubren las paredes alveolares (crecimiento intraalveolar o "lepídico"). Esta última forma de infiltración se asocia principalmente al carcinoma bronquioloalveolar y rara vez a las metástasis de adenocarcinomas del tubo digestivo, páncreas o pulmón24-26. La atenuación en vidrio deslustrado en este tipo de crecimiento se debe al engrosamiento de los septos alveolares por el revestimiento tumoral, con ocupación parcial del espacio aéreo alveolar2, 23. Algunos autores han señalado que la cuantificación de la atenuación en vidrio deslustrado en los adenocarcinomas pulmonares periféricos pequeños es un factor pronóstico, ya que los que tienen un mayor componente de vidrio deslustrado presentan un mayor componente de carcinoma bronquioloalveolar y, por tanto, mejor pronóstico27-29. Además, el carcinoma bronquioloalveolar es la entidad que con mayor frecuencia presenta signo del halo en los pacientes inmunocompotentes14 (fig. 3).
Carcinoma bronquioloalveolar en un paciente con tos crónica. A: tomografía computarizada de tórax donde se observan en el pulmón derecho nódulos con signo del halo, algunos con seudocavitación (flecha). En el pulmón izquierdo se aprecia una importante consolidación. B: imagen microscópica donde se observa cómo las células neoplásicas (flechas) tapizan los tabiques alveolares (asteriscos) (hematoxilina-eosina).
También se ha descrito el signo del halo asociado a otras variedades histológicas de tumores pulmonares primarios, como el carcinoma de células escamosas y el cistoadenocarcinoma mucinoso14, 30.
Los linfomas pulmonares pueden manifestarse en la TC torácica básicamente como áreas de consolidación o como nódulos pulmonares únicos o múltiples31. Los nódulos pueden presentar signo del halo, que se ha descrito en formas primarias, como en los linfomas de tejido linfoide asociado a las mucosas (linfomas MALT, de mucosa-associated lymphoid tissue), secundarias y en la enfermedad linfoproliferativa postrasplante32-34. En el linfoma el nódulo representa la densa infiltración tumoral central, mientras que el halo es la infiltración menos densa del intersticio pulmonar perinodular14, 33 (fig. 4).
Linfoma pulmonar en un paciente de 73 años que acudió a urgencias por disnea. A: imagen axial a la altura de los lóbulos inferiores que muestra múltiples nódulos pulmonares con signo del halo, con tendencia a la coalescencia en los segmentos posteriores. También hay derrame pleural bilateral, algo mayor en el lado derecho. El paciente falleció a las 3 semanas del ingreso en el hospital. En el estudio necrópsico se evidenció afectación de múltiples órganos por linfoma de linfocitos citolíticos naturales. B: aspecto microscópico a bajo aumento de un nódulo pulmonar. Existe un infiltrado celular neoplásico, de predominio peribroncovascular, con importante necrosis asociada (hematoxilina-eosina). C: a mayor aumento, la periferia del nódulo muestra la infiltración de los septos alveolares por las células neoplásicas (flechas) (hematoxilina-eosina).
Como los anteriores grupos, las enfermedades que a continuación se describen pueden manifestarse como nódulos hemorrágicos o no hemorrágicos. En el caso de estos últimos, el halo de atenuación en vidrio deslustrado se debe a la presencia de un infiltrado inflamatorio que generalmente afecta al intersticio alveolar.
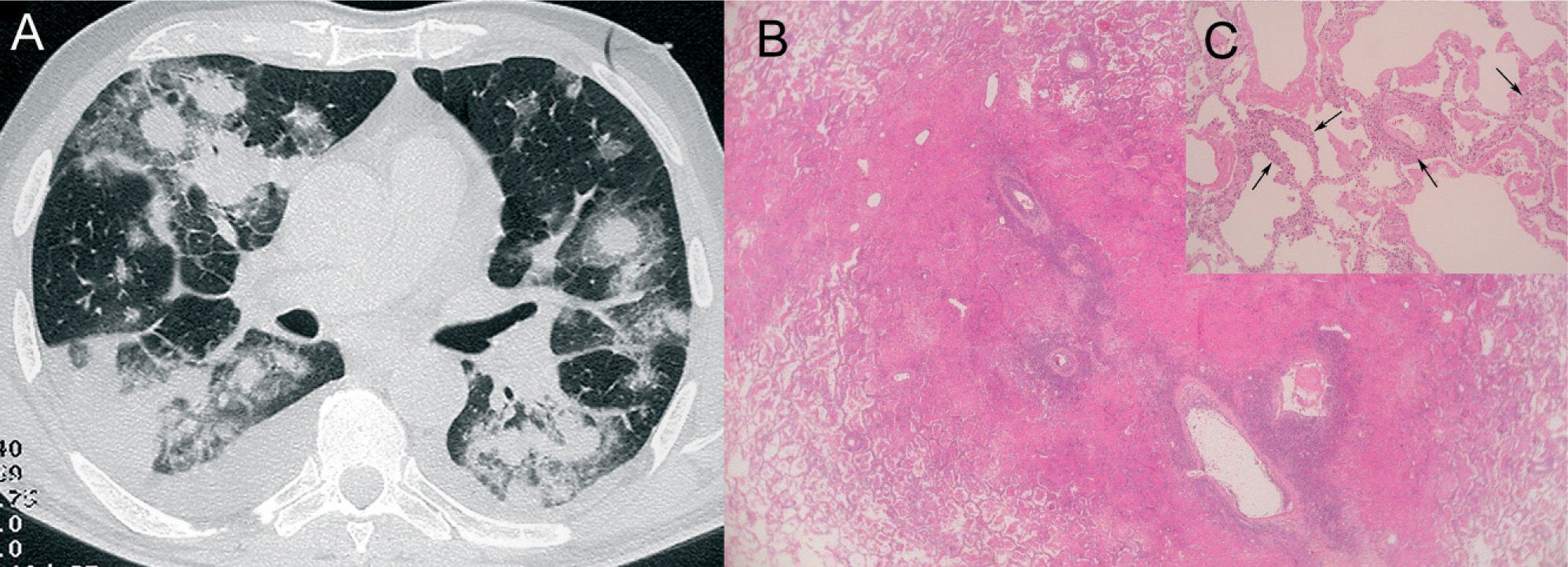
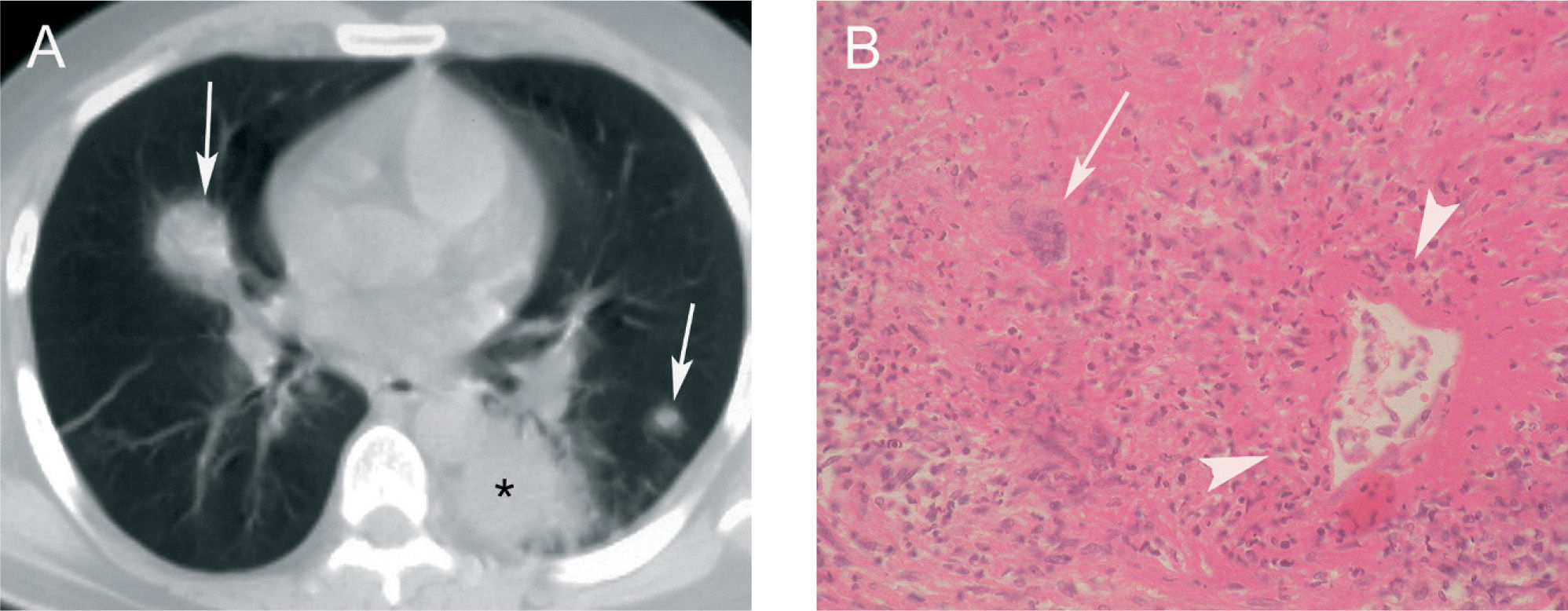
Nódulos hemorrágicosLa granulomatosis de Wegener es una forma de vasculitis granulomatosa que puede manifestarse con la tríada clásica de enfermedad pulmonar, sinusitis febril y glomerulonefritis necrosante. El pulmón es el órgano más frecuentemente afectado. Los principales hallazgos histológicos son la formación de granulomas necrosantes, que se acompañan de un infiltrado celular mixto de neutrófilos, linfocitos, histiocitos y eosinófilos, y vasculitis necrosante focal de vasos de pequeño y mediano calibre. La causa de la hemorragia pulmonar es la vasculitis necrosante35. El signo del halo en la TC torácica corresponde a la hemorragia pulmonar focal que rodea al nódulo central2, 3 (fig. 5).
Granulomatosis de Wegener. A: imagen axial de tomografía computarizada donde se observan 2 nódulos pulmonares que muestran signo del halo (flechas), así como una consolidación en el lóbulo inferior izquierdo (asterisco), que se acompaña también de un área de atenuación en vidrio deslustrado. El paciente, que comenzó con hemoptisis, también presentaba una glomerulonefritis rápidamente progresiva. B: imagen microscópica donde se observa la infiltración inflamatoria de la pared arterial, con alguna célula gigante multinucleada (flecha) y desprendimiento endotelial (puntas de flecha) (hematoxilina-eosina).
También la endometriosis pulmonar puede manifestarse como nódulos pulmonares hemorrágicos, ya que el tejido endometrial, aunque ectópico, puede presentar hemorragia durante la menstruación (hemorragia catamenial)3.
Se han descrito casos de nódulos pulmonares con signo del halo en pacientes con trasplante de pulmón a quienes se realiza una biopsia transbronquial, probablemente relacionado con hemorragia pulmonar secundaria a la biopsia4.
Nódulos no hemorrágicosLa sarcoidosis afecta a los pulmones aproximadamente en el 90% de los pacientes. La lesión histológica característica de esta entidad es el granuloma sarcoideo. La TC muestra múltiples nódulos de pequeño tamaño, que corresponden a los granulomas sarcoideos, de distribución predominantemente perivascular y subpleural, con engrosamiento del intersticio peribroncovascular y de los septos interlobulares. La coalescencia de los granulomas puede formar nódulos seudotumorales irregulares (signo de la "galaxia sarcoidea"). En ocasiones también pueden observarse áreas de atenuación en vidrio deslustrado, a veces rodeando estos nódulos (con signo del halo). Estas zonas son habitualmente reversibles y se cree que son indicativas de alveolitis36.
Entre los posibles hallazgos de la neumonía organizada en la TC se encuentran las áreas de consolidación o vidrio deslustrado, de distribución típicamente subpleural o peribronquial y de predominio en los lóbulos inferiores. Algunos pacientes presentan múltiples nódulos de borde irregular, que en ocasiones aparecen rodeados de un halo de atenuación en vidrio deslustrado13, 37. También se ha descrito un caso de neumonitis por hipersensibilidad subaguda con una reacción en forma de bronquiolitis obliterante con neumonía organizada, en el que el nódulo correspondía a los pólipos intraluminales de tejido de granulación de la neumonía organizada, y el halo, a un engrosamiento de las paredes alveolares por infiltrados de linfocitos38.
Las neumonías eosinófilas también pueden manifestarse como nódulos pulmonares rodeados de atenuación en vidrio deslustrado. Este halo probablemente se deba a infiltración pulmonar por eosinófilos y otras células inflamatorias3, 14, 39.
Las formas nodulares de la amiloidosis pulmonar pueden en algunos casos ir acompañadas de signo del halo. Es posible que el halo se deba a la presencia de células inflamatorias inespecíficas y/o a depósito de sustancia amiloide en los septos alveolares periféricos. Además, el signo del halo tiene un papel predictivo en la evolución de la enfermedad, ya que la amiloidosis nodular con halo predice una progresión más rápida y una mejor respuesta de las lesiones al tratamiento40.
Entre las numerosas alteraciones pulmonares secundarias a la toxicidad por amiodarona figuran los nódulos con signo del halo. Los mecanismos de neumonitis por este fármaco están relacionados con su principal metabolito, la desetilamiodarona, que interfiere en el catabolismo de los lípidos e induce de esta forma una fosfolipidosis generalizada, una causa iatrogénica de neumonía lipoidea endógena. El halo que se aprecia en la TC puede deberse al engrosamiento de las paredes alveolares con infiltrado de células inflamatorias mixtas en torno a un nódulo de pólipos intraluminares fibroblásticos, que pueden simular una neumonía organizada, pero que respetan los bronquiolos41.
ConclusionesExiste un amplio espectro de enfermedades que pueden manifestarse como nódulos pulmonares con el signo del halo en la TC torácica y que corresponden a distintas lesiones anatomopatológicas, no sólo nódulos hemorrágicos, sino también infiltración por células inflamatorias o tumorales. Por lo tanto, el signo del halo es poco específico, pero sin duda puede constituir un hallazgo muy útil en el diagnóstico diferencial. De hecho, el diagnóstico debe realizarse integrando todos los hallazgos de la TC torácica en el contexto clínico del paciente. Así, otros hallazgos de la TC, como el número de nódulos, la presencia de adenopatías o la afectación pleural, permiten acotar el diagnóstico diferencial. En el paciente inmunodeprimido los diagnósticos más probables son la API, las neumonías víricas, el sarcoma de Kaposi y el linfoma. En el paciente inmunocompetente deben tenerse muy en cuenta el carcinoma bronquioloalveolar y otras neoplasias, además de las infecciones víricas.