La coexistencia de procesos potencialmente agravantes es frecuente en asmáticos, especialmente en individuos con control difícil. Es objetivo primario conocer si la comorbilidad es más frecuente en los pacientes no controlados. Como objetivo secundario nos propusimos evaluar el grado de correlación entre test de control del asma (ACT) y la fracción exhalada de óxido nítrico (FENO).
Pacientes y métodosEstudio prospectivo, observacional, que comparó funcional y clínicamente dos grupos de asmáticos: controlados (ACT≥20) y no controlados (ACT<20). En todos se investigó la presencia de tabaquismo, rinosinusitis, obesidad, ansiedad, depresión, disfunción de cuerdas vocales, reflujo gastroesofágico (RGE), aspergilosis broncopulmonar alérgica (ABPA), EPOC y poliposis nasal.
ResultadosSe incluyeron 56 pacientes con asma controlada y 102 con un control subóptimo. Los pacientes con un ACT≥20 tenían mejor función pulmonar, menor variabilidad del PEF, menos hiperreactividad bronquial y menores valores de FENO. Se hallaron comorbilidades en el 95% de los asmáticos controlados y en el 97% de los no controlados. Sólo la presencia de poliposis nasal, RGE y ABPA fue más frecuente en el grupo no controlado. Sin embargo, la presencia simultánea de 3 o más factores de comorbilidad fue significativamente más frecuente en los pacientes con un control subóptimo (p=0,01). No hubo correlación significativa entre los valores del FENO y los del ACT (rho=−0,08; p=0,32).
ConclusionesLa suma de comorbilidades agravantes es más frecuente en pacientes con control subóptimo. No existe correlación entre los valores de ACT y de FENO.
The coexistence of potentially aggravating processes is common in asthmatics, particularly in patients with difficult control.
The primary aim of this study is to ascertain whether comorbidity id more common in uncontrolled patients. As a secondary aim, we propose to evaluate the correlation between the asthma control test (ACT) and the fraction of exhaled nitric oxide (FENO).
Patient and methodsA prospective, observational study comparing the function and clinical picture of two groups of asthmatics: controlled (ACT≥20) and uncontrolled (ACT<20). They were all assessed for, smoking, rhinosinusitis, obesity, anxiety, depression, vocal cord dysfunction, gastro-oesophageal reflux (GORD), allergic bronchopulmonary aspergillosis (ABPA), COPD and nasal polyps.
ResultsA total of 50 patients with controlled asthma and 102 with suboptimal control were included. The patients with an ACT≥20 had better lung function, less variation in PEF, less bronchial hyper-reactivity and lower FENO values.
Comorbidities were found in 95% of the controlled asthmatics and in 97% of the uncontrolled. Only the presence of nasal polyps, GORD and ABPA was more frequent in the uncontrolled group. However, the simultaneous presence of 3 or more comorbidity factors was significantly more frequent in patients with sub-optimal control (P=0.01).
There was no significant correlation between the FENO and the ACT values (rho=−0.08; P=0.32).
ConclusionsAggravating comorbidities are more common in patients with sub-optimal control. There was no correlation between the FENO and the ACT values.
El objetivo fundamental del tratamiento del asma, según la Guía Española para el Manejo del Asma (GEMA 2009), consiste en alcanzar el control de la enfermedad y mantenerlo1, ya que ello implica acercarse a la normalidad en la calidad de vida relacionada con la salud2. Sin embargo, lo habitual es que este objetivo no se logre en un número elevado de pacientes. Un estudio de González-Barcala et al3, realizado en el ámbito de la Atención Primaria sobre una muestra de 2.159 asmáticos, mostró que el 64% de ellos estaba mal controlado.
Son muchos los factores que pueden explicar un mal control del asma: medicación administrada a dosis subóptimas4, mal cumplimiento o inadecuada técnica inhalatoria5 y un fenotipo asmático poco sensible a la acción farmacológica6 son algunos de ellos. En 2 series de pacientes con asma de control difícil, se encontraron procesos concomitantes que podían agravar la enfermedad en el 19–34% de los casos7,8. Es posible que la presencia de comorbilidad se asocie con una peor respuesta a la escalada terapéutica que se recomienda en los pacientes mal controlados, pero no está claro que el tratamiento particularizado de los procesos intercurrentes mejore el control del asma8.
Durante los últimos años se han desarrollado, mediante una metodología estandarizada, instrumentos diseñados para medir el control del asma desde la perspectiva del paciente. Entre ellos, el test de control del asma (ACT)9 —cuya versión en idioma español ha sido recientemente validada10— se ha revelado como un cuestionario sencillo y útil para evaluar la situación clínica de los asmáticos. Por otra parte, los especialistas en asma han estado interesados en encontrar un marcador objetivo, fácil de medir y reproducible que pudiera facilitar el seguimiento de la enfermedad y evitar el exceso o el defecto en el tratamiento. El óxido nítrico exhalado (FENO) —un marcador indirecto de la inflamación bronquial eosinofílica— ha sido empleado para guiar la terapia del asma11,12. La relación entre ambos tipos de instrumentos, clínicos y bioquímicos, ha sido explorada en raras ocasiones y se ha apuntado que es posible que midan aspectos diferentes de la enfermedad13.
Este estudio se fundamenta en la hipótesis de que el control del asma puede verse negativamente afectado por procesos concomitantes. Como objetivo principal hemos querido saber si el mal control del asma se relaciona con la presencia de comorbilidades. Como objetivo secundario, nos planteamos conocer si el grado de control —medido por el ACT— se correlaciona con los niveles de FENO.
Material y métodosDiseño del estudioEstudio prospectivo y observacional llevado a cabo en los servicios de neumología y alergología de 2 hospitales. Se reclutaron pacientes que eran seguidos habitualmente en una consulta especializada en el tratamiento de asma.
PacientesSe incluyeron, de forma consecutiva, pacientes diagnosticados de asma mal controlada (definido por un valor<20 en el ACT) hasta alcanzar un número de 100. Se estableció un grupo control formado por los primeros 50 pacientes con asma bien controlada (ACT≥20 y sin agudizaciones en los últimos 3 meses). El diagnóstico de asma fue establecido por un especialista neumólogo o alergólogo con experiencia en la enfermedad. Se consideraron asmáticos aquellos pacientes con clínica sugestiva (episodios intermitentes de tos, disnea y sibilancias) más alguno de los siguientes criterios: prueba broncodilatadora positiva, variabilidad del pico de flujo espiratorio ≥20%, pruebas cutáneas positivas, prueba de metacolina positiva o FENO elevado. Todos los pacientes incluidos recibían, al menos, tratamiento con un corticoide inhalado y todos los encuadrados en el grupo «no controlado» utilizaban una combinación de corticoide inhalado-β2 agonista de larga duración. La totalidad de los sujetos incluidos recibió educación sobre su enfermedad y sobre el correcto uso de la medicación inhalada en una consulta de enfermería. El periodo de inclusión se prolongó desde el 1 de Febrero hasta el 24 de junio del año 2009. El estudio fue sometido a la aprobación de los Comités de Ética de cada hospital y se proporcionó un consentimiento informado a todos los participantes.
ProtocoloEn todos los casos se cumplimentó una detallada historia clínica que especificaba el hábito tabáquico, la coexistencia de rasgos atópicos, evolución de la enfermedad, tratamientos, etc. Se practicó una espirometría con prueba broncodilatadora, una prueba de metacolina (si no estaba contraindicado), medición del FENO, cumplimentación del cuestionario de Goldberg para ansiedad y depresión y se instruyó a los pacientes para que hiciesen un registro ambulatorio del pico de flujo (PEF) durante un mes. Se obtuvo una historia estructurada con el objeto de descartar procesos coexistentes (obesidad, tabaquismo, exposición al humo, ansiedad, depresión, medicaciones que pudieran afectar al control del asma, reflujo gastroesofágico, enfermedad de la vía aérea superior, disfunción de cuerdas vocales, enfermedad pulmonar obstructiva crónica y aspergilosis broncopulmonar alérgica) susceptibles de empeorar el control del asma. Se anotó cuáles de estos procesos habían sido diagnosticados y, en los casos en los que existía una sospecha clínica no confirmada, se solicitaron las pruebas pertinentes para asegurar el diagnóstico (ej: TAC torácico o de senos, endoscopia digestiva, etc.).
MedicionesÓxido nítrico exhaladoSe realizó una medición única utilizando un dispositivo portátil (NIOX MINO; Aerocrine AB; Solna: Sweden) a un flujo oral de 50 ml/s durante 10 segundos. El sensor del aparato fue cambiado periódicamente de acuerdo con las instrucciones del fabricante.
Función pulmonarLa espirometría se realizó empleando un espirómetro Datospir 120 (Sibelmed, Spain) de acuerdo con las guías de la American Society/European Respiratory Society14 para calcular el volumen espiratorio forzado en el primer segundo (FEV1), la capacidad vital forzada (FVC), la relación FEV1/FVC y el pico espiratorio de flujo (PEF). Los valores de FEV1 y FVC se expresaron como porcentaje sobre el teórico (% pred). La prueba broncodilatadora fue calculada como el porcentaje de variación del FEV1 respecto al basal, 15min después de inhalar 400μg de salbutamol.
La hiperreactividad bronquial a la metacolina (expresada como PC20metacolina) fue medida con un método de respiración a volumen corriente durante 2min, adaptado de Cockcroft et al15. Se interpretó la prueba como positiva con valores de PC20 ≤8mg/ml.
El PEF, medido cada 12h con un dispositivo portátil, fue registrado por el propio paciente en un diario.
Cuestionario de control del asmaSe valoró el control del asma mediante el empleo de la versión validada en lengua española del Asthma Control Test (ACT)10. Los pacientes valoraron de forma subjetiva el grado de discomfort causado por el asma durante las 4 semanas precedentes respondiendo a 5 preguntas mediante una escala de 5 posibles respuestas. El ACT es sencillo, está validado, y varía con los cambios en el control a lo largo del tiempo. Un punto de corte de 19 o menos identifica a los pacientes que tienen un control subóptimo10.
Test de Goldberg de depresión y ansiedadEsta prueba fue diseñada para ser usada por facultativos ajenos a la psiquiatría en investigaciones clínicas. El resultado refleja las respuestas («sí» o «no») a 9 preguntas sobre ansiedad y 9 sobre depresión (sólo es necesario responder el bloque completo de 9 preguntas si se contesta afirmativamente alguna de las primeras 4), que se centran en cómo se ha sentido el sujeto durante el mes precedente. Goldberg et al consideraron que un resultado ≥5 en el apartado de ansiedad o un resultado ≥2 en el apartado de depresión implicaba un 50% de probabilidad de sufrir un trastorno clínicamente relevante16.
Análisis estadísticoLos datos se presentan como media (desviación estándar) para las variables cuantitativas y como porcentajes para las cualitativas. Para medir la normalidad se utilizó la prueba de Saphiro-Wilks. Las diferencias entre variables cuantitativas se han calculado con la prueba t de Student para datos independientes cuando siguen la distribución normal y con la prueba de Wilcoxon para cuando no es así. Las diferencias entre porcentajes se han calculado con la prueba exactade Fisher. En el caso de variables ordinales se ha calculado el ji al cuadrado para tendencia. La presencia de factores de comorbilidad en los dos grupos (pacientes controlados y no controlados) se comparó mediante odds ratio calculados a partir de tablas 2×2, usando como grupo de referencia el de pacientes controlados y sin comorbilidad. Se utilizó la el coeficiente de correlación de rangos rh0 de Spearman para medir la correlación entre los valores de ACT y de FENO. Se considera significación estadística cuando p<0,05. Se proporcionan los intervalos de confianza del 95%.
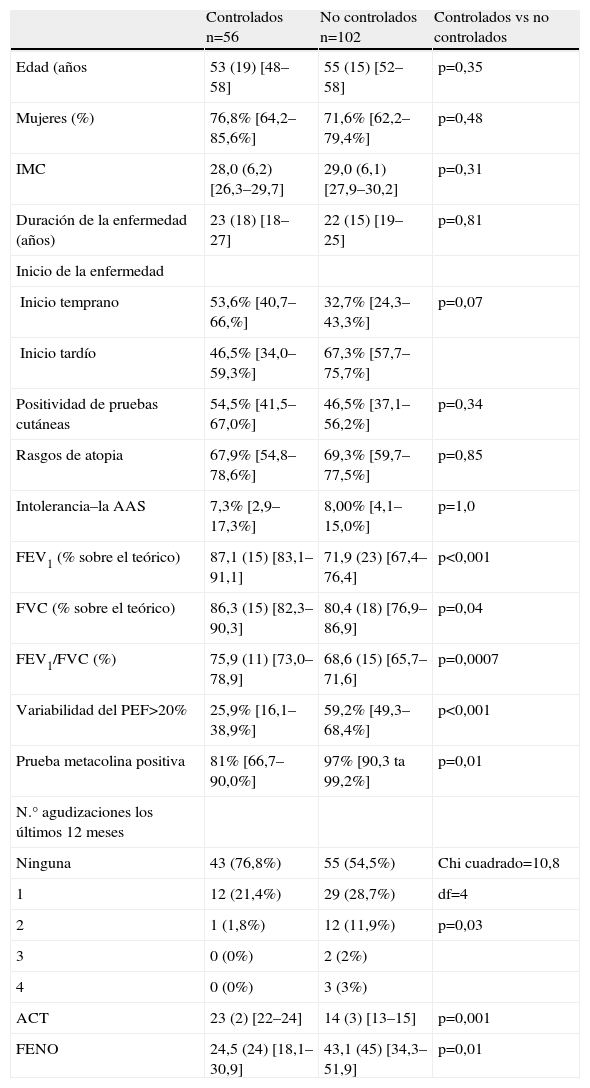
ResultadosCaracterísticas demográficasSe incluyeron 158 pacientes, divididos en 2 grupos: 56 con asma controladoa y 102 con un control subóptimo. Las características demográficas, clínicas y funcionales se reflejan en la tabla 1, acompañadas de la comparación entre los dos grupos de pacientes. No se encontraron diferencias significativas en la edad, sexo ni en el IMC. Los pacientes con un ACT ≥20 tenían una mejor función pulmonar, menor variabilidad del PEF, menos hiperreactividad bronquial y menores valores de FENO.
Características demográficas, clínicas y funcionales de los pacientes incluidos en el estudio de acuerdo con el grado de control del asma
| Controlados n=56 | No controlados n=102 | Controlados vs no controlados | |
| Edad (años | 53 (19) [48–58] | 55 (15) [52–58] | p=0,35 |
| Mujeres (%) | 76,8% [64,2–85,6%] | 71,6% [62,2–79,4%] | p=0,48 |
| IMC | 28,0 (6,2) [26,3–29,7] | 29,0 (6,1) [27,9–30,2] | p=0,31 |
| Duración de la enfermedad (años) | 23 (18) [18–27] | 22 (15) [19–25] | p=0,81 |
| Inicio de la enfermedad | |||
| Inicio temprano | 53,6% [40,7–66,%] | 32,7% [24,3–43,3%] | p=0,07 |
| Inicio tardío | 46,5% [34,0–59,3%] | 67,3% [57,7–75,7%] | |
| Positividad de pruebas cutáneas | 54,5% [41,5–67,0%] | 46,5% [37,1–56,2%] | p=0,34 |
| Rasgos de atopia | 67,9% [54,8–78,6%] | 69,3% [59,7–77,5%] | p=0,85 |
| Intolerancia–la AAS | 7,3% [2,9–17,3%] | 8,00% [4,1–15,0%] | p=1,0 |
| FEV1 (% sobre el teórico) | 87,1 (15) [83,1–91,1] | 71,9 (23) [67,4–76,4] | p<0,001 |
| FVC (% sobre el teórico) | 86,3 (15) [82,3–90,3] | 80,4 (18) [76,9–86,9] | p=0,04 |
| FEV1/FVC (%) | 75,9 (11) [73,0–78,9] | 68,6 (15) [65,7–71,6] | p=0,0007 |
| Variabilidad del PEF>20% | 25,9% [16,1–38,9%] | 59,2% [49,3–68,4%] | p<0,001 |
| Prueba metacolina positiva | 81% [66,7–90,0%] | 97% [90,3 ta 99,2%] | p=0,01 |
| N.° agudizaciones los últimos 12 meses | |||
| Ninguna | 43 (76,8%) | 55 (54,5%) | Chi cuadrado=10,8 |
| 1 | 12 (21,4%) | 29 (28,7%) | df=4 |
| 2 | 1 (1,8%) | 12 (11,9%) | p=0,03 |
| 3 | 0 (0%) | 2 (2%) | |
| 4 | 0 (0%) | 3 (3%) | |
| ACT | 23 (2) [22–24] | 14 (3) [13–15] | p=0,001 |
| FENO | 24,5 (24) [18,1–30,9] | 43,1 (45) [34,3–51,9] | p=0,01 |
Los datos se presentan como N.° (%), media (desviación estándar), con los intervalos e confianza del 95% entre corchetes. Se define como asma de inicio temprano aquélla en la que los síntomas comienzan antes de los 30 años y asma de inicio tardío si el comienzo es a partir de esa edad.
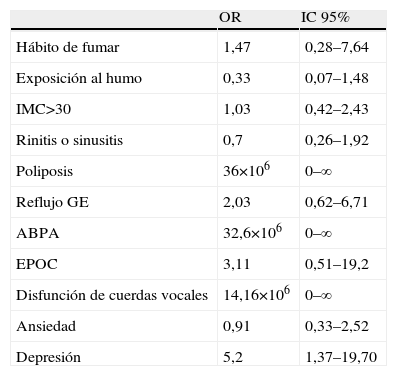
La presencia de algún factor de comorbilidad (hábito tabáquico, exposición al humo, obesidad, rinitis o sinusitis, poliposis nasal, reflujo gastroesofágico, aspergilosis broncopulmonar alérgica, EPOC, disfunción de cuerdas vocales, ansiedad o depresión) se encontró en el 95% [IC 95% 85,4 a 98,2] de los asmáticos controlados y en el 97% [IC 95% 91,7 a 99] de los que no habían logrado el control. No se encontraron diferencias significativas en el IMC al comparar sus distintos rangos en pacientes controlados y no controlados De forma respectiva, IMC<30: 64,3% [IC 95% 50,4 a 76,6] frente a 57,8% [IC 95% 48,2 a 67,4]; IMC entre 30 y 35: 21,4% [IC 95% 12,0–35,6 ] frente a 22,5% [IC 95% 14,4 a 30,7]; IMC >35: 14,3% [IC 95% 6,6–27,1] frente a 19,6% [IC 95% 11,9 a 27,3]. Sólo la presencia de poliposis nasal: 0% [IC 95% 0–5,5] frente a 8,8% [IC 95% 4,7–15,9] (p=0,03), la coexistencia de reflujo gastroesofágico: 8,9% [IC 95% 3,9 a 19,3] frente a 22,8% [IC 95% 15,5–31,6] (p=0,03), y la de aspergilosis broncoupulmonar alérgica: 0% [IC 95% 0 a 6,0] frente a 9,8% [IC 95% 5,4–17,1] (p=0,03) fueron más frecuentes en el grupo no controlado. La tabla 2 expone, expresada en OR, la incidencia de las diferentes comorbilidades entre ambos grupos.
Frecuencia de diagnóstico de los diferentes factores de comorbilidad en el grupo de pacientes no controlados respecto al grupo de pacientes controlados
| OR | IC 95% | |
| Hábito de fumar | 1,47 | 0,28–7,64 |
| Exposición al humo | 0,33 | 0,07–1,48 |
| IMC>30 | 1,03 | 0,42–2,43 |
| Rinitis o sinusitis | 0,7 | 0,26–1,92 |
| Poliposis | 36×106 | 0–∞ |
| Reflujo GE | 2,03 | 0,62–6,71 |
| ABPA | 32,6×106 | 0–∞ |
| EPOC | 3,11 | 0,51–19,2 |
| Disfunción de cuerdas vocales | 14,16×106 | 0–∞ |
| Ansiedad | 0,91 | 0,33–2,52 |
| Depresión | 5,2 | 1,37–19,70 |
ABPA: Aspergilosis broncopulmonar alérgica; EPOC: enfermedad pulmonar obstructiva crónica.
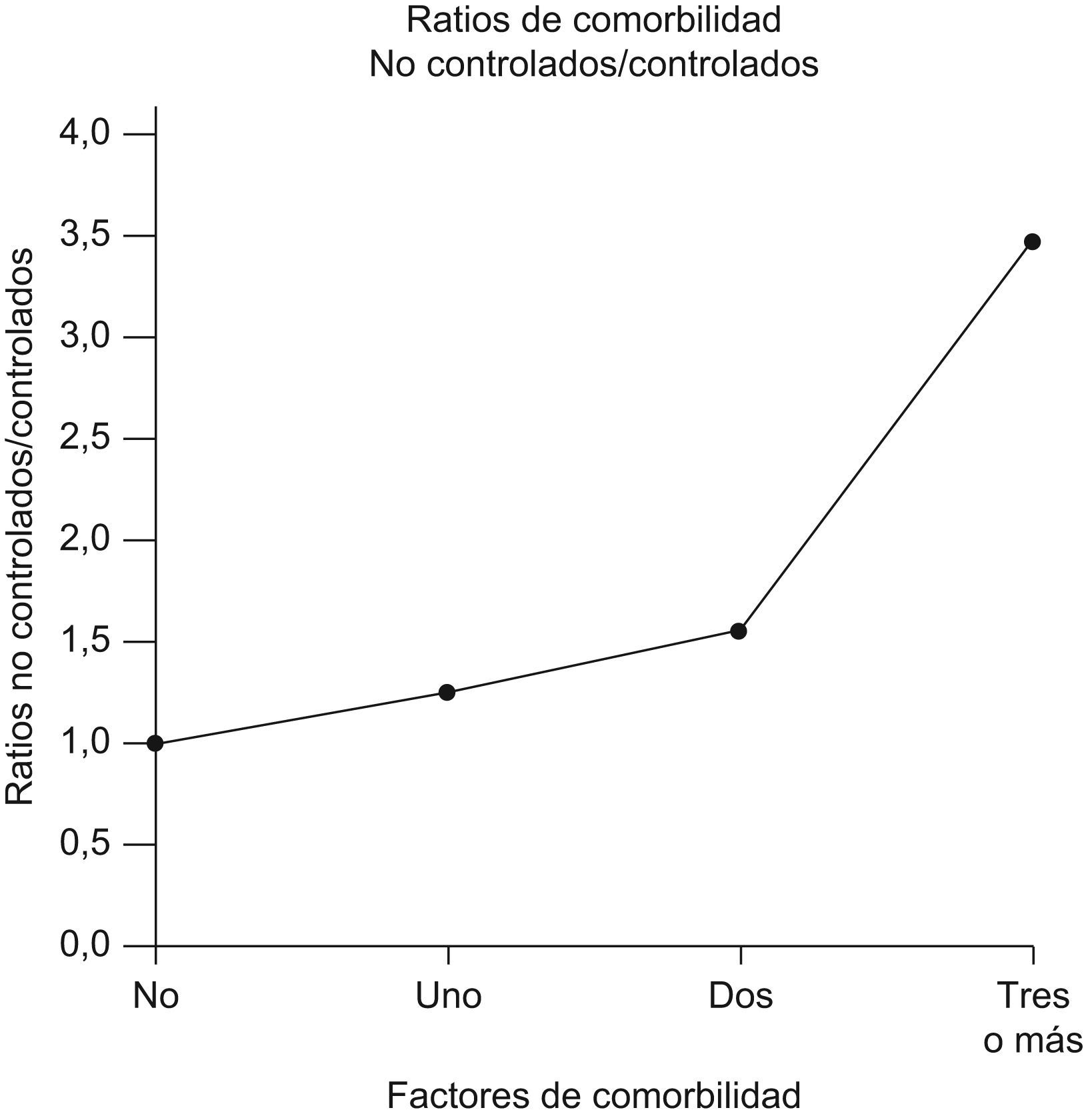
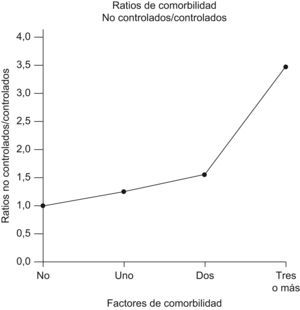
Sin embargo, la presencia simultánea de 3 o más factores de comorbilidad fue significativamente más frecuente en los pacientes con un control subóptimo (p=0,01). Los ratios de pacientes con un control subóptimo respecto a los que estaban controlados fueron: 1,24 en el caso de un solo proceso de comorbilidad, 1,53 en el caso de dos procesos y 3,46 en el caso de tres o más comorbilidades, lo que muestra la tendencia de los pacientes no controlados a tener más factores agravantes que los que sí han logrado el control del asma (fig. 1).
Correlación entre el FENO y el ACTComo cabría esperar, los valores de FENO fueron significativamente menores en los pacientes controlados: 24,5 [IC 95% 18,1 a 30,9] vs 43,1 [IC 95% 34,3–51,9]; p=0,01. Sin embargo, no se encontró una correlación significativa entrre los valores del FENO y los del ACT cuando se estudiaron, de forma conjunta, todos los pacientes incluidos en el estudio (rho=−0,08; p=0,32).
DiscusiónLos resultados de este estudio ponen en evidencia el alto porcentaje (>90%) de pacientes asmáticos que padecen comorbilidades susceptibles de empeorar el control del asma. Este hecho motiva que no se encuentren diferencias significativas en su incidencia entre pacientes asmáticos controlados y los que no lo están (95 vs 97%), si el concepto de comorbilidad se define como la presencia de, al menos, un factor potencialmente agravante del asma. Sin embargo, al mismo tiempo, el estudio muestra que la coexistencia en un mismo paciente de varias comorbilidades es más frecuente en los casos de mal control del asma (el 23,2% de los pacientes controlados presenta 3 o más comorbilidades, hecho que ocurre en el 44% de los no controlados).
Cada vez se concede más importancia a la influencia de la comorbilidad en la evolución y en el control del asma17 y se ha postulado que la identificación de estos factores debe formar parte de la evaluación rutinaria de los asmáticos, particularmente de aquéllos de control difícil. Se ha descrito una asociación entre la gravedad y respuesta al tratamiento del asma y los siguientes procesos: reflujo gastroesofágico18,19, obesidad20,21, disfución de cuerdas vocales22, ansiedad-depresión23,24, rinusinusitis25,26 y hábito tabáquico27. Sin embargo, la influencia de estas enfermedades sobre el curso del asma es variable y, en muchos casos, no está clara en absoluto. Teóricamente, podrían alterar el fenotipo asmático (ej: tabaquismo, ABPA), ser parte del mismo proceso fisiopatológico (ej: nasosinusitis) o bien actuar como factores de confusión en el proceso diagnóstico o en la evaluación del control del asma (ej: ansiedad y depresión). Sin embargo, la repercusión de cualquiera de estos procesos en cada paciente individual es diferente y, por lo tanto, difícilmente predecible. Nuestros resultados ponen de relieve que la amplia mayoría de los asmáticos presenta alguna enfermedad intercurrente que puede alterar su evolución, independientemente de cual pueda ser el grado de control. Solo la poliposis nasal (8,8 vs 0%), el reflujo gastroesofágico (22,8 vs 8,9%) y la ABPA (9,8 vs 0%) mostraron mayor frecuencia en los pacientes no controlados (la depresión no alcanzó la significación estadística por un escaso margen). Por contra, se apreció que los pacientes con mal control muestran una tendencia clara a sumar varias comorbilidades al tiempo.
De estos resultados se pueden obtener dos consecuencias prácticas evidentes. Por un lado, si la presencia de comorbilidades se relaciona con un mal control del asma, el tratamiento específico de aquéllas podría redundar en un beneficio en la calidad de vida de los pacientes. Sin embargo, esto no siempre es así, al menos no lo es en el caso del reflujo gatroesofágico subclínico diagnosticado por phmetría, ya que el estudio de The American Lung Association Asthma Clinical Research Centers demostró que el tratamiento con esomeprazol de asmáticos con este proceso intercurrente no mejoraba el control de su enfermedad28. Por otro lado, la coexistencia de procesos que potencialmente agravan el asma, pero que tienen una naturaleza biológica diferente a ésta, puede motivar que un aumento de la medicación —basado en lo recomendado por la GEMA— resulte ineficaz, ya que los síntomas que expresa el paciente no estarían directamente relacionados con el proceso bronquial inflamatorio. De ser esto así, nos encontraríamos con situaciones de tratamiento excesivo e inadecuado. En esta circunstancia, resultaría muy útil disponer de un marcador capaz de predecir la respuesta terapéutica, distinguiendo entre pacientes infratratados y aquellos en los que resultaría superfluo un esfuerzo terapéutico específico para el asma. Nuestro grupo ha comprobado que valores de FENO elevados implican que un asmático puede alcanzar el control con un incremento en su medicación. Por contra, un paciente mal controlado y con valores normales de FENO, es improbable que mejore con más tratamiento para el asma29, lo que se traduciría en una disminución de las expectativas terapéuticas, al menos si basamos el concepto de control del asma en cuestionarios sobre los síntomas.
El ACT se ha mostrado como un instrumento fiable para medir el control del asma9. Sin embargo, se basa en la percepción subjetiva que un paciente pueda tener de los síntomas que padece y la respuesta a alguna de las preguntas que incluye (por ejemplo, «durante las últimas 4 semanas, ¿con qué frecuencia ha notado que le faltaba el aire?») se puede ver influenciada por procesos concomitantes que pueden provocar síntomas similares (ej: obesidad, ansiedad, etc.). Siendo así, no es de extrañar que hayamos encontrado una nula correlación entre los valores de ACT y los valores de FENO. A la misma conclusión llegaron Shirai et al en un estudio con menos pacientes y que no hacía hincapié en la presencia de comorbilidad13. Como ellos encontraban valores elevados de FENO en pacientes con control total del asma, especulaban que la presencia de una inflamación eosinofílica activa subyacente (lo que en definitiva nos estaría mostrando de forma indirecta el FENO) no es obstáculo para que la medicación elimine los síntomas. En nuestra serie se observó que el valor de FENO era significativamente más alto en el grupo de pacientes con control subóptimo (43,1 vs 24,5ppb), y el hallazgo de casos con FENO alto y ACT≥20 fue muy poco común. Aunque la hipótesis mantenida por Shirai fuese cierta, pensamos que es excesivamente simple para explicar la discordancia entre FENO y ACT. Los pacientes con asma de control difícil forman un grupo muy heterogéneo y es posible que nuestra serie haya recogido individuos con fenotipo neutrofílico o pacientes cuyos síntomas correspondan a la presencia de comorbilidad, situaciones ambas en las que el ACT podría ser bajo y el FENO normal.
La orginalidad del estudio está en haber configurado los grupos de acuerdo con el grado de control del asma, algo que no se había hecho en los trabajos previos que se centraron en el potencial efecto de la comorbilidad sobre éste. Esto nos permite acercar nuestro planteamiento a los objetivos de la última versión de la GEMA —que apuntan al control como objetivo deseable— y especular sobre las limitaciones potenciales del ACT, una herramienta ampliamente difundida en la práctica clínica habitual. Establecer una relación causa-efecto entre la presencia de comorbilidad y un mal control del asma no será fácil, ya que existen potenciales factores de confusión que harán que los resultados sean de difícil interpretación.
Una limitación potencial del estudio es el número de pacientes incluido que, aunque mayor que en estudios similares, quizás sea insuficiente para demostrar una relación estadística entre el control del asma y ciertos procesos que —como la depresión— muestran una tendencia a alcanzar signficación en nuestros resultados. Otro defecto reside en el hecho de que el diagnóstico de reflujo gastroesofágico fue meramente clínico y no se realizó phmetría o endoscopia en todos los casos, algo que presumiblemente hubiese permitido identificar casos subclínicos.
Las conclusiones de este estudio son: la gran mayoría de los pacientes con asma —ya sea éste bien o mal controlado— presenta algún proceso susceptible de empeorar el control de la enfermedad; los pacientes con un control subóptimo muestran una tendencia a acumular comorbilidades; no existe correlación entre ACT y FENO, por lo que estas herramientas reflejan realidades clínicas diferentes.
ContribucionesGSK proporcionó los analizadores de óxido nítrico utilizados en este estudio. Esta fuente de financiación no participó en el diseño del estudio, ni en la recogida de los datos, ni en su análisis o interpretación. Tampoco ha estado vinculada a la redacción del manuscrito ni a la decisión de publicarlo.
Conflicto de interesesEl Dr Luis Pérez de Llano ha recibido compensación económica de los laboratorios GSK y Astra por participar en cursos y dar charlas sobre asma.