El objetivo del estudio ha sido valorar la inflamación bronquial en niños preescolares con bronquitis de repetición, mediante la determinación del óxido nítrico exhalado.
Pacientes y métodosSe incluyó en el estudio a pacientes menores de 4 años con antecedentes de 3 episodios de sibilantes en el último año (n=63), así como un grupo control (n=30). Se determinó el óxido nítrico exhalado mediante la técnica de recogida off-line, con respiración espontánea a volumen corriente con mascarilla, recogida en bolsa de Mylar.
ResultadosEl grupo con bronquitis presentó como media una fracción de óxido nítrico en aire exhalado (FENO) más elevada (media±desviación estándar: 5,3±1,3ppb) que el grupo control (4,6±1,1) (p=0,02). Hubo una diferencia significativa (p<0,05) entre el grupo control y los niños con bronquitis que no recibían corticoides inhalados, pero no con los que sí los recibían. Se observó una relación con el número de eosinófilos en sangre, de forma que los que tenían valores más elevados (>400/μl) presentaban concentraciones de FENO más altas (p<0,01). No se apreció relación entre la FENO y el hecho de tener una prueba de provocación bronquial positiva a la metacolina. Se realizó un seguimiento de los pacientes durante más de 20 meses. No hubo diferencias significativas (p=0,36) en el valor inicial de la FENO entre los pacientes que posteriormente presentaron sibilancias transitorias (5,2±0,98ppb), infrecuentes (5,6±1,5ppb) o frecuentes (4,8±1,34ppb).
ConclusionesLos niños menores de 4 años afectados de bronquitis sibilantes de repetición en fase asintomática presentan una discreta elevación de la FENO, con una amplia superposición de valores con el grupo control.
The objective of the study was to assess bronchial inflammation in preschool children with recurrent bronchitis by measuring exhaled nitric oxide.
Patients and MethodsThe study included patients under 4 years of age with at least 3 episodes of wheezing in the past year (n=63) and a control group (n=30). Exhaled nitric oxide was measured in samples collected offline during spontaneous tidal breathing with a face mask and stored in Mylar balloons.
ResultsThe fractional exhaled nitric oxide concentration (FENO) was higher in the group with bronchitis (mean [SD], 5.3 [1.3] parts per billion [ppb]) than in the control group (4.6 [1.1]ppb) (P=.02). There was a significant difference between the control group and children in the bronchitis group not treated with inhaled corticosteroids (P<.05), but not between controls and corticosteroid-treated patients. A relationship with eosinophil count was observed in that those with higher counts (>400♯mL) had higher FENO levels (P<.01). No relationship was observed between FENO and a positive methacholine challenge test. Follow-up lasted at least 20 months. The initial FENO level did not differ significantly according to whether patients were subsequently transient, infrequent, or frequent wheezers (5.2 [0.98]ppb, 5.6 [1.5]ppb, and 4.8 [1.34]ppb, respectively; P=.36).
ConclusionsIn children under 4 years of age with recurrent wheezing bronchitis who were asymptomatic at study entry, a small increase in FENO was observed although there was a good deal of overlap with the control group.
En los últimos años numerosos estudios han establecido la utilidad de la fracción de óxido nítrico en el aire exhalado (FENO) como primer marcador no invasivo de inflamación eosinofílica de las vías aéreas1,2, y se han desarrollado dispositivos que permiten su utilización en la práctica clínica diaria3–5. Se ha confirmado su utilidad en niños mayores y adultos como herramienta diagnóstica en el asma y como instrumento para controlar el cumplimiento y la respuesta al tratamiento de los pacientes6–8. Además, se ha estandarizado su medición, mediante una normativa de la American Thoracic Society (ATS) y la European Respiratory Society (ERS)9. Esta guía incluye recomendaciones prácticas para la determinación de la FENO en lactantes y preescolares, aunque en este grupo de edad la técnica no está estandarizada.
En los lactantes y preescolares no colaboradores existen dificultades técnicas para la recogida del aire exhalado, por lo que disponemos de menos información respecto a su utilidad en estos niños, en los que las bronquitis sibilantes de repetición tienen una prevalencia muy elevada10. Aproximadamente uno de cada 3 niños presenta al menos un episodio de bronquitis con sibilantes antes de los 3 años, y la prevalencia acumulada de bronquitis sibilantes a los 6 años de edad es del 50%11,12.
El asma es un síndrome con un espectro clínico variable, caracterizado por la inflamación de las vías aéreas, según la definición de la Global Initiative for Asthma (GINA)13. Sin embargo, no se conoce bien la naturaleza de la inflamación en los lactantes y preescolares, e incluso algunos de ellos podrían no presentarla14, por lo que es difícil realizar el diagnóstico de asma en niños preescolares. Por este motivo, un documento de consenso reciente sobre el manejo de los lactantes y preescolares con bronquitis sibilantes recurrentes15 recomienda utilizar un enfoque descriptivo basado en los síntomas, y no aplicar el término “asma” a estos niños, ya que no hay evidencias claras de que la fisiopatología de las bronquitis sibilantes recurrentes a esta edad sea similar a la del asma de los niños mayores y adultos.
Debido a estas dificultades, sería de gran utilidad disponer de una prueba diagnóstica que permitiera distinguir qué niños de esta edad presentan o desarrollarán asma eosinofílica y tendrán más probabilidades de responder al tratamiento con corticoides inhalados.
Baraldi et al16 fueron los primeros en describir que los lactantes con bronquitis recurrentes tenían un valor de FENO significativamente elevado durante una exacerbación aguda, comparados con los controles sanos y con lactantes con un primer episodio de bronquitis sibilante inducido por virus. Posteriormente se han publicado algunos estudios que han encontrado valores elevados de FENO en lactantes y preescolares con bronquitis sibilantes, comparados con niños sanos, particularmente en aquéllos con una predisposición atópica17–20.
Con estos antecedentes, nos planteamos los siguientes objetivos: determinar la FENO mediante un método de recogida off-line, con respiración a volumen corriente, en un grupo de niños de corta edad (<4 años) afectados de bronquitis sibilantes de repetición, fuera de los episodios de exacerbación, para valorar si presentan un aumento de la FENO comparados con un grupo de niños sanos de la misma edad, lo que indicaría la presencia de inflamación bronquial eosinofílica persistente. Asimismo, nos planteamos analizar las variables que podrían influir en las concentraciones de FENO en estos niños, y valorar si los valores iniciales de FENO podrían predecir qué niños evolucionarán con bronquitis sibilantes persistentes.
Pacientes y métodosPacientesPara la realización del estudio se incluyó de forma consecutiva a 63 pacientes, de entre 8 meses y 3 años y 11 meses de edad, que hubieran presentado durante el último año 3 o más episodios de bronquitis aguda sibilante, diagnosticada por un médico (grupo bronquitis). Se entendió por bronquitis aguda sibilante la presencia de un cuadro agudo de tos acompañado de sibilantes a la auscultación, con o sin signos de dificultad respiratoria, siempre que se hubiera administrado tratamiento con un broncodilatador. Se admitió que hasta un tercio de los niños siguiesen tratamiento con corticoides inhalados. Se excluyó a los afectados de enfermedades crónicas pulmonares (fibrosis quística, displasia broncopulmonar, etc.) o cardiovasculares, y a aquéllos con antecedentes de prematuridad.
Asimismo se estudió a un grupo de niños sanos (grupo control) que habían nacido a término y que carecían de antecedentes familiares y personales de atopia. Esta muestra procedía de la población sana que acudía a visitas de control en un área básica de salud de la periferia de Barcelona.
Se realizó el siguiente cálculo para determinar el tamaño de muestra necesario: a partir de los datos de la literatura médica, se estimó que la media del valor de FENO del grupo control debía de estar alrededor de 5,6ppb16. Se consideró un resultado clínicamente significativo una diferencia en la FENO entre el grupo control y el grupo de pacientes con sibilantes de 2,5ppb. Asumimos una desviación estándar de 3. Teniendo en cuenta un riesgo alfa de 0,05, un riesgo beta de 0,10 y una hipótesis unilateral, se necesitan 26 pacientes en cada grupo. Contando con un 15% de pérdidas, harían falta 30 niños en cada grupo. Dado que en el grupo bronquitis se incluyó a niños con y sin tratamiento con corticoides inhalados, para permitir la comparación de ambos subgrupos con el grupo control se pensó en incluir al menos a 60 niños en el grupo bronquitis.
En los pacientes del grupo bronquitis se determinó la FENO en fase estable, fuera de los episodios de agudización, siempre y cuando no hubiesen presentado bronquitis ni otra infección respiratoria en las 3 semanas previas a la medición. En los niños del grupo control se requirió que no hubiesen presentado una infección respiratoria de las vías altas en las 3 semanas anteriores.
Se recogió en la anamnesis la existencia de antecedentes familiares de atopia y de tabaquismo pasivo, así como otros factores de riesgo de bronquitis recurrentes. A los niños con bronquitis de repetición se les aplicó el siguiente protocolo de estudio clínico, que forma parte del estudio de su enfermedad de base: hemograma con recuento del número total de eosinófilos, determinación de inmunoglobulina E (IgE) total y específica frente los neumoalérgenos Dermatophagoides farinae, Dermatophagoides pteronyssinus, caspa de gato, Alternaria, Parietaria y olivo, y pruebas cutáneas (de punción) frente a los neumoalérgenos habituales en nuestro medio (ácaros, epitelio de perro y caspa de gato, olivo, Parietaria, gramíneas, árboles). Asimismo, se realizó a todos una prueba de provocación con metacolina, con la técnica de auscultación traqueal modificada21.
Con posterioridad se realizó un seguimiento clínico prospectivo de los pacientes para diferenciar 2 grupos: los que continuaban presentando bronquitis sibilantes y los que habían dejado de presentarlas. De esta forma, tras el seguimiento se clasificó a los pacientes en los grupos de bronquitis sibilantes transitorias (ningún episodio de bronquitis en el último año), bronquitis sibilantes infrecuentes (≤3 episodios/año) y bronquitis sibilantes frecuentes (>3 episodios/año).
El estudio fue aprobado por el Comité de Ética e Investigación Clínica local, y la inclusión de los niños se hizo previa información y consentimiento de los padres por escrito.
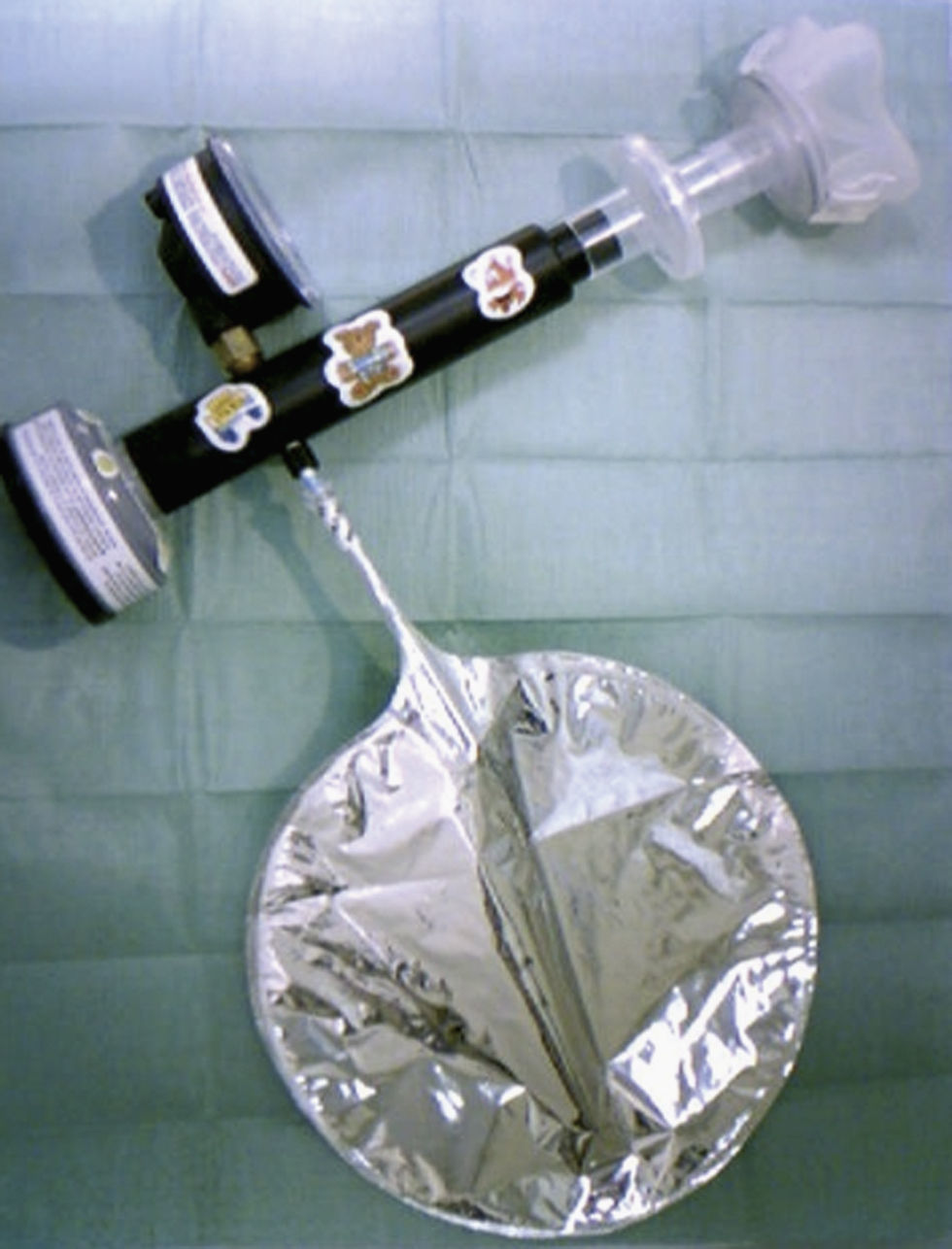
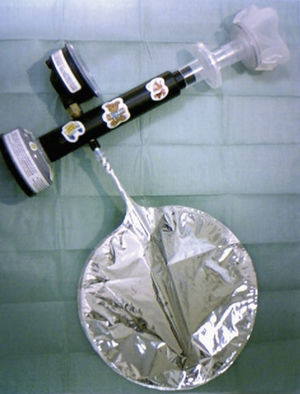
MétodosSe determinó la FENO mediante una técnica off-line, recogiendo el aire exhalado en una bolsa Mylar, cuyo contenido se analizó posteriormente. Para la recogida del aire exhalado utilizamos el sistema Deadspace Discard Bag Collection and Sampling Kit (BSK 01400; Sievers Instruments, Inc., Boulder, Co, EE.UU.). Este sistema se adapta a las recomendaciones de la ATS/ERS9 para la determinación de óxido nítrico (NO) off-line, e incluye los siguientes elementos (fig. 1): a) un filtro cero para NO, que permite una inspiración de aire libre de NO, con lo que se evita la contaminación ambiental; b) un manómetro para controlar la presión espiratoria; c) una bolsa Mylar de recogida, de 1,5l de capacidad, impermeable a los gases del exterior e inerte para el NO, y equipada con una válvula antirreflujo; d) una válvula para facilitar la circulación del aire por el sistema, que al abrirse permite su paso hacia la bolsa, y e) un filtro antibacteriano y antivírico de un solo uso, al que se conectó una mascarilla con tabique nasal (Rudolf Face Masks; Pediatric Small 7970 ♯2, Hans Rudolf, Inc., Mi, EE.UU.) para evitar la contaminación del aire exhalado con NO nasal.
El dispositivo proporciona una resistencia fija que hace que durante la espiración la presión varíe según el esfuerzo del niño entre 5 y 25cmH2O, lo que, con el diseño del sistema, supondría un flujo espiratorio entre 50 y 125ml/s22. Ya que a los niños pequeños no es posible enseñarles a mantener un flujo espiratorio constante, la recogida de la muestra se realiza durante la respiración a volumen corriente, y se obtiene un flujo espiratorio variable que oscila entre 0ml/s (justo antes de iniciar la espiración) y 125ml/s. La presión espiratoria superior a 5cmH2O ayuda a cerrar el paladar blando, lo que evita la contaminación del aire procedente de las vías respiratorias altas.
Antes de realizar la medición se limpiaban las bolsas de recogida aspirando el gas de su interior mediante la bomba de vacío del analizador, rellenándolas de gas libre de NO (oxígeno medicinal) y aspirando de nuevo el gas con la bomba de vacío.
Para la recogida de la muestra, se sentaba al niño en brazos de su madre o padre y, tras colocarle la mascarilla facial sobre la boca y la nariz, se le permitía realizar 5–10 respiraciones a volumen corriente a través del filtro cero. A continuación, mientras el niño mantenía un patrón respiratorio estable, se abría la válvula para recoger en la bolsa el aire espirado durante 15–45s (volúmenes aproximados de 50 a 300ml).
El NO del aire recogido en las bolsas se midió mediante un analizador de quimioluminiscencia (LR2000, Logan Research, Rochester, Reino Unido), conectando la bolsa Mylar a una línea de teflón del medidor de NO. Se realizó la medición del NO en la fase de nivel estable o meseta. El analizador se calibró diariamente con una bombona de NO de 110ppb.
Se recogieron 2 muestras por niño, que se medían en las 2h siguientes a su toma. Para cada paciente se tomó como valor de NO la media de los valores obtenidos en la medición de las 2 bolsas.
Análisis estadísticoEl análisis estadístico de los datos se ha realizado con el programa Medcalc® versión 9.0.1.0. Para estudiar la normalidad de la distribución de las variables se aplicó la prueba de normalidad de Kolmogorov-Smirnov. Para realizar las comparaciones entre 2 grupos, si seguían una distribución normal, se aplicó el test de la t de Student para datos no emparejados. De lo contrario, se aplicó el test no paramétrico de la U de Mann-Whitney. Para comparar 3 o más grupos se utilizó el análisis de la variancia de una vía, seguido del test de Bonferroni, o el test de Kruskal-Wallis si las variables no seguían una distribución normal. La comparación entre las variables cualitativas se efectuó mediante el test de la χ2. Se estudió la relación entre variables cuantitativas mediante el coeficiente de correlación de Pearson. Los resultados se expresan como media y desviación estándar. Se han considerado significativos valores de p<0,05.
ResultadosSe pudo determinar la FENO en 25 de los 30 niños del grupo control y en 62 de los 63 del grupo de pacientes con bronquitis de repetición. En los 6 niños en que no se consiguió medir fue debido a la falta de colaboración para la realización de la prueba (llanto intenso).
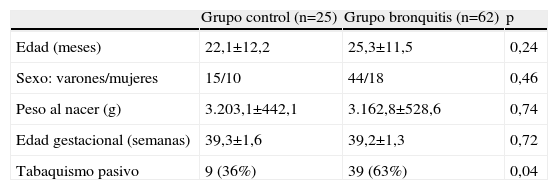
Los niños del grupo bronquitis tuvieron una edad media (±desviación estándar) de 25,3±11,5 meses, y los del grupo control, de 22,1±12,2 meses. Los grupos no difirieron en cuanto a sus características basales (tabla 1): edad, sexo, peso al nacimiento y edad gestacional. La proporción de niños expuestos al tabaco en su domicilio fue mayor en el grupo bronquitis (63%) que en el control (36%) (p=0,04).
Comparación de las características basales de los grupos control y bronquitis
| Grupo control (n=25) | Grupo bronquitis (n=62) | p | |
| Edad (meses) | 22,1±12,2 | 25,3±11,5 | 0,24 |
| Sexo: varones/mujeres | 15/10 | 44/18 | 0,46 |
| Peso al nacer (g) | 3.203,1±442,1 | 3.162,8±528,6 | 0,74 |
| Edad gestacional (semanas) | 39,3±1,6 | 39,2±1,3 | 0,72 |
| Tabaquismo pasivo | 9 (36%) | 39 (63%) | 0,04 |
Valores expresados como media±desviación estándar, o número de casos (porcentaje).
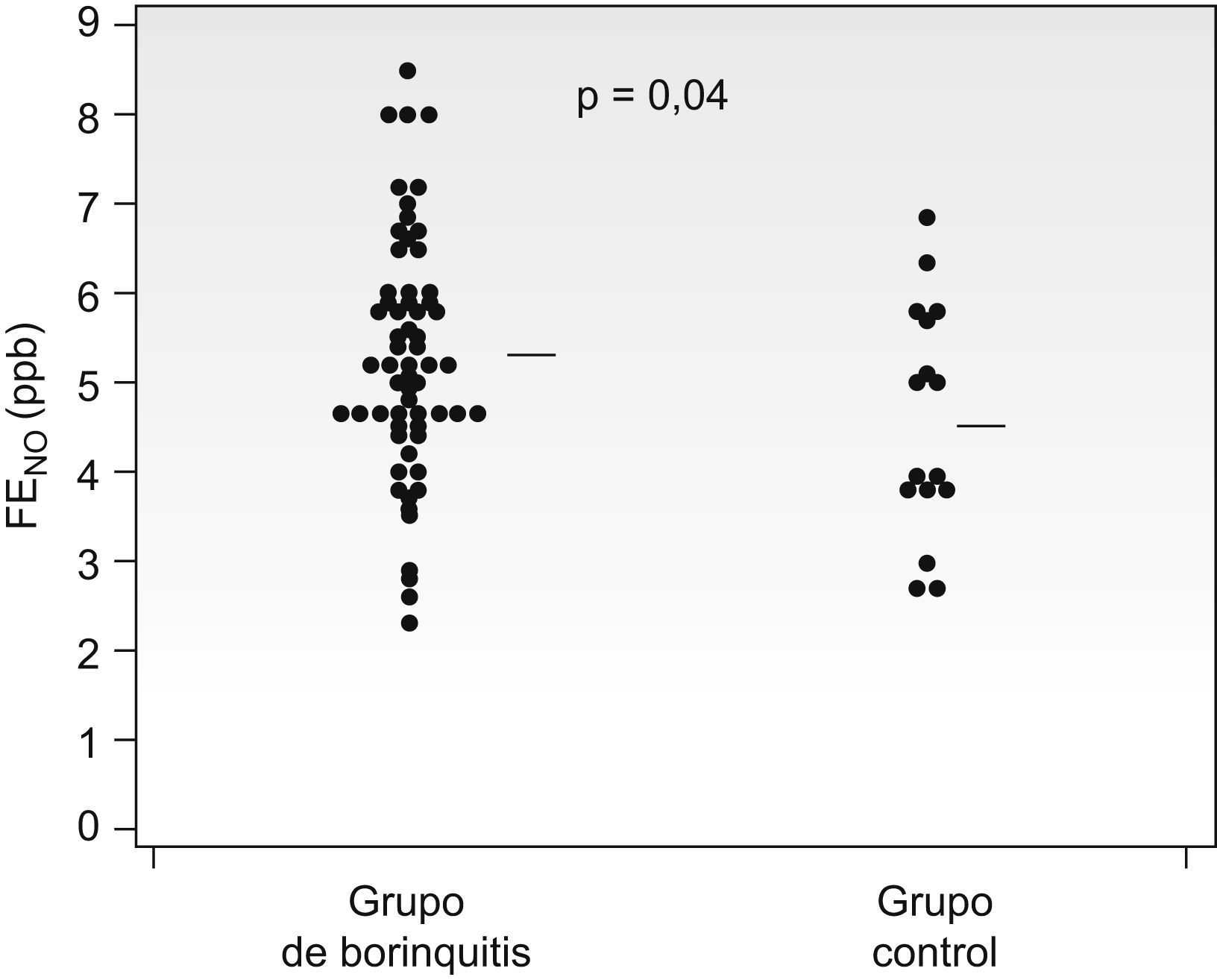
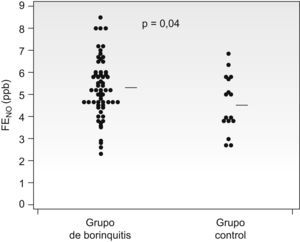
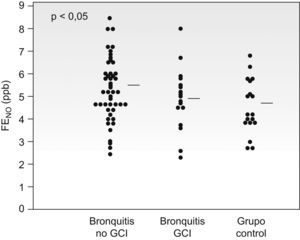
El valor de la FENO fue mayor en el grupo bronquitis (5,3±1,3ppb) que en el de niños sanos (4,6±1,1ppb) (p=0,02), aunque hubo una amplia superposición de valores (fig. 2).
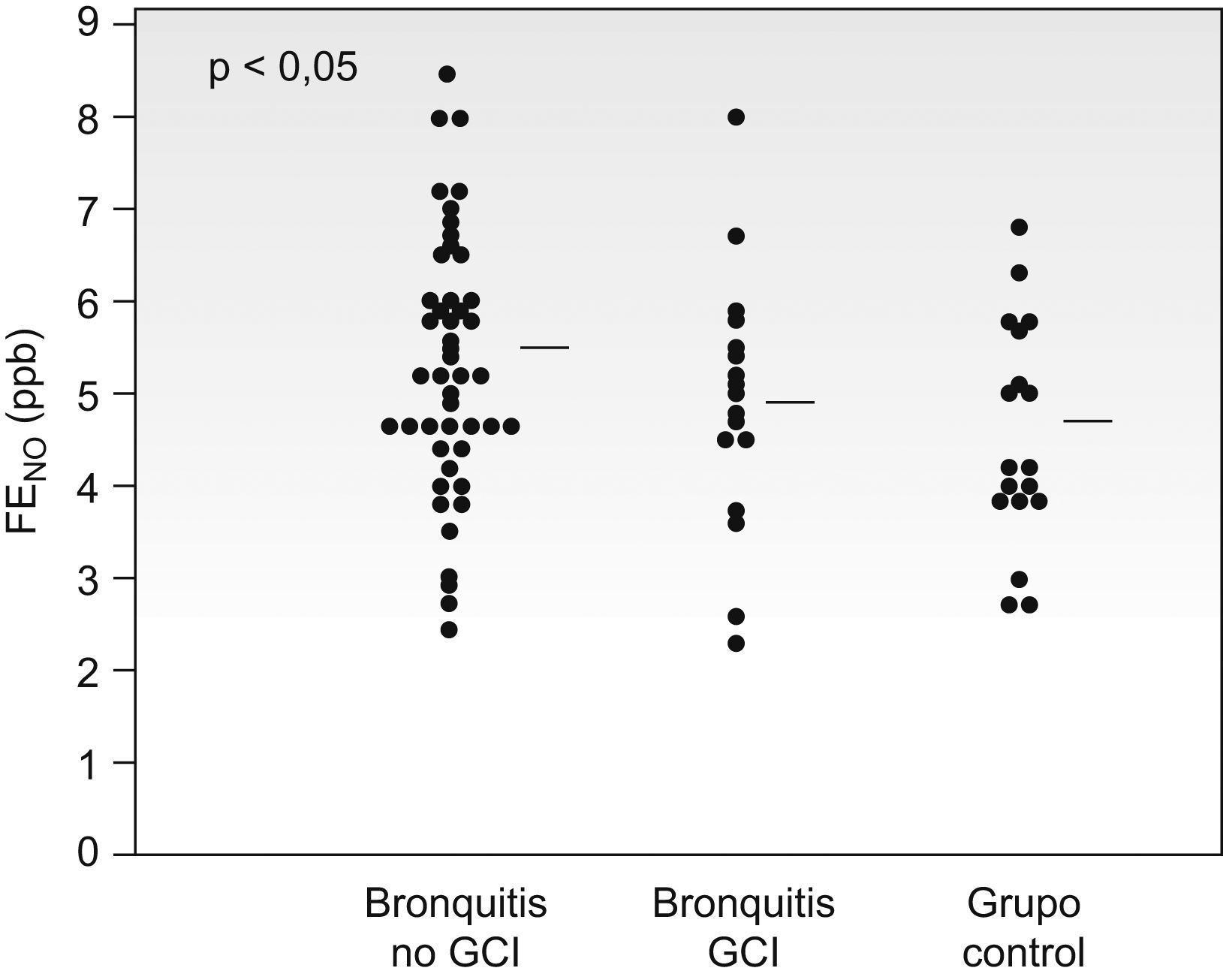
Al considerar el valor de la FENO en los pacientes del grupo bronquitis separando los que recibían tratamiento con corticoides inhalados (4,9±1,4ppb) de los que no lo recibían (5,4±1,3ppb), únicamente en estos últimos el valor del FENO fue superior al del grupo control (fig. 3).
En el grupo control de niños sanos el valor de la FENO no tuvo relación con la edad de la niños (r=−0,09; p=0,65), el peso al nacimiento (r=−0,28; p=0,18), la edad gestacional (r=−0,21; p=0,32), ni con la exposición al humo de tabaco en el domicilio (p=0,2). El valor de FENO fue más elevado en las niñas sanas [5,3ppb (DE 0,7)] que en los niños sanos [4,1; (DE 1,1)], (p=0,006).
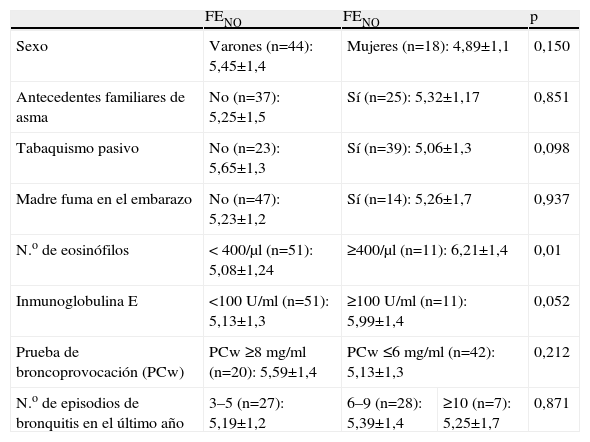
En el grupo de pacientes con bronquitis de repetición, la FENO no se relacionó con la edad (r=0,24; p=0,06), la edad gestacional (r=−0,1; p=0,44) y el peso al nacer (r=0,02; p=0,89). A diferencia del grupo de niños sanos, no hubo relación entre el sexo y la FENO. Tampoco hubo relación entre la FENO y la presencia de antecedentes familiares de asma, la exposición al humo del tabaco o el número de crisis de bronquitis agudas presentadas en el último año (tabla 2).
Comparación de los valores de óxido nítrico exhalado (FENO) con las diferentes variables en el grupo de pacientes con bronquitis de repetición
| FENO | FENO | p | ||
| Sexo | Varones (n=44): 5,45±1,4 | Mujeres (n=18): 4,89±1,1 | 0,150 | |
| Antecedentes familiares de asma | No (n=37): 5,25±1,5 | Sí (n=25): 5,32±1,17 | 0,851 | |
| Tabaquismo pasivo | No (n=23): 5,65±1,3 | Sí (n=39): 5,06±1,3 | 0,098 | |
| Madre fuma en el embarazo | No (n=47): 5,23±1,2 | Sí (n=14): 5,26±1,7 | 0,937 | |
| N.o de eosinófilos | < 400/μl (n=51): 5,08±1,24 | ≥400/μl (n=11): 6,21±1,4 | 0,01 | |
| Inmunoglobulina E | <100 U/ml (n=51): 5,13±1,3 | ≥100U/ml (n=11): 5,99±1,4 | 0,052 | |
| Prueba de broncoprovocación (PCw) | PCw ≥8mg/ml (n=20): 5,59±1,4 | PCw ≤6mg/ml (n=42): 5,13±1,3 | 0,212 | |
| N.o de episodios de bronquitis en el último año | 3–5 (n=27): 5,19±1,2 | 6–9 (n=28): 5,39±1,4 | ≥10 (n=7): 5,25±1,7 | 0,871 |
Valores expresados como media (desviación estándar).
PCw: PCwheeze.
Los niños del grupo bronquitis con una concentración de IgE de 100U/ml o superior tuvieron un valor ligeramente más elevado de FENO (5,99ppb) que los niños con una concentración menor de 100U/ml (5,13ppb), en el límite de la significación estadística (p=0,052), y aquéllos con un recuento de eosinófilos de 400/μl o más presentaron una cifra más elevada de FENO (6,21ppb) que los niños con un recuento inferior (p=0,01).
En 7 pacientes las pruebas cutáneas a neumoalérgenos o la IgE específica fueron positivas. La mediana del valor de FENO fue ligeramente superior (6,7ppb) que en el grupo en que estas pruebas fueron negativas (5,2ppb), pero sin ser la diferencia estadísticamente significativa (p=0,12).
En los niños con bronquitis de repetición se midió la hiperrespuesta bronquial mediante el método de la PCwheeze (PCw). No hubo diferencias significativas en la FENO entre el grupo que presentó hiperrespuesta bronquial (PCw<6mg/ml) y el que no la presentó (PCw≥8mg/ml).
Se completó un seguimiento de 20 meses o superior en 49 de los 62 pacientes. En el resto no fue posible por cambios de domicilio, o porque no acudieron a los controles y resultó imposible establecer contacto con ellos. El tiempo medio de seguimiento fue de 28,6 meses (rango: 21,6–41,8), y la edad media tras el seguimiento, de 53,8 meses (rango: 35–90). Tras el seguimiento 16 pacientes (32,7%) no habían tenido episodios de bronquitis en el último año (sibilantes transitorios), 23 (46,9%) habían tenido de uno a 3 episodios (sibilantes infrecuentes) y 10 (20,4%) habían presentado 3 o más episodios (sibilantes frecuentes).
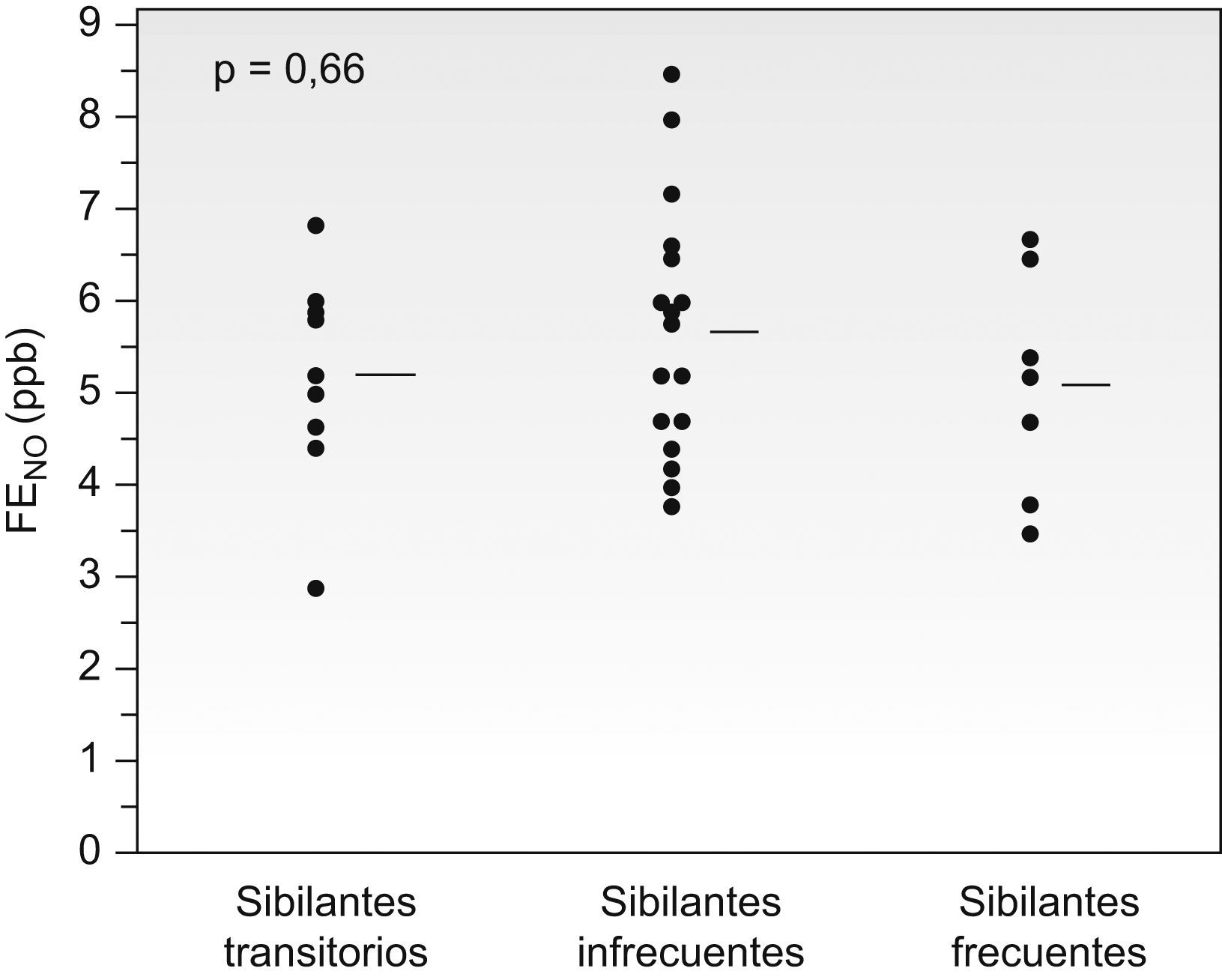
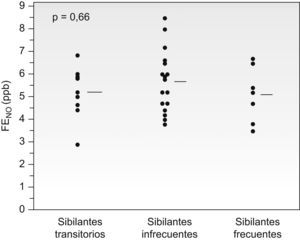
No hubo diferencias significativas (p=0,36) en el valor inicial de la FENO entre los pacientes que posteriormente fueron sibilantes transitorios (5,2±0,98ppb), infrecuentes (5,6±1,5ppb) o frecuentes (4,8±1,34ppb). Resultados similares se obtuvieron al considerar sólo a los pacientes que no recibían tratamiento con corticoides inhalados cuando se determinó la FENO (p=0,65) (fig. 4). El valor inicial de la FENO no fue predictivo de la persistencia de los episodios de bronquitis sibilantes posteriores, ni al analizarla en el conjunto de pacientes (área bajo la curva de eficacia diagnóstica=0,48; p=0,79) ni al analizarla sólo en aquellos que no recibían tratamiento con corticoides inhalados (área bajo la curva de eficacia diagnóstica=0,56; p=0,62).
Comparación de los valores iniciales de óxido nítrico exhalado (FENO) en los pacientes con bronquitis sibilantes recurrentes según se clasificaran sus episodios en el seguimiento posterior como bronquitis sibilantes transitorias, bronquitis sibilantes infrecuentes (1 a 3 episodios de bronquitis en el último año) o bronquitis sibilantes frecuentes (>3 episodios de bronquitis en el último año). Se incluye sólo a los pacientes que no recibían tratamiento con corticoides inhalados en el momento de la medición del FENO. Las líneas horizontales representan los valores medios.
En nuestro trabajo hemos demostrado que es posible realizar de una forma fiable la medición de la FENO en niños menores de 4 años no sedados, y hemos encontrado que los niños menores de 4 años con bronquitis sibilantes de repetición presentan un ligero incremento de la FENO con respecto a los sanos, aunque hubo una amplia superposición de valores entre ambos grupos. El valor de FENO no fue, por otro lado, predictivo de la persistencia de bronquitis con sibilantes.
La FENO pudo determinarse de forma satisfactoria en un porcentaje muy elevado de niños (el 98,5% de aquéllos con bronquitis sibilantes y el 86,5% de los controles sanos). Los niños afectados de bronquitis sibilantes están habituados a recibir medicamentos inhalados mediante cámara espaciadora con mascarilla, y el aparato de recogida de muestras de FENO es similar a una cámara espaciadora. En cambio, los niños sanos nunca habían utilizado una cámara espaciadora, de modo que en algunos de ellos, al colocarles el aparato de toma de muestras, la reacción de rechazo fue mayor, con llanto que imposibilitó la realización de la prueba.
Los valores medios normales de FENO en nuestra serie (4,6ppb) fueron similares a los encontrados por otros autores en estudios previos16,18,23. En cambio, Franklin et al19, que compararon los métodos de respiración única on-line y de respiración a volumen corriente off-line en niños sanos, obtuvieron unos valores medios más elevados, de 23,2 y 13,8ppb, respectivamente, lo que resalta la necesidad de disponer de valores propios de normalidad, dada la falta de estandarización de la técnica.
Aunque en el grupo de niños con bronquitis de repetición los valores de FENO fueron más elevados que en los niños sanos, hubo una superposición muy importante de valores entre ambos, lo que significa que la FENO no posee un valor discriminativo para diferenciar a los niños con bronquitis de repetición de los niños sanos, a diferencia de lo que se ha observado en trabajos efectuados en niños más mayores y en adultos, en quienes la FENO tiene una buena especificidad y sensibilidad para establecer el diagnóstico de asma6,24. Esta superposición de valores también se ha observado en otros estudios realizados en lactantes y preescolares16,18,20. Puede haber varias razones para ello. La FENO se considera un marcador no invasivo de la presencia de inflamación eosinofílica bronquial, pues tiene una buena correlación con el porcentaje de eosinófilos en las muestras de esputo inducido, lavado broncoalveolar y biopsia bronquial25. En los últimos años, varios estudios en niños lactantes y preescolares que han utilizado estas técnicas parecen demostrar que en los primeros 2 años de vida no existe (o apenas existe) inflamación eosinofílica, que empezaría a aparecer a partir de los 3 años y estaría más claramente establecida a partir de los 5 años de edad14,26. De acuerdo con esto, la ausencia de un claro aumento de la FENO en nuestro trabajo indicaría que la mayoría de los niños con bronquitis sibilantes recurrentes tendrían una inflamación bronquial de otro tipo (probablemente neutrofílica). En cualquier caso, sí observamos en nuestro trabajo una relación entre los valores de la FENO y los marcadores de inflamación eosinofílica, como el número de eosinófilos periféricos y la IgE total. Siete pacientes en quienes las pruebas cutáneas o el test radioalergosorbente fueron positivos tenían un valor de FENO superior (6,7 frente a 5,2ppb), aunque las diferencias no fueron significativas, dado el escaso número de niños que reunían este requisito. Otros autores sí han encontrado un aumento significativo en lactantes con bronquitis recurrentes y antecedentes de atopia en relación con los lactantes con bronquitis recurrentes sin antecedentes de atopia, aunque también con una superposición importante entre los grupos20.
Otra de las utilidades de la determinación de la FENO es que sirve de ayuda para controlar la evolución del asma y su tratamiento7,8. En nuestro estudio los niños con bronquitis sibilantes de repetición que no tomaban corticoides inhalados tuvieron un valor de FENO superior al de los niños sanos, mientras que los que se hallaban en tratamiento con corticoides inhalados no presentaban diferencias con los niños sanos. Este dato, junto con lo comentado en relación con la atopia, indica que la medición del FENO podría tener utilidad para determinar qué lactantes están afectados de asma atópica o predispuestos a desarrollarla. Sin embargo, la gran superposición de valores encontrada en nuestro estudio y en trabajos previos limita esta utilidad.
Varios factores pueden limitar la validez y utilidad de la determinación de la FENO en los preescolares y lactantes:
- •
La contaminación por NO ambiental. La existencia de contaminación ambiental por NO a partir de concentraciones bajas, de 5–10ppb, puede afectar la medición de la FENO en los niños pequeños27. En nuestro caso, para evitar este problema, antes de la recogida de la muestra de aire exhalado los niños respiraban a través de un filtro cero de NO.
- •
La contaminación por NO nasal. Aunque hay autores que consideran que no es un factor importante porque los senos paranasales a esta edad están poco neumatizados y, por lo tanto, la contaminación es mínima, se ha descrito una eliminación elevada de NO procedente de las vías aéreas superiores en recién nacidos pretérmino y a término28. Nosotros hemos descartado la exhalación de aire nasal mediante una mascarilla especial con tabique nasal, colocada sobre la boca y la nariz. Además, al cerrar la válvula del sistema de recogida, la resistencia del sistema genera una presión de al menos 3–5cmH2O, que ayuda a cerrar el paladar blando y contribuye también a evitar la contaminación nasal y paranasal.
- •
El problema más importante es la influencia del flujo espiratorio: la FENO varía con el flujo; a menor flujo, mayor FENO. Una limitación de la técnica de recogida del aire exhalado en lactantes y preescolares a respiración corriente es la imposibilidad de realizarla a un flujo constante (50ml/s, como recomienda la ATS/ERS9). La técnica recomendada en adultos y niños colaboradores es la exhalación única contra resistencia a un flujo controlado de 50ml/s. Desafortunadamente esta técnica no es aplicable a los lactantes y preescolares. Wildhaber et al17 han desarrollado un método similar utilizando la técnica de la compresión forzada (empleada para la medición de los flujos forzados en los lactantes) y analizando el gas espirado. Sin embargo, es una técnica complicada, que requiere de aparatos especializados y de sedación. Por ello, la técnica más empleada en lactantes y preescolares ha sido la de la respiración a volumen corriente. Algunos autores han descrito modificaciones de esta técnica utilizando una resistencia espiratoria variable que modifican para mantener un flujo de 50ml/s en niños mayores de 2 años23, o bien acoplando un neumotacógrafo de forma simultánea a la medición on-line a volumen corriente para seleccionar la fase de la espiración en la que el flujo espiratorio es igual a 50ml/s29.
Además de estos factores técnicos, hay parámetros fisiológicos, como el sexo, o ambientales, como el tabaco, que podrían influir en las concentraciones de NO exhalado. Hay discrepancias respecto al grado de influencia del sexo. Al contrario de lo que ocurre en niños mayores, en los que no hay diferencias en función del sexo, en los lactantes se han encontrado resultados algo variables. Nosotros, coincidiendo con Franklin et al19, encontramos unos valores de FENO significativamente mayores en el sexo femenino respecto al masculino en el grupo control, aunque no se apreció tal diferencia en el grupo de niños con bronquitis. Es posible que en estas diferencias en relación con el sexo influyan factores genéticos. Por otro lado, en la literatura médica se ha relacionado el tabaquismo prenatal, pero no el posnatal, con valores inferiores de FENO en los lactantes29,30. Nosotros, sin embargo, no hemos encontrado diferencias significativas en los valores de FENO en relación con la exposición pre o posnatal al tabaco, ni en el grupo de niños con bronquitis sibilantes ni en el de niños sanos.
Hemos visto en nuestro estudio que los niños pequeños con bronquitis sibilantes de repetición presentan mayor hiperrespuesta bronquial que los niños sanos, así como valores mayores de NO exhalado. En cambio, no hemos encontrado relación entre la presencia de hiperrespuesta bronquial, o su grado, y los valores de FENO. Esto concuerda con la idea de que no hay una relación directa entre la inflamación bronquial y la hiperrespuesta bronquial31, en la que influirían otros factores como el tono muscular, la remodelación de la pared bronquial o la disfunción autonómica.
Finalmente, a partir de nuestros hallazgos no parece que la determinación de la FENO en niños pequeños pueda predecir el desarrollo futuro de asma, y en la actualidad no hay en la literatura médica evidencias en este sentido.
Nuestro trabajo y los estudios realizados hasta ahora en lactantes y preescolares parecen indicar que es probable que, con un perfeccionamiento y una estandarización mayores de las técnicas de medición, la FENO pueda ser de utilidad clínica en los niños pequeños, aunque, en cualquier caso, no tan útil como en los niños mayores, en parte por las diferencias fisiopatológicas, y en parte por los problemas metodológicos32,33.
FinanciaciónEstudio financiado con las siguientes ayudas: Beca SEPAR 2001, Beca Fundació Oscar Ravà de la FUCAP 2001 y Beca Fundació Gol i Gorina.