El ronquido y el síndrome de apneas-hipopneas durante el sueño (SAHS) son dos enfermedades con una importante relevancia, debido a su elevada prevalencia en la población general y a su destacable morbimortalidad, asociada sobre todo a sus consecuencias nocivas sobre el sistema cardiovascular. Además del sexo, la edad, el peso, las malformaciones craneofaciales, el consumo de alcohol y los fármacos hipnóticos, se ha postulado que el tabaco puede constituir un factor de riesgo para desarrollar trastornos respiratorios durante el sueño. Si bien existe una evidencia sólida de la asociación independiente entre ronquido y tabaco tanto en niños como en adultos, en el caso del SAHS, a pesar de haber numerosos trabajos que evalúan dicha cuestión, todavía no está suficientemente claro si el tabaco constituye un factor de riesgo independiente para el desarrollo de SAHS, probablemente porque, si tal asociación existe, debe de ser muy débil.
Snoring and sleep apnea-hypopnea syndrome (SAHS) are two disorders of considerable relevance due to their high prevalence in the general population and their notable morbidity and mortality, particularly in association with their harmful effects on the cardiovascular system. As well as sex, age, weight, craniofacial malformations, alcohol consumption, and use of hypnotic drugs, it has been suggested that smoking may be a risk factor for developing sleep-disordered breathing. While there is solid evidence for the independent association between snoring and smoking in both children and adults, it is still unclear whether smoking constitutes an independent risk factor for developing SAHS, despite the many studies carried out to assess this link. This is probably because the association, if it exists, is very weak.
El ronquido y el síndrome de apneas-hipopneas durante el sueño (SAHS) son las enfermedades respiratorias asociadas al sueño más frecuentes. El ronquido es un trastorno muy habitual, que afecta a un 16–33% de los varones y a un 8–9% de las mujeres1–4. Su presencia se ha asociado a excesiva somnolencia diurna incluso aunque no haya un SAHS5–7 y a un incremento del riesgo cardiovascular8, de diabetes mellitus9 y de hipertensión inducida por el embarazo10.
El SAHS, según el documento de consenso nacional11, se define como un cuadro de somnolencia excesiva, trastornos cognitivo-conductuales, respiratorios, cardíacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior durante el sueño. Estos episodios se miden con el índice de alteración respiratoria. Un índice de alteración respiratoria mayor de 5h−1 asociado a síntomas relacionados con la enfermedad y no explicados por otras causas confirma el diagnóstico. El índice de alteración respiratoria se define como el número de apneas, hipopneas y esfuerzos respiratorios asociados a microdespertares por hora de sueño. Estudios poblacionales indican que la prevalencia del SAHS se sitúa en torno a un 2% de las mujeres y un 4% de los varones de edad media de la población general12,13. Debido a su gran prevalencia, las repercusiones sociolaborales, el desarrollo de enfermedades cardiovasculares14–17 y cerebrovasculares18, su asociación con accidentes de tráfico19 y su impacto negativo tanto en la calidad de vida20 como en la supervivencia21, se considera un problema sanitario de primera magnitud22–31.
Los factores de riesgo clásicos que se asocian a los trastornos respiratorios del sueño (TRS) son el sexo masculino32,33, la obesidad32, la edad32,33, el consumo de alcohol y relajantes musculares o hipnóticos32,33 y las malformaciones de la vía aérea superior como la retromicrognatia o el velo del paladar redundante y edematoso32,34. Además de dichos factores, también podría ser necesario considerar el consumo de tabaco, factor de riesgo por excelencia para la mayoría de los trastornos respiratorios35–37, con importantes repercusiones sobre la salud y la calidad de vida38–41, y todavía no completamente controlado con las intervenciones disponibles en la actualidad42–48. El tabaquismo es muy prevalente en los pacientes con SAHS, y hay datos en la bibliografía que apuntan a que se podría comportar como un factor de riesgo para desarrollar el síndrome. En la presente revisión se analizarán las bases fisiopatológicas, la prevalencia y los estudios más relevantes de la interacción existente entre el tabaco y los TRS, tanto en adultos como en niños.
Roncopatía y tabacoEl ronquido puede definirse como un fenómeno acústico complejo, que aparece durante el sueño debido a la vibración de estructuras orofaríngeas, y expresa la existencia de una resistencia al flujo aéreo en la vía aérea superior49. Su complejidad se debe a la interacción de uno o varios niveles de la orofaringe (nasal, oral, etc.), que podría conducir a una vía aérea lábil, que se comportaría de forma inestable y heterogénea50.
El ronquido es un síntoma clínico cuya importancia, hasta hace pocos años, se reducía a la de un fenómeno social objeto de problemas de pareja y convivencia. En los últimos 20 años se le ha prestado especial atención, probablemente en relación con el auge del estudio de los trastornos del sueño, corriente ésta que ha favorecido su estudio y la investigación de su génesis, fisiopatología y repercusión sobre la salud. En la actualidad, el ronquido se considera un síntoma dentro del espectro de alteraciones agrupadas en la categoría de TRS51, que comprenderían desde el ronquido simple hasta la apnea establecida. Según la presencia, en mayor o menor medida, de estos síntomas, se debe sospechar la posibilidad de que haya una enfermedad de base, que puede ir del ronquido simple (pacientes que roncan pero no presentan somnolencia diurna) hasta el ronquido asociado a somnolencia excesiva sin apneas presenciadas y el diagnóstico de SAHS establecido. Seguidamente se analizará la posible asociación entre el consumo de tabaco y la presencia de roncopatía y SAHS.
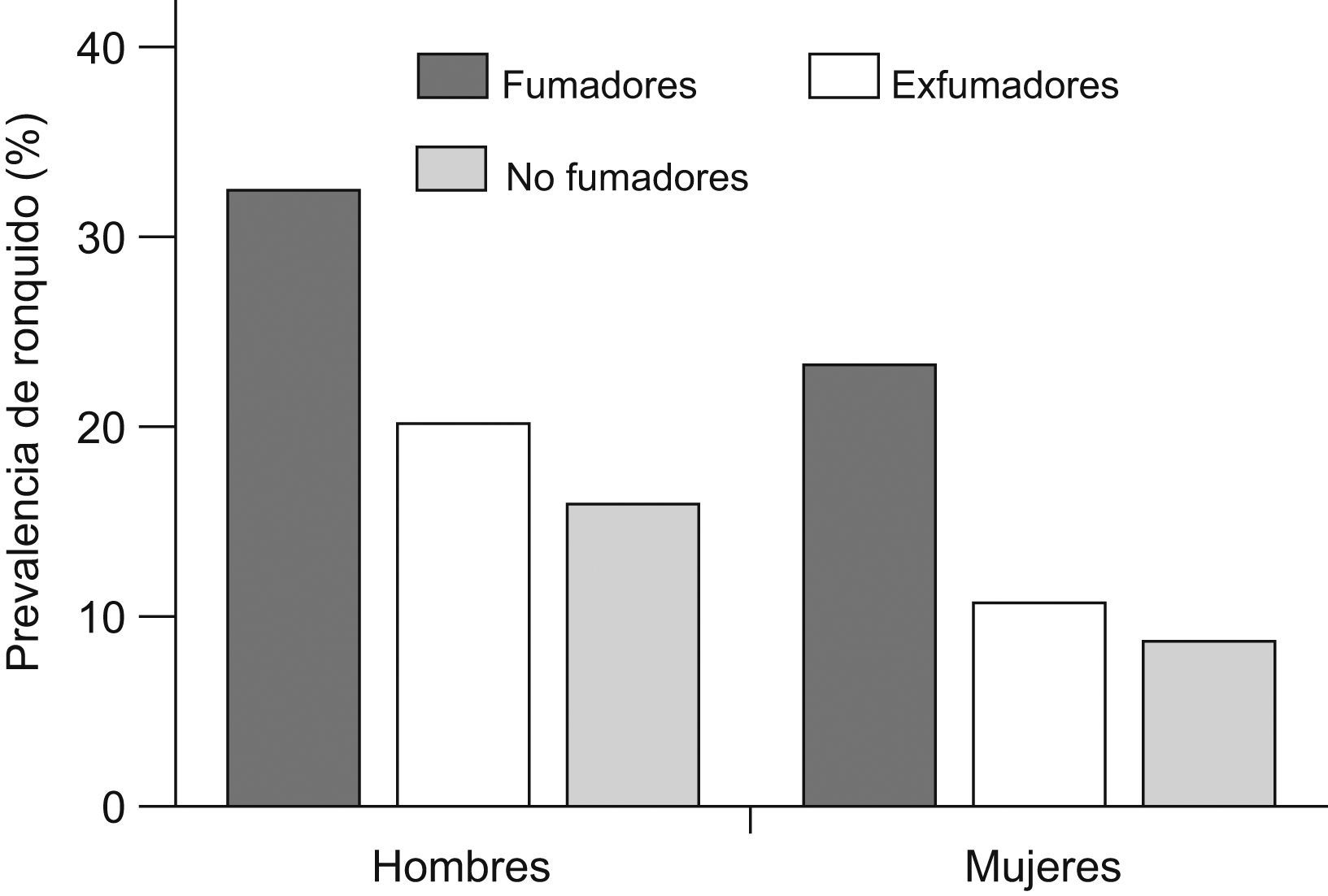
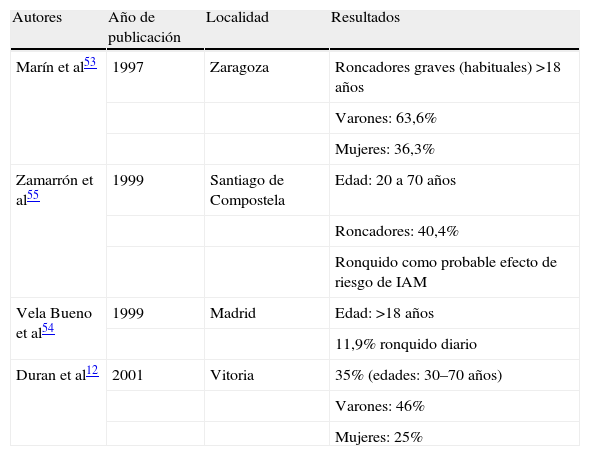
El ronquido es un fenómeno frecuente, aunque con amplia variabilidad según las series publicadas. En general, su prevalencia se cifra en un 40% en los varones y en un 20% en las mujeres52. Los estudios de prevalencia realizados en España12,53–55 se recogen en la tabla 1. La principal limitación de estos estudios es que la mayoría se basa en la utilización de cuestionarios clínicos, de modo que la medida del ronquido es una percepción subjetiva.
Estudios de prevalencia de ronquido en España
| Autores | Año de publicación | Localidad | Resultados |
| Marín et al53 | 1997 | Zaragoza | Roncadores graves (habituales) >18 años |
| Varones: 63,6% | |||
| Mujeres: 36,3% | |||
| Zamarrón et al55 | 1999 | Santiago de Compostela | Edad: 20 a 70 años |
| Roncadores: 40,4% | |||
| Ronquido como probable efecto de riesgo de IAM | |||
| Vela Bueno et al54 | 1999 | Madrid | Edad: >18 años |
| 11,9% ronquido diario | |||
| Duran et al12 | 2001 | Vitoria | 35% (edades: 30–70 años) |
| Varones: 46% | |||
| Mujeres: 25% |
IAM: infarto agudo de miocardio.
Hay una serie de factores de riesgo que se han asociado a la presencia del ronquido, tales como la edad, el sexo, el consumo de alcohol o ciertos fármacos (hipnóticos, relajantes musculares) y la obesidad, entre otros. La prevalencia aumenta con la edad56,57 —a partir de los 20 años en varones y de los 40 años en las mujeres—, con tendencia a disminuir a partir de la séptima década. También se ha demostrado que el ronquido es más frecuente en el sexo masculino49. La obesidad —índice de masa corporal (IMC) >25kg/m2— es el factor que clásicamente más se ha asociado al ronquido, cuya frecuencia aumenta de forma correlativa con un mayor IMC12,58. El consumo de alcohol también se ha ligado a la presencia de ronquido, sobre todo si se ingiere en las últimas horas del día. Este efecto se produce por una mayor relajación de la musculatura orofaríngea, lo que favorece su colapsabilidad y, por lo tanto, la aparición del ronquido.
Múltiples alteraciones anatómicas de la nariz y orofaringe pueden acompañarse de ronquidos, como, por ejemplo, la desviación del tabique nasal, la congestión y/o presencia de pólipos nasales, el aumento de la úvula o del paladar blando, la micrognatia, la macroglosia, el desarrollo excesivo de los pilares faríngeos, la hipertrofia amigdalar o los pólipos laríngeos59–61. También es más frecuente el ronquido en la posición de decúbito supino, por el desplazamiento posterior de la lengua, lo que en presencia de otros factores puede favorecer la obstrucción de la vía aérea.
Hay varias hipótesis que podrían explicar la potencial asociación entre la roncopatía y el consumo de tabaco. En primer lugar, el tabaco incrementa la respuesta inflamatoria de la vía aérea superior56,62. En la mucosa sinusal se han descrito cambios histológicos como hiperqueratosis o leucoplasia en la mucosa nasal de los fumadores63. Por otro lado, el tabaco aumenta las resistencias en las fosas nasales, especialmente en adultos jóvenes con asma o rinitis64. En la laringe, además del cáncer y otras lesiones premalignas relacionadas con su consumo, también puede aparecer edema de Reinke, enfermedad relacionada directamente con el humo del tabaco, que provoca irritación crónica de las cuerdas vocales y edema. Otro mecanismo patogénico descrito es la relación entre la aparición del ronquido con la disminución progresiva de las concentraciones sanguíneas de nicotina durante el período nocturno y la disminución del tono muscular secundaria a este proceso65, lo que favorecería la colapsabilidad de la vía aérea superior y potencialmente el ronquido.
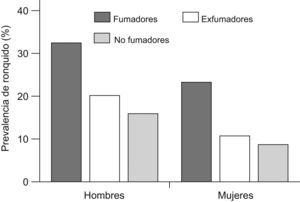
Varios trabajos han tratado de esclarecer si el consumo de tabaco también constituye un factor de riesgo para el ronquido. Ya en 1988 Bloom et al56 publicaron un estudio en el que valoraron los posibles factores de riesgo asociados al ronquido en 2.187 sujetos de raza blanca del Tucson Epidemiologic Study of Airways Obstructive Diseases. Los datos se recogieron mediante cuestionarios autoadministrados, en los que se preguntaba por la presencia y frecuencia de ronquido, así como el consumo de alcohol y otros fármacos. Según el consumo de tabaco, se clasificó a los participantes en no fumadores, exfumadores y fumadores activos, y se incluyó una historia tabáquica completa en estos 2 últimos grupos. Se apreció una prevalencia de ronquido mayor en varones que en mujeres entre los sujetos de edad inferior a 54 años, con una tendencia a igualarse en mayores de 64 años. La prevalencia de ronquido también fue mayor en obesos, incluso tras ajustar por edad y sexo. El efecto de la obesidad fue mayor en el grupo de mujeres más jóvenes, siendo la prevalencia de ronquido 3 veces superior en mujeres obesas. La prevalencia del ronquido fue superior en fumadores respecto a los no fumadores, mientras que los exfumadores presentaban tendencia a una mayor presencia de ronquido, pero sin llegar a alcanzar un nivel significativo. Además, al ajustar por obesidad, se apreció que el efecto del tabaco era mayor en personas no obesas. Asimismo, se encontró una correlación entre el ronquido y la intensidad del consumo de tabaco, ya que la prevalencia de aquél fue de un 43,9% en fumadores de más de 30 cigarrillos al día respecto al 24,3% en fumadores de 30 o menos (fig. 1). Curiosamente, la prevalencia del ronquido parecía igualarse a la de los no fumadores en los 4 años siguientes al abandono del tabaco.
Efecto del consumo de tabaco en la prevalencia del ronquido. EX: exfumadores; F: fumadores; NF: nunca fumadores. (Modificada de Bloom et al56.)
Otro estudio similar, publicado al año siguiente por Kauffmann et al66, incluyó a 457 policías parisinos varones de 22 a 54 años de edad, a los que se realizó un cuestionario sobre síntomas respiratorios, incluido el ronquido. El consumo de tabaco se estableció en gramos al día, y se clasificó a los participantes en no fumadores, exfumadores (como mínimo un mes sin fumar), fumadores moderados (<20g al día) y fumadores intensos (>20g al día). Asimismo se recogieron el hábito tabáquico de los padres, el consumo de alcohol y el IMC. El 60% de los sujetos roncaba de manera habitual, lo que se relacionó de forma significativa con síntomas de rinitis, la edad, el IMC y el consumo de tabaco, además de haber correlación con la cantidad diaria que se fumaba. Al realizar la regresión logística, se detectaron diferencias entre exfumadores y no fumadores (odds ratio [OR]=1,67), fumadores moderados y fumadores intensos (OR=2,10), y fumadores importantes y no fumadores (OR=2,89). Los resultados corroboraban los datos obtenidos por el grupo de Bloom56. No obstante, estos estudios tienen la limitación de estar basados en cuestionarios de salud, con el sesgo de información inherente que pueden presentar, y además no se realizaron estudios de sueño, lo que dificulta la comparación objetiva con otros trabajos.
Por otra parte, esta correlación no se ha demostrado en otros estudios poblacionales, como el realizado en 294 varones australianos (de 40 a 60 años). Se realizó a todos los sujetos incluidos un estudio simplificado de sueño en el domicilio, en el que se registraron 4 variables: ronquido, frecuencia cardíaca, saturación de oxígeno y posición corporal. La medida del ronquido se llevó a cabo mediante un micrófono situado en el cuello para su posterior análisis visual. La prevalencia global de tabaquismo activo fue del 18%. Un 81% de los varones estudiados roncaba durante más del 10% de la noche y un 22% más de la mitad del período nocturno. Los participantes fumadores roncaban durante un porcentaje de la noche mayor que los no fumadores (un 40,9 frente a un 31,3%), y el riesgo de roncar más de la mitad del período nocturno entre los fumadores era aproximadamente 2 veces mayor que el de los no fumadores (OR=2,32). No obstante, este riesgo no se relacionó con la cantidad de cigarrillos fumados58.
Larsson et al67 realizaron un estudio mediante un cuestionario validado para establecer la prevalencia del ronquido autorreferido, apneas y somnolencia diurna en pacientes con bronquitis crónica, broncoespasmo recurrente, rinitis y asma diagnosticada de la población general sueca. Incluyeron a 5.682 sujetos de la población general (de 20 a 69 años). El cuestionario incluía preguntas sobre síntomas y enfermedades respiratorias, consumo de tabaco y profesión. Presentaban ronquido un 10,7% de los participantes, apneas presenciadas un 6,8% y somnolencia diurna un 28,3%. La edad, el sexo masculino, la bronquitis crónica, el asma diagnosticada, la rinitis y el consumo de tabaco se relacionaron de forma significativa con el ronquido y con el ronquido asociado a somnolencia diurna. La OR de ronquidos en los fumadores activos fue de 1,55, y de 1,52 para ronquido asociado a somnolencia diurna. Esta relación se mantenía al ajustar por la presencia de condiciones de obstrucción de la vía aérea. La apnea presenciada también fue mayor en fumadores.
Stradling y Crosby59 llevaron a cabo un estudio de prevalencia en 1.001 varones aleatorizados de la población general, de 35 a 65 años de edad. Se administró a cada participante un cuestionario sobre posibles factores relacionados con el ronquido y el SAHS, el cual incluía preguntas relativas al consumo de alcohol y tabaco, presencia de congestión nasal o lesiones, cirugía nasal previa, antecedentes de adenotonsilectomía, uso de sedantes, hipnóticos y otros fármacos. Además de registrarse datos antropométricos, de función pulmonar (volumen espiratorio forzado en el primer segundo, capacidad vital forzada y pulsioximetría basal), se recogió información sobre el ronquido (corroborado por la pareja si era posible), así como la vida laboral. Se realizó una pulsioximetría nocturna a todos los participantes. Además, el estudio se completó con una polisomnografía en el hospital en aquéllos con más de 5 desaturaciones (de al menos un 4%) por hora de estudio. El análisis de las variables discontinuas mostró una relación significativa entre ronquido y consumo de tabaco. La prevalencia de roncadores frecuentes fue de un 15% en los 632 no fumadores, frente a un 30% en los 105 fumadores de más de 15 cigarrillos al día. La regresión lineal múltiple identificó que el ronquido se asoció de manera significativa a la congestión nasal, la circunferencia del cuello y el consumo de tabaco59.
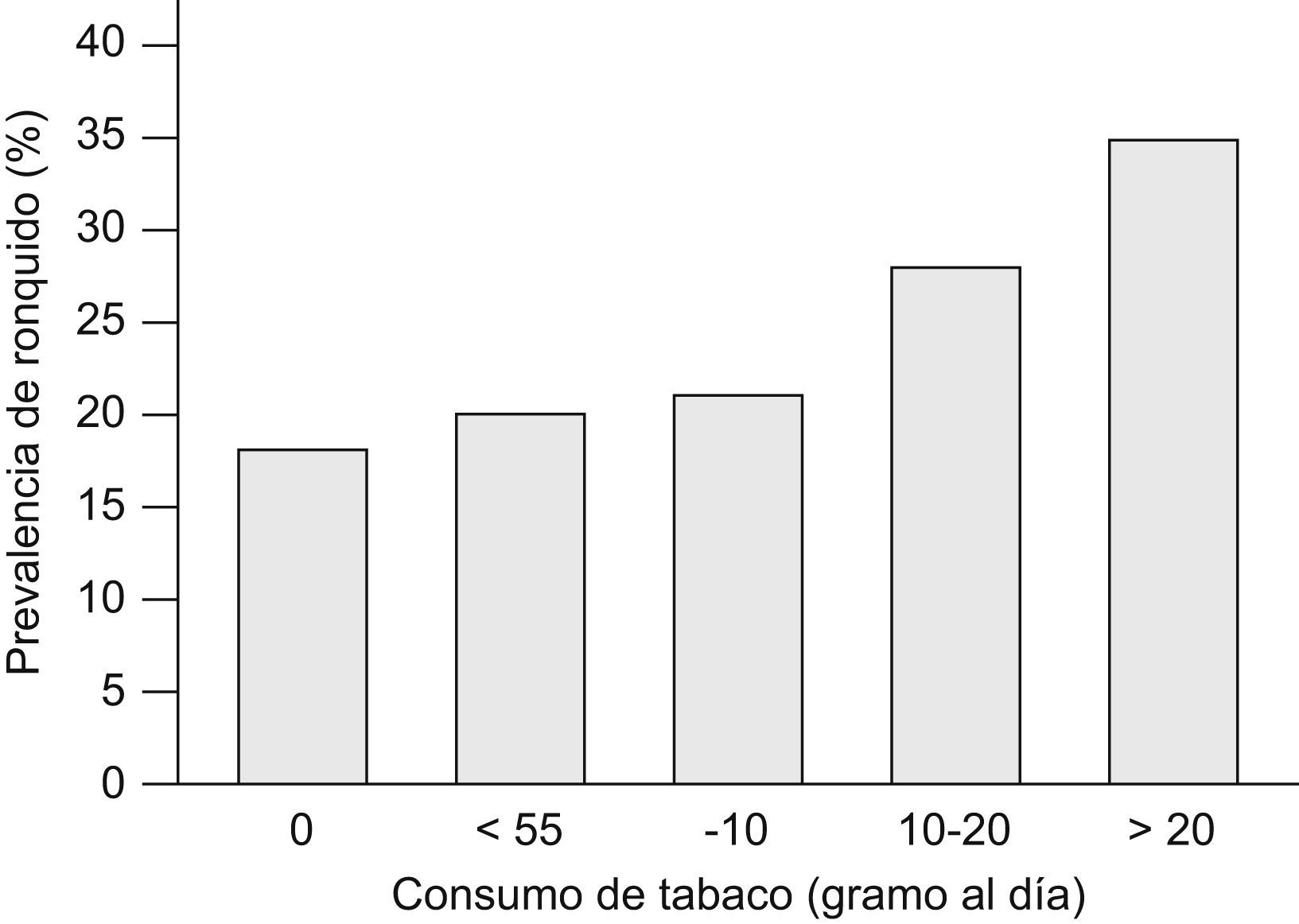
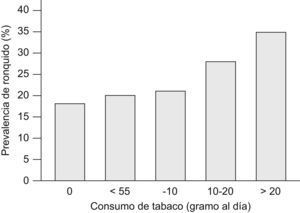
En 2004 Franklin et al68 publicaron un estudio novedoso en el que habían intentado establecer el impacto del tabaquismo activo y pasivo, así como la obesidad, en la presencia de ronquido. Incluyeron a un total de 15.555 varones y mujeres aleatorizados de la población general, de 25 a 54 años, procedentes de varios países del norte de Europa que contestaron a un cuestionario postal. El cuestionario incluía una escala de 5 puntos, de acuerdo con el Basic Nordic Sleep Questionnaire, respecto a la presencia de ronquido en los últimos meses. Los participantes se clasificaron en no fumadores, exfumadores y fumadores activos, y además se cuantificó el consumo en gramos de tabaco al día (1g por cigarrillo y 5g por cigarro puro). Se consideraron fumadores pasivos aquéllos no fumadores expuestos a diario al humo de tabaco en su domicilio. La bronquitis crónica se definió por síntomas indicativos sin diagnóstico conocido de asma, y la obesidad se estableció a partir de un IMC mayor de 30kg/m2. El ronquido habitual fue referido por un 18,3% de los sujetos. Fue más prevalente entre los fumadores activos (24%) y exfumadores (20,3%) respecto a los no fumadores (13,7%). Igualmente fue más frecuente en los fumadores pasivos: un 19,8% respecto a un 13,3% de los que no estaban expuestos al humo del tabaco en el domicilio. También se observó una clara relación dosis-respuesta entre el consumo de tabaco y la prevalencia de ronquido, que fue mayor en los que fumaban más de 20g de tabaco al día (fig. 2). El tabaquismo activo y el pasivo se mantuvieron como factores independientes para roncar después de ajustar por sexo masculino, IMC, país y edad. El ronquido habitual fue más prevalente en el 4,1% de pacientes con criterios clínicos de bronquitis crónica respecto a los que no los presentaban (un 34,9 frente a un 17,6%). El tabaquismo activo y la bronquitis crónica se observaron como factores de riesgo independientes y aditivos respecto a la presencia de ronquido. El riesgo atribuible a la presencia de ronquido fue del 17,1% en los fumadores y del 2,2% en los fumadores pasivos. No obstante, los datos, aunque bastante contundentes, presentan ciertas limitaciones, como la falta de información sobre el consumo de alcohol y de mediciones objetivas (p. ej., de función pulmonar), y la posible existencia de un sesgo de información en relación con el ámbito social de los diferentes países, lo que podría explicar diferencias en la prevalencia de ronquido y consumo de tabaco en los distintos centros68.
Prevalencia de ronquido y consumo diario de tabaco. (Modificada de Franklin et al68.)
En otro trabajo publicado más recientemente se estudió otro factor de riesgo no considerado en estudios previos: la exposición al humo del uso de biomasa como combustible. Se incluyó a pacientes de un estudio epidemiológico para establecer las características de los síntomas respiratorios durante el sueño y de otras enfermedades, a fin de determinar los factores de riesgo y su relación con el ronquido y las apneas observadas. Participaron en el estudio 12.270 personas, padres y abuelos de alumnos de 20 escuelas de primaria seleccionadas de forma aleatoria en áreas rurales y urbanas de Turquía. Se recogieron datos en cuestionarios sobre TRS y estado de ansiedad. El ronquido y la apnea observada fueron más frecuentes en los participantes de las áreas rurales, sobre todo en mujeres expuestas al humo de biomasa. Estas diferencias se mantenían al ajustar según sexo, edad, IMC, ingresos y nivel educativo. Además, la tasa de fumadores en ambas zonas fue similar69. No obstante, el mayor estrés psicológico de determinados individuos podría haberles llevado a sobrestimar dicha dimensión a la hora de autoevaluar los síntomas respiratorios durante el sueño.
Tras analizar la evidencia científica disponible, parece haber bastante uniformidad en los resultados de los estudios analizados, los cuales muestran que, además de los factores clásicos asociados al ronquido, como la edad, el IMC, el sexo masculino y el consumo de alcohol, el tabaquismo activo constituye un factor de riesgo independiente para roncar, a pesar de que la magnitud de dicha asociación difiere de forma significativa entre los estudios, probablemente debido a problemas metodológicos y a que las poblaciones estudiadas son distintas.
Tabaco y síndrome de apneas-hipopneas durante el sueño (SAHS)Como ya se ha comentado anteriormente, parece aceptada la asociación entre ronquido y tabaquismo. Por otra parte, el ronquido es uno de los síntomas por los que con más frecuencia consultan los pacientes con SAHS. Aunque la prevalencia de éste entre roncadores no está establecida, en algunas series alcanza el 50% de los roncadores importantes70,71. Por esta razón, se ha considerado que el hábito tabáquico podría ser un factor asociado al SAHS, junto con la obesidad, la edad y el sexo.
Antes de analizar la evidencia disponible, deberíamos plantear si hay bases fisiopatológicas que pudieran explicar una asociación, positiva o negativa, entre el tabaco y el SAHS. Por un lado, como ya se ha mencionado, el tabaco produce una inflamación crónica de la mucosa nasofaríngea56,62–64 que ocasiona una disminución de su calibre y facilita su colapso durante el sueño. Además, el tabaco podría estar asociado a una disminución de la respuesta de microdespertar a las apneas, lo que favorecería la mayor frecuencia y duración de éstas, aunque hasta la fecha esto sólo se ha demostrado de manera clara en neonatos, no en adultos72. A pesar de que se tiene la certeza de que el tabaco se asocia a alteraciones en la arquitectura normal del sueño73,74, se ha formulado una hipótesis provocativa que plantea la duda de si los pacientes con SAHS fuman como “autotratamiento”, ya que les ayudaría a estar más despiertos y a reducir su apetito y peso75. Por otro lado, ni el tabaco ni la nicotina han mostrado tener efectos nocivos en la mecánica o en el control muscular de la vía aérea superior76, e incluso, como se comentará más adelante, se ha intentado probar como tratamiento alternativo en el SAHS77,78.
Los trabajos de Bloom et al56 y Kauffman et al66 antes citados son estudios epidemiológicos realizados en la población general, y los datos se recogieron mediante cuestionarios, sin que se efectuaran estudios de sueño que objetivaran los eventos producidos durante el período nocturno. Wetter et al65 llevaron a cabo el primer estudio epidemiológico que abordó la cuestión de si el tabaco constituye un factor de riesgo para el desarrollo de TRS. El trabajo incluyó a 811 personas de EE.UU. A todos los participantes se les realizó un estudio polisomnográfico en el hospital y, según los resultados, se establecieron 5 categorías de TRS: a) sin alteraciones, es decir, sin ronquidos y con un índice de apneas-hipopneas (IAH) menor de 5h−1); b) ronquido (presencia de ronquido e IAH<5h−1); c) trastorno leve (IAH entre 5 y 15h−1); d) trastorno de moderado a grave (IAH>15h−1), y e) cualquier tipo de trastorno (IAH⩾5h−1). En el estudio se comprobó que los fumadores eran más roncadores que los no fumadores (OR=1,31; intervalo de confianza [IC] del 95%, 0,92–1,86), incluso cuando se ajustaba por edad, sexo, IMC, consumo de cafeína y de alcohol (OR=1,26; IC del 95%, 0,86–1,85), y tenían mayor tendencia a presentar TRS de grado moderado a grave. Esta tendencia también se observó al comparar los exfumadores con los no fumadores, aunque esta asociación desaparecía al ajustar por el resto de factores. También se estableció una asociación dosis-respuesta entre el consumo de tabaco y la presencia de TRS, siendo ésta mayor entre los fumadores de más de 40 paquetes-año (OR=40,47; IC del 95%, 2,37–50). Los fumadores de menos de 20 cigarrillos al día presentaron un riesgo aumentado de tener cualquier tipo de trastorno durante el sueño (OR=4,11; IC del 95%, 1,41–11,99). Como limitaciones del estudio hay que destacar que no se realizaron medidas objetivas del tabaquismo, información que se analizó en función de las respuestas de los cuestionarios autoadministrados a los pacientes.
En 2001 Kashyap et al79 publicaron un estudio de casos y controles para determinar la prevalencia de fumadores entre los pacientes con SAHS y establecer si el hábito tabáquico representaba un factor de riesgo independiente. Incluyeron a 214 participantes, 106 en el grupo control (IAH<5h−1) y 108 casos (IAH >10h−1), a los que se había realizado una polisomnografía nocturna hospitalaria. El tabaquismo se asoció a un riesgo mayor de SAHS, incluso después de ajustar por IMC, sexo, edad y consumo de alcohol. Además, se apreciaron diferencias significativas al comparar a fumadores con no fumadores y exfumadores: el riesgo de presentar SAHS fue 2,7 veces mayor en fumadores que en no fumadores y exfumadores en conjunto (OR=2,7; IC del 95%, 1,2–5,7), incluso al ajustar por las demás variables.
Hoffstein80 publicó el mayor estudio poblacional realizado hasta la fecha con el objetivo de determinar si el tabaco es un factor de riesgo para desarrollar SAHS, con resultados discrepantes respecto a los datos previos. La población del estudio se componía de pacientes remitidos a una consulta especializada por sospecha de TRS. Se incluyó a 3.509 sujetos, a los que se realizó una historia detallada sobre el consumo de tabaco, además de una polisomnografía nocturna en el hospital. La prevalencia de tabaquismo fue similar entre los sujetos sin apneas y los pacientes con SAHS. Únicamente se detectó una proporción mayor de fumadores activos (27%) entre los pacientes más graves (IAH>50h−1); además, en estos pacientes la dosis total acumulada de tabaco fue superior. En el análisis estadístico se dividió a los pacientes según la gravedad del IAH y posteriormente según su historia tabáquica, y se llevó a cabo una regresión uni y multivariante para establecer la correlación entre los paquetes-año y el IAH. Los fumadores tenían el doble de riesgo de roncopatía que los no fumadores; sin embargo, después de ajustar según la edad, el sexo y el IMC, el posible riesgo adicional del tabaco no alcanzó suficiente significación. Al dividir a los pacientes en roncadores y no roncadores tampoco se encontró asociación entre tabaco y ronquido una vez ajustados los resultados por edad, sexo e IMC, lo cual difiere de los estudios de Bloom et al56, Kauffmann et al66 y Kashyap et al79. Utilizando en la definición de SAHS el mismo punto de corte (IAH>5h−1) que el empleado en el Wisconsin Sleep Cohort65, se reproducían los resultados del trabajo de Hoffstein80, ya que, si bien el riesgo de SAHS era 1,5 veces superior en los fumadores, éste desaparecía cuando se ajustaba para edad, sexo e IMC. La probable explicación a la discordancia con los estudios previos es que las muestras poblacionales diferían, ya que en este caso se trataba de una población con alta sospecha de TRS y predominio del sexo masculino, apnea grave y consumo de tabaco, lo que podría haber atenuado los posibles efectos independientes del tabaco sobre esta enfermedad, a diferencia de lo que ocurre en los estudios realizados en población general (tabla 2).
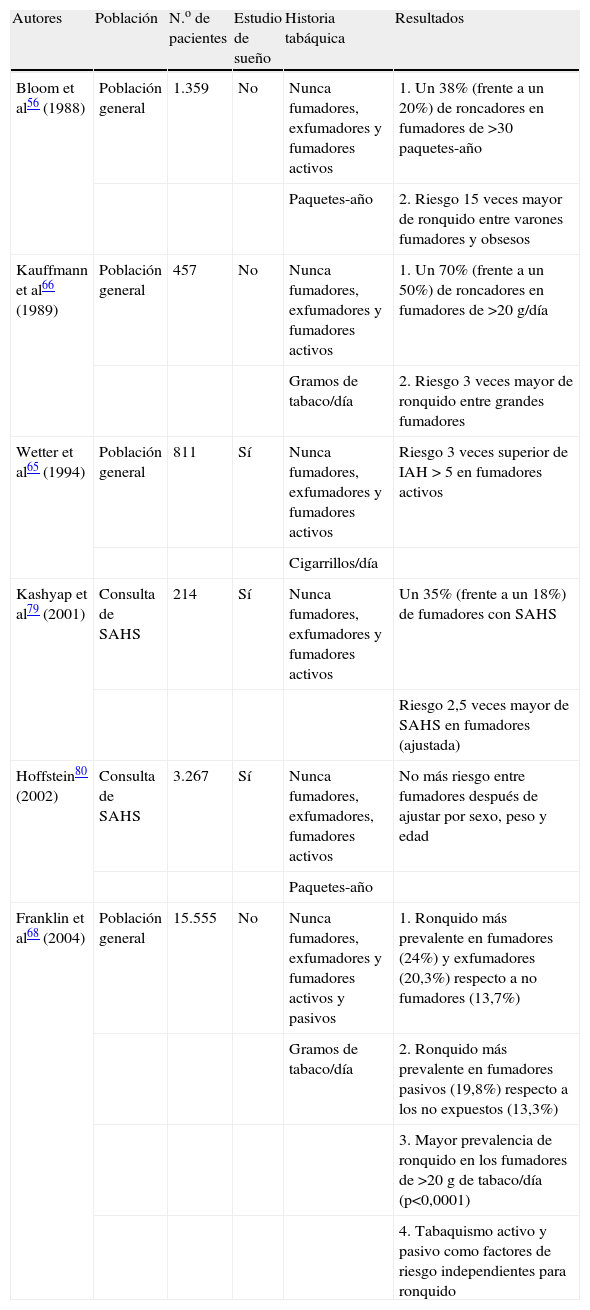
Principales estudios sobre la relación entre tabaco, ronquido y síndrome de apneas-hipopneas durante el sueño (SAHS)
| Autores | Población | N.o de pacientes | Estudio de sueño | Historia tabáquica | Resultados |
| Bloom et al56 (1988) | Población general | 1.359 | No | Nunca fumadores, exfumadores y fumadores activos | 1. Un 38% (frente a un 20%) de roncadores en fumadores de >30 paquetes-año |
| Paquetes-año | 2. Riesgo 15 veces mayor de ronquido entre varones fumadores y obsesos | ||||
| Kauffmann et al66 (1989) | Población general | 457 | No | Nunca fumadores, exfumadores y fumadores activos | 1. Un 70% (frente a un 50%) de roncadores en fumadores de >20 g/día |
| Gramos de tabaco/día | 2. Riesgo 3 veces mayor de ronquido entre grandes fumadores | ||||
| Wetter et al65 (1994) | Población general | 811 | Sí | Nunca fumadores, exfumadores y fumadores activos | Riesgo 3 veces superior de IAH > 5 en fumadores activos |
| Cigarrillos/día | |||||
| Kashyap et al79 (2001) | Consulta de SAHS | 214 | Sí | Nunca fumadores, exfumadores y fumadores activos | Un 35% (frente a un 18%) de fumadores con SAHS |
| Riesgo 2,5 veces mayor de SAHS en fumadores (ajustada) | |||||
| Hoffstein80 (2002) | Consulta de SAHS | 3.267 | Sí | Nunca fumadores, exfumadores, fumadores activos | No más riesgo entre fumadores después de ajustar por sexo, peso y edad |
| Paquetes-año | |||||
| Franklin et al68 (2004) | Población general | 15.555 | No | Nunca fumadores, exfumadores y fumadores activos y pasivos | 1. Ronquido más prevalente en fumadores (24%) y exfumadores (20,3%) respecto a no fumadores (13,7%) |
| Gramos de tabaco/día | 2. Ronquido más prevalente en fumadores pasivos (19,8%) respecto a los no expuestos (13,3%) | ||||
| 3. Mayor prevalencia de ronquido en los fumadores de >20g de tabaco/día (p<0,0001) | |||||
| 4. Tabaquismo activo y pasivo como factores de riesgo independientes para ronquido |
IAH: índice de apneas-hipopneas.
Uno de los estudios más recientes de prevalencia de ronquido y SAHS se ha realizado en 3.136 adultos brasileños, por medio de encuestadores domiciliarios81. Como variables independientes se consideraron la edad, el sexo, el color de piel, la situación conyugal, el nivel socioeconómico, el tabaquismo, el consumo de alcohol, la actividad física regular y el IMC. También se incluyeron preguntas sobre el período de sueño (media de horas de sueño, tiempo de latencia). La prevalencia de ronquido fue del 50,5% y la de apnea obstructiva del 9,9%. Tras ajustar por las diferentes variables, el ronquido habitual fue más frecuente en varones, personas mayores, fumadores activos (OR=1,15; IC del 95%, 1,07–1,25), consumidores de alcohol y obesos. Por otra parte, la presencia de apnea referida se asoció al sexo masculino, la edad, el tabaquismo activo (OR=1,60; IC del 95%, 1,25–2,05) y la obesidad. Como en otros estudios, el uso de cuestionarios con variables dicotómicas o escalas de valores y el hecho de no haber realizado pruebas de sueño favorecen el sesgo de información, sobre todo en variables tan subjetivas como el ronquido o la apnea presenciada. También la definición de ronquido habitual o la de apnea presenciada pueden diferir, lo que ayudaría a explicar los diferentes resultados obtenidos80,81.
Hay varios trabajos que, aunque cuentan con muestras menores, aportan datos interesantes. Blazejova et al82 compararon el IMC, la prevalencia de obesidad, de hipertensión arterial y de tabaquismo en 356 pacientes con SAHS (287 varones y 69 mujeres de 25 a 64 años) y en 2.353 personas que representaban el 1% de la población general checa. Observaron diferencias en el grupo de varones de 35–64 años en la prevalencia de hipertensión arterial sistémica, y en el subgrupo de edades entre 45 y 64 años en la prevalencia de tabaquismo, lo que indica que la prevalencia de tabaquismo entre los pacientes con SAHS es mayor que la de una muestra representativa de individuos de una población general. Casasola et al83 realizaron un estudio para evaluar la influencia del consumo de tabaco en la presencia de TRS en la población general. Estudiaron a 38 voluntarios sanos (21 varones y 17 mujeres de 30 a 54 años), a los que se realizó una poligrafía domiciliaria. Se determinaron el IAH y los índices de apneas y desaturación de oxígeno, además de calcularse el índice de hipoxia nocturna. Se midieron las concentraciones de carboxihemoglobina en sangre en todos los participantes antes y después del período de sueño. No se encontraron diferencias significativas en el IAH y los índices de apneas y desaturación de oxígeno entre fumadores y no fumadores. Por otra parte, los fumadores presentaron un mayor índice de hipoxia nocturna que los no fumadores, y en los fumadores se encontraron además correlaciones significativas entre dicho índice, la dosis de tabaquismo medida como paquetes-año y las concentraciones de carboxihemoglobina. La saturación de oxígeno fue significativamente menor en los fumadores que en los no fumadores. Otro dato importante es que el IAH y la desaturación guardaron una relación significativa con el ronquido habitual. Aunque no pudo establecerse que hubiese asociación entre el consumo de tabaco y las apneas durante el sueño, sí se comprobó que el tabaquismo se asocia con una disminución de la saturación de oxígeno nocturna.
En la actualidad, aunque hay bases fisiopatológicas que pudieran justificar una potencial asociación entre el consumo de tabaco y el SAHS, no hay ningún estudio que demuestre de forma definitiva su asociación. Probablemente los resultados contradictorios de los trabajos citados se deban a las diferencias de las poblaciones estudiadas y de los métodos empleados. No obstante, estas discrepancias reflejan que si el tabaco se encuentra relacionado con el SAHS, esta asociación sería débil, por lo que el consumo de tabaco tendría una importancia menor en la fisiopatología de la apnea nocturna.
Tabaco y trastornos del sueño en la infanciaEl SAHS infantil difiere del SAHS del adulto tanto en su etiología como en sus manifestaciones clínicas, diagnóstico y tratamiento. Es un TRS caracterizado por una obstrucción parcial y prolongada de la vía aérea superior y/u obstrucción intermitente completa que interrumpe la ventilación durante el sueño y los patrones normales del mismo. El síntoma guía en los niños es el ronquido, y la polisomnografía convencional es la prueba de referencia para su diagnóstico. La American Thoracic Society considera diagnóstico de SAHS en el niño un IAH de 3h−1 o mayor siempre y cuando haya clínica indicativa asociada. La causa más frecuente del SAHS en niños es la hipertrofia del tejido linfoide amigdalar y adenoideo, y su resolución suele ser completa después de realizar una adenoamigdalectomía. Hay otros procedimientos quirúrgicos dependiendo de la existencia de otras causas (uvulofaringopalatoplastia, cirugía maxilofacial, etc.). Si la adenoamigdalectomía fracasa o está contraindicada, la segunda línea de tratamiento es la presión positiva continua de la vía aérea84.
El ronquido primario o ronquido simple es el que no se acompaña de alteraciones polisomnográficas. Actualmente se cuestiona su inocuidad ya que se ha asociado a trastornos neurocognitivos y a bajo rendimiento escolar85–87.
Las enfermedades causadas por el tabaquismo pasivo en los niños pueden ser consecuencia de la exposición al humo del tabaco antes y/o después del nacimiento. La prevalencia del tabaquismo entre las gestantes es elevada. En un trabajo español88, el 43,4% de las gestantes eran fumadoras antes del embarazo y, de ellas, el 42,2% abandonó el consumo. Al final del embarazo, el 25,2% de las mujeres del estudio continuaba fumando.
En EE.UU., la prevalencia de exposición al humo del tabaco en los niños varía en el 35 y el 80% dependiendo del método de medida usado y de la población estudiada89. En un reciente trabajo español90, alrededor del 56% de los niños y adolescentes de 6 a 18 años estaban expuestos al humo del tabaco de alguno de los padres.
Parte de los componentes del humo del tabaco, entre ellos la nicotina, atraviesan la barrera hematoplacentaria90. La placenta de las embarazadas expuestas al humo de tabaco presenta alteraciones anatomopatológicas (necrosis isquémica, infartos retroplacentarios, aumento del espacio intravelloso, etc.) que, junto con un aumento de las concentraciones de carboxihemoglobina en la sangre de la gestante, condicionan un mayor número de complicaciones durante la gestación y una hipoxia fetal más intensa91.
Mediante interacciones complejas entre los sistemas neuroquímico y vascular, la exposición a la nicotina durante el embarazo influye en el desarrollo de las regiones del tronco cerebral asociadas con la regulación del despertar y con la homeostasis cardiorrespiratoria. Varios estudios han demostrado que los niños expuestos al humo del tabaco durante o después del embarazo presentan un umbral más alto para despertarse durante el sueño; es decir, tienen alterada la capacidad de realizar despertares transitorios tanto espontáneos como evocados en respuesta a estímulos auditivos o cuando se ven sometidos a hipoxia y/o hipercapnia72,92,93. También se ha observado el efecto de la exposición a la nicotina en la modulación del despertar transitorio en modelos animales de ratas en que se ha mostrado dificultad para la autorresucitación tras períodos breves de hipoxia inducida94. Todo esto parece tener gran relevancia, ya que se considera que los microdespertares constituyen un mecanismo de defensa y protegen de potenciales lesiones respiratorias durante el sueño. El microdespertar en el SAHS se asocia a un aumento del tono muscular de la vía aérea superior, lo que permite restablecer la permeabilidad al paso del aire y reinstaurar la respiración95.
En los últimos años se han publicado varios estudios que relacionan la exposición al humo del tabaco durante o después del embarazo con los TRS en la infancia (tabla 3). Un estudio que incluyó a 509 sujetos (267 niños y 242 niñas; 115 recién nacidos en la primera semana de vida y 394 alrededor de las 11 semanas de vida), cuyas madres se clasificaron en “no fumadoras” (no fumaron durante el embarazo), “fumadoras leves” (de 1–9 cigarrillos/día) y “fumadoras” (≥10 cigarrillos/día), relacionó el tabaquismo durante la gestación con un incremento de la frecuencia y duración de apneas obstructivas en niños. Además, la relación entre el tabaquismo materno y el número de apneas en sus hijos fue dependiente de la dosis. El riesgo relativo de apneas obstructivas en los niños de madres fumadoras durante la gestación fue de 2,76 (IC del 95%, 1,63–4,69). El tabaquismo durante la gestación, junto con el bajo peso al nacer y la sudoración profusa durante el sueño, se identificaron como factores de riesgo independientes de tener apneas obstructivas del sueño96.
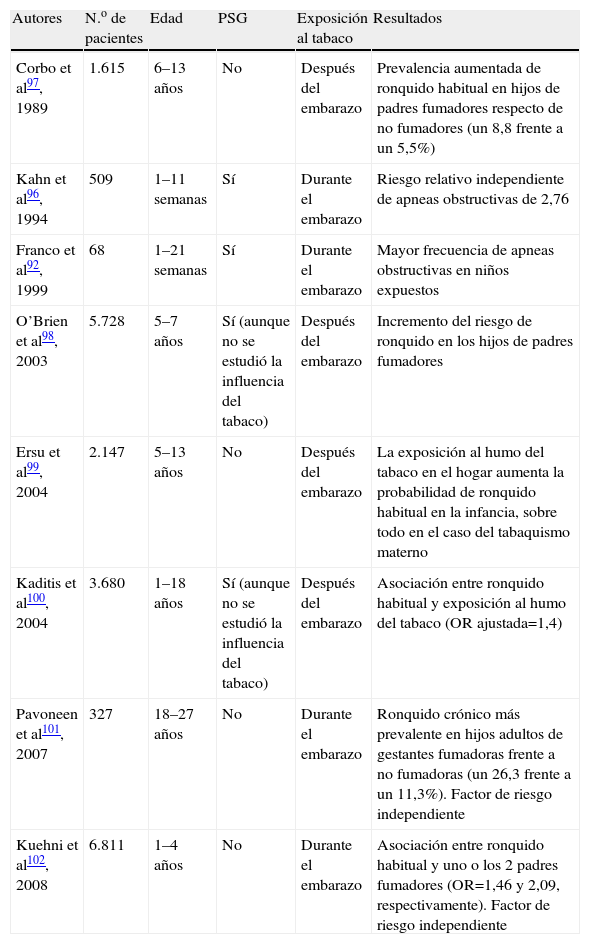
Estudios que relacionan la exposición al humo del tabaco durante o después del embarazo con los trastornos respiratorios del sueño en la infancia
| Autores | N.o de pacientes | Edad | PSG | Exposición al tabaco | Resultados |
| Corbo et al97, 1989 | 1.615 | 6–13 años | No | Después del embarazo | Prevalencia aumentada de ronquido habitual en hijos de padres fumadores respecto de no fumadores (un 8,8 frente a un 5,5%) |
| Kahn et al96, 1994 | 509 | 1–11 semanas | Sí | Durante el embarazo | Riesgo relativo independiente de apneas obstructivas de 2,76 |
| Franco et al92, 1999 | 68 | 1–21 semanas | Sí | Durante el embarazo | Mayor frecuencia de apneas obstructivas en niños expuestos |
| O’Brien et al98, 2003 | 5.728 | 5–7 años | Sí (aunque no se estudió la influencia del tabaco) | Después del embarazo | Incremento del riesgo de ronquido en los hijos de padres fumadores |
| Ersu et al99, 2004 | 2.147 | 5–13 años | No | Después del embarazo | La exposición al humo del tabaco en el hogar aumenta la probabilidad de ronquido habitual en la infancia, sobre todo en el caso del tabaquismo materno |
| Kaditis et al100, 2004 | 3.680 | 1–18 años | Sí (aunque no se estudió la influencia del tabaco) | Después del embarazo | Asociación entre ronquido habitual y exposición al humo del tabaco (OR ajustada=1,4) |
| Pavoneen et al101, 2007 | 327 | 18–27 años | No | Durante el embarazo | Ronquido crónico más prevalente en hijos adultos de gestantes fumadoras frente a no fumadoras (un 26,3 frente a un 11,3%). Factor de riesgo independiente |
| Kuehni et al102, 2008 | 6.811 | 1–4 años | No | Durante el embarazo | Asociación entre ronquido habitual y uno o los 2 padres fumadores (OR=1,46 y 2,09, respectivamente). Factor de riesgo independiente |
OR: odds ratio; PSG: polisomnografía respiratoria.
Franco et al92 estudiaron a 68 niños (26 neonatos y 42 niños de 4 a 21 semanas de vida) y observaron que los expuestos al humo del tabaco durante la gestación presentaban mayor frecuencia de apneas obstructivas (mediana de 3,1h−1) que los no expuestos (mediana de 1h−1), aunque la duración media de las apneas obstructivas, al contrario de lo hallado por Kahn et al96, fue similar en ambos grupos.
Además de la influencia del tabaquismo materno durante la gestación en la presencia de TRS en los niños, otros autores han estudiado el efecto de la exposición al humo del tabaco de los padres sobre dichos trastornos. Corbo et al97, en un estudio realizado en 1.615 niños (de 6 a 13 años), detectaron que el tabaquismo pasivo se asociaba con ronquido. La prevalencia de ronquido habitual se incrementó significativamente con el número de cigarrillos fumados por los padres (un 5,5% en niños de padres no fumadores y un 8,8% en niños de padres fumadores de 20 o más cigarrillos/día).
En otro estudio realizado en 5.728 niños de 5 a 7 años cuyo objetivo principal era relacionar los TRS con el trastorno por déficit de atención e hiperactividad, se observó, en una submuestra de 3.374 niños, un incremento del riesgo de ronquido en los hijos de padres fumadores —padre fumador, OR=1,83 (IC del 95%, 1,43–2,35); madre fumadora, OR=2,86 (IC del 95%, 2,14–3,82); ambos padres fumadores, OR=4,35 (IC del 95%, 3,17–5,96)—. A un subgrupo de niños con síntomas de trastorno por déficit de atención e hiperactividad se les realizó una polisomnografía, aunque en éstos no se estudió la influencia de la exposición al humo del tabaco de los padres en relación con la presencia o no de SAHS98. Ersu et al99 estudiaron a 2.147 escolares de Estambul para determinar la prevalencia de ronquido y evaluar los síntomas de TRS en niños. La prevalencia global de ronquido habitual en niños de 5 a 13 años fue del 7%. Los progenitores de los niños que habitualmente roncaban fumaban en mayor proporción (madres: 46,2%; padres; 65,5%) que los de aquellos que no roncaban (un 27,5 y un 53,8%, respectivamente). La influencia nociva del tabaco sobre el ronquido infantil era mayor si quien fumaba era la madre, ya que el riesgo de que los hijos roncasen era de más del doble en el caso de madres frente a padres fumadores (OR=2,3 y 1,6, respectivamente). Los autores lo atribuyen al hecho de que tradicionalmente los niños turcos permanecen más tiempo con sus madres. La conclusión final de este trabajo fue que la exposición al humo del tabaco en el hogar aumentaba la probabilidad de ronquido habitual en la infancia, sobre todo si era la madre quien fumaba.
Por su parte, Kaditis et al100 incluyeron en un estudio a 3.680 niños y adolescentes griegos (de 1 a 18 años), y comprobaron que había una asociación entre el ronquido habitual y la exposición al humo del tabaco en el hogar (prevalencia de tabaquismo pasivo entre roncadores habituales del 69% y entre no roncadores del 31%). De hecho, al igual que en el estudio de Ersu et al99, los hijos de progenitores fumadores tenían más riesgo de roncar que aquellos cuyos padres no fumaban; este riesgo se mantenía incluso después de ajustar por sexo masculino, obstrucción nasal crónica, infecciones del árbol traqueobronquial inferior, ronquido en padres o hermanos, asma o adenoidectomía en la madre (OR ajustada=1,4). En este estudio griego se realizaron polisomnografías a 70 niños elegidos al azar entre 307 roncadores a los que no se había practicado adenoidectomía ni amigdalectomía. La frecuencia estimada de SAHS en este subgrupo de niños fue del 4,3%, aunque lamentablemente no se estudió la potencial influencia de la exposición al humo del tabaco de los padres en este grupo de niños diagnosticados de SAHS. En esta línea, Paavonen et al101, del grupo de Helsinki, realizaron un estudio retrospectivo y longitudinal para conocer si el muy bajo peso al nacer (<1.500g) se asociaba con el riesgo de TRS, definido como ronquido crónico, en adultos jóvenes (de 18 a 27 años). Se observó que el ronquido crónico era más prevalente en los hijos de madres que habían fumado durante el embarazo que en aquéllos de madres no fumadoras (un 26,3 frente a un 11,3%). De los resultados obtenidos se extraen 2 conclusiones interesantes: por un lado, los niños prematuros con muy bajo peso al nacer tienen un riesgo incrementado de roncar en la edad adulta pero, además de si tienen o no bajo peso, el mayor factor de riesgo independiente para roncar es el antecedente de tabaquismo materno durante la gestación (OR ajustada=3,04).
En un estudio reciente de gran tamaño muestral realizado en una población de 6.811 niños británicos (entre 1 y 4 años) para conocer la prevalencia, la gravedad y los factores de riesgo del ronquido, se comprobó que la prevalencia de ronquido habitual en niños era del 7,9%. Después de ajustar para el resto de factores ambientales estudiados, edad, sexo, grupo étnico y factores socioeconómicos, el tabaquismo pasivo en el hogar se mostró como un factor de riesgo independiente para el ronquido habitual infantil, riesgo que incrementaba si ambos padres eran fumadores activos (OR de 1,46 si fumaba un solo progenitor y 2,09 cuando ambos fumaban). El hecho de que la asociación entre tabaquismo pasivo y roncopatía en los niños mostrase una relación dosis-respuesta, así como el hecho de que dicha asociación resultase ser más intensa en los niños de menor edad que pasaban más tiempo en el hogar, y que un tercio del ronquido habitual pudiera atribuirse a la exposición al humo (tabaquismo pasivo y tráfico rodado), evidencia la posible existencia de una relación causal entre ambas entidades102.
La mayoría de los estudios publicados sobre TRS y tabaquismo pasivo hacen referencia al ronquido habitual. Los estudios sobre SAHS son más escasos probablemente porque se precisa realizar una polisomnografía para su diagnóstico. En el caso del ronquido, los cuestionarios cumplimentados por los padres suelen ser el método utilizado para su medida.
Del resto de los TRS en la infancia, mencionaremos brevemente, por su gravedad y su elevado impacto sociofamiliar, el síndrome de muerte súbita del lactante. Se define como la muerte repentina de un lactante menor de 1 año de edad, no explicable tras la investigación exhaustiva del caso, con necropsia completa, examen del lugar del suceso y revisión de la historia clínica103. El tabaquismo materno es un factor de riesgo para dicho síndrome104, y el riego aumenta con el número de cigarrillos fumados al día.
En conclusión, la exposición al humo del tabaco durante y después de la gestación parece ser un factor evitable para el desarrollo de TRS en la infancia, más establecido en el caso del ronquido habitual que en el SAHS.
Influencia del tabaco y del SAHS en el riesgo cardiovascularEl SAHS representa un factor de riesgo para desarrollar arteriosclerosis y morbilidad cardiovascular17,105,106. Los mecanismos patogénicos que favorecen esta asociación son, entre otros, el estrés oxidativo107,108, la activación de células y mediadores inflamatorios109 y el incremento en la adherencia entre leucocitos y células inflamatorias109. Por otra parte, el tabaco se considera también un factor de riesgo cardiovascular asociado a una mayor prevalencia de arteriosclerosis y tiene vías patogénicas similares a las del SAHS. En los pacientes en que coexisten el SAHS y el tabaquismo, se ha demostrado la presencia de valores más altos de triglicéridos y de marcadores inflamatorios (proteína C reactiva, ceruloplasmina y haptoglobina) e inferiores de colesterol de alta densidad que en sujetos de la misma edad, peso e IAH pero que no fuman. Las concentraciones más elevadas de moléculas inflamatorias se han detectado en pacientes con SAHS más grave que fumaban, lo cual evidencia que existe un efecto sinérgico entre el tabaco y el SAHS en algunos de los marcadores bioquímicos de riesgo cardiovascular110. Aunque se trata de datos aún preliminares, todo parece indicar que los pacientes con SAHS grave que fuman al menos un paquete al día tienen un riesgo cardiovascular mayor que los fumadores con SAHS más leve o que los pacientes con SAHS que no consumen tabaco17,110.
Tratamiento del tabaquismo en pacientes con SAHSLa administración de nicotina, ya sea intravenosa o aplicada de manera tópica en la zona anterior de la médula, incrementa la actividad de los músculos de la vía aérea superior, como el geniogloso y el cricoaritenoideo posterior. Además se ha evidenciado que produce una disminución de la resistencia de la vía aérea superior en modelos animales78,111,112. A partir de los resultados de estas líneas de investigación, se extendió la idea de utilizar la nicotina como una sustancia que pudiera constituir una modalidad de tratamiento en el SAHS. Gothe et al78 estudiaron el efecto de la nicotina (administrada en forma de chicles) en 5 pacientes con SAHS grave. Detectaron una disminución del número total de apneas y del tiempo de sueño con apneas, sobre todo a expensas de una reducción del número de apneas obstructivas y mixtas. No obstante, se trata de un estudio preliminar con muy pocos pacientes y no controlado, que no permite generalizar sus resultados. Por ello, posteriormente se realizó un estudio con un diseño más correcto, a fin de evaluar el efecto agudo de la utilización de parches transdérmicos de nicotina en un ensayo aleatorizado y cruzado con placebo en 20 pacientes no fumadores con SAHS leve. La nicotina no evidenció mejorías en el IAH ni en el ronquido de los pacientes, y sí alteró de manera significativa y negativa la arquitectura del sueño, ya que aumentó su latencia y se detectó una disminución de la eficiencia y del tiempo total de sueño y del porcentaje de sueño REM77. Actualmente no se considera el uso de nicotina para mejorar las obstrucciones respiratorias que caracterizan el SAHS.
En nuestro conocimiento no hay estudios que hayan explorado el mejor abordaje para el tratamiento del tabaquismo en los pacientes con SAHS asociado. Existe cierta evidencia de que el abandono del consumo de tabaco se acompaña de fragmentación del sueño en el período inicial de su retirada, como parte del síndrome de abstinencia al tabaco113, y que ciertos fármacos usados en el tratamiento del tabaquismo, como el bupropión y la nicotina, pueden provocar alteraciones del sueño, como insomnio113. No obstante, no está bien definido el papel que desempeña cada uno de ellos.
En la práctica clínica diaria se pone casi todo el empeño en tratar a los pacientes con modalidades terapéuticas mecánicas, que obviamente han demostrado con claridad su eficacia y efectividad, pero en no pocas ocasiones se olvida dedicar el suficiente esfuerzo en recomendar y ayudar a los pacientes a adoptar estilos de vida más saludables, que, entre otros, incluyan el abandono del tabaco, debido a la elevada prevalencia de su consumo entre la población con SAHS y a sus probables efectos dañinos y potencialmente aditivos sobre el sistema cardiovascular.