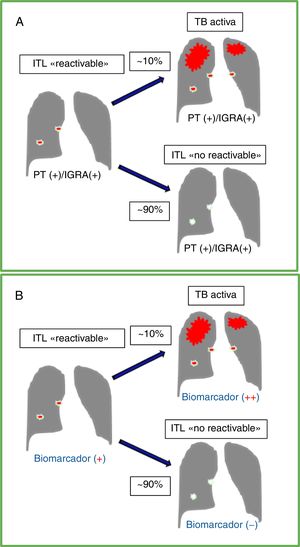
La detección, de manera precisa, de la infección tuberculosa latente (ITL) sigue siendo un reto tanto clínico como de salud pública a nivel global. Se estima que una cuarta parte de la población mundial está infectada por el Mycobacterium tuberculosis (Mtb), mayoritariamente de forma asintomática y latente1. Las personas inmunocompetentes con ITL tienen un 5-10% de riesgo de desarrollar una enfermedad tuberculosa activa (TB) durante su vida (fig. 1A). Este riesgo se incrementa en personas con inmunosupresión, aunque se reduce sustancialmente con el tratamiento preventivo de la ITL2. En los últimos años ha habido avances científicos importantes tanto en el conocimiento fisiopatológico como en el diagnóstico y el manejo de la ITL (ver el editorial «Nuevas perspectivas en infección tuberculosa latente»)3. A pesar de ello, las pruebas de laboratorio actualmente disponibles para la detección de ITL tienen serias limitaciones diagnósticas, incluyendo un valor predictivo<5% para identificar aquellas personas con ITL que van a desarrollar una reactivación de la TB4. La prueba de la tuberculina y los ensayos de liberación de interferón-gamma pueden detectar la respuesta inmune celular frente a Mtb. Sin embargo, ninguna de estas pruebas permite diferenciar a aquellas personas que tras una exposición previa al bacilo no se infectan (respuesta inmune innata) o consiguen una posterior erradicación y/o reclusión bacilar efectiva de la infección (respuesta inmune adaptativa con granuloma calcificado) de aquellas otras que tienen una infección silente y/o persistente, y que presentan un alto riego de reactivación5. Por consiguiente, será necesario perfeccionar las pruebas diagnósticas no solo para optimizar la capacidad de detección, sino también para una mejor valoración del riesgo de reactivación (fig. 1B) y, con ello, mejorar la selección de los individuos que realmente se pueden beneficiar del tratamiento preventivo, y contribuir a alcanzar niveles de erradicación de la TB en muchas partes del mundo, incluidas España y Latinoamérica6–8.
Curso natural de la infección tuberculosa latente (ITL), pruebas diagnósticas y biomarcador ideal. A. Muestra el curso de una ITL sin tratamiento en un individuo inmunocompetente con un riesgo de 5-10% de desarrollar en el tiempo una tuberculosis (TB) activa. Las pruebas disponibles para ITL, tanto la de la tuberculina (PT) como los ensayos de liberación de interferón-gamma (IGRA), dan usualmente resultados positivos antes y después de la reactivación de la TB activa. B. Muestra los resultados de una prueba con un biomarcador ideal que pueda diferenciar infección latente con potencial de reactivación (ITL «reactivable») vs. un individuo con resultados positivos en la PT y/o IGRA pero sin riesgo significativo de reactivación (ITL «no reactivable»). Un marcador ideal podría incrementarse significativamente al progresar de una ITL «reactivable» a una TB sintomática.
Recientemente, estudios longitudinales llevados a cabo en individuos con factores de riesgo para TB, así como estudios controlados de modelos de ITL en primates, han contribuido a elucidar detalles temporoespaciales y fisiopatológicos de la ITL y de la progresión a TB9–11. Se sabe que la repuesta inmune frente al Mtb es compleja, dinámica y multifocal, donde diferentes células del sistema inmune participan formando granulomas en los órganos infectados y activando ganglios regionales, los cuales pueden contener la infección y potencialmente esterilizarla, aunque también podrían fracasar y permitir el progreso de la infección9–11. Asimismo, estos estudios muestran que no solo las células T efectoras y los macrófagos activados controlan la replicación bacteriana y previenen la progresión o la reactivación de la enfermedad, sino que otras células inmunes también tienen un rol protagonista9,11. Sin embargo, los mecanismos moleculares de evasión y tolerancia inmunológica son solo parcialmente conocidos10. Una limitación de este tipo de estudios prospectivos, que incluyen gran número de individuos y pruebas inmunológicas y firmas de ARN, es que son difíciles de replicar por el alto costo y la sofisticación tecnológica tanto para su ejecución como para el análisis informático11.
Otro de los puntos críticos en la ITL es el desarrollo de marcadores de respuesta al tratamiento preventivo4. Una prueba diagnóstica precisa, con un biomarcador fiable para detectar este tipo de respuesta terapéutica, sería de gran valor clínico y de salud pública, sobre todo en áreas de alta incidencia donde la exposición recurrente y potencial reinfección pueden darse repetidamente. Más aún, los biomarcadores inmunológicos de respuesta al tratamiento preventivo en la ITL serían también indicadores de un estado inmunológico de bajo riesgo de progresión a la TB, dado que el tratamiento preventivo está asociado con una reducción de>60% del riesgo de reactivación12,13. La dificultad para la identificación de biomarcadores de alto y bajo riesgo en ITL radica en la falta de un gold standard que indique de manera precisa la existencia de una infección latente y reactivable. Lo que conocemos clínicamente como ITL es un término que aglutina a un grupo heterogéneo de individuos en diferentes estadios de infección, incluyendo infecciones con potencial de reactivación (ITL «reactivable»), pero también individuos con respuesta inmune a los antígenos de Mtb (prueba de la tuberculina y/o ensayo de liberación de interferón-gamma) con bacilos erradicados o sin posibilidad de reactivarse como ocurre en la mayoría de los granulomas calcificados (ITL «no reactivable») (fig. 1). En este contexto, una estrategia de investigación que evalúe el efecto del tratamiento preventivo en los diferentes subgrupos de ITL podría descubrir marcadores de ITL reactivable (fig. 2). Usando esta estrategia en un corte transversal, los marcadores de respuesta antigénica específica de los linfocitos T (coexpresión de CD25 (receptor-α de la IL-2) y CD134 (OX40, uno de receptores de TNF-α) diferenciaron estadísticamente a los individuos con ITL sin tratamiento de los que tenían historia de haber recibido tratamiento preventivo14. En el análisis secundario con un modelo multidimensional de estimación de riesgo de ITL, los individuos con pruebas positivas tanto de ensayos de liberación de interferón-gamma como de coexpresión de estos biomarcadores antigénicos específicos de Mtb en las células T CD4+ y CD8+, tuvieron el mayor riego de desarrollar reactivación de TB14. Una estrategia similar también mostró la reducción del marcador CD38 de activación de células T en individuos tratados por ITL15. Esta estrategia de investigación tiene sus limitaciones: el grupo heterogéneo de estudio; la dinámica y el tiempo en que estos marcadores se modifican con el tratamiento; y la dependencia de una función inmune adecuada y sin anergia. En todo caso, esta estrategia será útil no solo para la búsqueda y la validación preliminar de biomarcadores de respuesta al tratamiento, los cuales podrían estudiarse posteriormente con una validación longitudinal más concluyente, sino también para la valoración de riesgo de la ITL7,15. Aquellos marcadores que rápidamente disminuyan con el tratamiento de ITL y que sean específicos para Mtb y reproducibles en diferentes poblaciones serán los que identifiquen de forma más fiable a aquellos individuos que responden al tratamiento.
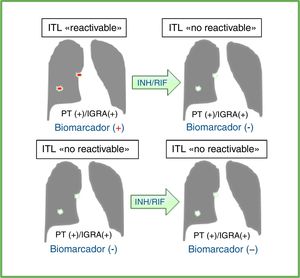
Efecto del tratamiento preventivo en las pruebas diagnósticas y biomarcador ideal en individuos con infección tuberculosa latente (ITL) reactivable vs. no reactivable.
Efecto del tratamiento preventivo con isoniazida (INH) y/o una rifamicina (RIF) en los resultados de la prueba de la tuberculina (PT) y/o los ensayos de liberación de interferón-gamma (IGRA) en individuos con diagnóstico de ITL. Las pruebas diagnósticas disponibles no diferencian los individuos con ITL con potencial de reactivación (ITL «reactivable») de aquellos que ya erradicaron bacteriológicamente o contuvieron la infección tuberculosa de manera efectiva y permanente (ITL «no reactivable»). Un biomarcador ideal debería ser detectado antes del tratamiento preventivo para la ITL y no después en los casos de la ITL reactivable. En los casos de ITL no reactivable, el marcador ideal no debería ser detectado antes ni después del tratamiento. Esto no ocurre con los resultados de la PT y/o IGRA, que usualmente se mantienen positivos después del tratamiento preventivo. Por consiguiente, un biomarcador ideal mejoraría la selección de individuos que realmente se beneficiarían del tratamiento para la ITL y, de este modo, serviría para evitar dar tratamiento preventivo a las personas que no lo necesiten o que tengan un riesgo significativo de desarrollar efectos secundarios a estos antibióticos.
En conclusión, es posible que en el futuro se descubran y evalúen nuevos biomarcadores para estratificar el riesgo de los individuos con ITL y su respuesta al tratamiento, pero aύn se necesitan estudios prospectivos longitudinales con diferentes tipos de poblaciones para validar estas prometedoras pruebas alrededor del mundo.
Conflicto de interesesEl trabajo de investigación y académico del Dr. Escalante ha sido respaldado por becas y fondos internos de la Clínica Mayo, incluyendo el «2019 Division of Pulmonary and Critical Care Medicine Midcareer Development Award», y recientemente por fondos del Instituto Nacional de Salud de los Estados Unidos de América (NIH, #1R01AI141591). El contenido de este documento es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales del Instituto Nacional de Salud de los Estados Unidos de América, de la Clínica Mayo, o de ninguna otra organización. No se proporcionó apoyo financiero o material para este trabajo a los autores. El Dr. Escalante y su institución han presentado patentes relacionadas con metodologías de laboratorio de inmunodiagnóstico para la infección tuberculosa latente. Hasta la fecha, no ha habido ingresos ni regalías asociados con las patentes presentadas. Ninguno de los autores tiene otros conflictos de intereses que declarar.