Las recomendaciones que se proponen pretenden ser un instrumento que facilite la toma de decisiones en pacientes con nódulo pulmonar solitario (NPS). Para una decisión óptima hay que incorporar la accesibilidad a las distintas técnicas diagnósticas y las preferencias del paciente.
La primera valoración, que incluye la tomografía computarizada torácica, separa a un grupo de pacientes con neoplasia extrapulmonar o muy alto riesgo quirúrgico que requieren manejo individualizado. Otros 2 grupos son los pacientes con NPS de hasta 8mm y los que tienen NPS subsólido, para los que se establecen recomendaciones específicas.
Los NPS mayores de 8mm se clasifican según su probabilidad de malignidad en baja (menor del 5%) donde se recomienda observación, alta (mayor del 65%) que se manejan con el diagnóstico de presunción de carcinoma en estadio localizado, e intermedia, donde la tomografía de emisión de positrones tiene gran rendimiento para reclasificarlos en alta o baja probabilidad. En los casos de probabilidad de malignidad intermedia o alta puede ser una opción la punción o biopsia transbronquial del nódulo.
Se recomienda la observación radiológica con tomografía computarizada de baja radiación y sin contraste en el NPS con baja probabilidad de malignidad, y la resección con videotoracoscopia en los casos no diagnosticados y con probabilidad de malignidad intermedia o alta.
The aim of the proposed recommendations is be a tool to facilitate decision-making in patients with a solitary pulmonary nodule (SPN). For an optimal decision, accessibility to the different diagnostics techniques and patient preferences need to be incorporated.
The first assessment, which includes a chest computed tomography scan, separates a group of patients with extrapulmonary neoplasm or a high surgical risk who require individualized management. Another two groups of patients are patients with SPN up to 8mm and those who have a subsolid SPN, for which specific recommendations are established.
SPN larger than 8mm are classified according to their probability of malignancy into low (less than 5%), where observation is recommended, high (higher than 65%), which are managed with a presumptive diagnosis of localized stage carcinoma, and intermediate, where positron emission tomography-computed tomography has high yield for reclassifying them into high or low probability. In cases of intermediate or high probability of malignancy, transbronchial needle aspiration or biopsy of the nodule may be an option.
Radiologic observation with low radiation computed tomography without contrast is recommended in SPN with low probability of malignancy, and resection with videothoracoscopy in undiagnosed cases with intermediate or high probability of malignancy.
La presente normativa pretende facilitar la toma de decisiones ante un nódulo pulmonar solitario (NPS)1–3. No pretende ser rígida, pues el NPS es un paradigma de cómo la estimación de la probabilidad de malignidad (PM), la accesibilidad a las distintas técnicas diagnósticas, la valoración de los riesgos de las técnicas diagnósticas y terapéuticas, y las preferencias del paciente influyen mucho en la decisión óptima. Este proceso debe individualizarse en el ámbito clínico y temporal concreto. Dado que la accesibilidad a algunas técnicas diagnósticas puede variar en diferentes ámbitos, se propone un algoritmo de actuación general (fig. 1) con 2 alternativas según el grado de accesibilidad a la tomografía de emisión de positrones (PET) (figs. 2 y 3). Las recomendaciones se han graduado en función de la fuerza (fuerte 1, débil 2) establecida a partir de la relación entre los beneficios esperables y los riesgos para el paciente; y la calidad de la evidencia científica, entre alta (A), moderada (B), baja (C) o muy baja (D), siguiendo el sistema GRADE4. Un resumen de estas recomendaciones2,5,6 se muestra en la tabla 1. La versión extendida de estas recomendaciones está disponible como suplemento online, así como tablas o figuras adicionales (S) (anexo 1).
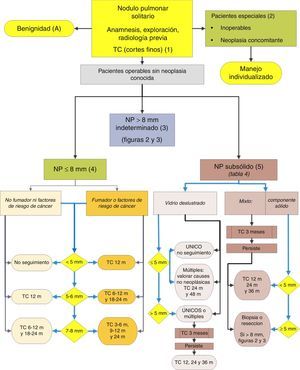
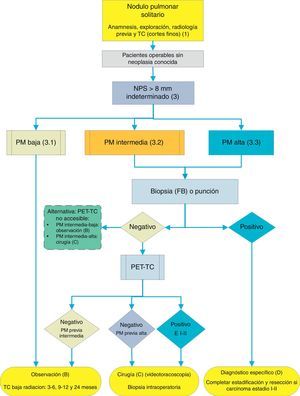
Algoritmo de manejo del NP: Clasificación inicial y pauta de observación en NPS≤8mm y NPS subsólidos. m: meses; NP: nódulo pulmonar; NPS: nódulo pulmonar solitario; TC: tomografía computarizada torácica, incluyendo cortes finos. Seguimiento con TC de baja radiación, siempre que no se detecte crecimiento. Los números y letras entre paréntesis hacen referencia a los apartados del texto en que son comentados.
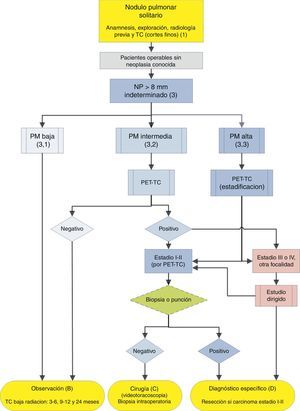
Algoritmo de manejo del NP>8mm: Ámbito clínico con fácil acceso a una PET-TC. m: meses; NP: nódulo pulmonar; PET-TC: tomografía de emisión de positrones con tomografía computarizada; PM: probabilidad de malignidad; TC: tomografía computarizada torácica, incluyendo cortes finos. Observación con TC de baja radiación, siempre que no se detecte crecimiento. Los números y letras entre paréntesis hacen referencia a los apartados del texto en que son comentados.
Algoritmo de manejo del nódulo pulmonar>8mm: Ámbito clínico con difícil acceso a PET-TC o preferencia por estudio citohistológico del NPS. FB: fibrobroncoscopia y biopsia dirigida; m: meses; NPS: nódulo pulmonar solitario; PET-TC: tomografía de emisión de positrones con tomografía computarizada; PM: probabilidad de malignidad; TC: tomografía computarizada torácica, incluyendo cortes finos. Observación con TC de baja radiación, siempre que no se detecte crecimiento. Los números y letras entre paréntesis hacen referencia a los apartados del texto en que son comentados.
Recomendaciones en el manejo del nódulo pulmonar solitario
| Recomendación | Gradoa |
| Valoración inicial NPS | |
| Toda decisión sobre el manejo de un NPS debe incluir la opinión y las preferencias del paciente, correctamente informado | 1C |
| Valorar estabilidad o crecimiento en estudios radiológicos previos si están disponibles | 1C |
| Estabilidad mayor de 2 años en NPS sólidos y calcificación de tipo benigna indican benignidad y no requieren estudios adicionales | 2C |
| La TC, incluyendo cortes finos de la lesión, es fundamental en la valoración inicial del NPS indeterminado | 1B |
| Los NPS en pacientes con neoplasia previa o concomitante requieren manejo y valoración individualizada | 1C |
| Los NPS en pacientes inoperables requieren manejo individualizado | 1C |
| Los NPS se clasificarán como nódulos sólidos>8mm, nódulos sólidos≤8mm y nódulos subsólidos | 1B |
| NPS sólidos>8mm | |
| Se clasificarán según la PM: baja (<5%), intermedia o alta (>65%) | 2C |
| NPS de PM baja: observación radiológica | 2C |
| Observación radiológica: TC de baja radiación sin contraste a los 3-6, 9-12 y 24 meses | 2C |
| NPS de PM intermedia: realización de PET-TC | 1B |
| PET-TC negativa: observación radiológica | 2C |
| NPS de PM intermedia: punción-biopsia es una alternativa aceptable | 2C |
| No diagnóstico histológico: realización de PET-TC | 1B |
| Punción o biopsia es aconsejable cuandoDiscordancia entre PM clínica y por imagenSospecha de etiologías que requieren tratamiento médico (por ejemplo, tuberculosis)Pacientes con aversión o rechazo a la cirugía diagnóstica | 2C |
| NPS con PM alta: manejo con el diagnóstico de presunción de carcinoma en estadio inicial | 2C |
| NPS con PM alta: FB con revisión bronquial y biopsia transbronquial | 2D |
| NPS no diagnosticados con PM mayor que baja en pacientes operables: resección del NPS | 2C |
| Técnica recomendada videotoracoscopiaBiopsia intraoperatoria para establecer tipo de resección | 1C |
| Los NP subcentimétricos asociados a un NPS no deben contraindicar cirugía curativa de carcinoma sin confirmar que son metástasis | 2C |
| NPS<8mm | |
| Pauta de observación siguiendo las recomendaciones de la Sociedad Fleischner (fig. 1) | 2C |
| Seguimiento con TC de baja radiación y sin contraste | 1C |
| NPS subsólidos | |
| Pauta de actuación siguiendo las recomendaciones de la Sociedad Fleischner (tabla 2) | 1B a 2C |
| Seguimiento con TC de baja radiación y sin contraste | 1C |
FB: fibrobroncoscopia; NP: nódulo pulmonar; NPS: nódulo pulmonar solitario; PET: tomografía de emisión de positrones; PM: probabilidad de malignidad; TC: tomografía computarizada.
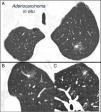
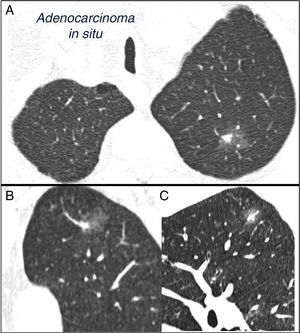
El NPS se define como una opacidad radiológica única, esférica, circunscrita, de diámetro máximo≤30mm, rodeada en su mayor parte por pulmón aireado y no asociada a atelectasia, agrandamiento hiliar o derrame pleural1–3. El NPS puede ser un hallazgo en la radiografía torácica o en la tomografía computarizada (TC) torácica realizada para el estudio de otras patologías o para el cribado diagnóstico del carcinoma pulmonar (CP)3,6,7. La TC detecta nódulos milimétricos (≤8mm de diámetro)1,2,6 y nódulos subsólidos (NSS)2,5 (fig. 4) que se manejan de forma diferente5–7 (fig. 1). Los NSS incluyen tanto los nódulos en vidrio deslustrado como los nódulos parcialmente sólidos que combinan un componente en vidrio deslustrado y otro sólido2,5–7.
Nódulo pulmonar solitario subsólido mixto en lóbulo superior izquierdo. Tomografía computarizada torácica con cortes finos de 2mm en un paciente con un nódulo pulmonar solitario en lóbulo superior izquierdo. Corte axial (A) a nivel de lóbulos superiores y reconstrucciones coronal (B) y sagital (C) a nivel de lóbulo superior izquierdo. Se aprecia un nódulo pulmonar solitario en vidrio deslustrado de 18mm de diámetro máximo, con un componente sólido en su interior de 7mm. La resección mediante videotoracoscopia demostró adenocarcinoma in situ.
La frecuencia de nódulos se estima en uno o 2 por cada 1.000 radiografías1,3,8. La prevalencia de nódulos en la TC practicada en adultos fumadores para cribado de CP es muy elevada, del 20 al 50%, generalmente menores de 10mm, con una incidencia del 10% en sucesivas TC anuales1,3,6,7.
Al evaluar un NPS con TC es frecuente que se encuentren otros pequeños nódulos. Cuando son pocos o hay uno claramente dominante deben ser considerados como NPS independientes pues, incluso tratándose de un CP, es frecuente que los nódulos subcentimétricos acompañantes sean benignos1,2,6,7. Es más, hasta en un 20% de los casos el nódulo neoplásico no es el de mayor tamaño7.
El NPS es la manifestación radiológica de muchas enfermedades3 (anexoonline-tabla 1S). Sin embargo, la mayor parte de los nódulos se deben a neoplasias pulmonares, granulomas y hamartomas1. La prevalencia de malignidad es variable entre diferentes series8,9, desde un 5 hasta un 70%, según procedan de exámenes en salud o de estudios sobre técnicas diagnósticas, y menor en NPS detectados en programas de cribado de CP: 1-10%, dependiendo del tamaño del nódulo3,7. La PM del NPS aumenta notablemente en pacientes con una neoplasia previa3,10.
La mayor parte de los NPS malignos son CP, siendo los más frecuentes adenocarcinomas y carcinomas de células grandes2,3. En los NSS neoplásicos la estirpe más frecuente está en el espectro de los adenocarcinomas5,11,12, desde la hiperplasia adenomatosa atípica en los de menor tamaño, adenocarcinoma in situ, adenocarcinoma mínimamente invasivo o adenocarcinomas invasivos cuando hay componente sólido, sobre todo los de crecimiento lepídico y los mucinosos5,11,12.
Técnicas diagnósticas en el estudio del nódulo pulmonar solitarioTomografía computarizada torácicaEs muy superior a la radiografía simple en la valoración del NPS2,3. Permite detectar otros nódulos, adenopatías mediastínicas, diagnosticar los seudonódulos (lesiones extraparenquimatosas) y ayudar en la planificación de la biopsia o de la punción del nódulo. En algunos casos permite un diagnóstico específico, como malformaciones arteriovenosas, micetomas, atelectasias redondas o hamartomas. Por todo ello se considera la exploración inicial fundamental en el estudio del NPS2.
El estudio del realce o captación de contraste demostró una sensibilidad del 98% para malignidad con un punto de corte de 15unidades Hounsfield (UH) de incremento, y una especificidad del 58%13. Es aplicable a NPS>8mm, esféricos, homogéneos, sin grasa, calcio, cavitación ni necrosis. Puede ser útil en centros con experiencia en la técnica, aunque con la introducción de la PET su uso no se ha generalizado3.
Tomografía de emisión de positronesEl estudio del NPS es una de las principales indicaciones de la PET-TC con 18F-desoxi-D-glucosa. La sensibilidad media para NPS sólidos¿10-15mm es 0,93 (IC 0,90-0,95), y la especificidad media es 0,80 (IC 0,74-0,85)2,14,15. Los falsos negativos de la PET-TC se asocian a una técnica deficiente, diámetro tumoral<7mm, tumores carcinoides, nódulos subsólidos y algunos adenocarcinomas, particularmente adenocarcinomas in situ, mínimamente invasivos, de crecimiento lepídico o mucinosos2,3. Los falsos positivos son más frecuentes: lesiones inflamatorias e infecciosas, como granulomas, tuberculosis, micosis o neumonías2,16.
La principal utilidad de la PET-TC está en los NPS¿8mm de PM intermedia: un estudio negativo la reduce mucho3. Para una PET-TC positiva, un mayor standardized uptake value (SUV) expresa una mayor agresividad del tumor y un peor pronóstico del paciente, aunque hay que tener en cuenta su discreta especificidad y la posibilidad, por tanto, de un falso positivo17,18. También permite seleccionar la localización más rentable y accesible para la toma de biopsia y ayudar, en su caso, a la planificación de radioterapia19. La PET-TC contribuye a la estadificación del carcinoma2,3 valorando metástasis mediastínicas y sistémicas, por lo que está recomendada en muchas guías de manejo del CP17,18,20. En estas recomendaciones la PET-TC se utiliza de las 2 maneras posibles: como herramienta de caracterización del NPS y como técnica de estadificación en NPS con alta PM.
Obtención de muestras citohistológicas del nódulo pulmonar solitarioPunción transtorácica con aguja fina guiada por tomografía computarizada, radioscopia o ecografíaUn análisis de la literatura sobre 48 estudios demuestra buena sensibilidad para el diagnóstico de malignidad, 86% (IC 84-88%), y gran especificidad, 99% (IC 98-99%)21. En NPS menores de 15mm la sensibilidad es menor, 70-82%2,22. En enfermedad benigna la especificidad también es menor21. La frecuencia media de neumotórax fue del 15% y precisaron drenaje un 7%2,21,23. La punción transtorácica está contraindicada en caso de mala colaboración, función respiratoria muy deficiente o pulmón único, diátesis hemorrágica y si existe enfisema o bullas extensas en la proximidad del nódulo. Hay entre un 4 y 50% de resultados no diagnósticos, y hasta un 20% de falsos negativos2. Si la PM es alta, la tasa de verdaderos negativos es igual a la de falsos negativos, por lo que no es útil para descartar neoplasia2.
Fibrobroncoscopia y técnicas asociadasLa rentabilidad diagnóstica para CP de la biopsia o punción transbronquial (BTB) dirigida al nódulo mediante control radioscópico varía en distintas series entre el 20 y el 80%, inferior en NPS menores de 20mm donde la rentabilidad media es del 30%2. En NPS benignos es del 10%. Es más rentable en nódulos de localización central, mayor tamaño (¿20mm) y con broncograma aéreo2,24. Los riesgos de la BTB son escasos: neumotórax, 2%2, y hemoptisis o hematomas menos frecuentemente. Aunque la rentabilidad para el diagnóstico del NPS es menor que la de la punción-aspiración transtorácica con aguja fina (PAAF), permite una revisión endobronquial antes de planificar la cirugía del CP25. Se están evaluando broncoscopios ultrafinos para acceder mejor a las lesiones, vainas-guía para conducir la pinza, ecobroncoscopia radial, broncoscopia con navegación electromagnética y broncoscopia con navegación virtual, técnicas que permiten guiar la pinza hasta el nódulo y mejorar el rendimiento2,26. Un metaanálisis26 compara estas técnicas: la rentabilidad conjunta era del 70%, mejor que en series previas guiadas por radioscopia, y la rentabilidad de las técnicas individuales oscilaba entre el 68,5 y el 73%, aunque con gran variabilidad y heterogeneidad entre los estudios. La rentabilidad era menor en NPS¿20mm, 61%, frente al 80% en los ¿20mm. La combinación de técnicas puede mejorar algo el rendimiento2. Como se desprende de estos datos, ninguna técnica destaca sobre las demás en rentabilidad por lo que la recomendación es que cada centro emplee aquellas técnicas para las que tiene equipamiento y experiencia.
Videotoracoscopia y toracotomíaPermite la resección del NPS2. Cuando los NPS son pequeños o profundos en el parénquima se pueden marcar previamente, generalmente mediante punción transtorácica dirigida con TC e introducción de un colorante o de un arpón metálico. Los riesgos de la videotoracoscopia son bajos, sin apenas mortalidad (menor del 1%), escasa morbilidad y buen rendimiento en el diagnóstico del nódulo, similar al de la toracotomía pero con menos morbilidad2. Cuando el NPS es un CP, si la situación clínica del enfermo lo permite, está indicada una resección anatómica, generalmente lobectomía y disección ganglionar mediastínica2,20,27.
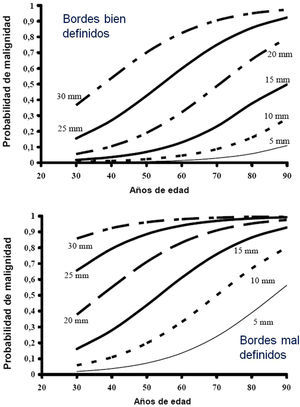
Estimación de la probabilidad de malignidadLos NPS malignos difieren de los benignos en ciertas características clínicas y radiológicas, que se describen con más detalle en la versión extendida como suplemento online. Los factores más fuertemente asociados a malignidad son: tamaño del NPS, características de los bordes, densidad, edad del paciente, dosis acumulada de tabaco, existencia de otra neoplasia y detección de crecimiento2,3,6,7,10,28–30. La calcificación central, laminar o total del NPS se considera un buen criterio de benignidad2,3, así como la estabilidad radiológica más de 24 meses, que implica un tiempo de duplicación mayor de 730 días. Este criterio no es válido para NSS, donde la observación se extiende a 3 años como mínimo1–3,5.
La mayoría de los clínicos estiman la PM intuitivamente pero se han propuestos diferentes modelos y reglas de clasificación del NPS7,28–32 e incluso hay calculadores accesibles vía web (anexoonline-tabla 2S) o descargable para teléfonos móviles (Medcalc medical calculator). En la tabla 2S del anexo online se dan las fórmulas obtenidas de distintos modelos logísticos y en la figura 1S un nomograma válido para NPS en radiografía torácica.
Esta estimación de la PM orienta el proceso diagnóstico posterior1,2,31. Lógicamente, en la predicción de malignidad se incorporarán los resultados de las técnicas de estudio efectuadas, como el resultado de la PET-TC31,32, los resultados de la punción o biopsia y la valoración del crecimiento si hubiera imágenes disponibles para hacerlo.
Junto a la PM hay que valorar los beneficios esperables del tratamiento y sus riesgos. Existe un umbral de PM para observación, es decir, aquella PM en la que la opción más razonable es observar prospectivamente la estabilidad o crecimiento del NPS, y un umbral de cirugía, o PM en la que la cirugía está claramente recomendada pues la probabilidad de cáncer en estadio inicial es alta. Estos umbrales dependen de los beneficios esperados, por ejemplo, probabilidad de curación o respuesta al tratamiento en los casos de neoplasia, de los riesgos quirúrgicos, que pueden variar entre pacientes, y de la propia actitud y preferencias del paciente1.
Evaluación secuencial del nódulo pulmonar solitarioEl estudio de un NPS tiene como objetivo diagnosticar y tratar NPS que representen enfermedades activas, en particular CP, pues un estadio precoz tiene una supervivencia del 70-80% a 5 años20; y no someter a los costes y riesgos de los distintos procedimientos a pacientes con granulomas, hamartomas y otras lesiones benignas. No hay una forma de actuación aceptada unánimemente. En la evaluación, los elementos claves son: estimación de la probabilidad de malignidad, accesibilidad y experiencia con las distintas pruebas diagnósticas, y preferencias del paciente1,2.
En las figuras 1–3 mostramos la propuesta de la evaluación secuencial del NPS: en la figura 1 se presenta la clasificación inicial en función del tamaño del NPS y de su densidad, sólida o subsólida, separando aquellos pacientes que requerirán un manejo individualizado y los que pueden diagnosticarse ya en el momento inicial. Las figuras 2 y 3 se refieren a la propuesta de actuación en NPS sólidos indeterminados mayores de 8mm en función de que se tenga un acceso rápido a la PET-TC (fig. 2) o el acceso sea más difícil (fig. 3).
Evaluación clínica y radiológica inicial (1)Comprende la anamnesis, exploración y la valoración de las características radiológicas, así como la comparación con radiografías previas2,31: recomendación grado 1C.
Si no hay constancia de estabilidad mayor de 2 años o calcificación benigna, está indicada la TC, con cortes finos al nivel del nódulo2: recomendación grado 1B.
Algunos nódulos pueden clasificarse en esta fase como benignos, por estabilidad mayor de 2 años, calcificación benigna o por sus características en la TC2,31: recomendación grado 2C.
En los NPS de etiología indeterminada se prosigue el estudio en función de las características del paciente y las características radiológicas del nódulo.
Pacientes con situaciones especiales (2)Bien porque modifican la frecuencia etiológica o la PM del NPS, bien porque los riesgos quirúrgicos limitan la actuación a técnicas poco invasoras.
- •
Pacientes con neoplasia previa o sincrónica. En ellos aumenta mucho la PM de los NP sean únicos o múltiples3,10 incluso si son de pequeño tamaño6. La posibilidad de metástasis es mayor aún si son NPS que no estaban previamente. No obstante, cuando los NPS son subcentimétricos, hasta un tercio son benignos por lo que se debe confirmar el diagnóstico con punción, biopsia o videotoracoscopia antes de negar tratamientos potencialmente curativos: recomendación grado 2C2,10. Los NPS en pacientes con inmunosupresión requieren estudio individualizado, prefiriéndose punción o biopsia33.
- •
En pacientes inoperables, el estudio del NPS está limitado. La punción o biopsia estará indicada en los casos con alta PM o PET-positivas para orientar el tratamiento quimio o radioterápico en caso de tratarse de un CP: recomendación grado 2C.
El primer paso es clasificar al paciente en función de la PM estimada como baja (¿5%), intermedia o alta (>65%)1,2,29,31: recomendación grado 1C.
Probabilidad de malignidad baja (3, 1)Son PM estimadas por debajo del 5%2,31. Aquí se clasifican NPS aún de pequeño tamaño (¿10-15mm), bordes netos, pacientes más jóvenes (menos de 40 años), baja carga tabáquica y, por supuesto, sin malignidad extrapulmonar2,28–32,34. En estos casos se aconseja observación radiológica2,31: recomendación grado 2C. También incluyen aquellos NPS de PM intermedia en los que la PET-TC fue negativa, o estudiados con PAAF con resultado de benignidad2: recomendación grado 2C.
Probabilidad de malignidad intermedia (3, 2)NPS con PM entre 5-65%2,28–32,34. Aconsejamos PET-TC al ser una prueba poco invasiva, de bajo riesgo y alto poder de discriminación (fig. 2): recomendación grado 1B. Un resultado negativo reduce bastante la PM y puede recomendarse observación; un resultado positivo la aumenta y se consideraría de alta PM2,31.
En función de la accesibilidad y de la demora de la PET-TC, una alternativa es la realización de PAAF guiada por TC o fibrobroncoscopia (FB)-BTB guiada por radioscopia, ecoendoscopia, navegación electromagnética o virtual (fig. 3): recomendación grado 2C. La opción de biopsia es especialmente aconsejable cuando hay discordancia entre la PM clínica y los resultados de imagen, cuando se sospechan etiologías con tratamiento médico específico (como tuberculosis) o si el paciente tiene aversión a la cirugía2: recomendación grado 2C.
La repetición de técnicas de punción o biopsia en caso de negatividad inicial solo es aconsejable cuando la PM del NPS sea alta y se considere necesario el diagnóstico previo a la cirugía o esta esté contraindicada.
Si el resultado es negativo se indicaría PET-TC (fig. 3): recomendación grado 1B. Si no se dispusiera de PET-TC, la alternativa sería el seguimiento con TC, especialmente si la PAAF hubiera sido negativa, o la cirugía.
Probabilidad de malignidad alta (3, 3)La PM es alta en pacientes mayores de 50 años, con antecedentes de tabaquismo o con características radiológicas de malignidad: NPS¿15mm, bordes espiculados o densidad heterogénea. También los que son hipermetabólicos en la PET-TC, los que han aumentado de tamaño o cambiado de forma y los que tienen citología o biopsia pulmonar sospechosa de malignidad2,28–32,34.
En estos casos algunos autores invocan la cirugía diagnóstico-terapéutica directa y otros técnicas de biopsia2,31. En la población seleccionada mediante este algoritmo, al haber excluido a pacientes con otras neoplasias, la mayoría de los NPS son cánceres de pulmón. Por ello se propone su manejo como tal2, indicando la PET-TC como método de estadificación17,18: recomendación grado 2C.
El diagnóstico histológico previo a la cirugía es factible mediante FB-BTB, que permite, además, evaluar el árbol bronquial antes del procedimiento quirúrgico, o mediante PAAF. Un resultado negativo no reduce lo suficiente la PM como para obviar la resección del NPS. No está estudiado si es eficaz intentar el diagnóstico previo a la cirugía de los NPS con alta PM, toda vez que están estadificados como estadio i o ii clínico con TC y PET-TC, y son pacientes operables. Por ello en el algoritmo se deja como opción (fig. 2), aunque la valoración prequirúrgica mediante FB es una práctica habitual: recomendación grado 2C.
En caso de que la PET-TC muestre captaciones mediastínicas o extratorácicas sugestivas de metástasis se estudiarían previamente a una cirugía de resección17,18. Si el NPS con alta PM fuera PET-TC-negativo la PM no se reduce lo suficiente como para que pueda recomendarse observación2, proponiéndose resección mediante videotoracoscopia: recomendación grado 2C. La menor captación, sin embargo, supone mejor pronóstico y menor probabilidad de diseminación, algo a tener en cuenta si el paciente tuviera fuerte reticencia a la cirugía3,31.
En la pauta propuesta el estudio de un NPS con alta PM concluye con un diagnóstico específico o con resección diagnóstico-terapéutica (figs. 2 y 3).
Nódulo pulmonar solitario menor de 8mm (4)La prevalencia de estos NPS es muy alta en los estudios de TC y la PM es baja, salvo que hubiera un tumor metastatizante previo o sincrónico2,6. Son difícilmente accesibles a las técnicas de biopsia, y la PET-TC y la TC dinámica tienen muy baja sensibilidad2,6. Se propone una pauta de observación siguiendo las recomendaciones de la Sociedad Fleischner6 (fig. 1), siempre considerando a pacientes asintomáticos y sin neoplasia concomitante: recomendación grado 2C.
El seguimiento se hace con TC de baja radiación, sin contraste6: recomendación grado 1C. De nuevo, el paciente debe estar informado y han de considerarse sus preferencias en este seguimiento2.
Nódulo pulmonar subsólido (5)Son nódulos en vidrio deslustrado, puros o con un componente sólido5 (fig. 4). Determinar el carácter subsólido requiere cortes finos, preferiblemente de 1mm, pues NPS sólidos de pequeño tamaño en cortes de TC de 5mm pueden aparentar ser en vidrio deslustrado2,5.
Los NSS son poco accesibles para la punción o biopsia y la PET-TC tiene baja sensibilidad5,35. Sin embargo su PM es relativamente alta, 15% o más para NPS en vidrio deslustrado y más del 50% para el nódulo mixto5. En estas lesiones también es más difícil establecer cambios en el tamaño o volumen durante el seguimiento, y las neoplasias que se manifiestan así pueden ser indolentes durante mucho tiempo por lo que el período de observación ha de ser mayor5, como mínimo 3 años.
Como muchas de las etiologías benignas son procesos agudos o subagudos se propone una pauta de observación inicial con TC en 3 meses, pues algunos NPS pueden desaparecer. Si persisten, la pauta vendrá determinada por el tamaño de los NPS, si tienen componente sólido y si son únicos o múltiples (fig. 1). En la tabla 2 se detallan las recomendaciones según la propuesta por la Sociedad Radiológica Fleischner5.
Pauta de manejo de nódulos pulmonares subsólidos
| Grado recomendacióna | ||||
| NPS en vidrio deslustrado | ||||
| ≤5mm | No seguimiento | 1C | ||
| >5mm | TC 3meses | Persiste | TC anualSeguimiento>3años | 1B |
| NPS parcialmente sólido (parte sólida) | ||||
| <5mm | TC 3meses | Persiste | TC anualSeguimiento>3años | 2C |
| ≥5mm | TC 3meses | Persiste | Biopsia, resección, PET-TC si parte sólida>10mm | 1B |
| NP en vidrio deslustrado múltiples | ||||
| ≤5mm | Considerar causas no neoplásicas | TC a los 2 y 4 años | 1C | |
| >5mm | TC 3meses | Persiste | TC anualSeguimiento>3años | 1B |
| NP múltiples con componente sólido | TC 3meses | Persiste | Biopsia, resección, especialmente si parte sólida>5mm | 1C |
NP: nódulo pulmonar; NPS: nódulo pulmonar solitario; PET: tomografía de emisión de positrones; TC: tomografía computarizada.
El nivel de recomendación es el propuesto por la Sociedad Fleischner5 basado en el sistema GRADE. Las recomendaciones de la American College of Chest Physicians2 rebajan en un grado la fuerza de la recomendación. La TC de evaluación debe ser de corte fino y el seguimiento con TC de baja radiación.
- A.
Diagnóstico de benignidad: Pacientes con diagnóstico específico por TC, como hamartomas, malformaciones arteriovenosas, lesiones quísticas, atelectasias redondas, micetomas, seudonódulos o nódulos calcificados, o con criterios de benignidad por estabilidad documentada de, al menos, 2 años en caso de ser sólidos, o 3 años si son subsólidos2,3: recomendación grado 2C.
- B.
Observación radiológica: Indicada en NPS con baja PM, o intermedia cuando la PET-TC es negativa: recomendación grado 2C. También puede estar indicada en NPS no diagnosticados si el riesgo quirúrgico es muy alto o si el paciente rechaza cirugía: recomendación grado 2C.
En los NPS>8mm con PM baja se recomienda un control con TC a los 3-6 meses, otro a los 9-12 meses y otro a los 24 meses2. En los NPS≤8mm y en los NSS hay pautas específicas2,5,6 (fig. 1 y tabla 2): recomendación grado 2C. Las TC de control han de ser de baja radiación y sin contraste: recomendación grado 1C.
- C.
Cirugía diagnóstico-terapéutica: A los pacientes operables con NPS no diagnosticado y PM mayor que baja se les ofertará la resección: recomendación grado 2C. Aunque la videotoracoscopia es el método de elección (recomendación grado 1C), cada equipo quirúrgico decidirá la mejor vía de abordaje. Se aconseja biopsia intraoperatoria para completar la resección apropiada en caso de CP: recomendación grado 1C.
- D.
Diagnóstico específico: Es el diagnóstico etiológico del NPS. Si se diagnostica de CP se aplicarán los protocolos específicos de estadificación y tratamiento locales20.
No puede completarse el algoritmo sin insistir, una vez más, en que la decisión óptima debe incluir la opinión y las preferencias del paciente correctamente informado2: recomendación grado 1C.
Los autores declaran no tener ningún conflicto de intereses.