A pesar de los múltiples avances diagnósticos o terapéuticos de la medicina de los últimos años, el derrame pleural (DP) continúa siendo una de las enfermedades que con frecuencia tiene que abordar el especialista de aparato respiratorio o el cirujano torácico. El presente texto no tiene como objetivo realizar una revisión exhaustiva sobre las enfermedades que pueden producir DP, su diagnóstico o su tratamiento, sino constituir una actualización de los conocimientos publicados en los últimos años. Teniendo en cuenta la vocación eminentemente práctica de esta normativa, se ha concedido más extensión a las enfermedades que presentan una mayor incidencia o prevalencia, aunque no hemos renunciado a un ligero recordatorio de otras menos frecuentes. Entre los mayores avances destacan los conocimientos sobre la utilidad de la ecografía torácica, los fibrinolíticos y los agentes pleurodésicos, o la utilización de nuevas técnicas de drenaje pleural, como los tubos torácicos finos o los catéteres tunelizados. La actualización periódica de las normativas favorece la potencial incorporación de nuevas técnicas en el estudio de la enfermedad pleural.
Although during the last few years there have been several important changes in the diagnostic or therapeutic methods, pleural effusion is still one of the diseases that the respiratory specialist have to evaluate frequently. The aim of this paper is to update the knowledge about pleural effusions, rather than to review the causes of pleural diseases exhaustively. These recommendations have a longer extension for the subjects with a direct clinical usefulness, but a slight update of other pleural diseases has been also included. Among the main scientific advantages are included the thoracic ultrasonography, the intrapleural fibrinolytics, the pleurodesis agents, or the new pleural drainages techniques.
Desde la publicación de la primera normativa SEPAR sobre diagnóstico y tratamiento del DP en el año 20061, ha aparecido nueva información que complementa el estudio de estos pacientes. La presente normativa no pretende establecer una revisión exhaustiva sobre el DP, sino ofrecer una actualización sobre los conocimientos científicos aparecidos desde entonces. El grado de evidencia de las recomendaciones se clasifica según el sistema Grade2, como se muestra en el anexo 1.
Evaluación del paciente con derrame pleuralEn primer lugar debe realizarse una anamnesis y exploración física completa, que incluya los antecedentes patológicos y laborales, así como los fármacos que reciba el paciente. De las técnicas de imagen la radiografía posteroanterior de tórax suele identificar la existencia de DP1. La ecografía torácica debe estar fácilmente accesible para el estudio de estos pacientes. Es además recomendable que se realice por el mismo facultativo que hace la punción, al incrementar la rentabilidad y disminuir las complicaciones de la toracocentesis (A)3. La ecografía es más sensible que la radiografía en la identificación del DP, y que la tomografía computarizada (TC) para la identificación de septos (C). Sus indicaciones incluyen además la localización de DP pequeños o encapsulados para su punción o biopsia, la caracterización del líquido o la superficie pleural, o dirigir el punto de entrada de la toracoscopia. Se recomienda su utilización para dirigir todas las técnicas invasivas pleurales (B), y si es posible debe realizarse inmediatamente antes de la técnica, evitando la punción en el punto marcado tiempo antes (F)4. La TC torácica puede ser de utilidad para modificar la probabilidad de malignidad de un DP, localizar zonas adecuadas para la biopsia, o identificar otras regiones patológicas, como el parénquima pulmonar o el mediastino. La TC abdominal puede ser útil al descartar enfermedades infradiafragmáticas causantes de DP.
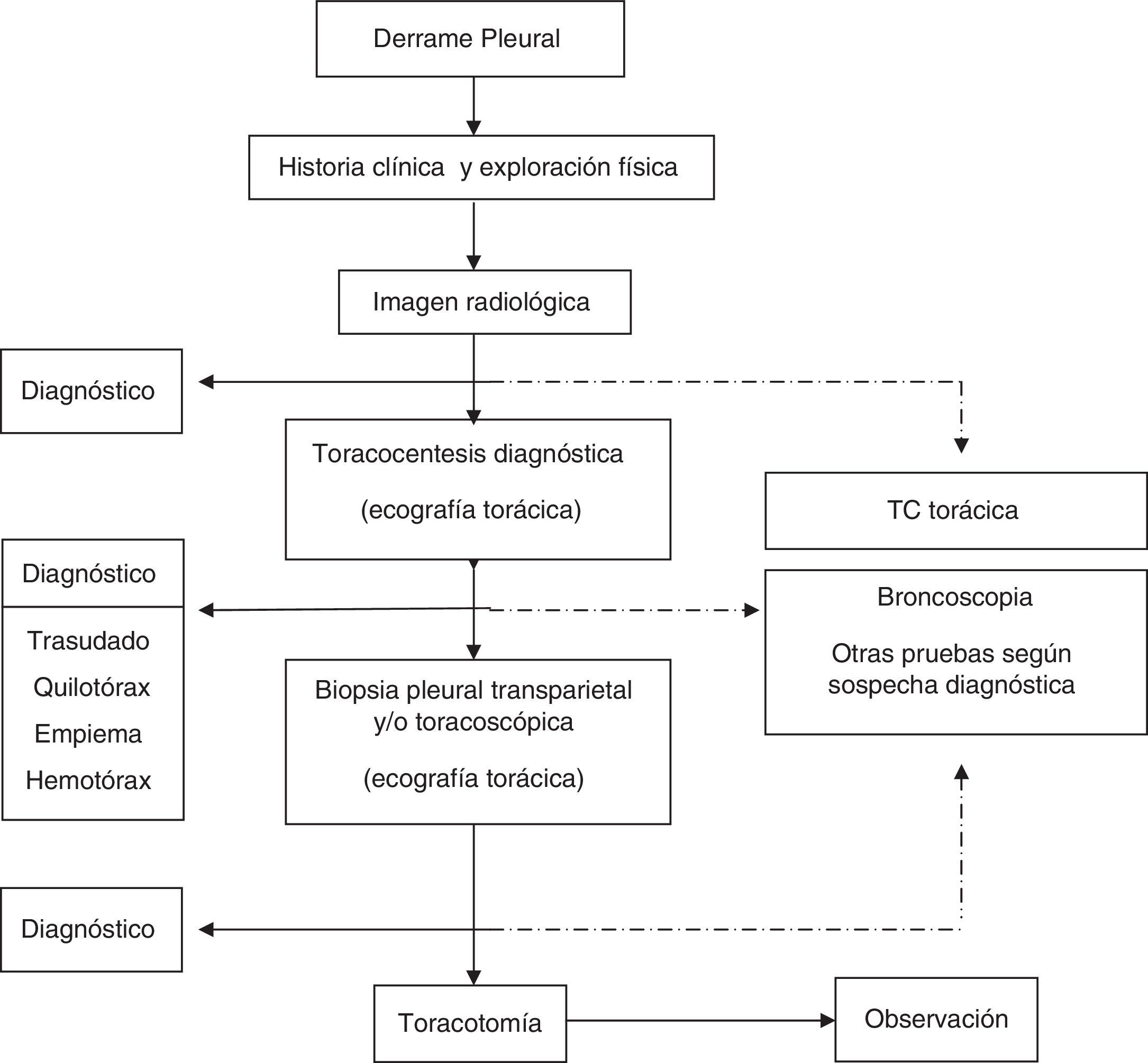
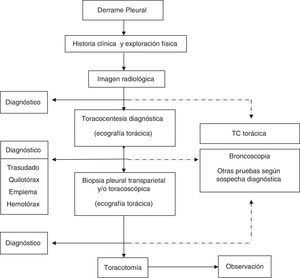
Con los datos clínicos y radiológicos debe establecerse un diagnóstico de presunción. Las principales etiologías del DP se mostraron en la normativa previa1. En pacientes con DP bilateral y en un contexto clínico que sugiera fuertemente un trasudado, no está indicada la realización de toracocentesis5 (H). En el resto de situaciones se realizará una toracocentesis si la cuantía del líquido lo permite. La preparación de las muestras, así como las principales determinaciones en líquido pleural (LP), se especificaron en la normativa previa1. Si con el análisis del LP no es posible establecer un diagnóstico, se tomarán muestras histológicas pleurales, mediante biopsia pleural transparietal (sospecha elevada de tuberculosis y en centros con experiencia) o toracoscopia. La guía de la biopsia pleural con métodos de imagen incrementa la sensibilidad de la biopsia hasta valores cercanos a la toracoscopia6. La broncoscopia está indicada cuando coexisten síntomas bronquiales (hemoptisis, cambios en la tos o expectoración), o datos radiológicos como nódulos o masas pulmonares, o sugestivos de obstrucción bronquial. El esquema del estudio diagnóstico de los pacientes con DP se muestra en la figura 1.
Diferenciación entre derrame pleural trasudado y exudadoLa diferenciación entre trasudados y exudados se considera el paso inicial en el diagnóstico etiológico de cualquier DP. Los primeros resultan de un desequilibrio entre las fuerzas hidrostáticas y oncóticas en la circulación pulmonar o sistémica, mientras que los segundos se producen por un aumento de la permeabilidad vascular. Los trasudados se deben mayoritariamente a insuficiencia cardiaca (80%) y, en menor medida, a cirrosis hepática. Habitualmente no son necesarios otros procedimientos diagnósticos adicionales. Por el contrario, los exudados precisan de una evaluación diagnóstica más extensa ya que pueden tener numerosas etiologías1. No obstante, en el 80% de ocasiones el exudado es secundario a un cáncer, neumonía, tuberculosis o pleuro-pericarditis vírica. En la práctica clínica se diferencian los exudados de los trasudados mediante los criterios de Light (B), según los cuales una DP es exudado cuando cumple una o más de las siguientes condiciones:
- -
Cociente de proteínas entre el LP y el suero superior a 0,5.
- -
Conciente de lactato deshidrogenasa (LDH) entre LP y suero superior a 0,6.
- -
LDH del LP superior a 2/3 del límite superior de la normalidad de la LDH sérica.
Estos criterios identifican correctamente la práctica totalidad de los exudados (98%), pero clasifican erróneamente como «exudados» alrededor del 30% de DP cardíacos y el 20% de hidrotórax hepáticos7. Esta circunstancia es particularmente frecuente en pacientes que han recibido tratamiento diurético o que tienen DP hemáticos. Si sospechamos insuficiencia cardiaca pero el DP es un exudado limítrofe, se recomienda calcular el gradiente (resta) entre la albúmina del suero y del LP. Si dicha diferencia es superior a 1,2g/dl, circunstancia que se da en el 83% de pacientes con estos «falsos exudados» cardiacos, asumiremos la naturaleza trasudativa del DP7. Los hidrotórax hepáticos etiquetados de exudados por los criterios de Light muestran, en el 77% de ocasiones, un cociente entre la albúmina del LP y la albúmina sérica inferior a 0,67. Si está disponible, unas concentraciones pleurales del péptido natriurético NT-proBNP superiores a 1500pg/ml son muy útiles (cociente de probabilidades positivo mayor de 10) para diagnosticar insuficiencia cardiaca8, y tienen una buena correlación con las determinaciones en sangre de NT-proBNP. Se han propuesto otros criterios para la clasificación como exudado con menor rentabilidad, como el colesterol en el líquido pleural mayor a 60mg/dl, o el cociente entre el colesterol en líquido pleural y suero superior a 0,3.
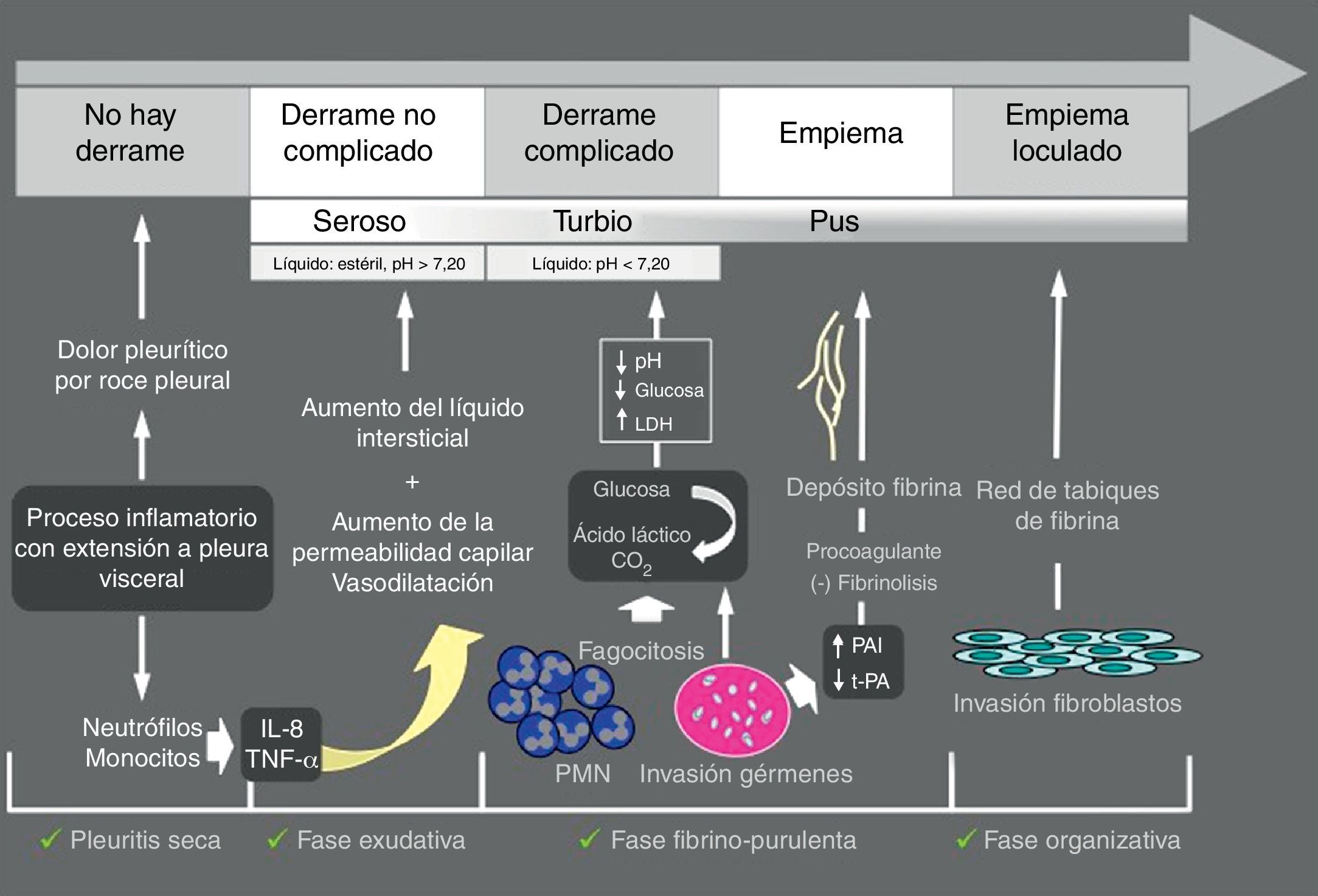
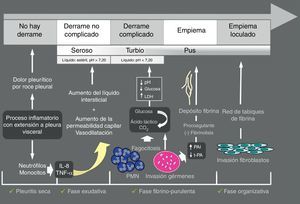
Derrame pleural paraneumónicoEl derrame pleural paraneumónico (DPPN) es el asociado a una infección pulmonar, generalmente una neumonía, un absceso o unas bronquiectasias infectadas. Entre un 20 y 57% de las neumonías bacterianas se acompañan de un DPPN durante su curso clínico, y alrededor de un 40% de estos son DPPN complicados o empiema9, de forma que, en todos los pacientes con neumonía debe plantearse la presencia de DPPN. El DPPN se presenta con más frecuencia en los 2 extremos de la vida, y 2/3 de los pacientes con DPPN complicado o empiema tienen un factor de riesgo asociado como enfermedades pulmonares (bronquiectasias, EPOC, cáncer de pulmón, tuberculosis previa), enfermedades sistémicas que favorecen la aspiración o déficits en la inmunidad. En la figura 2 se muestra la patogenia del DPPN.
La incidencia de aislamiento de los microorganismos es muy variable, y en más del 40% de los empiemas no se encuentra el microorganismo responsable. En los DPPN asociados a una neumonía adquirida en la comunidad los gérmenes más frecuentemente aislados son grampositivos aeróbicos, como el estreptococo (S. milleri y S. pneumoniae) y el S. aureus, seguidos por los anaeróbicos —frecuentes en la neumonía por aspiración—, y por un pequeño grupo de gramnegativos —enterobacterias, E. coli y H. influenzae— en pacientes con comorbilidad, especialmente diabetes o alcoholismo10. Cuando la neumonía es nosocomial el germen más frecuente es el S. aureus, de los que el 60% corresponden a S. aureus meticilín resistente. Le siguen en frecuencia los gramnegativos aerobios —E. coli, Enterobacter sp. y Pseudomonas sp.— y los anaerobios junto con los gramnegativos. Las infecciones fúngicas son infrecuentes y la Candida sp. es el hongo más común, sobre todo en pacientes inmunocomprometidos.
DiagnósticoDurante la evaluación de toda neumonía debe considerarse la posibilidad de un DPPN. Es importante el estudio de las imágenes radiológicas —radiografía simple, TC, ecografía— y la toracocentesis. La TC con contraste es útil para diferenciar una consolidación pulmonar, que capta el contraste, de un DP que es hipodenso. Permite identificar las colecciones interlobulares, las localizadas en la pleura mediastínica y las de pequeño tamaño paravertebrales. Facilita la diferenciación entre un absceso periférico y un DPPN complicado que muestra el signo de la «pleura escindida» (pleuras parietal y visceral engrosadas, con desplazamiento de los vasos circundantes), lo que ayuda a distinguirlo de un absceso de pulmón. El aire en el interior del DPPN, en ausencia de maniobras previas, puede ser debido a la presencia de un germen formador de gas, o a la evolución del empiema, con una fístula broncopleural o pleuroparietal (empiema necessitatis). En la TC el engrosamiento de la pleura y la atenuación de la grasa subcostal sugieren infección de la cavidad pleural, y también puede ser útil para detectar una neoplasia acompañada de un DPPN11. La TC es poco sensible para visualizar septos en la cavidad pleural.
La ecografía torácica ayuda a identificar DP pequeños. La presencia de septos en la ecografía sugiere un DPPN complicado y la hiperecogenicidad se asocia con pus en la cavidad pleural12. La ecografía facilita la elección del mejor lugar para la colocación del drenaje, permite mejorar su rendimiento y disminuye el riesgo de complicaciones (B).
Ante la sospecha de un DP infeccioso debe realizarse siempre una toracocentesis (B) y extraer hemocultivos (B). El paso de un DPPN no complicado a complicado puede producirse en menos de 12h, por lo que el control clínico debe de ser muy estrecho. La presencia de microorganismos, la turbidez o el olor pútrido confirman el diagnóstico de DPPN, considerándose empiema si contiene pus. Frecuentemente los cultivos del LP son negativos o no puede esperarse el resultado para tomar una decisión terapéutica precoz (24 a 48h). En este caso el pH es el mejor marcador (A)13, pero otros parámetros bioquímicos como la glucosa o la LDH son también de gran ayuda diagnóstica y pronóstica. Conviene recordar que el pH puede ser diferente en distintas cámaras del DP loculado y, también es ácido en el DP neoplásico, la artritis reumatoide, la pleuritis lúpica y el DP tuberculoso. Por el contrario, el Proteus sp. provoca la alcalinización del LP.
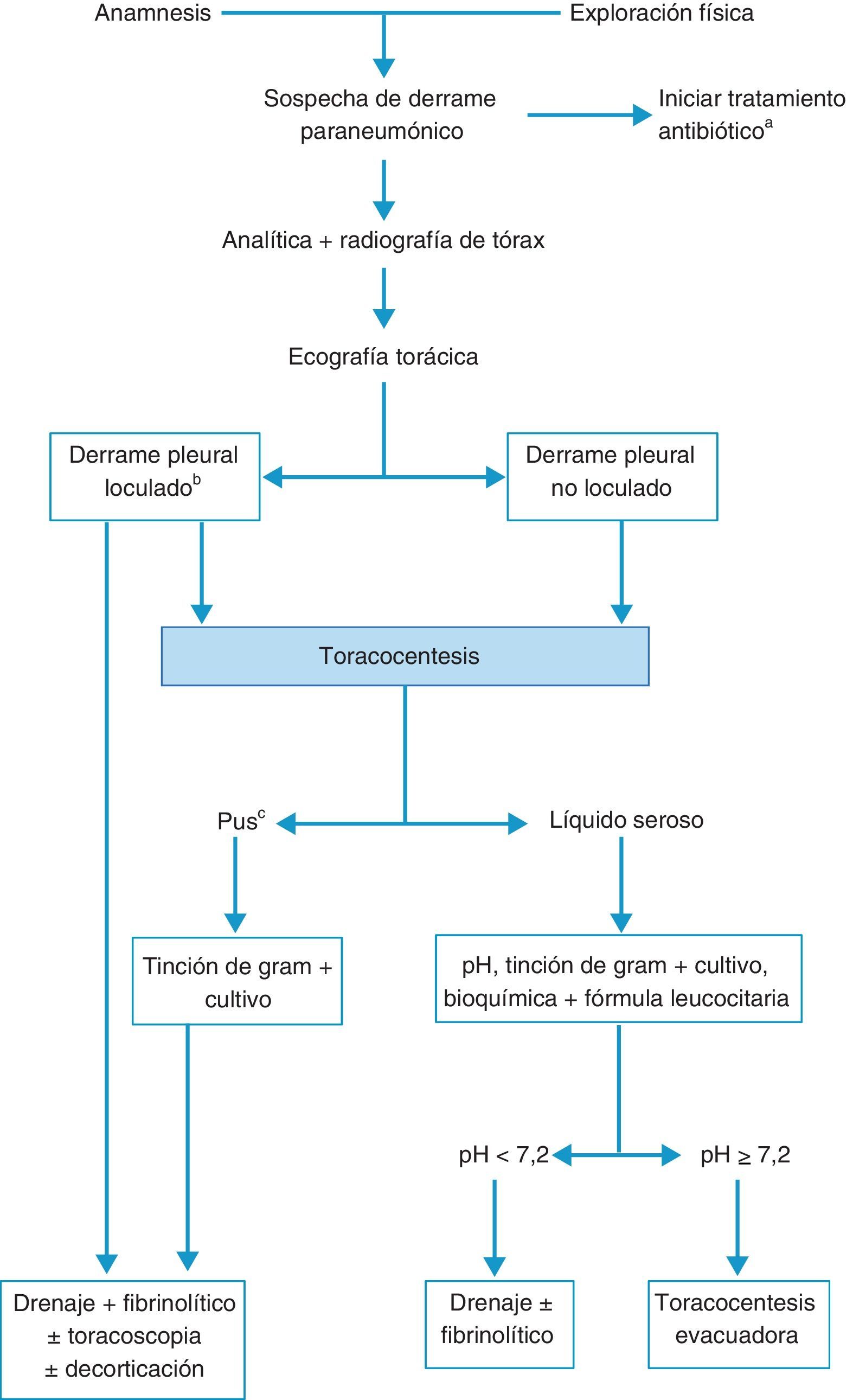
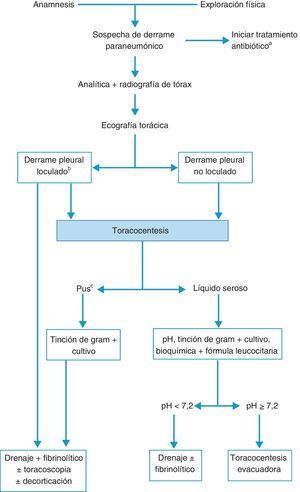
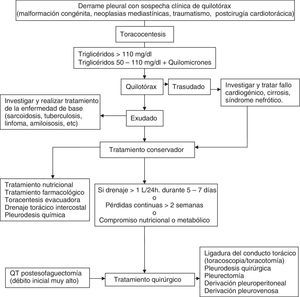
TratamientoLos objetivos son controlar la infección con el antibiótico apropiado y drenar el DP infectado y/o complicado14,15. No hay que omitir una buena nutrición, principalmente en pacientes hipoproteicos, y la profilaxis antitrombótica11. La figura 3 muestra el algoritmo para el tratamiento de un DPPN.
Algoritmo para el tratamiento del derrame paraneumónico.
aEn todos los casos se debe de comenzar con un tratamiento antibiótico empírico temprano, para ajustarlo luego al resultado de los cultivos.
bLa presencia de loculación también se puede basar en los hallazgos de la tomografía computarizada o de la radiografía torácica.
cTambién si el líquido pleural es turbio o maloliente.
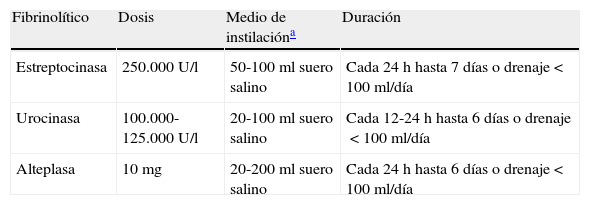
El tratamiento antibiótico debe comenzarse de forma empírica y precoz, incluyendo los gérmenes anaerobios (C), y ajustarlo al resultado de los cultivos. La selección del antibiótico se realizará teniendo en cuenta el origen comunitario o nosocomial del DPPN, las características del paciente, las peculiaridades microbiológicas geográficas y locales y la actividad del antibiótico en el LP (B). Se puede utilizar una combinación de cefalosporina de tercera generación asociada a clindamicina o metronidazol, o monoterapia con amoxicilina-clavulánico. Los pacientes alérgicos a las penicilinas pueden recibir tratamiento con clindamicina, habitualmente en combinación con una quinolona. Si el origen es una infección nosocomial los antibióticos recomendados incluyen vancominica o linezolid (contra el S. aureus meticilín-resistente), las penicilinas antipseudomonas (piperacilina-tazobactam), carbapenem, o cefalosporinas de tercera generación con metronidazol. Es importante señalar que los aminoglucósidos tienen una escasa penetración pleural y no está indicada la utilización de antibióticos intrapleurales (H). La toracocentesis evacuadora es un procedimiento terapéutico eficaz cuando el DP es de tamaño moderado y no cumple los criterios de drenaje con tubo torácico (H). El drenaje torácico está indicado en todos los casos de empiema o DPPN complicado (pH menor de 7,20, derrame loculado o gérmenes en el LP) (B). En caso de no disponer de la determinación de pH, la glucosa menor de 60mg/dl y la LDH mayor de 1.000 U/l son útiles para identificar la necesidad de un drenaje pleural13. Destacar que puede requerirse el drenaje pleural en caso de una evolución clínica tórpida, aunque el pH sea superior a 7,20. En los DP loculados la ecografía torácica facilita su localización y la colocación del drenaje, sobre todo si se requiere más de un tubo, para drenar distintas cavidades. No hay consenso en el tamaño del tubo de drenaje más apropiado, pero los catéteres de pequeño tamaño (10-14F) son más fáciles de colocar, menos traumáticos y más confortables para el paciente y, si se añaden lavados y tratamiento fibrinolítico, su eficacia es similar a los de mayor calibre16. Se considera que el drenaje ha fracasado cuando, a pesar del tratamiento antibiótico, persiste el cuadro séptico. Puede ser debido a una colocación inadecuada del drenaje, a la presencia de múltiples loculaciones, al inicio tardío del tratamiento antibiótico, o a la presencia de una fístula broncopleural. Los fibrinolíticos deben iniciarse de forma precoz cuando hay loculaciones en la cavidad pleural y en el empiema. Facilitan el drenaje de líquidos muy densos y previenen la formación de tabiques en la cavidad pleural. Se utilizan principalmente estreptocinasa, urocinasa o alteplasa con DNasa17, y no existe consenso respecto a las dosis a utilizar18. En la tabla 1 se muestran las pautas más utilizadas. No hay suficiente evidencia científica para recomendar un agente o una pauta sobre las demás.
Dosis de los fibrinolíticos en el tratamiento del derrame pleural paraneumónico
| Fibrinolítico | Dosis | Medio de instilacióna | Duración |
| Estreptocinasa | 250.000U/l | 50-100ml suero salino | Cada 24h hasta 7 días o drenaje<100ml/día |
| Urocinasa | 100.000-125.000U/l | 20-100ml suero salino | Cada 12-24h hasta 6 días o drenaje<100ml/día |
| Alteplasa | 10mg | 20-200ml suero salino | Cada 24h hasta 6 días o drenaje<100ml/día |
Es un tratamiento seguro, con escasos efectos secundarios, mejora la evolución radiológica y disminuye los días de drenaje y estancia hospitalaria19. La única contraindicación es la presencia de una fístula broncopleural.
La toracoscopia precoz es una opción para los pacientes con derrame tabicado, permite el desbridamiento pleural con la consiguiente reexpansión pulmonar, evacuación del pus y colocación de un drenaje. El tratamiento quirúrgico está indicado para controlar la sepsis cuando falla el tratamiento médico y el drenaje con fibrinolíticos.
Derrame pleural tuberculosoLa tuberculosis es un gran problema de salud pública; su prevalencia en España es de 30/100.000 habitantes. La tuberculosis pleural (TBP) representa el 4-10% de de todos los casos de tuberculosis y el 10-15% de las grandes series de DP estudiados mediante toracocentesis en España. La TBP habitualmente es la consecuencia de una respuesta inmunológica compartimentalizada frente a escasos componentes antigénicos del M. tuberculosis que alcanzan la pleura desde focos subpleurales. Esta respuesta está mediada por células mesoteliales, neutrófilos, linfocitos Th1 (CD4), monocitos y sus correspondientes citoquinas (IL1-6, IL8, interferón-gamma [INF-gamma], factor de crecimiento endotelial vascular [VEGF]), responsables de la inflamación local, incremento de la permeabilidad vascular y acumulación de líquido en el espacio pleural20.
En nuestro país afecta especialmente a jóvenes menores de 35 años (60-70%). Clínicamente suele presentarse de forma aguda o subaguda, con tos, dolor torácico y fiebre (70% de los pacientes), malestar general, astenia, anorexia, pérdida de peso, sudoración y diferentes grados de disnea. El DP suele ser unilateral (95%), de tamaño pequeño-moderado, aunque en ocasiones es masivo (12-18%) y en otras loculado (30%). Puede objetivarse enfermedad pulmonar coexistente en la radiografía de tórax (4-20%) o en la TC (40-85%).
DiagnósticoLas características de los métodos asociados con el diagnóstico de la TBP se muestran en la tabla 2. El análisis del LP corresponde a un exudado pleural de predominio linfocítico en la mayoría de los casos (90%), ocasionalmente es polimorfonuclear en los primeros días, con niveles elevados de adenosindesaminasa (ADA), sin eosinofilia y menos del 5% de células mesoteliales20 (A). El diagnóstico de confirmación de TBP se obtiene con el aislamiento de M. tuberculosis en LP o tejido pleural. El uso del BACTEC permite un mayor y más rápido rendimiento (2 semanas), respecto al cultivo de Löwenstein-Jensen (LJ)21. El análisis de observación microscópica de susceptibilidad a fármacos (MODS) permite una mayor celeridad de resultados (2 semanas) y superior sensibilidad que el LJ (en LP 20% frente al 7%; en muestras de tejido pleural 81% frente al 51%)21 (C). Los test de amplificación de ácido nucleico en el diagnóstico de la TBP presentan baja sensibilidad (posiblemente relacionada con la presencia inhibidores en líquido pleural o secuestro intracelular de micobacterias) y alta especificidad22.
Métodos diagnósticos en la tuberculosis pleural
| Test diagnóstico | Comentario | Grado evidencia |
| Prueba de tuberculina | Positivo en el 75% sin infección por VIH y 53% con ella | C |
| Esputo inducido | Rendimiento variable:Presencia o no de infiltrado pulmonar: 28-50% vs 4-7%ZN 12%, LJ: 52% independientes de lesión radiológica | F |
| Líquido pleural | ZN <5%; LJ: 36-55%19 (superior en infección VIH) | A |
| Tejido de biopsia pleural transparietal | ZN 30-50%; LJ: 40-71%. Granulomas 80% (conjunto >90%) | A |
| BACTEC (cultivom. líquido) | Resultado superior y más rápido (2 semanas) que el LJLíquido pleural: 24% en VIH negativo, 75% en VIH positivoPleura: 34% en VIH negativo y 71% en VIH positivo | C |
| MODS (cultivo líquido) | Mayor celeridad de resultados (2 semanas) y superior sensibilidad que el LJ (líquido 20% vs 7%; biopsia 81% vs 51%) | C |
| Amplificación ácidos nucleicos | Dos métodos comercializados: AMPLICOR MTB vs AMTD(sensibilidad 62% vs 76%; especificidad 97% vs 91%). Caro con sensibilidad limitada | C |
| ADA total (ADAt) | Es muy útil en regiones con alta prevalencia y bajas resistencias. Sensibilidad: 88-100%, especificidad 81-97%.Falsos positivos más frecuentes: paraneumónicos complicados, artritis reumatoide y linfoma | B |
| ADA>35 U/I+Linf/neutrof>0,70+edad <35años: sensibilidad 93-94%, especificidad: 94-97% | F | |
| ADA2 (ADA1/ADAt) | Sensibilidad 100%, especificidad 97-99% | F |
| INF-gamma | Sensibilidad 89-99%, especificidad 92-98%. Falsos positivos: paraneumónicos y linfomas. El ADA mejor precio y celeridad | B |
ADA: adenosín deaminasa; ADA1: isoenzima de la ADA; ADA2: isoenzima de la ADA; INF-gamma: interferón gamma; LJ: Löwenstein-Jensen; MODS: observación microscópica de susceptibilidad a fármacos; ZN: Ziehl-Neelsen.
El análisis de tejido pleural, obtenido por biopsia pleural transparietal, puede mostrar granulomas y supone un diagnóstico presuntivo. Su sensibilidad es superior al 80% y su rendimiento aumenta (90%) y confirma el diagnóstico, con la presencia de bacilos ácido alcohol resistentes (30-50%) o el aislamiento de M. tuberculosis en el cultivo (40-71%)20 (A). La toracoscopia diagnóstica solo estará indicada ante la sospecha clínica persistente y negatividad de los estudios realizados (F).
Los niveles de ADA en LP están elevados, con una sensibilidad del 88-100% y especificidad del 81-97%23, y el nivel de corte más aceptado es de 35 UI (B). Los rendimientos son similares en pacientes con serología para el virus de la inmunodeficiencia humana (VIH) positiva, inclusive con cifras de linfocitos CD4 muy bajas24. El rendimiento mejora en pacientes menores de 35 años con una proporción linfocitos/neutrofilos en LP>0,70 (sensibilidad 93-94%, especificidad 94-97%). Los falsos positivos de ADA inciden principalmente en DPPN complicados (especialmente empiemas) y linfomas, e incluyen otros menos comunes como la artritis reumatoide o algunos carcinomas. Los incrementos de ADA en la TBP lo hacen a expensas de la isoenzima ADA2, derivada preferentemente de los monocito-macrófagos. De ahí que, valores de la relación ADA1/ADAtotal<0,42 (ADAtotal=ADA1+ADA2), se describan con rendimientos superiores al ADA, con sensibilidad del 100% y especificidad del 97-99%25 (F).
El nivel de INF-gamma derivado de la activación de linfocitos T (CD4) también se encuentra elevado en la TBP, y su rendimiento diagnóstico es tan alto como el ADA20 (sensibilidad 89-99%, especificidad 92-98%), con un nivel de corte variable según método y unidades (B). Los falsos positivos se describen en empiemas y linfomas. El menor precio y la celeridad del ADA respecto al INF-gamma han justificado su recomendación.
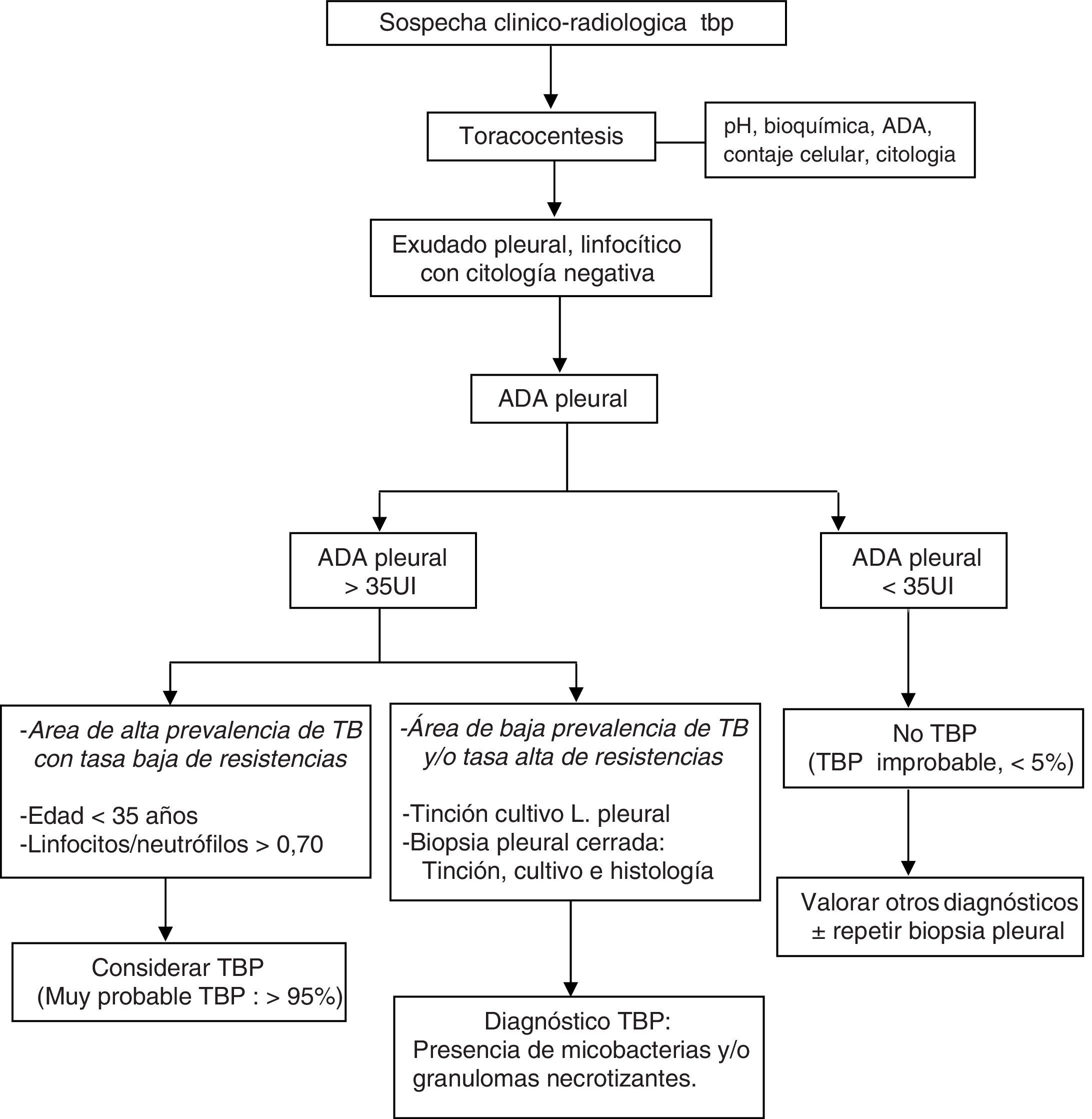
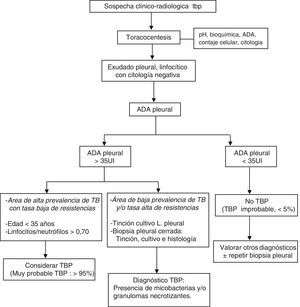
La combinación de test diagnósticos en DP linfocíticos que incluya la edad del paciente, los niveles de ADA, la tinción y cultivos del LP, los cultivos de micobacterias y el análisis histológico de la muestra de biopsia pleural transparietal, y la respuesta terapéutica, permiten una adecuada aproximación diagnóstica (fig. 4).
El tratamiento de la TBP no difiere del aplicado en la tuberculosis pulmonar: 2 meses (isoniazida+rifampicina+etambutol+pirazinamida) y los siguientes 4 meses (isoniazida+rifampicina) (A). El drenaje pleural coincidente puede disminuir el periodo sintomático, pero no existen evidencias de que mejoren los resultados a medio-largo plazo26.
El uso de fibrinolíticos intrapleurales en la TBP loculada puede facilitar la resolución del DP y disminuir la paquipleuritis residual (>10mm). No obstante, el engrosamiento pleural se observa en menos del 20% de pacientes al año de seguimiento y el impacto funcional es escaso en la mayoría de las ocasiones (G). Los corticoides, iniciados 2 semanas después del tratamiento antituberculoso, pueden ser útiles en casos clínicamente severos, al acortar el periodo sintomático, pero no muestran utilidad a largo plazo (G).
El empiema tuberculoso es poco común, pero su hallazgo frecuentemente requiere decorticación pleural por incapacidad funcional e ineficacia terapéutica al encontrarse un pulmón atrapado, frecuentemente loculado, con pleura engrosada, e inclusive calcificada, que puede dificultar el acceso de los fármacos (H).
Derrame pleural malignoEl derrame pleural maligno (DPM) supone entre el 15 y el 35% de todos los DP y es una de las principales causas de exudado pleural, aunque también hay que tener en cuenta que puede haber afectación neoplásica de la pleura sin DP. La mediana de supervivencia suele oscilar entre 4 y 6 meses. La mayoría de los DPM son producidos por metástasis pleurales, sobre todo de tumores pulmonares (más de un tercio de los casos) y mama. Dependiendo de la exposición a asbesto, el mesotelioma puede ser la tercera causa de DPM, pero también hay que considerar el linfoma y los tumores de ovario, entre otros. Un DP en una mujer con neoplasia conocida de mama (ipsi o contralateral a la mama afecta) es metastásico como primera posibilidad.
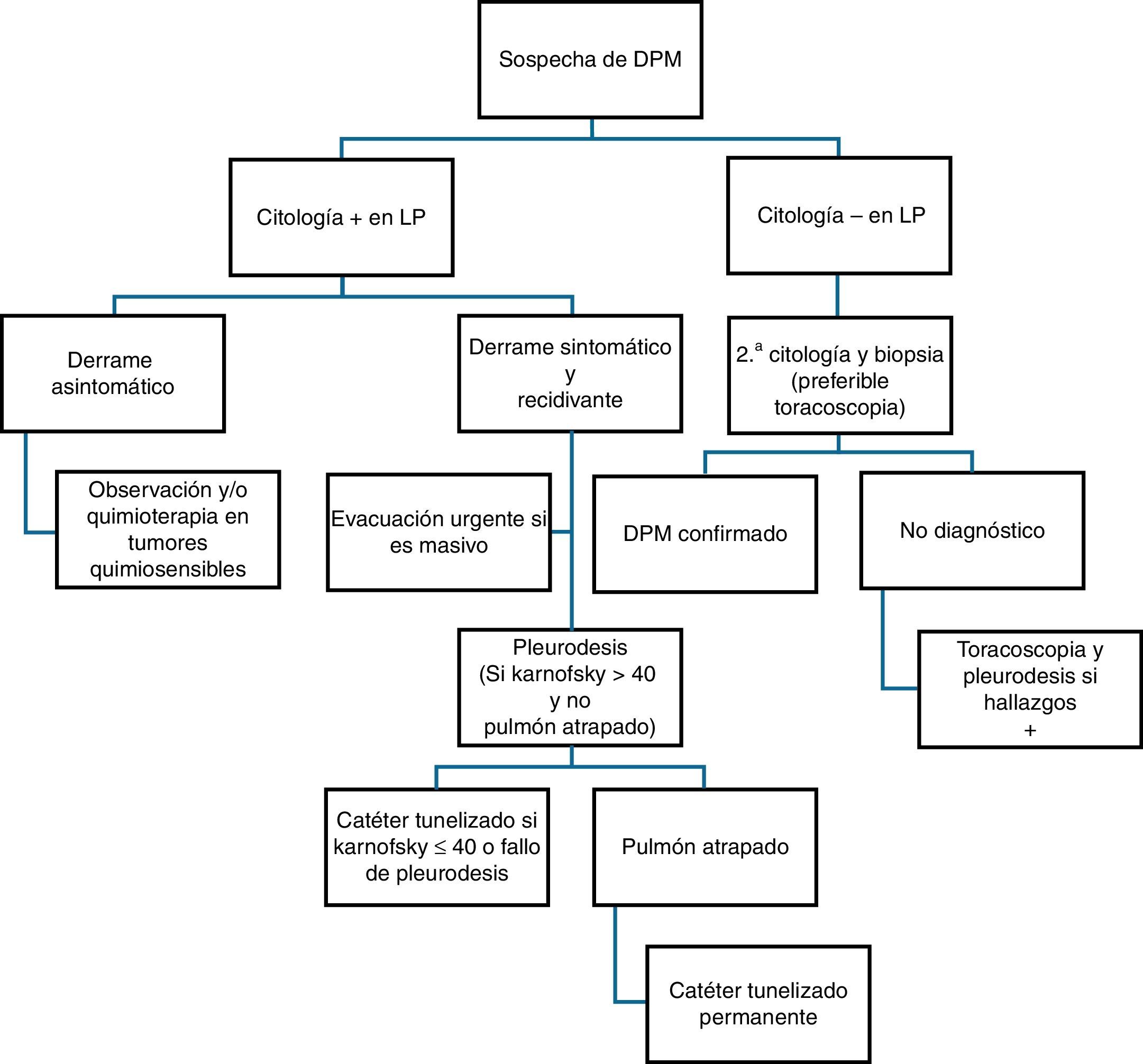
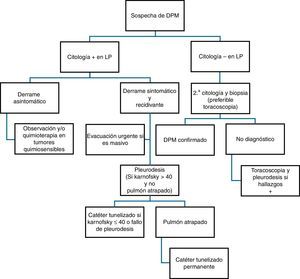
El principal mecanismo de producción de DPM es el aumento de la permeabilidad vascular, frecuentemente asociado a obstrucción del drenaje linfático a nivel pleural y/o mediastínico. También se puede producir «DP paraneoplásico» por causas en las que no hay infiltración pleural directa por el tumor, tales como neumonitis obstructiva o atelectasia, embolismo pulmonar, bloqueo linfático mediastínico, obstrucción del conducto torácico (quilotórax), síndrome de vena cava superior, afectación tumoral del pericardio, síndrome post-radio/quimioterapia o hipoalbuminemia. En la figura 5 se muestra la recomendación de actuación ante pacientes con sospecha de DPM.
La mayoría de los DPM comienzan con disnea de esfuerzo, que progresa a medida que aumentan de tamaño y comprimen el pulmón y el diafragma. Si cursan con dolor intenso y continuo debe sospecharse un mesotelioma, especialmente en sujetos con historia de exposición previa a asbesto.
Radiológicamente hay que tener en cuenta las siguientes características:
- -
Con frecuencia llega a ocupar más de la mitad del hemitórax.
- -
Si es bilateral (más frecuente en metástasis de mama y ovario) el tamaño aparente del corazón no está aumentado (salvo en presencia de derrame pericárdico, en fases muy avanzadas).
- -
Si el mediastino está centrado en presencia de un DP unilateral masivo hay que sospechar obstrucción bronquial proximal, fijación del mediastino por tumor y/o adenopatías, o infiltración pleural extensa (por mesotelioma y/o «pulmón atrapado»).
- -
Se recomienda realizar la TC con contraste, en la que puede encontrarse el DP sin ningún otro hallazgo en más del 50% de los casos. Hay que sospechar neoplasia si se observan nodulaciones pleurales, engrosamiento difuso de la pleura parietal mayor de 1cm, engrosamiento «circunferencial» de toda la pleura (incluyendo la mediastínica, que aparece frecuentemente en mesotelioma avanzado), o presencia de metástasis hepáticas coexistiendo con el DP.
- -
La ecografía torácica puede superar el 95% de especificidad para DPM si se observa engrosamiento marcado de pleura parietal o visceral, o se ven nódulos sobre la superficie del diafragma27.
El aspecto hemorrágico refuerza la sospecha de malignidad. En más del 95% se trata de un exudado. Más del 80% tienen predominio linfocitario, con ADA menor de 35U/l en aproximadamente el 95% de los casos. La glucosa es menor de 60mg/dl y el pH de 7,30 en aproximadamente el 30%, lo que indica enfermedad avanzada, y se asocia con mayor probabilidad de obtener citología y biopsia positivas. Destacar que la determinación de marcadores tumorales no es recomendable como método de rutina en el LP (C). El rendimiento de la citología oscila alrededor del 60%, pero es más alto en neoplasias de mama y ovario respecto a linfomas, sarcomas y mesoteliomas28, y cuando se remiten 60ml o más de LP. No es rentable repetir la citología más de 2 veces (B), y se recomienda añadir toma de muestras mediante biopsia cuando se requiera una segunda citología29. Si se sospecha linfoma puede ser de gran ayuda el estudio del LPmediante citometría de flujo. Las técnicas de bloque celular o la tinción con inmunocitoquímica son de utilidad clínica. Salvo instrucciones expresas, la muestra de LP para estudio citológico se puede incluir en tubos citratados para prevenir su coagulación, pero no en cualquier otro medio, por el riesgo de interferir con las técnicas de laboratorio.
Biopsia pleural con agujaSu sensibilidad en DPM es inferior a la de la citología en LP, y oscila alrededor del 50%, pero aumenta en presencia de glucosa y pH bajos en el LP. El uso conjunto de citología y biopsia mejora el rendimiento diagnóstico, y está especialmente indicada cuando se duda entre tuberculosis o neoplasia, por su alto rendimiento diagnóstico en pleuritis tuberculosa, y a diferencia de la toracoscopia puede realizarse en régimen ambulatorio. Si se observa marcado engrosamiento pleural difuso con escasa cantidad de líquido o presencia de grandes nódulos en la pleura parietal (mediante ecografía o TC), el rendimiento puede llegar a un 85% si se realiza punción-biopsia guiada por TC30 (B).
ToracoscopiaEs el procedimiento de elección cuando el derrame persiste durante más de 2 semanas y la citología es negativa, con un rendimiento diagnóstico superior al 95% (B). Permite tomar bajo control visual amplias biopsias de la pleura parietal y visceral (para inmunohistoquímica y otros estudios). También permite valorar la carga tumoral en la cavidad pleural y aplicar pleurodesis en el mismo acto, y puede realizarse en una unidad de endoscopia respiratoria adecuadamente dotada, con anestesia local y analgesia/sedación sin necesidad de intubación.
TratamientoSe plantean varias opciones en el manejo del DPM.
Terapia sistémicaLa quimioterapia puede ser efectiva para controlar el DPM asociado a linfoma, carcinoma de pulmón de células pequeñas y cáncer de mama. No obstante, se recomienda aplicar precozmente pleurodesis si el DP recidiva rápidamente, con objeto de evitar el deterioro del paciente o el desarrollo de un pulmón atrapado, que impediría la reexpansión pulmonar y la sínfisis entre la pleura visceral y parietal (B).
Toracentesis evacuadoraDebe realizarse con carácter urgente en pacientes con DP masivo y desplazamiento contralateral del mediastino, pero la evacuación debe efectuarse lentamente para evitar edema pulmonar de reexpansión. Hay que ser especialmente cautelosos si el mediastino está centrado con un DP masivo, y en estos casos es recomendable monitorizar la presión pleural durante la evacuación del líquido31. No se recomienda aplicarla como única medida terapéutica para el control del DPM, salvo en pacientes con corta expectativa de vida (menor de un mes), y es preferible optar por la colocación de un catéter fino (10-14F), con aplicación de pleurodesis si el pulmón no está atrapado32 (A).
PleurodesisMediante la aplicación intrapleural de un agente irritante se provoca una intensa inflamación que conduce a fibrosis, sínfisis entre pleura visceral y parietal y obliteración del espacio pleural. Para su indicación se requiere33 que el DP sea sintomático (disnea) y muestre tendencia a la recidiva tras toracentesis evacuadora, un índice de Karnofsky mayor de 40 y que el pulmón sea reexpandible tras una toracentesis terapéutica, descartándose obstrucción bronquial proximal y/o pulmón atrapado.
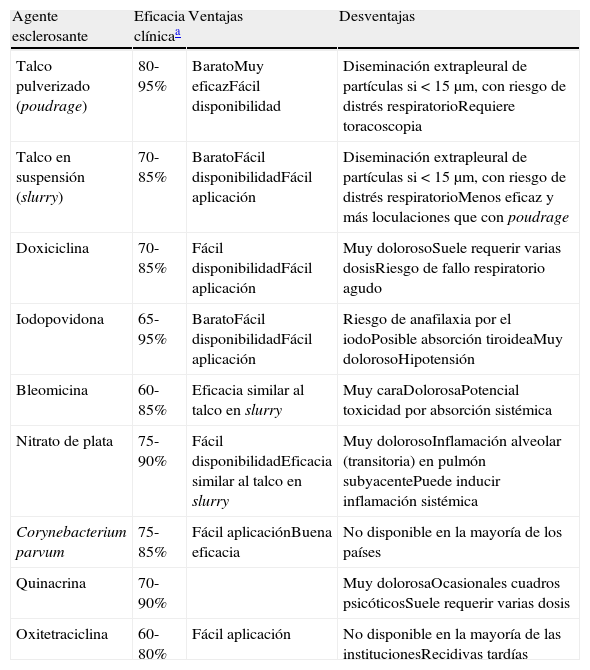
El talco es el agente de elección para la pleurodesis (A), y con objeto de minimizar el riesgo de complicaciones se requiere que esté libre de contaminantes (asbesto y otros) y que el tamaño de sus partículas sea superior a 15μm (B)34. Cuando se dispone de esta técnica la toracoscopia permite combinar diagnóstico y tratamiento (pleurodesis con talco pulverizado, poudrage). El talco puede también aplicarse en suspensión (en suero fisiológico) a través de un tubo de drenaje (slurry), y esta opción es preferible en pacientes con afectación pleuro-pulmonar contralateral (que no tolerarían el colapso unipulmonar necesario para realizar la toracoscopia), o en aquellos con bajo índice de Karnofsky. También puede instilarse doxiciclina en estos casos, teniendo en cuenta siempre la necesidad de una cuidadosa analgesia. La instilación de bleomicina, yodopovidona y nitrato de plata se han postulado como alternativas para pleurodesis, pero ninguno de ellos está exento de complicaciones, y su efectividad es algo inferior a la del talco. En la tabla 3 se muestran las características de los diferentes agentes sinfisantes, así como su eficacia clínica35.
Agentes más frecuentemente usados para pleurodesis en la práctica clínica
| Agente esclerosante | Eficacia clínicaa | Ventajas | Desventajas |
| Talco pulverizado (poudrage) | 80-95% | BaratoMuy eficazFácil disponibilidad | Diseminación extrapleural de partículas si<15μm, con riesgo de distrés respiratorioRequiere toracoscopia |
| Talco en suspensión (slurry) | 70-85% | BaratoFácil disponibilidadFácil aplicación | Diseminación extrapleural de partículas si<15μm, con riesgo de distrés respiratorioMenos eficaz y más loculaciones que con poudrage |
| Doxiciclina | 70-85% | Fácil disponibilidadFácil aplicación | Muy dolorosoSuele requerir varias dosisRiesgo de fallo respiratorio agudo |
| Iodopovidona | 65-95% | BaratoFácil disponibilidadFácil aplicación | Riesgo de anafilaxia por el iodoPosible absorción tiroideaMuy dolorosoHipotensión |
| Bleomicina | 60-85% | Eficacia similar al talco en slurry | Muy caraDolorosaPotencial toxicidad por absorción sistémica |
| Nitrato de plata | 75-90% | Fácil disponibilidadEficacia similar al talco en slurry | Muy dolorosoInflamación alveolar (transitoria) en pulmón subyacentePuede inducir inflamación sistémica |
| Corynebacterium parvum | 75-85% | Fácil aplicaciónBuena eficacia | No disponible en la mayoría de los países |
| Quinacrina | 70-90% | Muy dolorosaOcasionales cuadros psicóticosSuele requerir varias dosis | |
| Oxitetraciclina | 60-80% | Fácil aplicación | No disponible en la mayoría de las institucionesRecidivas tardías |
Suma de éxitos completos y parciales en los que, aunque se observe pequeña recidiva del derrame, no se requiere toracocentesis evacuadora durante todo el tiempo de evolución del paciente a partir de la aplicación del agente sinfisante35.
En los últimos años se ha popularizado el uso de estos catéteres para el control de los derrames pleurales malignos, incluso como alternativa a la pleurodesis química36–41. Su colocación está especialmente indicada en pacientes con pulmón atrapado, o en aquellos con corta expectativa de vida o en los que ha fallado un intento previo de pleurodesis42 (B). Aunque en aproximadamente la mitad de los casos se produce sínfisis pleural espontánea en los pacientes portadores de este tipo de catéteres, también se ha planteado la posibilidad de instilar talco a su través, para complementar su efecto terapéutico. Sus principales problemas radican en el coste del sistema, riesgo de infección, invasión neoplásica de la zona de inserción y pérdida crónica de proteínas por las evacuaciones repetidas del LP.
PleurectomíaPuede plantearse en casos muy excepcionales, especialmente en mesotelioma y en pacientes con buen estado general con fallo de la pleurodesis. Se realiza con cirugía vídeo-toracoscópica. Es un procedimiento muy invasivo y con importante morbilidad.
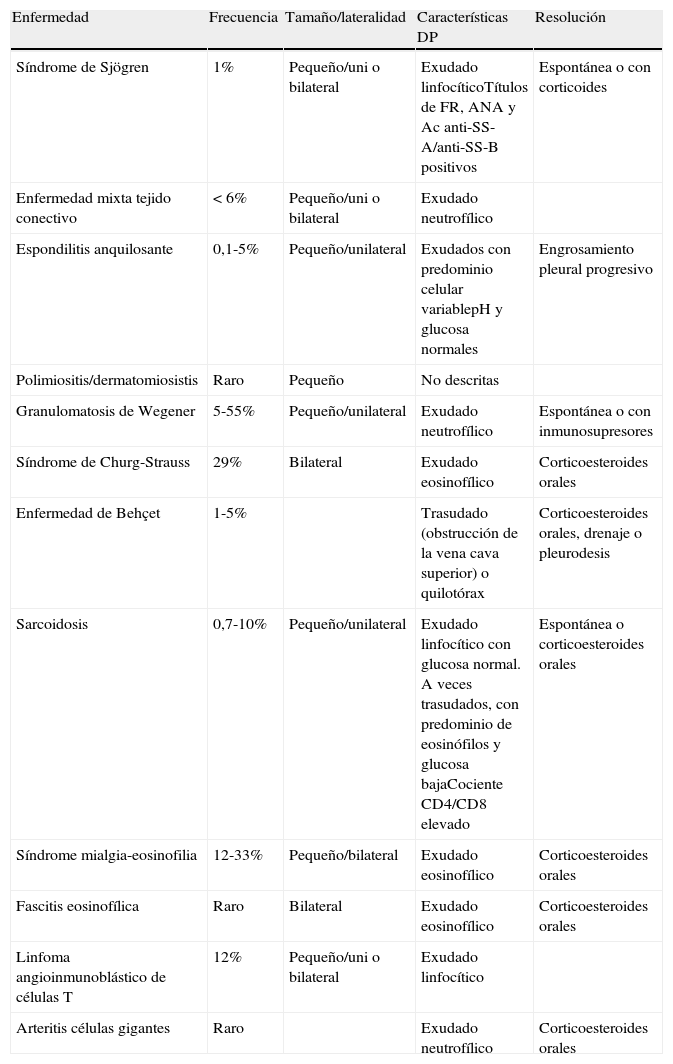
Derrame pleural en enfermedades sistémicasLa incidencia del DP en las enfermedades sistémicas es aproximadamente del 1%. El rasgo más importante, sobre todo en las enfermedades del tejido conectivo, es el incremento de la permeabilidad capilar, como consecuencia de una infiltración directa de la pleura o por un mecanismo inmune. También puede aparecer DP como consecuencia de la afectación renal o cardiaca que pueden acompañar a estas entidades, así como por una enfermedad tromboembólica o por la toma de fármacos. Las 2 entidades más frecuentes son la artritis reumatoide (AR) y el lupus eritematoso sistémico (LES), el resto de enfermedades se resumen en la tabla 443.
Características del derrame pleural en las enfermedades sistémicas menos frecuentes
| Enfermedad | Frecuencia | Tamaño/lateralidad | Características DP | Resolución |
| Síndrome de Sjögren | 1% | Pequeño/uni o bilateral | Exudado linfocíticoTítulos de FR, ANA y Ac anti-SS-A/anti-SS-B positivos | Espontánea o con corticoides |
| Enfermedad mixta tejido conectivo | <6% | Pequeño/uni o bilateral | Exudado neutrofílico | |
| Espondilitis anquilosante | 0,1-5% | Pequeño/unilateral | Exudados con predominio celular variablepH y glucosa normales | Engrosamiento pleural progresivo |
| Polimiositis/dermatomiosistis | Raro | Pequeño | No descritas | |
| Granulomatosis de Wegener | 5-55% | Pequeño/unilateral | Exudado neutrofílico | Espontánea o con inmunosupresores |
| Síndrome de Churg-Strauss | 29% | Bilateral | Exudado eosinofílico | Corticoesteroides orales |
| Enfermedad de Behçet | 1-5% | Trasudado (obstrucción de la vena cava superior) o quilotórax | Corticoesteroides orales, drenaje o pleurodesis | |
| Sarcoidosis | 0,7-10% | Pequeño/unilateral | Exudado linfocítico con glucosa normal. A veces trasudados, con predominio de eosinófilos y glucosa bajaCociente CD4/CD8 elevado | Espontánea o corticoesteroides orales |
| Síndrome mialgia-eosinofilia | 12-33% | Pequeño/bilateral | Exudado eosinofílico | Corticoesteroides orales |
| Fascitis eosinofílica | Raro | Bilateral | Exudado eosinofílico | Corticoesteroides orales |
| Linfoma angioinmunoblástico de células T | 12% | Pequeño/uni o bilateral | Exudado linfocítico | |
| Arteritis células gigantes | Raro | Exudado neutrofílico | Corticoesteroides orales |
Ac: anticuerpos; ANA: anticuerpos antinucleares; DP: derrame pleural; FR: factor reumatoide.
La afectación pleural es la manifestación intratorácica más frecuente de la AR, ya que ocurre en el 5% de los pacientes. Aunque la AR es más frecuente en mujeres, la mayoría de DP reumatoideos corresponden a varones (80%) de edad media, con altos títulos de factor reumatoide, nódulos reumatoideos y presencia de HLA-B8 y Dw3. El DP suele ser pequeño, unilateral (70%), normalmente del lado izquierdo, y el paciente está generalmente asintomático. Suelen aparecer años después del diagnóstico de la AR y pueden ser transitorios, recurrentes o crónicos. El aspecto del líquido puede ser seroso, lechoso, hemorrágico e incluso purulento. Las características bioquímicas de un DP crónico (80% de los casos) suelen ser pH<7,20, bajo nivel de glucosa (en el 80% por debajo de 50mg/dl), cociente de glucosa pleura/suero <0,5, LDH elevada (>1.000 U/l), título de factor reumatoide mayor de 1/320 (generalmente mayor en el líquido que en la sangre) y complemento hemolítico total y componentes del complemento bajos. Sin embargo, en los DP agudos los niveles de pH y glucosa suelen ser normales. En países con una baja incidencia de tuberculosis los derrames reumatoideos crónicos son la causa más frecuente de pseudoquilotórax, pero también se han descrito quilotórax y empiemas. La biopsia pleural no suele ser diagnóstica. No suelen requerir tratamiento, pero para evitar el engrosamiento pleural y el pulmón atrapado a veces hay que recurrir a toracocentesis terapéuticas de repetición44.
Lupus eritematoso sistémicoLa afectación pleural puede ser la forma de presentación en un 5% de los casos, si bien entre el 30-50% desarrollarán una inflamación pleural sintomática a lo largo de su enfermedad. Los DP tienden a ser bilaterales (50%), pequeños y no suelen acompañarse de enfermedad pulmonar subyacente. Se comportan como exudados típicos y no hay pruebas positivas definitivas que los diferencien de otros tipos de derrames. En LP, los niveles bajos de complemento y los títulos altos de anticuerpos antinucleares (ANA) (>1/160) son sugestivos, pero no diagnósticos, ya que algunos DPM, sobre todo linfomas, pueden tener títulos elevados. Un trabajo reciente demuestra que la determinación de ANA en LP no aporta información adicional a la de su determinación en suero, y solamente se recomienda su determinación en pacientes con un LES y un DP de etiología incierta, ya que la ausencia de ANA en el líquido iría en contra del diagnóstico de pleuritis lúpica45. La presencia de células de lupus eritematoso es altamente específica, si bien este test raramente se lleva a cabo debido al largo tiempo de preparación que precisa. En la biopsia pleural puede observarse un patrón de inmunofluorescencia específico caracterizado por la tinción nuclear de las células pleurales, ya sea con anti-IgM, anti-IgG o anti-C3. En el lupus inducido por fármacos el DP también puede estar presente y suele desaparecer una vez que se retira el medicamento. En la mayoría de los casos los derrames por LES o lupus inducido por fármacos responden bien a los antiinflamatorios no esteroideos (AINE) o a bajas dosis de corticoesteroides orales46.
Derrame pleural por enfermedad cardiovascularDerrame pleural por insuficiencia cardiacaEs probablemente la causa más frecuente de DP. En la radiografía simple aproximadamente el 60% de estos DP son bilaterales, el 30% unilaterales derechos y el 10% unilaterales izquierdos47. En más del 80% de ocasiones el DP ocupa tan solo un tercio o menos el hemitórax47. En ocasiones, el LP se acumula en las cisuras y puede simular un tumor pulmonar. En un contexto clínico-radiológico típico no es necesario analizar el LP. La toracocentesis solo estaría indicada en: 1) DP unilateral, particularmente si no existe cardiomegalia; 2) pacientes con fiebre o dolor pleurítico; y 3) DP persistente a pesar del tratamiento diurético.
En la mayoría de pacientes con insuficiencia cardiaca el DP se resuelve con el uso de diuréticos. En los pocos casos en los que el DP cardiaco es refractario al tratamiento médico convencional se puede optar por el empleo de toracocentesis evacuadoras repetidas, pleurodesis o inserción de un catéter intrapleural permanente. La pleurodesis unilateral conlleva el riesgo de incrementar el DP en el hemitórax opuesto. Aunque la experiencia es escasa, los catéteres intrapleurales permanentes controlan la disnea en todos los pacientes, y en la mitad de los casos se pueden retirar al cabo de un par de meses, fundamentalmente por el desarrollo de una pleurodesis espontánea48.
Derrame poscirugía de revascularización coronariaEn el postoperatorio inmediato de una cirugía de revascularización mediante bypass aortocoronario la mayoría de pacientes presentan pequeños DP que se resuelven gradualmente49. Sin embargo, la incidencia de DP que ocupan más de un cuarto del hemitórax es del 10%. Estos DP de tamaño moderado o grande producen disnea y su localización es izquierda o, si son bilaterales, predominan en el lado izquierdo. Se debe realizar siempre una toracocentesis, ya que el diagnóstico diferencial incluye la insuficiencia cardiaca, la embolia pulmonar, el quilotórax o el DP infeccioso. Los DP sintomáticos durante los primeros 30 días del postoperatorio suelen deberse al traumatismo quirúrgico y el LP es un exudado, con frecuencia hemático y eosinofílico. Los DP que alcanzan su tamaño máximo después de un mes de la cirugía son exudados linfocitarios cuya patogenia es probablemente inmunológica, representando quizás una variante limitada del síndrome poslesión cardiaca. El tratamiento consiste en la toracocentesis terapéutica que, en un 20% de los casos, es necesario repetir 2 o más veces.
Enfermedades del pericardioEl síndrome poslesión cardiaca consiste en la aparición de pericarditis (con o sin derrame pericárdico), días, semanas o meses después de un infarto agudo de miocardio (síndrome de Dressler), una cirugía cardiaca con pericardiotomía, un traumatismo pericárdico o incluso un factor precipitante menor como una intervención coronaria percutánea, la inserción de un marcapasos o una ablación por radiofrecuencia. La incidencia de síndrome de Dressler es inferior al 1% y la del síndrome pospericardiotomía del 15%. El mecanismo de producción es inmunológico y los pacientes presentan típicamente dolor pleurítico y/o pericardítico, fiebre y elevación de reactantes de fase aguda, junto con pequeños exudados pleurales unilaterales de predominio izquierdo y, ocasionalmente, infiltrados pulmonares. El tratamiento consiste en ácido acetilsalicílico (síndrome de Dressler), AINE (resto de casos) y, si hay refractariedad o recidiva, se pueden administrar corticoides. El uso profiláctico de colchicina en el postoperatorio inmediato (0,5mg/12h durante un mes) reduce significativamente el riesgo de derrame pleuro-pericárdico después de una cirugía cardiaca50.
Al menos una cuarta parte de las pericarditis agudas y más de la mitad de las constrictivas se acompañan de DP. En el primer caso los DP son mayoritariamente pequeños (≤1/3 del hemitórax) y unilaterales izquierdos, mientras que en el segundo predominan los DP bilaterales. El análisis bioquímico casi siempre demuestra exudados. La pericarditis aguda se trata con AINE, a los que se debe asociar colchicina durante 3 meses (0,6mg/d si <70kg de peso o 1mg/d si >70kg de peso) para reducir el riesgo de enfermedad persistente o recurrente.
Tromboembolismo pulmonarUn tercio de los pacientes con embolia pulmonar tienen DP en la radiografía de tórax, si bien técnicas más sensibles como la ecografía o la TC lo demuestran en la mitad de los casos51. El DP ocupa menos de un tercio del hemitórax en el 90% de los pacientes y es unilateral en más del 85% de ocasiones. En el 20% de sujetos, particularmente si el diagnóstico se retrasa más de 10 días después del inicio de los síntomas, el DP está loculado51. Debido al pequeño tamaño de los DP y a la anticoagulación inmediata ante la sospecha clínica de esta entidad, solo un tercio de los pacientes se someten a toracocentesis diagnóstica. El LP es hemático en la mitad de los casos, con características bioquímicas de exudado y predominio variable de neutrófilos o linfocitos. El tratamiento del embolismo no se modifica por la presencia del DP.
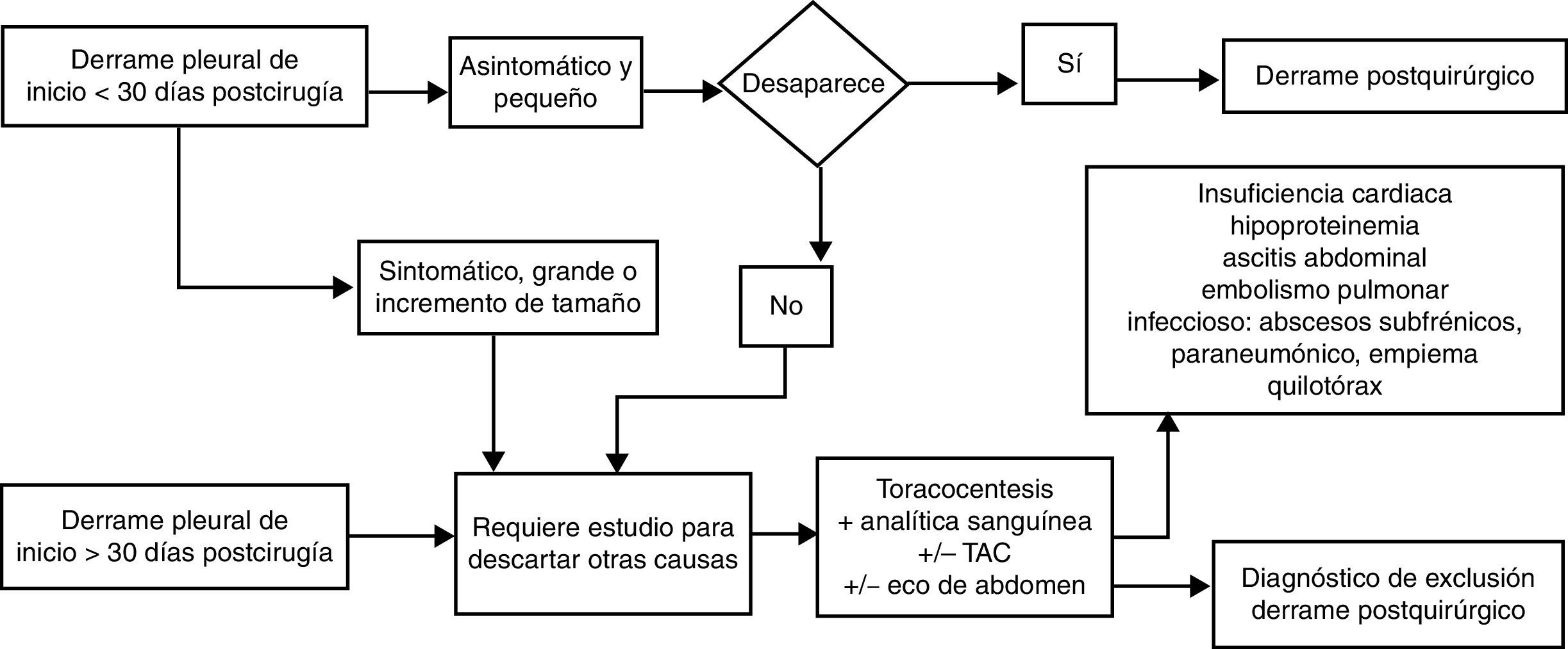
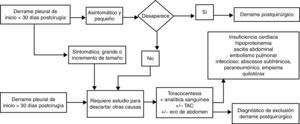
Derrame pleural posquirúrgicoLa aparición de DP tras cirugía abdominal o torácica (ya sea resección pulmonar, trasplante pulmonar o cirugía cardiaca) sin que haya otra causa que lo justifique como embolismo, infección, insuficiencia cardiaca, quilotórax o pulmón atrapado, es frecuente en el postoperatorio inmediato desde el primer al cuarto día, con incidencia variable entre 40 y 80% según su diagnóstico se realice con radiografía de tórax o con ecografía. Estos DP posquirúrgicos inmediatos pueden ser uni o bilaterales, suelen ser pequeños y asintomáticos y desaparecen espontáneamente en el primer mes (no es necesaria la toracocentesis), aunque en ocasiones persisten hasta más de 3 meses, pero casi siempre de tamaño inferior a un cuarto del hemitórax.
En la cirugía cardiaca o torácica el DP posquirúrgico suele ser exudado neutrofílico en el primer mes y posteriormente linfocítico. Es secundario a la manipulación de la cavidad pleural y/o al síndrome posdaño cardiaco (asociado en este caso a fiebre, disnea y leucocitosis)49. El DP poscirugía abdominal con mayor frecuencia es trasudado favorecido por ascitis previa, hipoalbuminemia, etc., aunque en ocasiones la irritación diafragmática origina también un exudado52.
Los síntomas acompañantes al DP tras cirugía abdominal o torácica como fiebre o dolor, la aparición tardía del DP, su persistencia más de 30 días o el incremento de tamaño en el tiempo obliga a descartar otras etiologías que puedan complicar el postoperatorio como sangrado pleural, embolismo, infección, quilotórax, insuficiencia cardiaca, pulmón atrapado, absceso o hematoma subdiafragmáticos entre otras (fig. 6). El DP posquirúrgico no requiere tratamiento específico y la necesidad de drenarlo depende del compromiso respiratorio que origine al paciente.
En los pacientes con trasplante pulmonar la aparición de un DP en cualquier momento de su evolución, o el incremento del DP posquirúrgico, aunque sea asintomático, obliga a descartar un rechazo del injerto mediante biopsia pulmonar transbronquial. Solo una vez descartado este estará indicada la toracocentesis buscando otras causas de DP como infección o neoplasia53.
Derrame pleural por fármacosEl DP secundario a fármacos, normalmente asociado a afectación parenquimatosa, es una entidad infrecuente. La lista de agentes que pueden producirlo es extensa (www.pneumotox.com), por lo que es imperativo realizar una cuidadosa historia clínica. Entre los más frecuentes están los secundarios a amiodarona, nitrofurantoína, metisergida o bromocriptina. No hay ningún dato específico para establecer el diagnóstico, que siempre deberá hacerse tras excluir otras posibles etiologías. El DP puede ser eosinofílico y en ocasiones se acompaña de eosinofilia periférica. La biopsia pleural suele mostrar una inflamación inespecífica20,54. Para el diagnóstico debe establecerse una relación temporal entre la toma del medicamento y la presencia del DP. Su desaparición tras el cese de la administración del fármaco confirmaría la relación causal, y por tanto el diagnóstico20,54,55 (C).
Derrame pleural en enfermedades ginecológicas benignasEl síndrome de Meigs, la endometriosis o el síndrome de hiperestimulación ovárica son causas infrecuentes de DP acompañadas normalmente de ascitis20,55. El síndrome de Meigs se caracteriza por la presencia simultánea de ascitis y DP en asociación con una tumoración sólida benigna ovárica, aunque en algunas ocasiones también con tumores de bajo grado de malignidad, como los tumores de las células granulares. El diagnóstico se confirma cuando, después de extirpar la neoplasia primaria, la ascitis y el DP se resuelven, aunque pueden tardar en desaparecer algunas semanas. La endometriosis en estadios avanzados debe incluirse en el algoritmo diferencial del DP en mujeres en edad fértil, siendo una causa muy rara de hemotórax20,55. En estas 2 entidades debe tenerse en cuenta que pueden producirse elevaciones de marcadores tumorales, como el CA 125, sin que deba asumirse el diagnóstico de una enfermedad maligna diseminada20. El síndrome de hiperestimulación ovárica hace referencia al cuadro clínico de agrandamiento ovárico debido a la existencia de múltiples quistes y acumulación de líquido en el espacio extravascular. Para establecer el diagnóstico es necesario el antecedente de tratamiento hormonal de fertilización reciente y la exclusión de otras causas de DP. El tratamiento de esta entidad se basa en el control hidroelectrolítico y la prevención de complicaciones como la enfermedad tromboembólica. Si el DP produce disnea está indicada la toracocentesis evacuadora20,55 (D).
Derrame pleural en enfermedad digestiva benignaLas enfermedades pancreáticas y hepáticas, los abscesos intraabdominales, la perforación esofágica o los procedimientos quirúrgicos abdominales pueden con cierta frecuencia producir DP, aunque su detección dependerá de la técnica de imagen utilizada (radiografía, ecografía o TC de tórax)20,55. El cuadro clínico suele estar marcado por el proceso digestivo que lo ocasiona y el tratamiento dependerá del control de este. Habitualmente la toracocentesis diagnóstica está indicada cuando se sospeche que el DP esté complicado u otras posibles etiologías (D). Aunque la elevación de amilasa en el LP es muy característica de los DP secundarios a enfermedad pancreática o por perforación esofágica, también puede producirse en DP malignos y menos frecuentemente tuberculosos20,56. Cuando el DP es muy sintomático o no se resuelve tras el control de la enfermedad digestiva podría estar indicada la toracocentesis evacuadora o el drenaje pleural (D).
El hidrotórax hepático, que complica alrededor del 6% de las cirrosis con ascitis, se trata inicialmente con restricción salina y la combinación de furosemida y espironolactona. Puede ser necesaria una o más toracocentesis evacuadoras si el DP es grande o masivo. Cerca de la tercera parte de los hidrotórax hepáticos se hacen refractarios al tratamiento diurético57. A estos pacientes se les debe indicar un trasplante hepático, la única medida que se asocia con una mayor supervivencia. Mientras el paciente se encuentra en lista de espera, o si hay circunstancias que contraindican el trasplante, el hidrotórax hepático refractario se puede controlar con una derivación portosistémica percutánea intrahepática o con un catéter intrapleural permanente57. Sin embargo, la pleurodesis no se considera una buena opción, ya que fracasa en la mayoría de ocasiones.
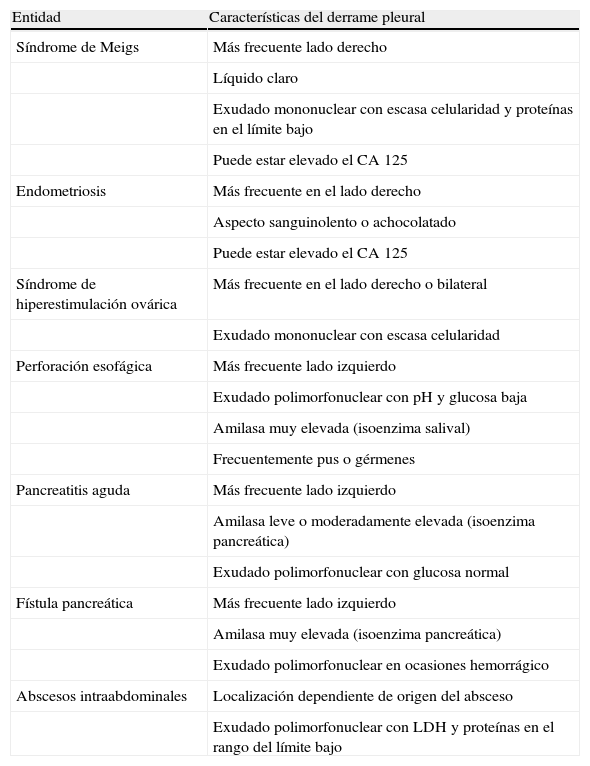
Las características del DP producido por las enfermedades ginecológicas y digestivas que más frecuentemente lo causan se resumen en la tabla 5.
Características más comunes del derrame pleural asociado a las enfermedades ginecológicas y digestivas benignas
| Entidad | Características del derrame pleural |
| Síndrome de Meigs | Más frecuente lado derecho |
| Líquido claro | |
| Exudado mononuclear con escasa celularidad y proteínas en el límite bajo | |
| Puede estar elevado el CA 125 | |
| Endometriosis | Más frecuente en el lado derecho |
| Aspecto sanguinolento o achocolatado | |
| Puede estar elevado el CA 125 | |
| Síndrome de hiperestimulación ovárica | Más frecuente en el lado derecho o bilateral |
| Exudado mononuclear con escasa celularidad | |
| Perforación esofágica | Más frecuente lado izquierdo |
| Exudado polimorfonuclear con pH y glucosa baja | |
| Amilasa muy elevada (isoenzima salival) | |
| Frecuentemente pus o gérmenes | |
| Pancreatitis aguda | Más frecuente lado izquierdo |
| Amilasa leve o moderadamente elevada (isoenzima pancreática) | |
| Exudado polimorfonuclear con glucosa normal | |
| Fístula pancreática | Más frecuente lado izquierdo |
| Amilasa muy elevada (isoenzima pancreática) | |
| Exudado polimorfonuclear en ocasiones hemorrágico | |
| Abscesos intraabdominales | Localización dependiente de origen del absceso |
| Exudado polimorfonuclear con LDH y proteínas en el rango del límite bajo |
El contacto con asbesto puede producir múltiples manifestaciones de afectación pleural, coexistiendo varias de ellas frecuentemente en el mismo paciente. Entre ellas se incluyen las placas pleurales, la fibrosis pleural difusa o el derrame asbestósico benigno. Este último se caracteriza por ser un exudado unilateral moderado o pequeño, serohemático, y frecuentemente con eosinofilia. Su diagnóstico es de sospecha, con la exclusión de otras enfermedades, para lo que se precisa un seguimiento de al menos 3 años. En su evolución tiende a la resolución espontánea, con recidiva en un tercio de los casos.
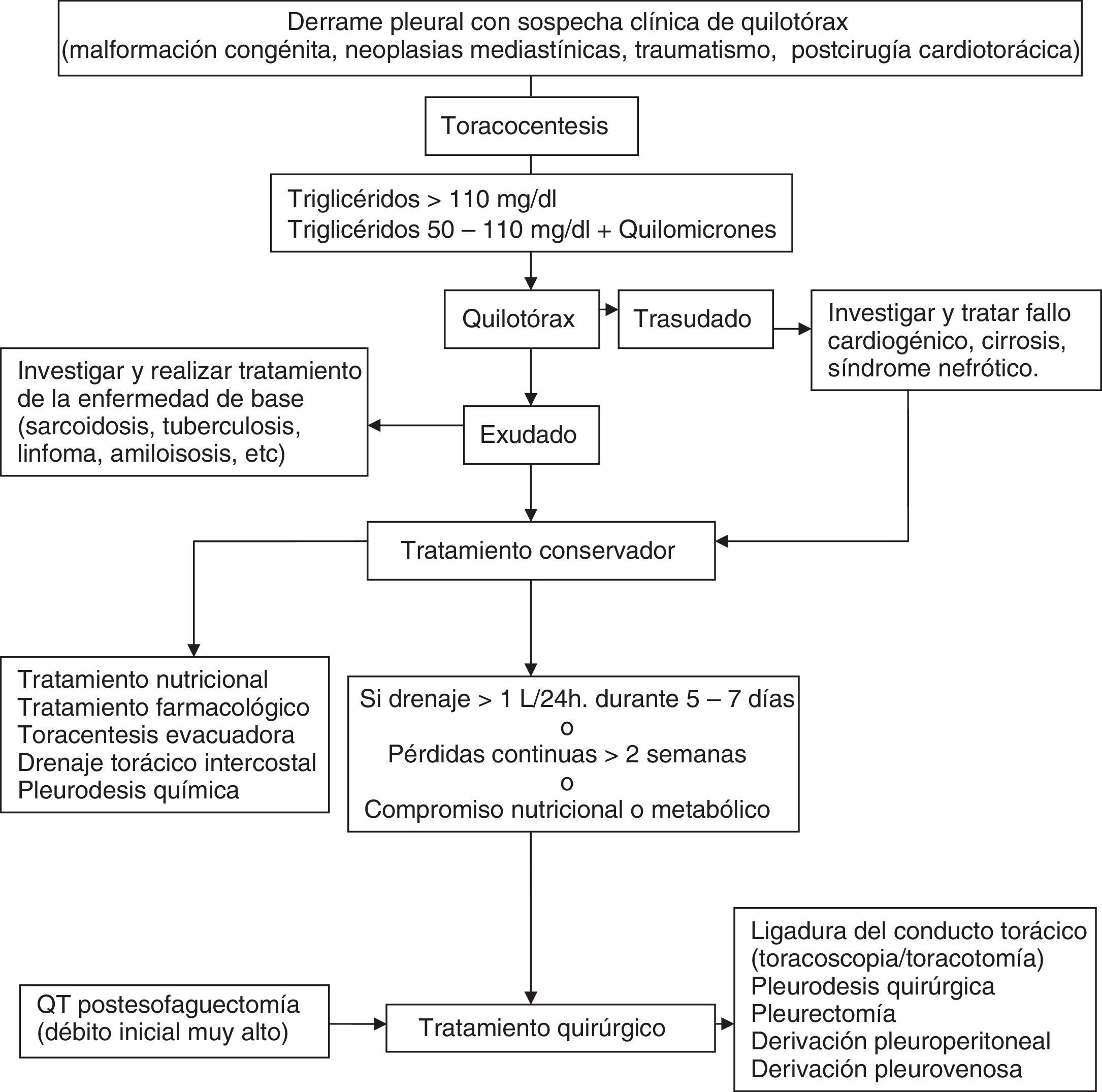
QuilotóraxSurge por la acumulación del líquido linfático de origen intestinal (quilo) en la cavidad torácica, como consecuencia de la rotura u obstrucción del conducto torácico, o por el paso de quilo acumulado en el espacio peritoneal (ascitis quilosa). Entre las causas más frecuentes están las neoplásicas y las traumáticas1. Su diagnóstico se establece por la determinación en LP de una concentración de triglicéridos mayor de 110mg/dl. Un nivel de triglicéridos inferior a 50mg/dl excluye un quilotórax (QT) con razonable certeza en ausencia de dieta o nutrición parenteral. Cuando el nivel de triglicéridos se sitúa entre 50 y 110mg/dl la detección de quilomicrones mediante lipidograma confirma el diagnóstico. Es obligado diferenciarlo del pseudoquilotórax, que son DP de larga evolución, y con niveles superiores a 200mg/dl de colesterol en el LP1.
Aunque no existen consensos o guías basadas en la evidencia sobre el tratamiento del QT, el tratamiento inicial no parece estar en discusión y consiste en la descompresión del espacio pleural y de los linfáticos torácicos mediante drenaje continuo a través de un tubo de tórax. Este drenaje es más efectivo que la toracocentesis, dado que la superficie pleural en contacto con la zona fistulosa puede acelerar su cierre y además el drenaje continuo proporciona una monitorización precisa del débito de quilo.
La combinación de las diferentes opciones terapéuticas se aplicará atendiendo a una secuencia lógica en función de la etiología (congénita, traumático, maligno, posquirúrgico, etc.), estado nutricional, metabólico y la ausencia de contraindicaciones quirúrgicas. Siempre se realizará tratamiento de la enfermedad de base cuando sea factible58 (fig. 7).
Tratamiento nutricionalEstá basado en 2 opciones fundamentales para disminuir el débito de quilo y la concentración de triglicéridos: 1) nutrición enteral oral exenta de triglicéridos de cadena larga para evitar la formación de quilomicrones, permitiendo la ingesta de triglicéridos de cadena media, dado que se absorben directamente en el sistema porta y disminuyen el flujo del conducto torácico; y 2) reposo digestivo absoluto y nutrición parenteral. Las 2 alternativas presentan similares resultados, algo mejores con la nutrición parenteral59.
Tratamiento instrumentalLa toracentesis evacuadora en algunos casos puede ser suficiente hasta que el tratamiento de la enfermedad de base haga efecto. Si es insuficiente se puede plantear la colocación de drenaje torácico para control del débito diario y descomprensión. La pleurodesis química se realiza frecuentemente en pacientes que no responden al drenaje torácico y régimen dietético. Incluye la instilación de talco a través del tubo de drenaje, insuflación de talco durante la toracoscopia; otras formas de pleurodesis mecánica se pueden realizar mediante videotoracoscopia o toracotomía. La pleurodesis es una opción muy aceptada para los QT malignos y refractarios o cuando no se puede ligar el conducto torácico.
Tratamiento farmacológicoConsiste en el uso de un análogo de la somatostatina, el octreótrido, que disminuye el flujo esplácnico, hepático y portal y el volumen de linfa.
Tratamiento quirúrgicoEstá basado en la ligadura del conducto torácico. Se realiza frecuentemente por videotoracoscopia o toracotomía derecha a la altura del hiato aórtico. Es la cirugía estándar en tanto en los QT traumáticos como en los yatrógenos cuando persiste un gran débito de quilo, aparece malnutrición, inmunodepresión, se alarga la hospitalización o falla el tratamiento conservador. Otros tratamientos más infrecuentes son la derivación pleuroperitoneal, embolización percutánea guiada por fluoroscopia y anastomosis del conducto torácico al sistema venoso.
HemotóraxEs la presencia de sangre en la cavidad pleural. Habitualmente se considera un DP hemático como hemotórax si su hematocrito es mayor del 50% del hematocrito en sangre periférica.
DiagnósticoLos síntomas y signos varían en función de la causa, el volumen y el ritmo de acumulación. En el hemotórax traumático agudo suelen predominar los secundarios a inestabilidad hemodinámica y el dolor, mientras que en los no traumáticos destacan la disnea y la semiología de ocupación pleural por líquido. La radiografía, la ecografía y la TC de tórax revelan la presencia de un DP libre o loculado, ocasionalmente con imágenes compatibles con coágulos; asimismo, pueden poner de manifiesto lesiones asociadas que orientarán hacia la causa. El diagnóstico definitivo se obtiene mediante toracocentesis y estudio del LP.
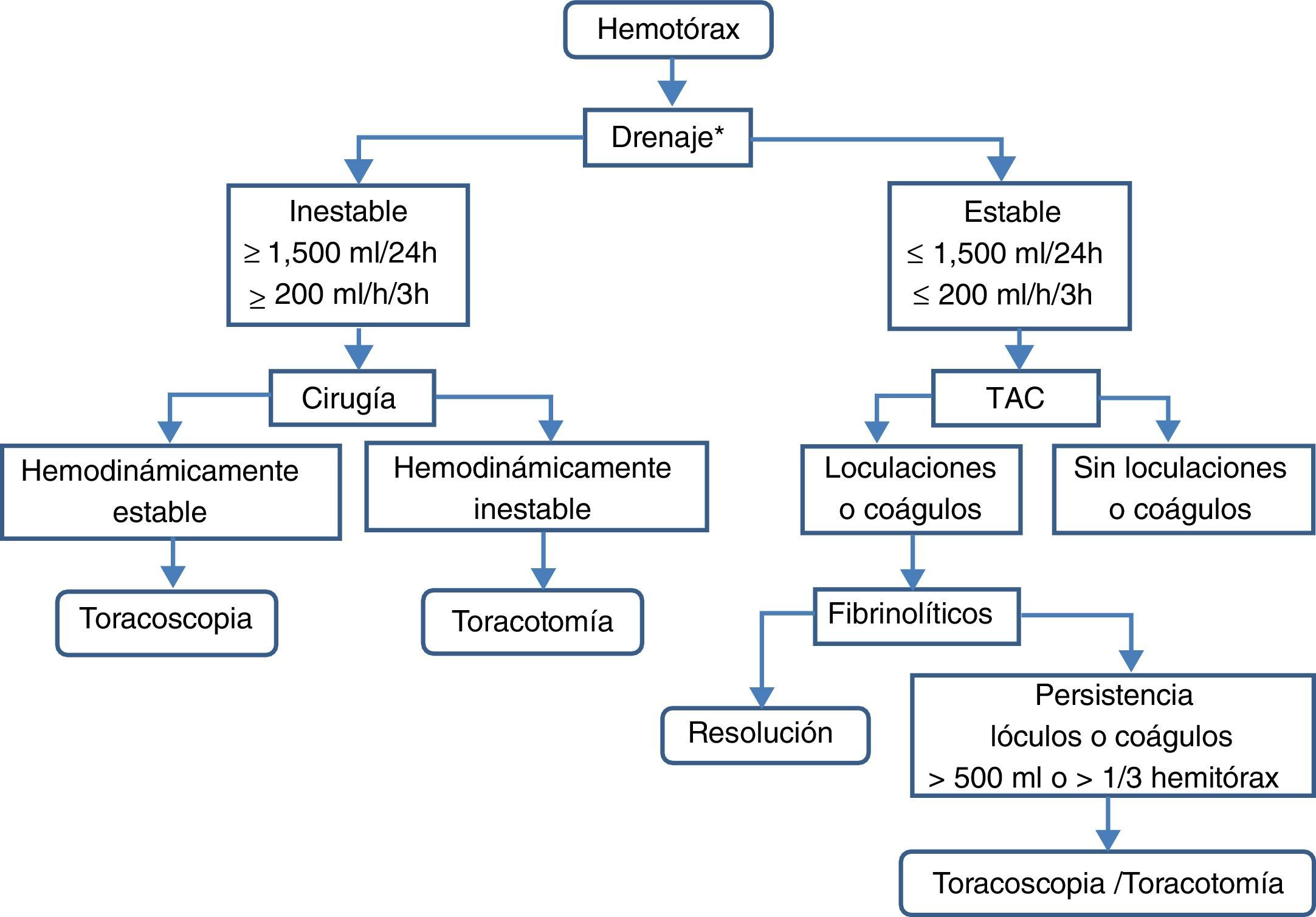
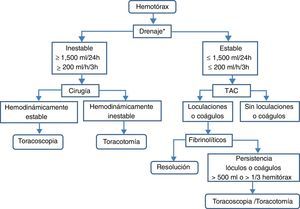
TratamientoSe debe diferenciar entre el hemotórax agudo y el residual (fig. 8).
Hemotórax agudoEn pacientes hemodinámicamente estables y con hemotórax de escaso volumen (solo pinzamiento del seno costofrénico o volumen calculado menor de 300ml) puede optarse por vigilancia clínico-radiológica (B). Una alternativa en pacientes que continúan con hemotórax activo es la toracoscopia videoasistida, ya que habitualmente permite realizar actuaciones hemostáticas60. En pacientes hemodinámicamente inestables o con volumen calculado mayor de 300ml deberá implantarse, previa administración de antibioterapia profiláctica, un drenaje pleural de grueso calibre —24F o 28F— en línea axilar media, sobre el sexto espacio intercostal y dirigido hacia atrás (B). Si el drenaje inicial es mayor de 1.500ml/24h (20ml/kg peso) o el ritmo de drenaje es mayor de 200ml/h (3ml/kg peso) durante más de 3h consecutivas está indicada la toracotomía (B).
Si se sospecha que el hemotórax puede ser secundario a rotura de aneurisma aórtico no está indicado el drenaje, por poder favorecer la exanguinación (C).
Hemotórax residual o coaguladoLos hemotórax residuales de escasa cuantía —pinzamiento del seno costofrénico— pueden tratarse conservadoramente con fisioterapia respiratoria y vigilancia (B).
Los hemotórax estimados en más de 500ml o de lóculos y coágulos residuales que ocupan un tercio o más del hemitórax requieren tratamiento para evitar complicaciones subagudas (atelectasia, empiema, neumonía) o crónicas (fibrotórax) (B). En la primera semana puede intentarse la colocación de nuevos drenajes torácicos, y si no son eficaces, puede tratarse con la instilación de fibrinolíticos intrapleurales —uroquinasa— (B). Una alternativa, o si los fibrinolíticos no son eficaces, es la evacuación temprana de los coágulos mediante toracoscopia60 (B). Si la toracoscopia no es eficaz o el hemotórax es crónico y produce atrapamiento pulmonar —fibrotórax— se procederá a la decorticación (B).
Conflicto de interesesCada uno de los autores manifiesta que no presenta conflicto de intereses alguno en su participación como autor de la Normativa SEPAR de derrame pleural.
| A. Recomendación consistente, calidad de la evidencia alta. |
| B. Recomendación consistente, calidad de la evidencia moderada. |
| C. Recomendación consistente, calidad de la evidencia baja. |
| D. Recomendación consistente, calidad de la evidencia muy baja. |
| E. Recomendación débil, calidad de la evidencia alta. |
| F. Recomendación débil, calidad de la evidencia moderada. |
| G. Recomendación débil, calidad de la evidencia baja. |
| H. Recomendación débil, calidad de la evidencia muy baja. |
Fuente: Schünemann et al.2.