Se presenta la cuarta puesta al día de la “Normativa sobre diagnóstico y tratamiento del neumotórax”, de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).
La presencia de aire dentro de la cavidad pleural de causa no traumática o iatrógena es un problema clínico relevante. Se propone un método de cuantificación del neumotórax mediante su clasificación en parcial, completo o total, que junto a la valoración clínica parece suficiente para adoptar las diversas actitudes terapéuticas.
En la presente actualización se incorpora la aspiración simple ambulatoria, como método equiparable en resultados al drenaje convencional, para el tratamiento del neumotórax espontáneo primario no complicado, cuyo uso no está todavía muy extendido en España.
Para el tratamiento definitivo del neumotórax espontáneo primario, la cirugía videotoracoscópica con bullectomía y abrasión pleural es la técnica más ampliamente utilizada por la mayoría de cirujanos torácicos.
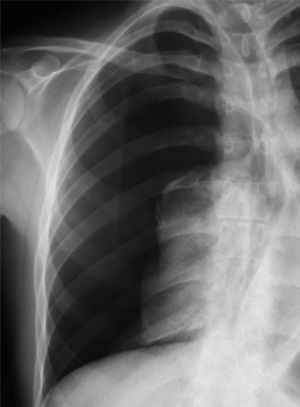
En el tratamiento del neumotórax espontáneo secundario se recomienda el ingreso y la colocación de drenaje torácico convencional.
Se ha introducido también una referencia al neumotórax catamenial, probablemente infradiagnosticado.
En caso de recidiva o fuga aérea persistente, el tratamiento definitivo suele ser el quirúrgico o el uso de talco a través del drenaje en caso de contraindicación.
Los algoritmos de estrategia terapéutica aquí propuestos pretenden convertirse en una herramienta de trabajo útil para todos los implicados en el diagnóstico y tratamiento de esta enfermedad.
This is the fourth update of the guidelines for the diagnosis and treatment of pneumothorax published by the Spanish Society of Pulmonology and Thoracic Surgery (SEPAR).
Spontaneous pneumothorax, or the presence of air in the pleural space not caused by injury or medical intervention, is a significant clinical problem. We propose a method for classifying cases into 3 categories: partial, complete, and complete with total lung collapse. This classification, together with a clinical assessment, would provide sufficient information to enable physicians to decide on an approach to treatment.
This update introduces simple aspiration in an outpatient setting as a treatment option that has yielded results comparable to conventional drainage in the management of uncomplicated primary spontaneous pneumothorax; this technique is not, as yet, widely used in Spain.
For the definitive treatment of primary spontaneous pneumothorax, the technique most often used by thoracic surgeons is video-assisted thoracoscopic bullectomy and pleural abrasion.
Hospitalization and conventional tube drainage is recommended for the treatment of secondary spontaneous pneumothorax.
This update also has a new section on catamenial pneumothorax, a condition that is probably underdiagnosed.
The definitive treatment for a recurring or persistent air leak is usually surgery or the application of talc through the drainage tube when surgery is contraindicated.
Our aim in proposing algorithms for the management of pneumothorax in these guidelines was to provide a useful tool for clinicians involved in the diagnosis and treatment of this disease.
El presente documento es la cuarta puesta al día de la “Normativa sobre el diagnóstico y tratamiento del neumotórax”, de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Hemos intentado cumplir con los 2 objetivos fundamentales de las Normativas SEPAR: a) ayudar al neumólogo, cirujano torácico o personas interesadas en el tema a tomar las decisiones más adecuadas para resolver un problema clínico concreto, y b) definir la posición oficial de la SEPAR en este problema clínico relevante.
Esta Normativa se centra en el tratamiento del neumotórax espontáneo (NE), entendiendo como tal la presencia de aire en la cavidad pleural, de causa no traumática o iatrógena. Nos sigue pareciendo útil la distinción entre NE primario (NEP) y NE secundario (NES), aun conociendo la obvia presencia de alteración patológica también en el NEP, ya que es una terminología usada mundialmente, que nos permite conocer y definir a la perfección las características de ambas entidades clínicas.
En la Normativa de hace 5 años se incorporaban los métodos de drenaje con catéteres finos y válvulas antirretorno como formas de tratamiento de corta estancia o incluso ambulatorias. En la Normativa actual se simplifican los criterios de clasificación y cuantificación radiológica y se incorpora la aspiración simple como método sencillo, seguro y efectivo, equiparable en resultados al drenaje convencional en el tratamiento del NEP no complicado de primera vez, que es muy poco utilizado todavía en España. En el tratamiento definitivo del NEP recidivante persiste la controversia entre algunos “neumólogos intervencionistas” que propugnan la simple toracoscopia convencional con talco, frente a la resección de bullas y abrasión mecánica pleural o pleurectomía parcial a través de cirugía videotoracoscópica de los cirujanos torácicos.
Hemos introducido una referencia al neumotórax catamenial, probablemente infradiagnosticado y quizá por ello con resultados poco satisfactorios.
En definitiva, creemos que esta Normativa debe convertirse en una herramienta de trabajo útil para su aplicación en el ámbito del área de la urgencia hospitalaria, de interés para médicos de urgencias, internistas, cirujanos generales, neumólogos y cirujanos torácicos, como profesionales encargados del diagnóstico y tratamiento de esta prevalente enfermedad. A pesar de que pocas veces la situación clínica de un NE pone en peligro la vida del paciente, salvo en presencia de neumotórax hipertensivo o de una grave enfermedad pulmonar subyacente, creemos que la colaboración interdisciplinaria y la utilización de los algoritmos de estrategia terapéutica aquí propuestos mejorarán la atención a estos pacientes.
Características etiológicas y fisiopatológicasConceptoDenominamos neumotórax a la presencia de aire dentro del espacio pleural, que modifica la presión subatmosférica (negativa) intrapleural y ocasiona colapso pulmonar parcial o total.
ClasificaciónEl neumotórax puede clasificarse, según la etiología, en espontáneo y adquirido (iatrógeno y traumático). El espontáneo se divide a su vez en: a) primario, cuando no hay una evidente enfermedad pulmonar; b) secundario, cuando hay enfermedad pleuropulmonar subyacente, y c) catamenial, cuando se produce en relación con el ciclo menstrual.
EpidemiologíaEl NE es un problema de salud significativo, cuya incidencia es muy variada1-4. En Inglaterra, Gupta et al1 observaron que la tasa global del NE era de 16,8 casos por 100.000 habitantes/año (24 en varones y 9,8 en mujeres); la incidencia de los que precisaron ingreso hospitalario fue de 11,1 casos por 100.000 habitantes/año (16,6 en varones y 5,8 en mujeres). En EE.UU. Melton et al3, al ajustar por edad y tipo de NE, observaron que el NEP presentaba una incidencia de 4,2 casos por 100.000 y el NES de 3,8 casos; por sexos, la incidencia del NEP era de 7,4 por 100.000 en varones y de 1,2 en mujeres (predominio de varones sobre mujeres de 6,2:1), y la del NES de 6,3 por 100.000 en varones y de 2 en mujeres (predominio de varones sobre mujeres de 3,2:1). Bense et al4 hallaron en Suecia que el NEP presentaba una tasa de incidencia de 18-28 por 100.000 en varones y de 1,2-6 en mujeres. Conviene destacar que la incidencia del NEP no es del todo real, ya que en ocasiones puede presentarse o cursar clínicamente de forma asintomática; no obstante, se ha demostrado un progresivo incremento durante los últimos años1. Con respecto a la edad de presentación, es importante referir que el pico de máxima incidencia se sitúa para el NEP en los jóvenes y para el NES en las personas mayores de 55 años1,3.
La tasa de recidiva varía ampliamente en la literatura médica, en función del tratamiento elegido y del período de seguimiento empleado5. Aunque no se puede predecir el curso evolutivo de los NE en general, se estima que el porcentaje de recidivas del NEP es de aproximadamente el 30%, con un rango entre el 16 y el 52%, con seguimiento en algunos estudios de hasta 10 años5; en el NES es del 40-56%6,7. En la mayoría de las ocasiones la recidiva se produce durante los 6 meses posteriores al primer episodio8. Sadikot et al9, que siguieron durante 54 meses a 153 pacientes con NEP, observaron una tasa de recurrencia del 39% durante el primer año, y un 15% del total de NEP desarrolló neumotórax contralateral. Después de un segundo neumotórax, sin una adecuada actitud terapéutica la posibilidad de un tercer episodio aumenta considerablemente. Así, Voge y Anthracile10 encontraron un 28% de recidivas tras un primer episodio, de las cuales un 23% presentó una segunda recidiva, y un 14% de ese 23% tuvo una tercera recidiva; la tasa de recidiva global fue del 35%.
Entre los factores de riesgo de recidiva en el NE, Lippert et al6 mencionan la presencia de fibrosis pulmonar detectada en el estudio radiológico, la edad mayor de 60 años y el incremento de la relación altura/peso corporal (nivel de evidencia 2–). Según la British Thoracic Society (BTS)2, entre los factores de riesgo de recidiva del NEP cabe destacar el consumo de tabaco, la altura en los varones y la edad, y entre los del NES, la edad, la presencia de fibrosis pulmonar y presentar enfisema pulmonar. Es importante señalar que el Pleural Disease Group de la BTS2 encontró relación entre la recurrencia del NE y el mantenimiento del consumo de tabaco (nivel de evidencia 3).
Con respecto a la tasa de mortalidad por NE, en el Reino Unido fue de 0,62 por millón de habitantes y año para las mujeres, y de 1,26 para los varones1. Al analizar la mortalidad de pacientes hospitalizados mayores de 55 años según el sexo, fue del 1,8% en varones y del 3,3% en mujeres (nivel de evidencia 3)1. Por lo que se refiere a la mortalidad según la forma de presentación, es infrecuente en los pacientes con NEP1, mientras que en el NES la tasa de mortalidad es mayor como consecuencia de la enfermedad pulmonar de base y la menor reserva funcional11. En pacientes con enfermedad pulmonar obstructiva crónica (EPOC) la tasa varía entre el 1 y el 7%. Videm et al7 afirman que en estos pacientes la mortalidad se incrementa por 4 con cada nuevo episodio (nivel de evidencia 2+).
Aspectos etiológicos y fisiopatológicosEl NEP es aquel que sucede sin causa precipitante específica en una persona que en teoría no presenta enfermedad pulmonar de base. Está asociado con el consumo de tabaco y con la constitución física o biotipo morfológico, más concretamente con el tipo asténico o leptosómico12. El consumo de tabaco es un factor importante de desarrollo como consecuencia de la existencia de bronquiolitis respiratoria, que se detecta en el 88% de los fumadores con NEP13. En varones fumadores de más de 20 cigarrillos/día se observa un riesgo del 12,3 frente al 0,1% en los no fumadores; esta incidencia guarda una relación directa y exponencial con la cantidad consumida (nivel de evidencia 2++)4. Hay que destacar que estas conclusiones también se aplican a las mujeres. Bense et al4 observaron que el hábito de fumar incrementaba la posibilidad de NE 22 veces en los varones y 9 veces en las mujeres. Sorprende que, a pesar de la aparente relación entre el NE y el consumo de tabaco, el 80-86% de los pacientes sigan fumando tras el primer episodio14. Los patrones de herencia familiar, aunque infrecuentes, pueden influir. Varios estudios han analizado la incidencia familiar del NE, sobre todo del NEP. Contrariamente a la creencia popular, la actividad física no influye de forma evidente en la producción del NEP, y tampoco se ha demostrado con claridad la influencia de los cambios climáticos y de presión atmosférica (nivel de evidencia 2+)15. Por otra parte, el NEP se ha relacionado infrecuentemente con determinadas actividades laborales y deportivas (nivel de evidencia 3)16.
El NES puede estar provocado por gran cantidad de enfermedades, tales como procesos infecciosos (Pneumocystis jiroveci, Mycobacterium tuberculosis, neumonías necrosantes), enfermedades pulmonares intersticiales y del colágeno, histiocitosis de células de Langerhans, linfangioleiomiomatosis, fibrosis quística y EPOC. Estas 2 últimas son las más frecuentes11.
Los mecanismos fisiopatológicos del NE continúan siendo desconocidos17,18, aunque se supone que el NEP es el resultado de la formación y posterior rotura de bullas subpleurales5. Como posibles hipótesis, se ha postulado que en el desarrollo de los cambios estructurales en el parénquima pulmonar, denominados “cambios enfisematoides” (emphysema-like changes), influiría el mayor gradiente de presión desde el vértice hasta la base de la cavidad pleural, que ocasiona un aumento de la presión intraalveolar y una gran distensión en los alvéolos subpleurales apicales, con la consiguiente formación de quistes y posterior rotura, asociada a la existencia de degradación de las fibras elásticas pulmonares como consecuencia, sobre todo en los fumadores, de la acción de los mediadores liberados por los neutrófilos y macrófagos. Esta degradación ocasiona un desequilibrio de los sistemas proteasa-antiproteasa y oxidante-antioxidante, que da lugar a un daño irreversible del parénquima pulmonar, con la formación de enfisema y bullas pulmonares. Tras la formación de la bulla, la inflamación de las pequeñas vías aéreas incrementa la presión alveolar, con rotura y fuga de aire por el intersticio pulmonar hacia el hilio11. En un estudio, se detectaron cambios enfisematoides en el 81% de las tomografías computarizadas (TC) de varones con un episodio previo de NEP, que no eran ni fumadores ni presentaban déficit de alfa-1-antitripsina, y sólo en el 20% del grupo control sin NEP previo. Estos cambios se localizaban en los vértices de los lóbulos superiores del pulmón y se observaban como áreas localizadas de atenuación baja, de un mínimo de 3mm de diámetro y que podían estar delimitadas o no por paredes delgadas19. A pesar de la evidencia de cambios enfisematoides en pacientes con NEP, algunos autores afirman que no es la única causa. Así, podría ser la asociación de varios factores, como la inflamación de las vías aéreas distales debido a la predisposición hereditaria, a alteraciones anatómicas o al consumo de tabaco, que desempeña un papel importante, al igual que sucede con los cambios enfisematoides subpleurales difusos y bilaterales, y la porosidad de la pleura visceral demostrada en estos pacientes, que podría desencadenar y hacer que persistiera la fuga de aire18,20.
Jordan et al21 observaron ampollas en el 46-52% de las TC estudiadas y Lesur et al22 hasta en el 80%. Janssen et al23 las hallaron mediante la toracoscopia en el 69-77% de los casos y Donahue et al24 en el 90%. Sihoe et al25 detectaron lesiones ampollosas bilaterales mediante TC en el 54% de los casos e Ikeda et al26, mediante cirugía bilateral, en el 93% de los casos. No obstante, en un estudio comparativo de pacientes con un único episodio de NEP y pacientes con recidiva no se encontró mayor número de ampollas en estos últimos, por lo que los autores señalan que éstas no constituyen el único factor de riesgo23. Los hallazgos del estudio de Horio et al27 indican que la realización de bullectomía sin pleurodesis química o pleurectomía asociada no previene las recidivas.
La fisiopatología del NES es multifactorial y sigue siendo desconocida. El aire entra en la cavidad pleural tras la rotura alveolar como resultado de la necrosis pulmonar periférica o dependiendo del mecanismo propio de cada enfermedad de base2,20.
Evaluación diagnósticaEs importante conocer y precisar si el neumotórax es primario o secundario, si se trata de un primer episodio o de una recidiva, así como la presencia o no de derrame pleural asociado. Para ello es indispensable realizar un adecuado y preciso interrogatorio y exploración física como plan integral de la asistencia de este tipo de enfermedad.
La valoración y cuantificación radiográfica del tamaño y volumen del neumotórax deben acompañarse de la evaluación del estado clínico del paciente, el tipo de NE y la presencia o ausencia de fugas de aire, con vistas a determinar la actitud terapéutica más adecuada2,28,29.
Clínica y exploración físicaEl grado de colapso pulmonar y la disminución de la capacidad ventilatoria que éste ocasiona guardan relación con el volumen de aire intrapleural. Sin embargo, los síntomas que refiere el paciente con NES están más relacionados con la reserva funcional de los pulmones que con el grado de colapso pulmonar presente.
El perfil del paciente con NEP es un joven de entre 20 y 30 años, alto, delgado o asténico y preferentemente varón11. La clínica no guarda relación directa con el tamaño del neumotórax (nivel de evidencia 2+)2. Un 10% de los casos se encuentran asintomáticos y pueden identificarse en el curso de un examen médico habitual o en la valoración de otras enfermedades. Se ha demostrado que incluso un 46% de los pacientes con NEP espera más de 2 días con síntomas antes de acudir a un servicio sanitario2 (nivel de evidencia 3). En un 80-90% de las ocasiones sucede estando en reposo o realizando escasa actividad física, y en personas con unas determinadas características físicas, como la constitución morfológica de tipo leptosómico, o psicológicas, como un patrón de conducta tipo A, que se caracteriza por una elevada competitividad, impaciencia, desconfianza, hostilidad y gran implicación laboral (nivel de evidencia 3). El paciente refiere dolor pleurítico homolateral, agudo o subagudo, que aumenta con los movimientos respiratorios profundos o con los brotes de tos y se alivia con la respiración superficial e inmovilización, y cierto grado de disnea de presentación repentina, que en ocasiones se acompañan de tos irritativa20, síntomas todos ellos que se ven acentuados con los movimientos respiratorios. Si el neumotórax es pequeño, el dolor puede ser el único síntoma y desaparecer horas después, en las 24h siguientes, incluso sin ser tratado o estar resuelto11. El resultado de la exploración física del NEP es variable; puede ser prácticamente normal, pero con frecuencia se observa taquicardia en el neumotórax de pequeño tamaño, o puede cursar con mínima disminución de la motilidad del hemitórax afectado, reducción o ausencia del ruido respiratorio, aumento de la resonancia a la percusión y disminución de la transmisión de la voz11. Con respecto a la localización, el hemitórax más frecuente es el derecho y el neumotórax bilateral se produce en menos del 10-15% de los pacientes con NE9,11.
Los síntomas y signos del NES son más intensos y llamativos que los registrados en los pacientes con NEP. La presencia de disnea intensa, insuficiencia respiratoria y escasa reserva respiratoria funcional puede representar una amenaza vital, que requiera tratamiento inmediato. Además, entre los síntomas que pueden aparecer según la enfermedad de base cabe destacar el dolor torácico homolateral, diferentes grados de hipoxemia con o sin hipercapnia e hipotensión arterial sistémica. La exploración física es poco reveladora debido a la propia enfermedad de base; predominan la abolición del ruido respiratorio, hiperresonancia a la percusión y disminución de las vibraciones vocales4.
En ocasiones tanto el NEP como el NES pueden coexistir con un derrame pleural (10-20%) de mayor o menor volumen y de predominio celular eosinófilo, debido a la irritación pleural por la entrada de aire, y en infrecuentes ocasiones cursar con hemotórax.
En definitiva, la historia clínica no es un indicador fiable del tamaño del neumotórax (nivel de evidencia 2+)2. Con respecto al estado clínico, según los criterios del American College of Chest Physicians (ACCP)28, un neumotórax es clínicamente estable cuando la frecuencia respiratoria es menor de 24 respiraciones/min, la frecuencia cardíaca se encuentra entre 60 y 120 lat/min, la presión arterial sistémica está en el rango de la normalidad, la saturación arterial de oxígeno respirando aire ambiente es mayor del 90% y, por último, el paciente puede pronunciar frases completas entre respiraciones. La guía de la BTS2 añade como marcador de estabilidad clínica la ausencia de disnea.
Pruebas complementariasUn aspecto importante en el diagnóstico del neumotórax son las pruebas complementarias.
Técnicas de imagen antes del tratamiento. El diagnóstico definitivo lo aportan las pruebas de imagen, entre las que destaca el estudio radiológico simple de tórax en proyección estándar (posteroanterior, bipedestación e inspiración forzada), el cual identifica la línea de la pleura visceral, línea nítidamente definida de aumento de la opacidad y ausencia de trazados pulmonares distales a ella. Las diferentes guías no recomiendan de forma sistemática la maniobra de espiración forzada para el diagnóstico2,28-30 (grado de recomendación B).
A pesar de que la TC puede revelar lesiones fisiopatológicas de base que causen el NE, el ACCP28 no recomienda realizarla sistemáticamente a los pacientes con un primer episodio de NEP o pacientes con NES. Por otra parte, la TC puede ser útil en pacientes con NES recurrentes, o bien para determinar la actitud ante fugas de aire persistentes o para planificar una intervención quirúrgica. La BTS2 recomienda la TC cuando haya dificultad para diferenciar un neumotórax de una enfermedad pulmonar bullosa; cuando se sospeche colocación anómala del tubo torácico, y cuando resulte difícil interpretar la radiografía simple de tórax por la existencia de enfisema subcutáneo (grado de recomendación C).
Gasometría arterial basal-pulsioximetría. En el NEP la determinación de gases en sangre arterial puede mostrar un incremento del gradiente alveoloarterial de oxígeno y alcalosis respiratoria aguda11. Cuando el neumotórax ocupa aproximadamente un 25% o más del volumen del hemitórax, el trastorno de la relación de la ventilación pulmonar del territorio afectado puede producir hipoxemia con aumento del gradiente alveoloarterial de oxígeno. La gasometría arterial basal no se considera una prueba complementaria que deba realizarse sistemáticamente a pacientes con NEP.
Exploración de la función respiratoria. Estas pruebas no se recomiendan para valorar la presencia de neumotórax, su tamaño y el estado funcional del paciente con neumotórax en fase activa o antes del tratamiento.
Electrocardiograma. Las alteraciones en el electrocardiograma son infrecuentes. No se considera una prueba complementaria que deba realizarse de forma sistemática a pacientes con NEP.
Cuantificación radiológica del neumotórax espontáneoAl no haber consenso con respecto al método para cuantificar el tamaño o el grado de colapso pulmonar o el volumen de aire acumulado, se ha empleado una gran variedad de métodos y graduaciones: desde el índice de Light12, con la fórmula de los diámetros del pulmón y del hemitórax al cubo (porcentaje de neumotórax = 100 [1 – diámetro pulmonar3/diámetro hemitórax3]), hasta el cálculo de la distancia interpleural media y su ajuste en un nomograma propuesto por Rhea et al31. No obstante, la mayoría de las clasificaciones subestiman su volumen y ninguna de las 2 recientes guías utiliza el porcentaje de colapso pulmonar para decidir la actitud terapéutica2,28. Así, el estudio de consenso del ACCP28 utiliza la denominación de “neumotórax pequeño” cuando la distancia desde el vértice pulmonar a la cúpula torácica es menor de 3cm, y “neumotórax grande” cuando es mayor de 3cm. En cambio, la BTS2 considera que un neumotórax es pequeño cuando la separación entre el margen pulmonar y la caja torácica es menor de 2cm, y grande cuando es mayor de 2cm. Henry32, en un reciente editorial, menciona la posibilidad de realizar una cuantificación práctica del tamaño del neumotórax; así, propone que éste sería grande cuando hubiera una separación completa entre la pleural visceral y la caja torácica, y parcial cuando la separación fuera incompleta.
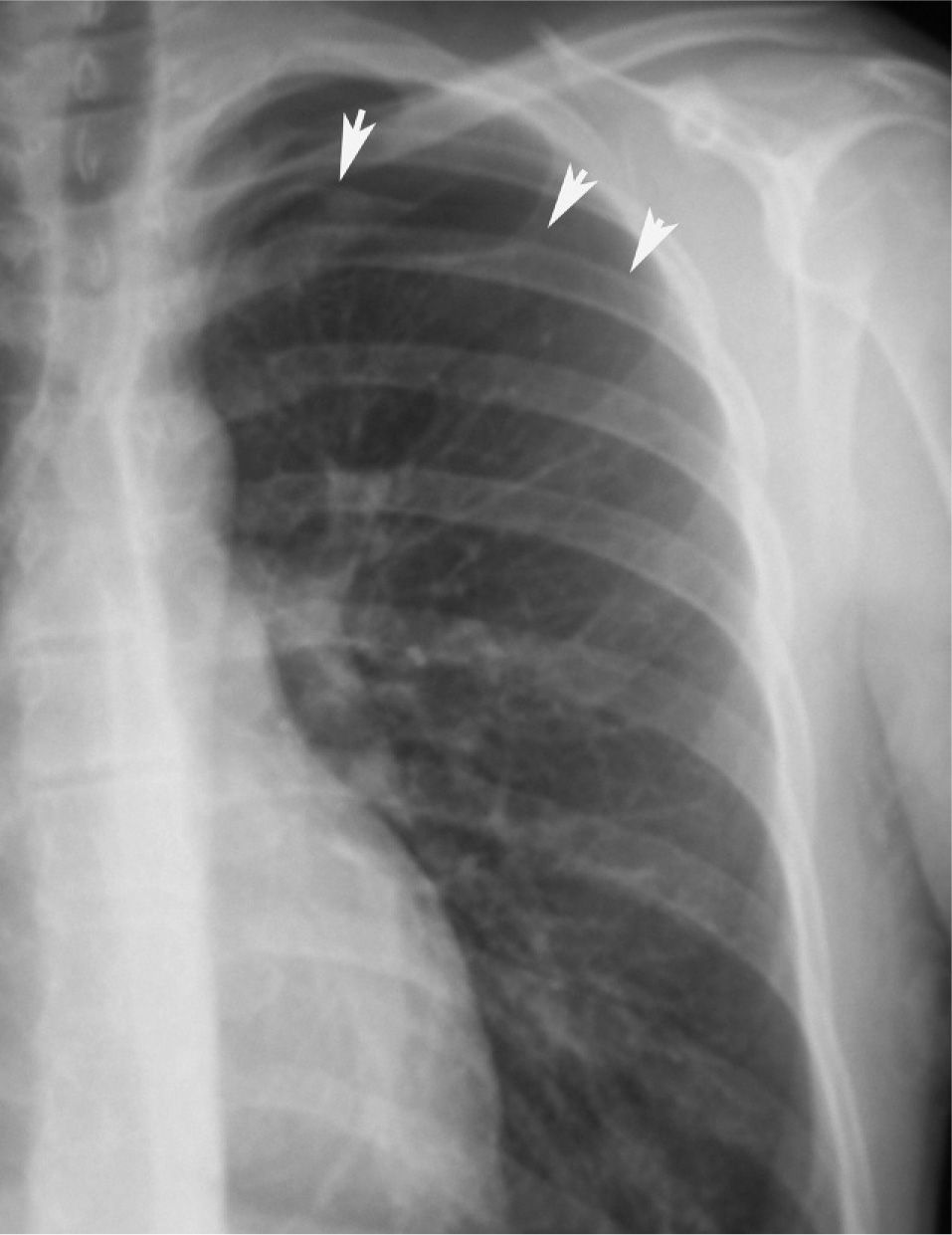
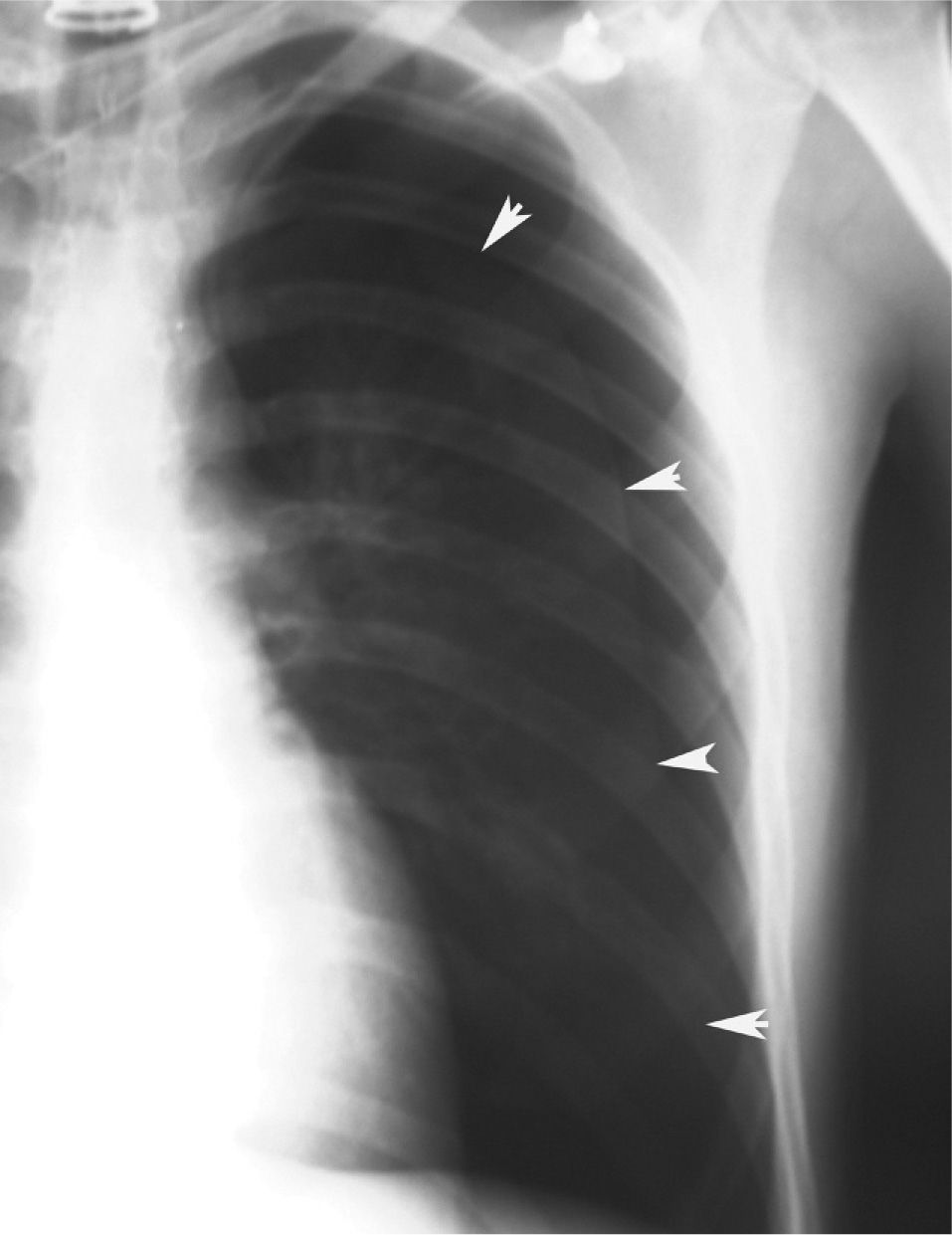
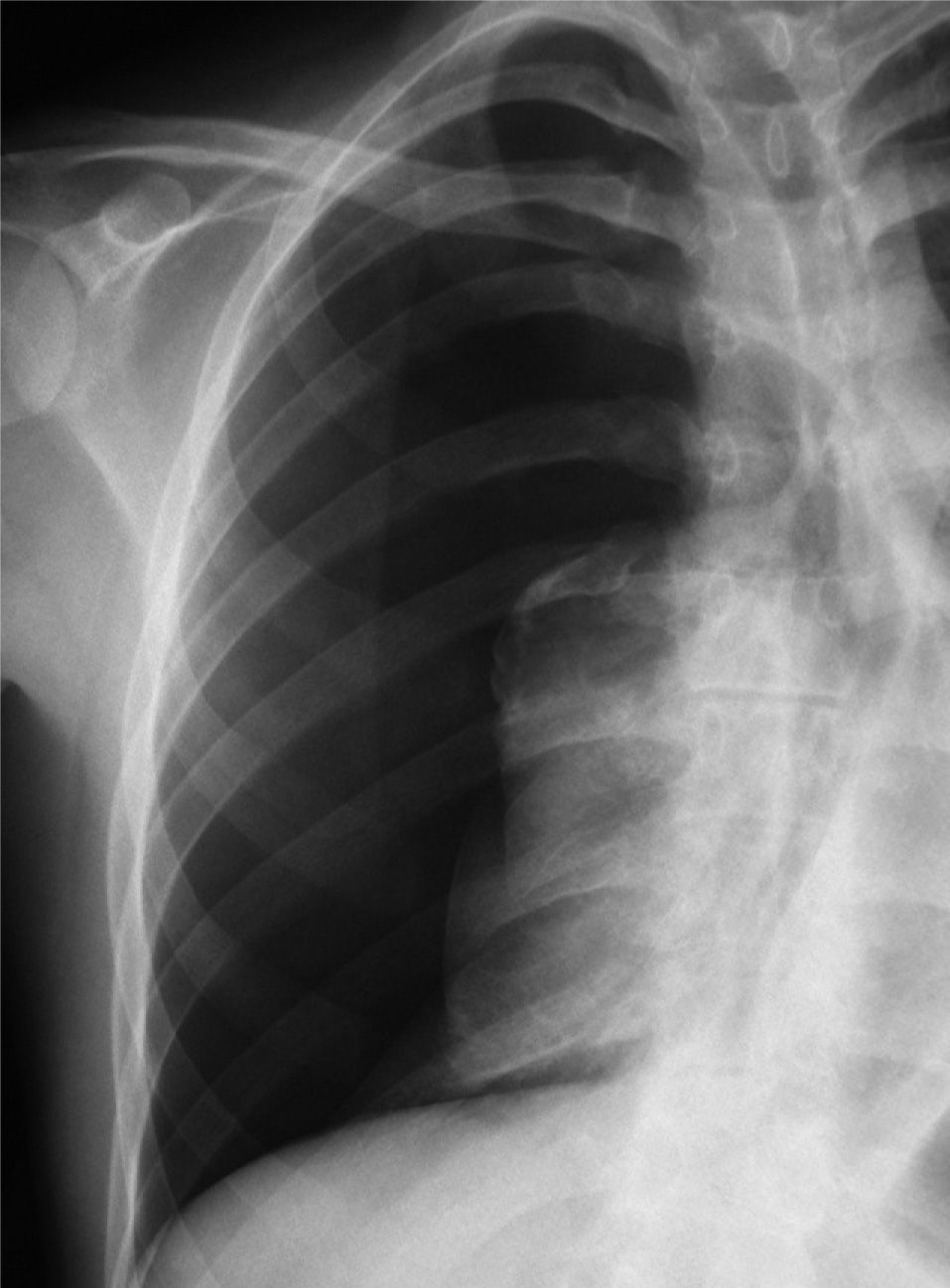
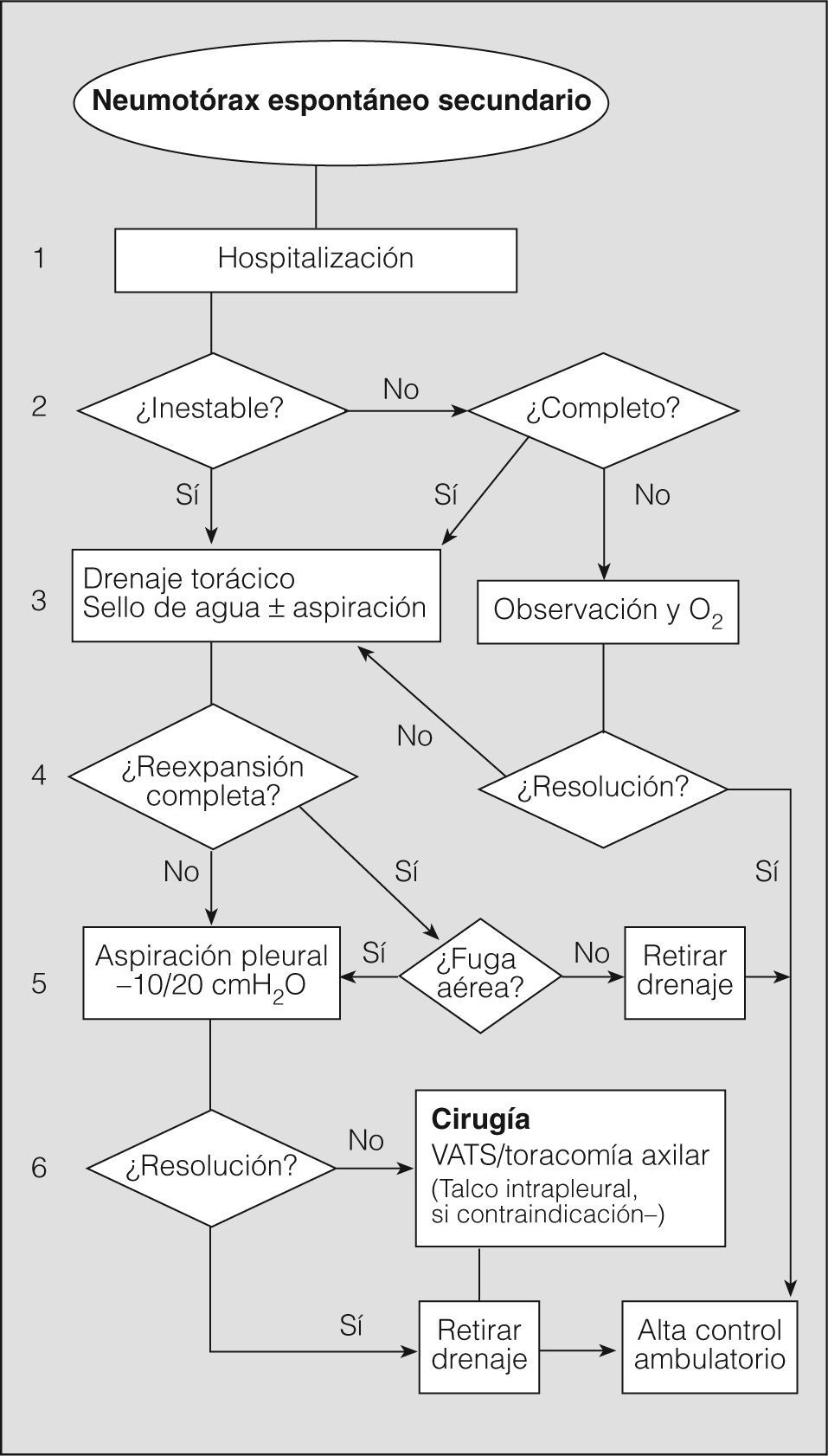
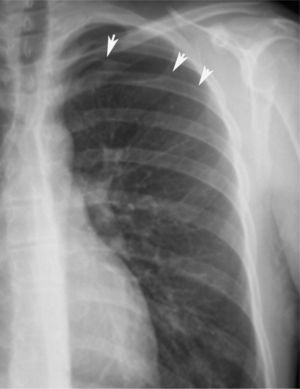
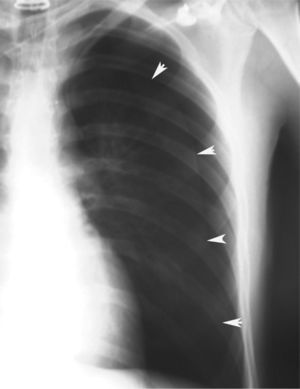
En definitiva, resulta difícil la valoración del neumotórax en centímetros, dada la creciente utilización de la radiografía digitalizada, o en porcentajes, al no adoptar en ocasiones una conformación constante y uniforme, por lo que el criterio de los autores de esta Normativa es la cuantificación del neumotórax mediante la simple visualización anatómica y morfológica. De este modo, el neumotórax se clasificará del siguiente modo: a) parcial, si la separación de la pleura visceral ocupa una parte de la cavidad pleural, siendo la más frecuente la apical (fig. 1); b) completo, cuando la separación entre la pleura visceral y la parietal se produce a todo lo largo de la cavidad pleural, pero sin llegar al colapso total (fig. 2), y c) total, si hay colapso pulmonar con formación uniforme de un muñón (fig. 3). Este método para cuantificar el tamaño radiográfico del neumotórax es simple, sencillo, cómodo y rápido, y junto con la valoración del estado clínico del paciente aporta información suficiente y adecuada para tomar una u otra actitud terapéutica.
Actitud terapéutica generalEl objetivo terapéutico en el neumotórax es la reexpansión del pulmón con la menor morbilidad posible, evitar las recidivas y tratar de forma adecuada los síntomas que provoca, así como la enfermedad de base que lo ha ocasionado en los NES. La solución del problema radica en la adecuada utilización de los tratamientos existentes, lo que no significa que se haya de abandonar la investigación de nuevas opciones.
Medidas generalesEntre los cuidados generales que se deben dispensar a estos pacientes, es de destacar la adecuada analgesia con la finalidad de evitar el dolor ocasionado por el propio neumotórax o por el tratamiento aplicado.
No hay evidencia de que el reposo absoluto en cama mejore la reexpansión pulmonar y/o la reabsorción del aire, y sí puede dar lugar a complicaciones en pacientes con NE. En el caso de que el reposo sea preciso, un aspecto importante es la prevención de la enfermedad tromboembólica de forma sistemática en todos los pacientes con riesgo. Para ello se aplicarán medidas físicas o farmacológicas, como la administración de heparinas de bajo peso molecular en el tiempo y las dosis adecuadas (grado de recomendación B)33.
La absorción espontánea del neumotórax cada día oscila entre el 1,25 y el 1,8% (50-75ml) del volumen de aire intrapleural, y dicho proceso se ve acelerado hasta 4 veces si se aporta oxígeno suplementario. Se recomienda que los pacientes dentro del ámbito hospitalario reciban aporte suplementario de oxígeno mientras esperan ser evaluados o cuando ingresan con un simple tratamiento conservador (grado de recomendación B)2, ya que la inhalación de oxígeno reduce la presión parcial de nitrógeno en los capilares, con lo que aumenta la velocidad de reabsorción del gas contenido en el espacio pleural. La BTS2 recomienda administrar altos flujos de oxígeno suplementario (p. ej., 10l/min), pero insiste en tener precaución en los pacientes con EPOC por el riesgo de ocasionar hipercapnia (grado de recomendación B).
Dejar de fumar debe ser una de las prioridades de los pacientes con NE y supone una medida preventivo-terapéutica importante tanto en el inicio, deterioro funcional y recidiva del NE.
Recomendaciones en situaciones especialesDebido al aumento de los viajes en avión, así como de los deportes y las profesiones de riesgo, según la “Normativa SEPAR: Patología respiratoria y vuelos en avión”34, el neumotórax es una contraindicación para el vuelo y sólo se aceptará que el paciente viaje en avión cuando el pulmón se haya reexpandido por completo. Por tanto, no debería ser admitido en un avión hasta 72h después de retirado el drenaje pleural y con una radiografía de tórax realizada a las 48h de retirar el drenaje que confirme la resolución (grado de recomendación C)35. La Aerospace Medical Association36 afirma que, de forma opcional, algunas compañías aéreas pueden aceptar el transporte de pasajeros con drenaje pleural. En este caso, como es difícil garantizar una aspiración continua durante el vuelo, se recomienda la colocación de una válvula de Heimlich. Con carácter excepcional, puede resultar necesaria la evacuación de un neumotórax durante el vuelo, que debe realizar personal entrenado.
En la normativa de la BTS2 se afirma que las líneas comerciales advierten de que deben evitarse los viajes en avión en un intervalo de 6 semanas desde el episodio y una vez controlado, en el caso de los NEP. Aunque no hay evidencia de recurrencia por el propio vuelo en sí, las consecuencias de que se produzca durante éste pueden ser graves al carecer de asistencia médica. Las restricciones pueden tener más sentido en pacientes con mayor riesgo en caso de presentar neumotórax, como son los fumadores y los pacientes con enfermedades pulmonares de base (NES). En el caso del NES que no ha sido intervenido quirúrgicamente el período se amplía al año (grado de recomendación C)2.
Por otra parte, se deberá disuadir de la práctica de deportes de riesgo como el submarinismo a los pacientes que no han sido intervenidos quirúrgicamente de su neumotórax (grado de recomendación C)2. La guía de la BTS sobre aspectos respiratorios del buceo37 recomienda que los pacientes con antecedentes de neumotórax no realicen esta actividad hasta que se les haya intervenido mediante toracotomía bilateral y pleurectomía apical o abrasión pleural. No considera la videotoracoscopia porque el porcentaje de recidivas de algunas series, entre el 5 y el 10%, es intolerable para esta actividad de riesgo. Por tanto, cabe afirmar que la toracotomía bilateral con pleurectomía apical, cuya tasa de recidiva es del 0,5%38, o la videotoracoscopia bilateral con pleurectomía apical, con un 0% de recidiva39, deben ser las técnicas de elección en estos pacientes.
Seguimiento y controlesLos pacientes con NE resuelto no necesitan controles posteriores. Por otra parte, los pacientes con NE sin tratamiento o con drenaje ambulatorio deben ser revisados por las especialidades implicadas según la disponibilidad de los distintos niveles asistenciales.
Tratamiento del neumotórax espontáneo primarioEl NEP afecta a individuos sin enfermedad pulmonar aparente y, por tanto, no debe considerarse una enfermedad grave. En la mayoría de los casos se resuelve mediante observación o bien con procedimientos poco invasivos y, por consiguiente, con escasa repercusión en la actividad diaria de estos pacientes.
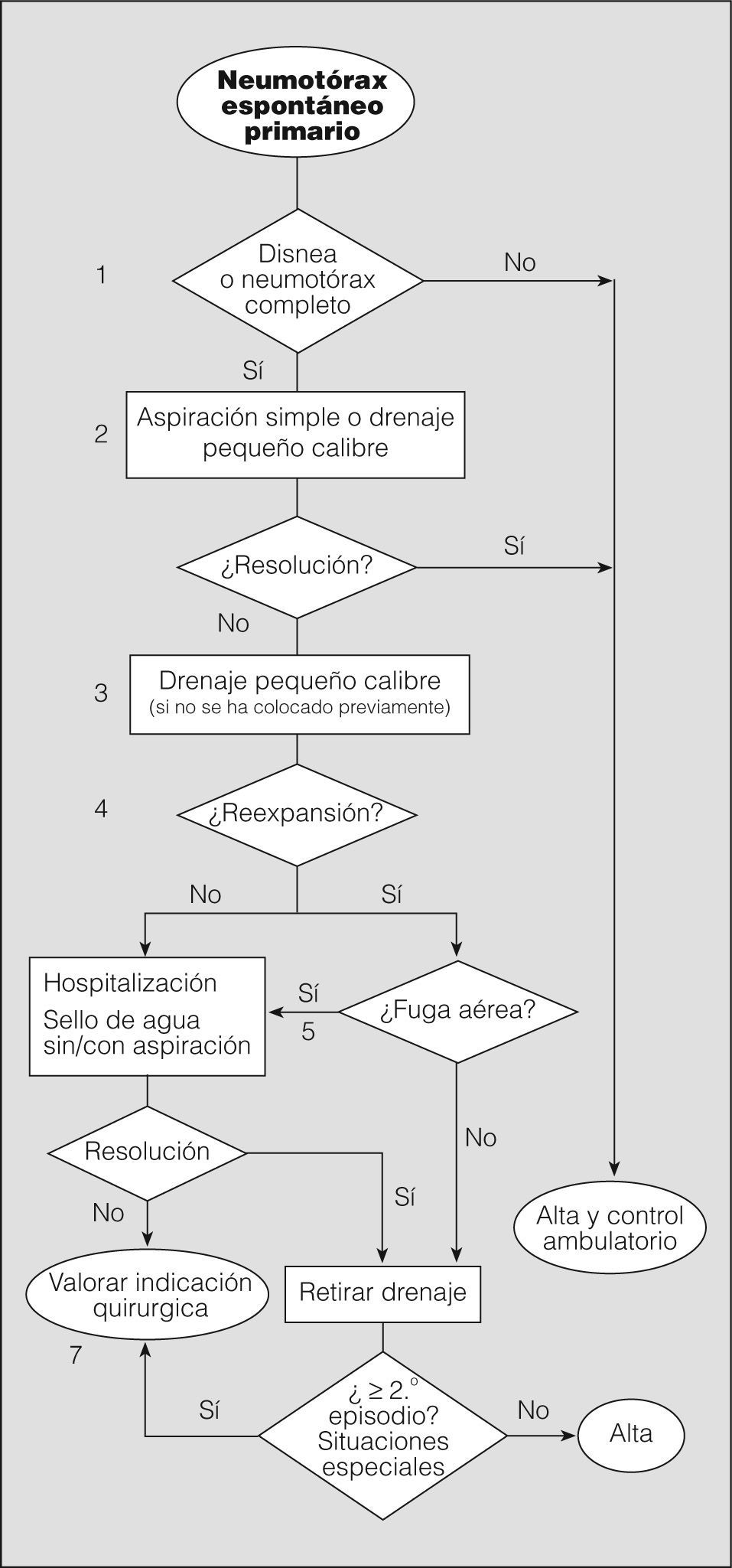
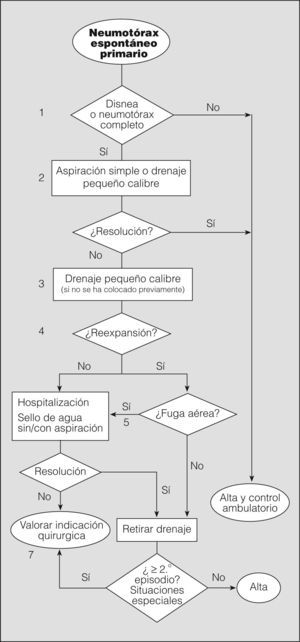
El objetivo inicial del tratamiento del NEP es eliminar el aire intrapleural, mediante observación si es parcial, o extrayéndolo por los distintos métodos disponibles si es completo o total. El segundo objetivo es prevenir las recurrencias en los casos con alta probabilidad de recidiva o en situaciones de potencial gravedad. Seguidamente analizaremos mediante un algoritmo la actitud terapéutica en los diferentes niveles de actuación (fig. 4).
Notas al algoritmo para el tratamiento del neumotórax espontáneo primario1. La observación es la actitud de elección en neumotórax parciales sin disnea (grado de recomendación B)40. Un neumotórax parcial en el que persiste la disnea debe hacer pensar en la posibilidad de una enfermedad subyacente y, por tanto, en un NES, o en un aumento de tamaño de éste. Algunos autores recomiendan observar al paciente en el área de urgencias durante 3-6h y repetir el estudio radiológico simple de tórax antes del alta para comprobar que no hay progresión (grado de recomendación D)2. Estos pacientes no requieren ingreso hospitalario, a menos que vivan muy lejos o tengan serias dificultades para acceder a un servicio de urgencias28. En todos los casos debe realizarse un seguimiento ambulatorio con instrucciones claras de acudir a urgencias en caso de dificultad respiratoria.
Aunque un neumotórax del 25%, a un ritmo de reabsorción del 1,25-1,8% diario, puede tardar unos 20 días en resolverse41, no disponemos de evidencias para recomendar un calendario de revisión concreto. El grupo de expertos del ACCP28 recomienda entre 2 y 14 días, y nos parece razonable realizar al menos una radiografía de tórax para comprobar la resolución del neumotórax (grado de recomendación D).
2. Aunque la aspiración simple no es un procedimiento muy extendido en España -sólo se ha publicado un artículo en castellano al respecto en los últimos 10 años42-, hay varios ensayos clínicos aleatorizados que demuestran que es tan eficaz a corto y largo plazo como el drenaje torácico43-45, además de producir menos dolor y evitar el ingreso hospitalario (grado de recomendación A). La tasa de resolución inicial oscila entre el 50 y el 88%, similar a la del drenaje torácico. Esta actitud favorece el manejo ambulatorio de gran número de pacientes con NEP.
La guía de la BTS para el manejo del NEP recomienda repetir la aspiración simple en caso de fracasar el primer intento, especialmente si el volumen aspirado la primera vez fue escaso (grado de recomendación B)2.
Los métodos de aspiración simple son variados: desde el uso de un catéter venoso hasta la utilización de equipos con drenajes torácicos de pequeño calibre que pueden retirarse una vez comprobada la reexpansión. Si se mantiene colocado el drenaje más allá del tiempo que el paciente permanece en urgencias, se considera propiamente colocación de drenaje torácico39, de tal forma que la diferencia entre aspiración simple y colocación de drenaje torácico de pequeño calibre reside exclusivamente en el tiempo que permanece colocado. Ambos métodos pueden considerarse igualmente válidos para el tratamiento del NEP completo, en especial si se realiza tratamiento ambulatorio de pacientes con drenaje pleural de pequeño calibre8. En todos los casos, antes de dar el alta se debe realizar una radiografía de tórax para comprobar la reexpansión pulmonar.
- 3.
La mayor parte de los estudios no encuentran diferencias en la tasa de éxito entre los drenajes de pequeño calibre (≤ 14F) y los drenajes torácicos (≥ 16F). Por tanto, el uso de drenajes de pequeño calibre es de elección (grado de recomendación B)46,47 para el manejo tanto intra como extrahospitalario. Además, son más sencillos de colocar y menos molestos para el paciente.
- 4.
Una vez comprobada la reexpansión del pulmón con una radiografía de tórax, y en ausencia de fuga aérea, se procede a retirar el drenaje y se da de alta al paciente.
- 5.
Los pacientes con reexpansión pulmonar completa y fuga aérea mantenida deben conectarse a un sistema unidireccional tipo sello de agua o valvular, con lo que en la mayoría de los casos se consigue la resolución del neumotórax con una media de drenaje de 48h (grado de recomendación B)41. Los sistemas valvulares permiten el tratamiento ambulatorio en pacientes colaboradores y con domicilio cercano al centro hospitalario.
- 6.
No hay evidencia de que el uso precoz de la aspiración conectada al sistema de drenaje pleural acelere la resolución del neumotórax48. Si tenemos en cuenta la experiencia de la succión tras lobectomía pulmonar, en todos los ensayos clínicos realizados se concluye que la succión no aporta beneficio y en la mayoría de los casos retrasa la resolución de la fuga aérea (grado de recomendación A)49. El uso de la succión es frecuente de forma empírica en los casos de fuga aérea mantenida o falta de reexpansión, aunque no hay unanimidad sobre la presión que se debe aplicar. El riesgo de edema pulmonar por reexpansión es anecdótico y no debe retrasar su uso si se considera necesario8. En cualquier caso, si se decide utilizar la aspiración, ésta debe realizarse bajo supervisión2.
Otro aspecto no analizado es la influencia de la fisioterapia en la resolución del neumotórax. Parece razonable pensar que, en ausencia de fuga aérea importante, la fisioterapia respiratoria debe favorecer la resolución-salida de aire del espacio pleural. La creencia popular y la práctica tradicional de mantener en reposo a los pacientes con neumotórax espontáneo, incluso aquéllos con drenaje, carece de base fisiopatológica2,28.
En todos los casos se debe realizar una radiografía de tórax para comprobar la reexpansión pulmonar. No hay evidencia que sustente la necesidad de pinzar el drenaje o de esperar un período antes de su retirada, una vez comprobada la reexpansión (grado de recomendación B)48. Noppen50 recomienda esperar 12h desde el cese de la fuga aérea (grado de recomendación D), aunque esta consideración es de poca utilidad, ya que la evaluación de la fuga aérea en estos pacientes rara vez se hace antes de 24h.
En España, como en otros países, un gran número de médicos prefiere pinzar el drenaje antes de la retirada (un 47% en el grupo de expertos de la ACCP28) por la posibilidad de detectar fugas pequeñas o intermitentes y así evitar la necesidad de colocar un nuevo drenaje. Se debe tener en cuenta que esta maniobra es potencialmente peligrosa y, por tanto, debe realizarse sólo con la supervisión de personal sanitario entrenado, para despinzar si fuera necesario. En cualquier caso, este pinzamiento no debe mantenerse más de 6-12h (grado de recomendación D)28.
7. Aunque en la mayoría de los pacientes con NEP y fuga aérea ésta se resuelve antes de 2 semanas51, es una práctica generalizada remitir o ponerse en contacto con un servicio de cirugía torácica a los 5 días para realizar tratamiento quirúrgico definitivo, debido a la nula mortalidad y escasa morbilidad de la cirugía. No obstante, no existe evidencia científica que justifique esta pauta y, por consiguiente, cualquier otra debida a factores organizativos puede ser adecuada.
Otras indicaciones de tratamiento quirúrgico teniendo en cuenta el riesgo de recurrencias o de complicaciones graves son: segundo episodio de NEP homolateral, primer episodio de NEP contralateral o bilateral simultáneo, primer episodio de NEP hipertensivo, hemoneumotórax espontáneo significativo y profesiones o actividades de riesgo (pilotos, buceadores, paracaidistas, etc.)2.
Tratamiento definitivo del neumotórax espontáneo primarioNinguno de los métodos utilizados con intención curativa o de prevención de la recidiva del neumotórax ha demostrado hasta el momento una superioridad clara sobre los demás. No obstante, debemos valorar la relación riesgo-beneficio a la hora de recomendar unos procedimientos sobre otros. La pleurodesis química con agentes esclerosantes es menos eficaz que los procedimientos quirúrgicos y no es recomendable en el tratamiento del NEP46. La toracotomía con pleurectomía total es el método que presenta una menor tasa de recidivas, pero es muy agresivo para el tratamiento del NEP (grado de recomendación D)28. La videotoracoscopia ofrece resulta dos similares a los de la toracotomía en prevención, con menor morbilidad y mejor cosmética (grado de recomendación C)52. La bullectomía con abrasión pleural es la técnica más utilizada por la mayoría de cirujanos torácicos (grado de recomendación D)28.
El talco intrapleural a través del drenaje o mediante toracoscopia se ha utilizado con éxito20, pero estudios experimentales y opiniones de algunos expertos plantean dudas razonables sobre su seguridad53,54, por lo que su uso en pacientes jóvenes, como son la mayoría de los casos de NEP, no es recomendable.
Tratamiento del neumotórax espontáneo secundarioComo ya se ha comentado, en el NES existe una enfermedad pleuropulmonar subyacente, principalmente la EPOC, con presencia o no de ampollas, por lo que el tratamiento de aquél está condicionado por dicha enfermedad.
Al igual que sucede en el NEP, la observación sigue siendo la actitud de elección en neumotórax parciales sin disnea, aunque ésta aparece más frecuentemente en los pacientes con EPOC moderada o grave, por lo que la hospitalización suele ser necesaria. El paciente con NES requiere con más frecuencia la colocación de un drenaje torácico y la consideración de un tratamiento ulterior para inducir pleurodesis, pues, además de la enfermedad de base, el propio neumotórax es un indicador de la mortalidad de los pacientes con EPOC7. La recidiva estimada del NES es del 40-56%6.
Aunque en general se establece como adecuado un abordaje más agresivo en el NES que en el NEP, no hay estudios aleatorizados ni una opinión consensuada respecto al tratamiento específico que debe aplicarse. En el estudio de consenso del ACCP28, se recomienda la colocación de un drenaje torácico y pleurodesis a todos los pacientes en su primer episodio de NES para prevenir la recidiva, aunque el 19% de los expertos pospondría la pleurodesis hasta el segundo neumotórax. La BTS2 y la Sociedad Belga de Neumología29 recomiendan la aspiración simple de los neumotórax parciales en pacientes con enfermedad pulmonar leve, aunque reconocen que la mayoría de los pacientes requerirán un drenaje torácico. La BTS recomienda asimismo la retirada de drenaje tras la reexpansión pulmonar sin fugas, y reservar la pleurodesis para los casos con fuga aérea permanente o neumotórax recidivante2. Por el contrario, la Sociedad Belga de Neumología recomienda en el NES el tratamiento preventivo de la recidiva ya en el primer episodio, por la alta incidencia y el incremento exponencial de mortalidad en un segundo neumotórax29.
Menos consenso existe en cuanto al método ideal de pleurodesis una vez indicada. El ACCP28 y la Sociedad Belga de Neumología29 recomiendan un procedimiento mínimamente invasivo como la toracoscopia o la cirugía torácica asistida por vídeo (VATS) como primera opción, por su menor morbilidad, reservando la toracotomía axilar con abrasión pleural como segunda opción. La BTS2, por el contrario, recomienda la toracotomía como primera opción y reservar la VATS para los pacientes que no puedan tolerar un procedimiento “a cielo abierto”.
En casos seleccionados, y aunque no exista una evidencia considerable, comentamos la posibilidad de aplicar pleurodesis con “parche de sangre autóloga” a pacientes con fuga aérea persistente e importante enfermedad pulmonar de base55,56, precisamente para tratar de evitar otras opciones terapéuticas con mayor morbimortalidad.
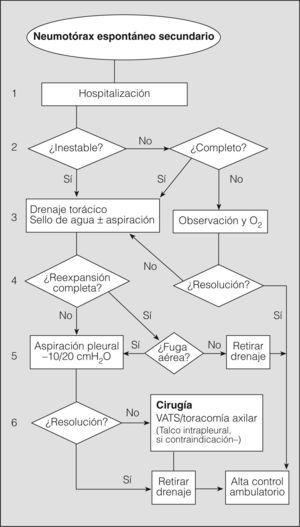
Seguidamente analizaremos mediante un algoritmo la actitud terapéutica en los diferentes niveles de actuación (fig. 5).
1. Se recomienda la hospitalización de todos los pacientes con NES, independientemente del tratamiento que se vaya a realizar y de la situación clínica, por la elevada morbimortalidad asociada a su enfermedad de base (grado de recomendación D)2,11,20,29.
- 2.
El paciente con NES parcial que permanece clínica y funcionalmente estable no requiere aspiración simple ni drenaje de pequeño calibre, e ingresará básicamente para observación y administración de oxígeno si lo precisara. El resto –la gran mayoría: pacientes inestables o estables con un neumotórax completo– requerirá la colocación de un drenaje torácico (grado de recomendación C)2,28,29. La aspiración simple es poco recomendable por inefectiva, incluso para la BTS2.
- 3.
El drenaje de pequeño calibre (≤ 14F) está indicado en los pacientes estables con neumotórax completo, aunque, debido a la enfermedad de base, es más recomendable el drenaje torácico (> 16F), e indispensable si hay riesgo de precisar ventilación mecánicac (grado de recomendación C)2,28,29.
- 4.
En los pacientes en observación, el aumento del neumotórax y/o la aparición de disnea conllevan la colocación de un drenaje torácico. Como en el NEP, el sello de agua puede ser suficiente inicialmente, y se requerirá aspiración pleural (–10/20cm de agua) si no se consigue la reexpansión pulmonar completa (grado de recomendación C)2,28,29.
- 5.
Una vez conseguida la reexpansión completa del pulmón sin fuga aérea durante más de 24h, se retira el drenaje previa radiografía de tórax de comprobación. Respecto al pinzamiento previo del tubo, aún sin consenso, muchos profesionales lo realizan por las consecuencias de una recidiva inmediata del NES (grado de recomendación D)28. La fuga aérea es frecuente y su persistencia entre 4 y 7 días debe llevar a considerar una actitud más agresiva, observándose una mayor efectividad del tratamiento ulterior y un menor coste del procedimiento (grado de recomendación C)28,30,57. En cualquier caso, la decisión debe individualizarse según las situaciones clínicas y organizativas que pueden influir en la consideración del momento de aplicar otro procedimiento, por ejemplo: edad del paciente, posibilidad inmediata de quirófano, etc.
- 6.
El procedimiento quirúrgico recomendado es la pleurodesis abrasiva o pleurectomía apical más bullectomía mediante VATS (por mejor visualización) o la toracotomía axilar. Aunque la toracotomía con pleurectomía presenta el menor número de recidivas, se considera un tratamiento demasiado agresivo de entrada (grado de recomendación C)2,28,29.
La aplicación de talco intrapleural a través del drenaje o por toracoscopia se ha demostrado eficaz en los pacientes con NES y EPOC grave, y está más extendida y justificada que en el NEP20. No obstante, se aconseja reservarla para los casos con contraindicación quirúrgica o mal pronóstico de la enfermedad de base (grado de recomendación D)2,28,29.
Neumotórax catamenialEl neumotórax catamenial se produce coincidiendo con el ciclo menstrual, aunque también se han descrito casos en el período premenstrual e incluso intermenstrual58,59. Es un problema poco frecuente. Desde la primera descripción de Maurer hasta 2004 se habían publicado 229 casos60, aunque probablemente esté infradiagnosticado. El tratamiento convencional de pleurodesis y hormonoterapia tiene una elevada tasa de fracasos58.
Su mecanismo de producción no está del todo claro. Se han propuesto varias teorías sustentadas en algunos hallazgos clínicos y experimentales61. La primera postula la existencia de orificios congénitos en el diafragma que durante la menstruación, debido a la permeabilidad de las trompas de Falopio, permiten el paso de aire a la cavidad pleural. La segunda propone que los orificios diafragmáticos podrían estar producidos por endometriosis en esta zona y el mecanismo de producción sería el mismo. Según la tercera hipótesis, la endometriosis del parénquima pulmonar puede producir fuga aérea durante la menstruación. Por último, se ha apuntado la existencia en algunas mujeres, durante la menstruación, de prostaglandina F2, que es un potente constrictor de bronquiolos y vasos, lo que podría producir la rotura de los alvéolos.
Estos mecanismos patogénicos permiten distinguir 2 grupos de pacientes: con orificios diafragmáticos y sin ellos62. La presencia de orificios en el diafragma se ha constatado en más del 50% de los casos publicados60. Por esta razón la mayoría de los tratamientos propuestos incluyen el tratamiento local sobre el diafragma en forma de sutura de los orificios, plicatura de las áreas con orificios en el diafragma, resección de la parte membranosa del diafragma, sutura y pleurodesis con malla de ácido poliglicólico.
En los casos en que no se observan orificios no hay una pauta empírica tan definida. Algunos autores58 recomiendan el tratamiento local sobre el diafragma por la posibilidad de que estos orificios pasen inadvertidos, más la abrasión de la pleura parietal convencional.
El tratamiento anovulatorio convencional no es eficaz en la mayoría de los casos, pero la amenorrea inducida con los análogos de la gonadotropina impide la recidiva del neumotórax. Sin embargo, este tratamiento hormonal no se tolera durante períodos prolongados, por lo que se reserva como tratamiento de apoyo a la cirugía, para evitar la recidiva, mientras se producen las adherencias en la superficie diafragmática en el período postoperatorio. El tratamiento con análogos de la gonadotropina debe ser pautado y controlado por un ginecólogo.
Situaciones especialesDebe tenerse en cuenta que la amenorrea es probablemente el factor más eficaz para evitar este tipo de neumotórax, por lo que en pacientes que requieran histerectomía o anexectomía por otro motivo este tratamiento será la solución definitiva. Asimismo, durante el embarazo y la lactancia es improbable la recidiva del neumotórax, pero obviamente esto es temporal y está relacionado con el período de amenorrea.
ComplicacionesSe debe informar a los pacientes de las infrecuentes pero graves complicaciones, inmediatas o tardías, que se derivan del neumotórax en sí o de las actitudes terapéuticas aplicadas. Entre ellas cabe destacar el edema pulmonar por reexpansión brusca del neumotórax de gran volumen o por neumotórax de varios días de evolución (10%); el hemoneumotórax por laceración de un vaso durante la colocación de un tubo convencional o por desgarro de las adherencias entre la pleura parietal y visceral (5%); la reacción vagal con la correspondiente hipotensión sistémica por el dolor o por el edema por reexpansión pulmonar; la neuralgia intercostal; el neumomediastino y enfisema subcutáneo por rotura alveolar o drenaje pleural incorrecto; la existencia de neumotórax a tensión o hipertensivo (2-3%); el neumotórax bilateral simultáneo (2%); el fallo de la reexpansión y la cronicidad tras más de 3 meses, y la fuga aérea persistente11.
ApéndiceNiveles de evidencia631++: metaanálisis o revisiones sistemáticas de ensayos clínicos aleatorizados (ECA) de alta calidad, o ECA con un riesgo muy bajo de sesgo.
1+: metaanálisis o revisiones sistemáticas de ECA bien realizados, o ECA con un riesgo bajo de sesgo.
1–: metaanálisis, revisiones sistemáticas o ECA con un riesgo alto de sesgo.
2++: revisiones sistemáticas de estudios de casos y controles o de cohortes de alta calidad, o estudios de casos y controles o de cohortes de alta calidad con un riesgo muy bajo de sesgo, confusión o casualidad y una alta probabilidad de que la relación sea causal.
2+: estudios de casos y controles o de cohortes bien dirigidos con un riesgo bajo de confusión, sesgo o casualidad y una probabilidad moderada de que la relación sea causal.
1–: estudios de casos y controles o de cohortes con un riesgo alto de confusión, sesgo o casualidad y un riesgo significativo de que la relación no sea causal.
3: estudios no analíticos, como casos clínicos o series de casos.
4: opinión de expertos.
- A
: por lo menos un metaanálisis, revisión sistemática o ECA clasificados como 1++ y directamente aplicables a la mayoría de la población objeto, o una revisión sistemática, un ECA o un cuerpo de evidencia constituido principalmente por estudios clasificados como 1+, directamente aplicables a la población objeto y en los que se demuestre la uniformidad global de los resultados.
- B
: un cuerpo de evidencia, incluidos los estudios clasificados como 2++ directamente aplicables a la población objeto, en que se demuestre la uniformidad global de los resultados, o evidencia extrapolada de estudios clasificados como 1++ o 1+.
- C
: un cuerpo de evidencia, incluidos los estudios clasificados como 2+ directamente aplicables a la población objeto y una vez demostrada la uniformidad global de los resultados, o evidencia extrapolada de estudios clasificados como 2++.
- D
D: niveles de evidencia 3 o 4, o evidencia extrapolada de estudios clasificados como 2+.