Las micobacterias no tuberculosas (MNT), también llamadas atípicas o ambientales, se encuentran ampliamente distribuidas en el agua y el suelo1, pero su potencial patogénico fue subestimado durante mucho tiempo.
Con la pandemia VIH/sida y la mayor sobrevida alcanzada por pacientes con enfermedades respiratorias crónicas y otras enfermedades debilitantes, como neoplasias, diabetes, enfermedades autoinmunes, trasplantes y tratamientos inmunosupresores, las MNT han ganado interés y existe un creciente número de casos y nuevas especies reconocidas1,2.
Entre las MNT Mycobacterium peregrinum es una especie de presentación infrecuente, con muy pocos casos reportados a nivel mundial, por lo que su significado clínico y el tratamiento óptimo no están bien establecidos3.
En este contexto, el reporte de casos es de gran valor para ampliar el conocimiento del tema.
Presentamos el caso de una mujer de 40 años que asistió a la consulta de neumología por presentar tos con escasa expectoración mucosa de 2 meses de evolución, sin otros síntomas asociados. Había recibido tratamiento empírico con amoxicilina y, dada la persistencia de la tos, se había indicado salbutamol sin obtener mejoría.
Como antecedentes de interés presentaba uveítis autoinmune, por lo que recibía micofenolato 2g/día desde 3 años previos a la consulta, y se su profesión era la de técnica extraccionista en el laboratorio de nuestro hospital.
En el examen físico no se evidenciaron hallazgos relevantes.
Entre los estudios complementarios realizados se menciona: hematocrito 32%, hemoglobina 9,9g/dl, discreta anisocromía con hipocromía. Recuento leucocitario 10.670/mm3 (neutrófilos 64%, linfocitos 22%, monocitos 11%, eosinófilos 2%, basófilos 0,5%), eritrosedimentación 54mm/h; hepatograma, función renal, glucemia y proteinograma con valores dentro de los límites de referencia. Prueba cutánea de la tuberculina: 2mm.
La espirometría mostraba valores normales (FVC 4,05l [122% del teórico], FEV1 3,27l [119% del teórico], FEV1/FVC 81%), sin respuesta significativa a los broncodilatadores.
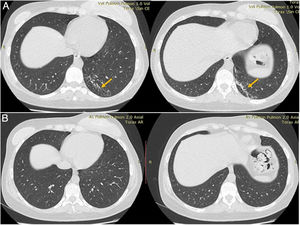
La tomografía simple de tórax evidenció un infiltrado hiperdenso con bronquiectasias en el segmento posterior del lóbulo inferior izquierdo (fig. 1).
Ante la sospecha de enfermedad infecciosa se solicitó baciloscopia de esputo que resultó positiva, con desarrollo en el cultivo de M. peregrinum (en 2 muestras de esputo distintas), identificado por el método molecular de análisis de los productos de restricción de amplicones de 439pb del gen hsp65, amplificados por PCR. La sensibilidad a claritromicina, ciprofloxacino, amikacina y linezolid, fue demostrada por la prueba de determinación de la concentración inhibitoria mínima por el método de microdilución, de acuerdo a las normas CLSI.
Tras verificar una función auditiva y electrocardiograma normales se inició tratamiento con ciprofloxacino 500mg/12horas y claritromicina 500mg/12horas. A los 30 días de iniciar los antibióticos había cedido la tos y la expectoración, por lo que no fue posible obtener nuevas muestras de esputo para su examen microbiológico, y había normalizado el hemograma y la eritrosedimentación.
Tras 6 meses de tratamiento con buena tolerancia y sin eventos adversos significativos, se repitió la tomografía de tórax, que resultó normal, y se le otorgó el alta.
Las MNT se clasifican según sus características de crecimiento y los pigmentos que elaboran4. En el grupo de crecimiento lento (más de 7 días) se destacan M. kansasii y M. avium complex, y dentro de las de crecimiento rápido se encuentran M. fortuitum, M. chelonae y M. abscessus.
Estas especies presentan gran variabilidad en su distribución geográfica, su potencial patológico y su presentación, incluso dentro de una misma región1,4,5. La gran mayoría de las enfermedades clínicamente detectables se debe a micobacterias de crecimiento lento (alrededor del 82% de los casos), siendo mucho menos frecuente el reporte de infecciones por micobacterias de crecimiento rápido.
M. peregrinum se ubica entre de las de rápido crecimiento, dentro del grupo Mycobacterium fortuitum, en el que se encuentran M. fortuitum (la más común de estas, conocida por causar infecciones oportunistas), y otras 8 especies que comparten características como ausencia de pigmentación y suceptibilidad a polimixina B, sulfonamidas y nuevas fluoroquinolonas3,6.
En un estudio ambiental realizado en distintas fuentes de agua en Bahía Blanca, Buenos Aires, Argentina, se aislaron MNT en el 51,6% de las muestras de agua de dique y de grifo (64/124), de las cuales el 11% correspondía a M. peregrinum7.
Más allá de su amplia distribución, M. peregrinum es muy raro como patógeno para los humanos8 y se estima que representan del 1% a 2% de las infecciones por micobacterias de crecimiento rápido3. La prevalencia de las infecciones respiratorias por este germen se desconoce.
Los pocos casos reportados se asocian a enfermedades similares a las producidas por otros miembros del grupo M. fortuitum, como absceso amigdalino8, infección de sitio quirúrgico con fístula cutánea9, infección de piel en un paciente con psoriasis10, endocarditis en un paciente con válvula aórtica protésica11 e infecciones pulmonares (solo hallamos 3 casos publicados hasta el momento)12–14.
Respecto al tratamiento de las MNT, generalmente resisten a antituberculosos y son sensibles a antibióticos tradicionales como claritromicina, amikacina, ciprofloxacino, tigeciclina y sulfonamidas, pero suele encontrarse discordancia entre las pruebas de sensibilidad in vitro y la respuesta clínica4. El tratamiento recomendado es con 2 fármacos que hayan demostrado sensibilidad in vitro5.
La sensibilidad in vitro de M. peregrinum ha sido estudiada y se evidenció que las nuevas fluoroquinolonas poseen gran actividad contra la bacteria, especialmente moxifloxacina, y se aconseja utilizar esquemas similares a los indicados para M. fortuitum, combinando una fluoroquinolona con otro fármaco15. Sin embargo, dado que hay pocos reportes de casos, la actividad de estos antibióticos debe testearse in vivo antes de hacer una recomendación.
En conclusión, en nuestro conocimiento este es el cuarto reporte de infección pulmonar por M. peregrinum a nivel mundial. El esquema antibiótico aplicado difiere del utilizado en los 3 casos anteriores, pero resultó efectivo y seguro.
El reporte de las estrategias diagnósticas y terapéuticas para afrontar este patógeno contribuye a un mejor conocimiento de su significado clínico y es necesario para ayudar a guiar su manejo en futuras ocasiones.