El pulmón es uno de los órganos más afectados por las infecciones provocadas por micobacterias no tuberculosas. Los pacientes con comorbilidades o con terapia inmunosupresora son más propensos a adquirirlas1. Dado el aumento en la incidencia de estos factores de riesgo, es probable que las enfermedades producidas por micobacterias no tuberculosas sean más frecuentes en el futuro. El estudio microbiológico de estas especies es esencial para diseñar el tratamiento más adecuado1.
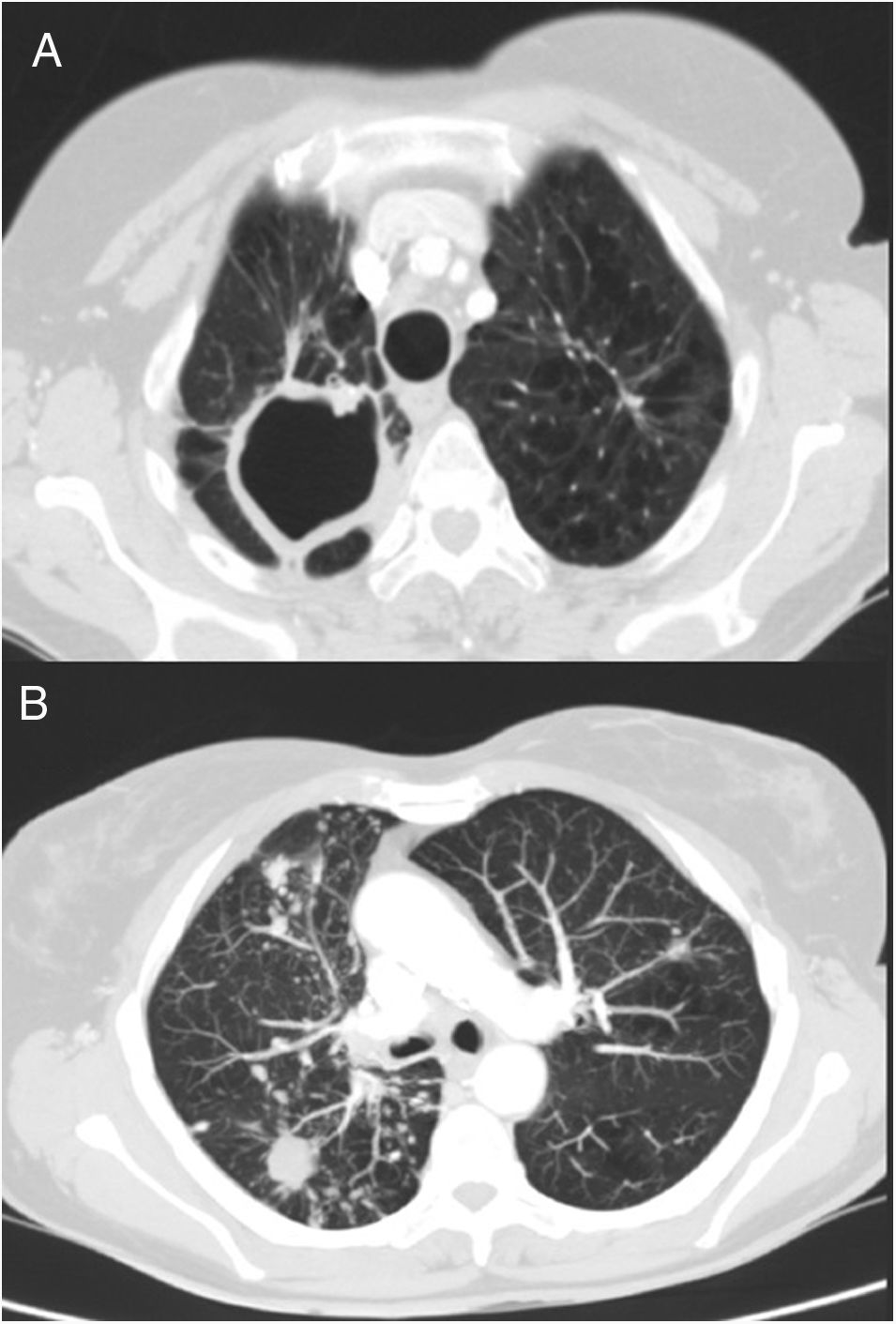
Una mujer de 69 años acudió a nuestras consultas por dolor lumbar crónico como única sintomatología. En la anamnesis refirió antecedentes personales de exfumadora (índice paquetes-año de 75), alcoholismo crónico y tuberculosis pulmonar a los 41 años. Tras una radiografía de tórax, que mostraba la presencia de nódulos pulmonares bilaterales, se realizó una tomografía computarizada (TC) torácica, donde se observó la presencia de secuelas de un proceso tuberculoso previo, con cicatrices parenquimatosas y signos de pérdida de volumen de ambos lóbulos superiores, y con una gran cavidad y granulomas en el vértice derecho. La TC también reveló la existencia de múltiples nódulos bilaterales y difusos, cavitados los de mayor tamaño (15mm) en el lóbulo inferior derecho, y un patrón micronodular de distribución en árbol en brote en los lóbulos medio e inferior derecho (fig. 1). Después se hizo una broncoscopia diagnóstica, donde la celularidad del lavado broncoalveolar fue benigna y los cultivos microbiológicos negativos, estando pendiente de resultados el cultivo de micobacterias. En la espirometría, la relación entre el volumen espiratorio máximo en el primer segundo (FEV1) y la capacidad vital forzada (FVC) posbroncodilatadora fue de 0,6, con un FEV1 del 75%, y una FVC del 101%. Tras estos resultados, la paciente fue diagnosticada de enfermedad pulmonar obstructiva crónica (EPOC) y se inició tratamiento con tiotropio.
TC de tórax. A) Imagen de secuelas de proceso tuberculoso previo, con signos de pérdida de volumen de ambos lóbulos superiores y cicatrices parenquimatosas con gran cavidad en vértice derecho. B) Visión de múltiples nódulos bilaterales y difusos, algunos cavitados, y patrón micronodular de distribución en árbol en brote en lóbulo inferior derecho y lóbulo medio, en relación con el proceso infeccioso actual.
Una semana después de la broncoscopia, la paciente acudió a Urgencias por fiebre de 39°C, tos y expectoración purulenta de 6 días de evolución, y sin presentar mejoría tras tratamiento con amoxicilina-ácido clavulánico. Fue hospitalizada y tratada con levofloxacino e imipenem. En el análisis de esputo se observó la presencia de bacilos alcohol-resistentes, por lo que ante la posibilidad de tratarse de una tuberculosis pulmonar se cambió el tratamiento a rifampicina, isoniazida, pirazinamida y etambutol. La reacción en cadena de polimerasa (PCR) para Mycobacterium tuberculosis fue negativa, por lo que en espera de los resultados del cultivo para micobacterias, y tras mejoría clínica y radiológica, la paciente fue dada de alta con el mismo tratamiento.
Un mes después se observó un crecimiento de Mycobacterium malmoense en el cultivo de esputo, en 3 muestras distintas y en el lavado broncoalveolar. Estas fueron inoculadas en medios sólidos (Lowestein-Jensen y Coletsos) y líquidos (Sistema Versatrek). Para la identificación del microorganismo se utilizó el kit GenoType CM/AS. El antibiograma mostró sensibilidad a rifampicina, claritromicina y estreptomicina, con resistencia a isoniazida y pirazinamida. Tras estos resultados el tratamiento se cambió a rifabutina, etambutol y claritromicina. Al inicio del mismo la paciente refirió astenia, hiporexia y vómitos, y se modificó la pauta terapéutica a una toma de rifampicina diaria, y etambutol los lunes, miércoles y viernes. La paciente no presentó más efectos secundarios, por lo que la dosis del etambutol fue incrementada paulatinamente a una dosis diaria, con adecuada tolerancia clínica. El tratamiento se prolongó hasta los 2 años, y tras estos la paciente seguía asintomática y con mejoría radiológica. En la TC torácica permanecían las lesiones residuales, pero disminuyó el tamaño de la cavidad superior derecha y de los nódulos pulmonares.
M. malmoense es la micobacteria no tuberculosa más frecuentemente encontrada en países del norte de Europa2. En otros países europeos ha habido un número limitado de casos publicados3,4, pero en España se han descrito series desde solamente 5 casos4 hasta 20 en los últimos 35 años5,6. Los factores de riesgo para contraer una infección son los de cualquier otra micobacteria; inmunosupresión, enfermedades respiratorias previas, tabaquismo y abuso de alcohol, todos ellos presentes en nuestra paciente. Dado que hay un mayor número de pacientes con enfermedades pulmonares subyacentes o con tratamientos inmunosupresores, es probable que la incidencia de la infección por M. malmoense siga en aumento. La infección por esta micobacteria es clínicamente relevante en alrededor del 70-80% de pacientes con enfermedad pulmonar. Además, es el patógeno más importante tras Mycobacterium avium complex7.
El aislamiento de M. malmoense en muestras respiratorias es probablemente indicativo de infección8. En nuestra paciente llegamos al diagnóstico tras observar su crecimiento en los cultivos de esputo y en el lavado broncoalveolar. La identificación del microorganismo fue realizada mediante una técnica molecular (GenoType CM/AS), ampliamente empleada desde hace tiempo por la mayoría de laboratorios. El empleo de esta técnica molecular se ha convertido en una práctica habitual, y por su mayor rapidez y efectividad ha desplazado completamente a la identificación clásica basada en pruebas bioquímicas9. Más recientemente se ha introducido la técnica de MALDI-ToF para la identificación de microorganismos, incluyendo las micobacterias. Aunque no se empleó en este caso, esta técnica ya ha demostrado su utilidad10. Para el tratamiento de dichas infecciones se recomienda la combinación de rifampicina (o rifabutina) y etambutol durante 2 años, pudiendo añadir claritromicina según cada caso. La triple terapia no ha demostrado ser superior a la doble, por lo que a veces se prefiere esta última por los efectos adversos frecuentes de la claritromicina1. En nuestro caso, la determinación de la sensibilidad antimicrobiana también fue de gran ayuda a la hora de decidir el tratamiento pautado. Para ello, empleamos la técnica de microdilución en caldo, y se emplearon los puntos de corte establecidos para el M. avium complex por el Clinical and Laboratory Standards Institute (CLSI)11.
Concluimos que la frecuencia de infecciones respiratorias causadas por M. malmoense en España es baja, aunque probablemente esté en aumento y haya llegado para quedarse. Desafortunadamente hay poca evidencia con respecto a la efectividad del tratamiento, aunque la doble terapia y de larga duración parece ser eficaz en el manejo de esta patología. Como en otras micobacterias, el estudio microbiológico es importante para el manejo en estas infecciones.