La fibrosis quística (FQ) es la enfermedad monogénica potencialmente mortal más común en población caucásica1,2. La principal causa de morbimortalidad es la afectación respiratoria, causada por obstrucción, inflamación e infección de vías respiratorias que conduce a daño epitelial, remodelación tisular y enfermedad pulmonar terminal1,2. En las últimas décadas, las micobacterias no tuberculosas (MNTB) constituyen una de las complicaciones infecciosas más desafiantes de la FQ3. Son patógenos que pueden causar enfermedad pulmonar significativa, cuyo diagnóstico puede ser difícil en la FQ por la superposición de síntomas, signos y hallazgos radiológicos y cuyo tratamiento constituye una sobrecarga adicional al paciente3. Presentamos los 2 primeros casos de pacientes pediátricos con FQ e infección pulmonar por Mycobacterium lentiflavum (M. lentiflavum).
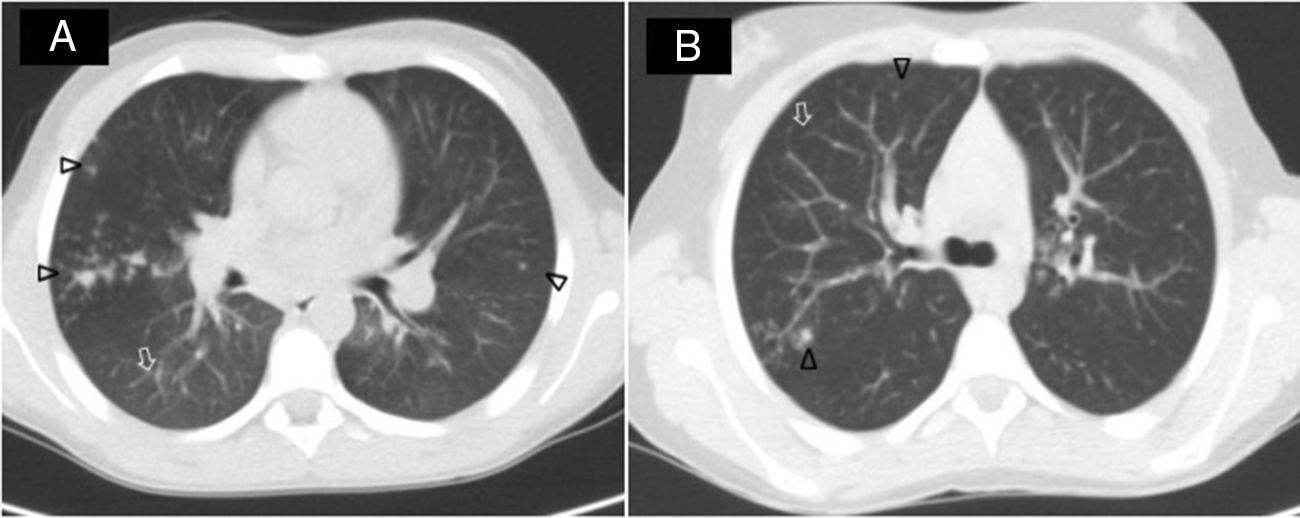
En primer lugar, varón diagnosticado de FQ con síntomas clásicos, 2 mutaciones del gen CFTR (c.1521_1523delCTTT/1820_1903del) y cloro en sudor de 100 y 84mmol/l. Estaba colonizado crónicamente por Staphylococcus aureus oxacilin sensible y Haemophilus influenzae e intermitentemente por Pseudomonas aeruginosa. Con 13 años presentó aumento de secreciones respiratorias, deterioro de la función pulmonar y pérdida de peso. Realizó tratamiento con ciprofloxacino sin mejoría clínica. El TACAR pulmonar mostró aumento de bronquiectasias, imagen de árbol en brote y nódulos acinares (fig. 1A). Tras 2 cultivos de esputo positivo para M. lentiflavum, comenzó tratamiento con claritromicina (500mg/12h), cicloserina (500mg/24h) y etambutol (500mg/24h) hasta completar 6 meses, consiguiéndose la erradicación del patógeno.
El segundo paciente es una mujer de 11 años, diagnosticada de FQ en contexto de tos crónica persistente, 2 test del sudor con cloro 102mmol/l y 2 mutaciones en CFTR (c.[1521_1523delCTT/c.1000C>T). Estaba colonizada intermitentemente por Staphylococcus aureus oxacilin sensible. Presentó, coincidiendo con discreto aumento de tos y empeoramiento de la función pulmonar, aislamiento de M. lentiflavum en 2 esputos. El tacar pulmonar mostró nódulos pulmonares y aumento de bronquiectasias (fig. 1B). Tras 6 meses de tratamiento oral con claritromicina (500mg/12h), cicloserina 500mg/12h, etambutol (500mg/24h) y amikacina nebulizada presentó buena evolución clínica y espirométrica y erradicación del M. lentiflavum.
En los últimos años estamos asistiendo a un aumento de la supervivencia de la FQ gracias a múltiples causas como el diagnóstico precoz mediante el screening neonatal, mejor soporte nutricional, intervenciones más precoces y agresivas de infecciones respiratorias, manejo multidisciplinar, seguimiento en unidades de referencia y desarrollo de moduladores de la proteína CFTR (Cystic fibrosis transmembrane conductance regulator)1. Paralelamente estamos observando un cambio epidemiológico de patógenos relacionados con la infección pulmonar, puesto que actualmente están surgiendo microorganismos emergentes con importante impacto clínico que, además de hacer más complejo el abordaje de estos pacientes, repercuten sustancialmente en la función pulmonar al perpetuar el binomio inflamación-infección4. Las MNTB son un ejemplo de esos patógenos emergentes2. Se hallan ampliamente distribuidas en el medio ambiente, siendo el mecanismo de transmisión más aceptado la aerosolización de microorganismos2,5, aunque comienza a haber evidencia de transmisión entre humanos, subrayándose la importancia del seguimiento de protocolos estrictos de control de infección cruzada2. Pueden ocasionar infección pulmonar crónica, particularmente en sujetos con enfermedad inflamatoria pulmonar preexistente, como nuestros pacientes2,5. Su incidencia aumenta con la edad6 y su prevalencia real tal como define la American Thoracic Society no es bien conocida, aunque se estima entre 4-14%2. Mycobacterium avium complex y Mycobacterium abscessus son las MNTB más frecuentemente aisladas7,8.
M. lentiflavum es una MNTB pigmentada, escotocromógena, de crecimiento lento, descrita en 19967–9. Crece a 25-37°C, formando colonias de 1-2mm de diámetro, con pigmentación amarilla brillante7,8,10. Es causa rara de infección humana, siendo la linfadenitis cervical la forma de presentación pediátrica más frecuente7,8,11,12, aunque también se han descrito infecciones en pacientes inmunocomprometidos7,8,11,12 y comienza a haber evidencia de casos de enfermedad pulmonar crónica en pacientes inmunocompetentes7,12, como los casos presentados.
La significación clínica de la infección pulmonar por M. lentiflavum en pacientes inmunocompetentes genera dudas al ser un microorganismo ambiental7,8,10,13. En los casos presentados, el diagnóstico de infección por M. lentiflavum se realiza cumpliendo los criterios establecidos en el último consenso de la Sociedad Europea y la Fundación Americana de FQ para el diagnóstico de infección por MNTB en pacientes con FQ. Concretamente ambos pacientes presentaron síntomas de exacerbación respiratoria no atribuibles a otros microorganismos ni a otras causas, empeoramiento radiológico y 2 cultivos de esputo positivos para M. lentiflavum. A ello añadimos clara mejoría radiológica, espirométrica y nutricional y la negativización de los cultivos tras el tratamiento. En base a la mencionada repercusión clínica de la infección por este patógeno en la enfermedad pulmonar de nuestros pacientes, proponemos que M. lentiflavum no es siempre un contaminante simple y consideramos imprescindible su identificación en el paciente con FQ9.
Las características bioquímicas de este microorganismo dificultan su identificación9, siendo necesarios para su caracterización estudios adicionales de ácidos nucleicos: amplificación del gen hsp-65, digestión con enzimas de restricción y amplificación del gen 16S del ARNr con posterior secuenciación de una zona hipervariable dentro del gen9. El régimen terapéutico óptimo y su duración no se ha establecido10; debiéndose tener en cuenta que se trata de un microorganismo resistente a la mayoría de los antituberculosos12. Se utiliza comúnmente una combinación de claritromicina o azitromicina más rifampicina, rifabutina o etambutol9. Se han identificado cepas sensibles a amikacina, ciprofloxacino, cicloserina, canamicina u ofloxacina12. En nuestros casos conseguimos la erradicación con 6 meses de tratamiento oral con claritromicina, cicloserina y etambutol y amikacina nebulizada, siendo bien tolerado. Las revisiones oftalmológicas y audiométricas no presentaron alteraciones.
En conclusión, proponemos que M. lentiflavum sea incluida en la creciente lista de MTNB causantes de enfermedad pulmonar, tanto en pacientes inmunocomprometidos como inmunocompetentes, siendo imprescindibles tanto su correcta identificación mediante el uso de herramientas moleculares específicas como el conocimiento de su alta tasa de resistencia antimicrobiana. Son necesarios estudios y/o ensayos clínicos que esclarezcan su prevalencia real, identifiquen los factores de riesgo relacionados con la infección y estudien su repercusión clínica en pacientes con neumopatía crónica y concretamente en la FQ. Con ello, podremos mejorar las estrategias diagnósticas y sustentar la decisiones terapéuticas en una consistente evidencia científica, con el objetivo de mejorar el control de la infección y evitar el deterioro de la función pulmonar asociado a esta bacteria.