Introducción
Estudios recientes demuestran que el epitelio bronquial es más que una simple barrera estructural, contribuye al inicio y a la persistencia del infiltrado inflamatorio, además de inducir cambios estructurales de la misma pared de la vía aérea1. Por lo tanto, el estudio del epitelio es interesante para conocer cómo comienzan o se mantienen diversas enfermedades respiratorias, además de otras funciones todavía sin determinar.
Los modelos in vitro basados en cultivos primarios de células epiteliales bronquiales (CEB) humanas son difíciles de desarrollar. El cultivo primario se realiza a partir de explantes de muestras que proceden de pacientes operados, de material extraído de las autopsias o bien de fragmentos de biopsias obtenidas a través de un broncoscopio2. Los fragmentos de tejido obtenidos son pequeños y, por lo tanto, rinden un escaso número de CEB. Para solucionar la dificultad de obtener un número suficiente de células requeridas en experimentos más complejos, se han desarrollado líneas comerciales de CEB. Estas células no siempre proporcionan el genotipo de la enfermedad en estudio3.
El objetivo del presente estudio ha sido desarrollar un método que incrementase la producción de CEB humanas en cultivo primario. Este método permitiría realizar estudios complejos repetidos a partir de explantes de muestras de un mismo paciente procedentes de broncoscopia o cirugía torácica.
Material y métodos
Obtención de muestras
Se incluyeron muestras de pacientes sometidos a resección quirúrgica o bien a broncoscopia según el manejo habitual de sus enfermedades siguiendo los protocolos estandarizados. Se informó acerca del tipo de intervención realizada a todos los pacientes, que firmaron su consentimiento. El estudio fue aprobado por el Comité de Ética del hospital.
Cirugía torácica
Se incluyeron muestras de 9 pacientes que se sometieron a cirugía torácica resectiva por tumoración. De la pieza quirúrgica extirpada se seleccionó y seccionó un pequeño fragmento no afectado, situado en el extremo más distal de la zona patológica.
Broncoscopia
Se incluyó a 3 pacientes a los que se practicó una broncoscopia. Con ayuda de una pinza para broncoscopio se realizó una biopsia por paciente en la carina principal considerando que esta zona no presentara aspecto patológico.
Cultivos celulares
La composición del medio y las concentraciones finales se prepararon según Devalia et al2. El medio de cultivo 199 con L-glutamina se suplementó con 2,5 μg/ml de insulina, 0,361 μg/ml de hidrocortisona y 2,5 μg/ml de apo-transferrina (Sigma Chemical Co., St. Louis, MO, EE.UU), un 2,5% de Nu-serum IV y 20 ng/ml de factor de crecimiento epidérmico (Becton Dickinson, Bedford, MA, EE.UU.), un 1% de penicilina-estreptomicina (Life Technologies, Gibco BRL, Grand Island, NY, EE.UU.) y 2 μg/ml de anfotericina B (Squibb Industria Farmacéutica S.A., Esplugues de Llobregat, Barcelona, España).
Obtención de células epiteliales
De la pieza procedente de quirófano se obtuvo el máximo número de explantes raspando la cara interna del bronquio con ayuda de unas pinzas y un bisturí. Las biopsias endoscópicas se dividieron en fracciones o explantes. Todos los explantes midieron de 1 a 2 mm. Se lavaron con suero fisiológico, cloruro sódico al 0,9%, con un 1% de penicilina- estreptomicina, y se colocaron en placas previamente tratadas con colágeno tipo I (Sigma Chemical Co., St. Louis, MO, EE.UU.) para estimular su proliferación. Se añadió una gota de medio 199 suplementado sobre cada explante después de asegurarse de su adhesión a la placa. La placa se incubó a 37 ºC, con un 5% de dióxido de carbono y un 90% de humedad, y no se movió durante 3 días para evitar que se despegaran los explantes. Transcurrido este tiempo, se reemplazó el medio por 3 ml de medio nuevo por placa. En días alternos se siguió la proliferación celular bajo lupa y se cambió el medio de cultivo.
Subcultivo de explantes
Los explantes se subcultivaron en otra placa, a los 10 días, cuando se observó un radio de proliferación celular moderado a su alrededor. Se retiraron los explantes de tejido y se transfirieron a otra placa recubierta de colágeno respetando el resto de CEB.
Disgregación enzimática
Cuando las células recubrían más de la mitad de la superficie de crecimiento, a las 3 semanas, se disgregaron enzimáticamente. Se extrajo el medio de las placas y se lavaron con suero fisiológico estéril, con un 1% de penicilina-estreptomicina. Se añadieron 2 ml de la solución tripsina-EDTA (Biological Industries, Beit Haemek Kibbutz, Israel) por placa y se incubaron a 37 ºC durante 5 min. Para inhibir la acción de la tripsina, se añadieron 2 ml de suero fetal bovino (Biological Industries, Beit Haemek Kibbutz, Israel) y se centrifugó a 345 g durante 5 min. Se prepararon extensiones en duplicado para realizar la técnica immunocitoquímica. El resto se resuspendió en 2 ml de suero fisiológico estéril al 0,9% con un 1% de penicilina-estreptomicina. El recuento celular y la viabilidad se valoraron en 10 μl de esta suspensión con la utilización del colorante de exclusión azul de trípano al 0,4% (Sigma Chemical Co., St Louis, MO, EE.UU.) y la cámara de Neubauer.
Tinción inmunocitoquímica para citoqueratina 7
Se utilizaron el anticuerpo primario monoclonal de ratón anticitoqueratina 7 humana y el anticuerpo secundario de cabra antiinmunoglobulina G de ratón marcado con peroxidasa. La reacción química se realizó con el substrato 3,3'-diaminobenzidina para peroxidasa y se tiñó con hematoxilina de Harris para contrastar. El material para inmunocitoquímica se obtuvo de DAKO corporation (Carpinteria, CA, EE.UU.). Se calculó el porcentaje de células positivas para anticitoqueratina 7. Paralelamente, se realizó un bloque de parafina con epitelio bronquial sano y se tiñó por inmunohistoquímica para calcular el porcentaje de células epiteliales postivas para citoqueratina 7. El control negativo para citoqueratina 7 fueron cultivos con fibroblastos.
Análisis estadístico
En el análisis estadístico se utilizó el paquete informático Statistical Package for the Social Sciencies (SPSS®) versión 10.0 (1999). Se obtuvieron los valores medios para cada variable y su desviación estándar.
Resultados
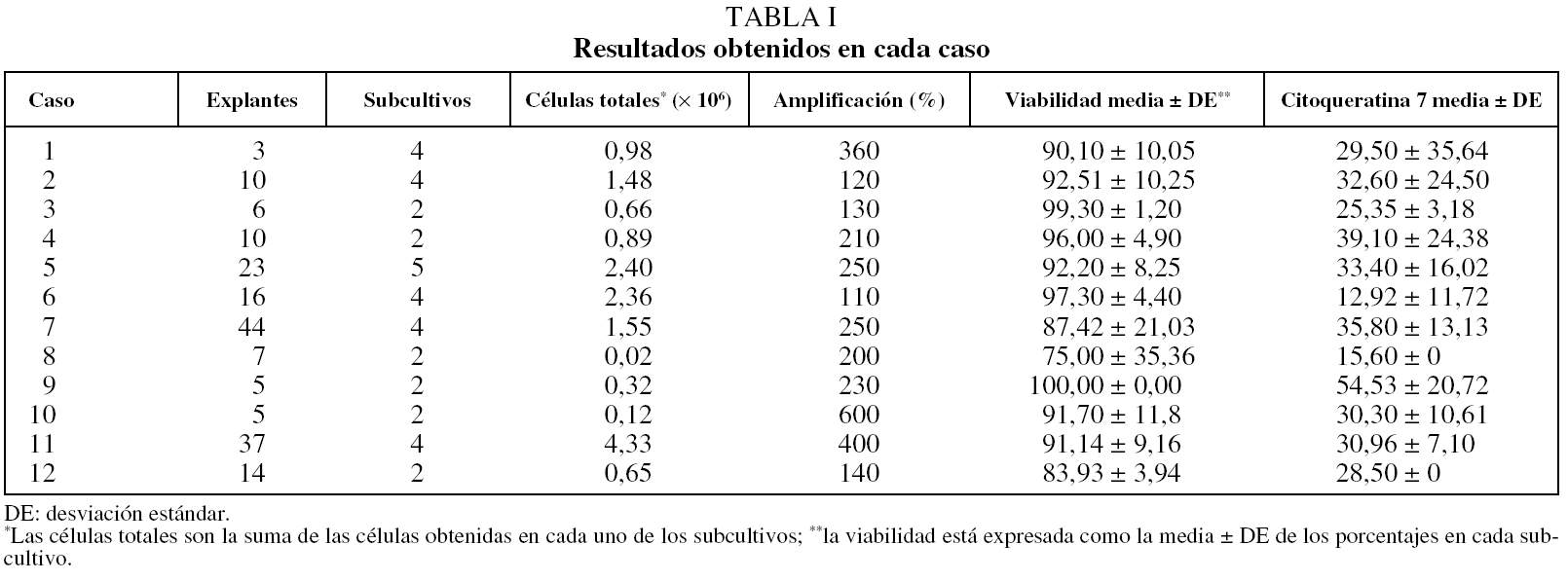
Se obtuvo un total de 12 muestras: 9 procedentes de cirugía torácica y 3 de broncoscopia. Del total de casos, había 11 varones y 1 mujer, y la edad media (± desviación estándar) era de 65 ± 12 años. Todos los sujetos eran fumadores o ex fumadores, con un volumen espiratorio forzado en el primer segundo medio del 70 ± 13% de su valor teórico, y 5 de ellos habían recibido quimioterapia. Los resultados, caso por caso, se describen en la tabla I.
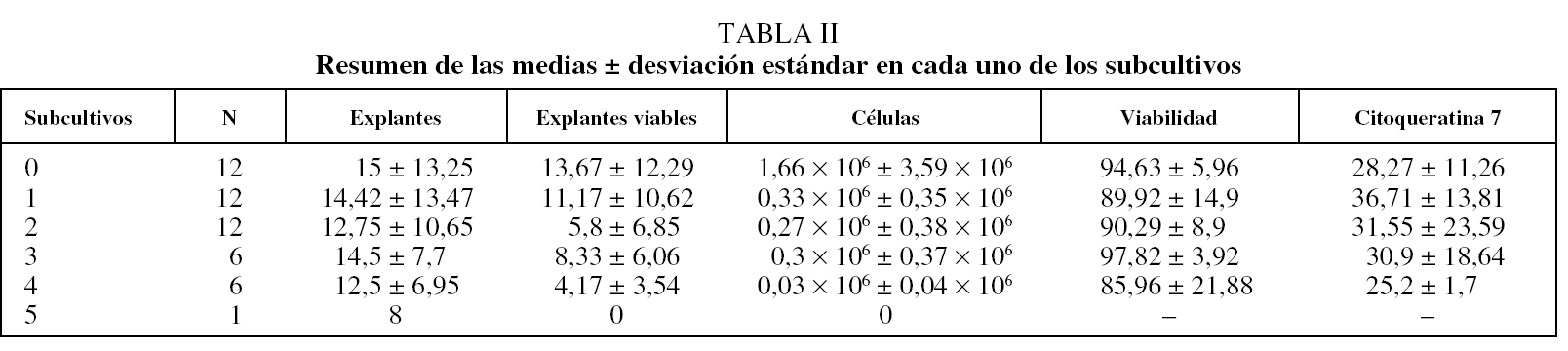
La media de explantes fue de 18,1 ± 14,0 procedentes de muestras obtenidas por resección quirúrgica y de 6 ± 1,2 procedentes de biopsia bronquial por broncoscopia. Los explantes de las muestras cultivadas se subcultivaron una media de 3,4 veces (entre 2 y 5 subcultivos). Los fragmentos procedentes de resección quirúrgica dieron mejores resultados que los procedentes de broncoscopia. En la tabla II se describen las medias por cada subcultivo.
La media en millones de CEB obtenidas después del procedimiento fue de 2,42 ± 4,08 (3,18 ± 4,5 en muestras de resección quirúrgica y 0,15 ± 2,2 en muestras de biopsia bronquial). La media del porcentaje de amplificación del número de CEB obtenidas de los cultivos primarios fue del 300 ± 143% (del 343% para los casos de biopsia bronquial y del 200% para los de resección quirúrgica). En el total de CEB se observó una viabilidad media del 91,9 ± 11,7%: del 92,1 ± 10,3% en los casos de resección quirúrgica y del 90,47 ± 18,9% en los de biopsia bronquial.
El rendimiento, definido como la obtención de un elevado número de CEB con alta viabilidad, varió durante los subcultivos, de modo que fue superior en los subcultivos iniciales, para disminuir a medida que el explante envejecía.
La técnica de inmunocitoquímica mostró una media del 30,7 ± 10,68% de células positivas para citoqueratina 7. La media del control positivo fue del 59,2%. Los subcultivos finales mostraron tendencia a incrementar ligeramente el número de células no positivas para citoqueratina 7.
Discusión
Aunque la técnica de cultivo ha sido expuesta previamente2, ésta es la primera vez que se utiliza para amplificar el número de CEB y, además, se describe de manera detallada. Esta amplificación permitiría realizar experimentos de mayor magnitud, además de incrementar el número de ensayos para cada una de las muestras, ya que el número de CEB obtenidas de los cultivos primarios es, de media, 3 veces mayor a las conseguidas de un simple cultivo. El mayor incremento de CEB se da en subcultivos iniciales y es menos acentuado en los finales. Aunque la viabilidad no varía a lo largo del proceso, hay una disminución en cuanto a la calidad de las células, reflejada en el descenso de la positividad para citoqueratina 7. Parece ser que las CEB procedentes de cirugía torácica y broncoscopia se comportarían igual en este aspecto. No ha sido así en cuanto al número de subcultivos. Una explicación a este fenómeno sería la escasez de muestra, que ha limitado el número de explantes cultivados. En este estudio, los resultados de las muestras procedentes de broncoscopia y cirugía son algo distintos, por lo que quizá no deberían mezclarse.
Existen diferentes protocolos, ya descritos en la bibliografía, para cultivar CEB: cultivo de órganos, cultivo de explantes y cultivo de células disociadas. En el cultivo de órganos, las CEB están acompañadas de otros tipos celulares no epiteliales como fibroblastos, células endoteliales, inflamatorias y musculares, que podrían interferir en algunos experimentos4. Varios autores prefieren disgregar enzimáticamente el tejido para aislar las CEB3. La disgregación enzimática podría causar cambios bioquímicos y morfológicos en las células que les impidieran diferenciarse y madurar correctamente hasta la forma final ciliada2.
Las CEB requieren un sustrato para permitir la adhesión celular al ser cultivadas. De las distintas técnicas de recubrimiento descritas en la bibliografía, en este estudio se ha utilizado el colágeno con el fin de incrementar la proliferación de CEB5. Existe controversia sobre la adición o no de suero al medio de cultivo. Jorissen et al4 observan que concentraciones elevadas de suero (10-20%) inhiben el crecimiento e inducen la diferenciación escamosa, pero la utilización de derivados séricos como NU-serum o Ultroser G permite el cultivo con éxito de células epiteliales nasales. La tinción inmunocitoquímica con anticitoqueratina 7 es una técnica de gran utilidad para caracterizar el origen celular de los cultivos. El epitelio traqueal humano normal expresa dicho polipéptido, que se ha estudiado en patología para discriminar entre tumores primarios y metastásicos en el pulmón6. También se ha descrito in vitro para caracterizar células epiteliales glandulares de cultivos y demostrar que las CEB pueden mantener una características morfológicas y bioquímicas similares a las encontradas in vivo7. En ese mismo estudio, el 39,8 ± 0,95% de las CEB cultivadas eran de tipo glandular, mientras que en nuestro estudio obtenemos una media del 30,71 ± 10,68%.
En conclusión, el método desarrollado en este estudio permite incrementar 3 veces como media el número de CEB humanas obtenidas en cultivos primarios. Este método posibilita la realización de estudios complejos y repetidos en los que se precise una mayor cantidad celular a partir de explantes de muestras de un mismo paciente obtenidas por broncoscopio y/o resección quirúrgica.
Agradecimientos
Los autores quieren expresar su gratitud al Dr. R.J. Sapsford por proporcionar detalles sobre métodos de cultivo y a los compañeros de Cirugía Torácica y Broncoscopia del Departamento de Neumología del Hospital de la Santa Creu i Sant Pau por aportar las muestras estudiadas.
Este estudio ha sido subvencionado en parte por Red-Respira-ISCIII-RTIC-03/11.