El presente artículo analiza el concepto de lesiones fibróticas inactivas de presumible origen tuberculoso (old healed tuberculosis), su definición por sus características radiológicas y la presencia de prueba de la tuberculina (TST) positiva. Se revisa el fundamento basado en la evidencia de la indicación de tratamiento de infección tuberculosa latente en estos casos, el riesgo de reactivación en la literatura antigua y reciente, así como los problemas que plantea el diagnóstico diferencial con la tuberculosis activa con bacteriología negativa. Se consideran los datos sobre prevalencia de lesiones fibróticas en la literatura reciente. Se analiza el posible papel de las técnicas de Interferon Gamma Release Assay (IGRA) versus TST, así como otras técnicas moleculares de detección antigénica en esputo que pueden ayudar a hacer el diagnóstico. Se analizan las actuales indicaciones de quimioprofilaxis, las diferentes opciones y se proponen algoritmos diagnósticos y terapéuticos basados en la estratificación del riesgo según la edad y otros factores, para manejar las lesiones radiológicas que plantean diagnóstico diferencial entre lesión fibrótica inactiva y tuberculosis pulmonar con bacteriología negativa.
This article analyzes the concept of inactive fibrotic lesions of presumed tuberculous origin (old healed tuberculosis), defined by radiological characteristics and a positive tuberculin skin test (TST), and we examine the evidence-based foundation for the indication of treatment of latent tuberculosis infection in these cases. We explore the risk of reactivation in older and recent literature, and the problems raised by the differential diagnosis with active tuberculosis with negative bacteriology. We also analyze data on the prevalence of fibrotic lesions in the recent literature. We examine the possible role of Interferon Gamma Release Assays (IGRAs) versus TST and other molecular antigen detection techniques in sputum that can aid in establishing the diagnosis and we discuss the current indications for chemoprophylaxis and the different options available. We propose diagnostic guidelines and therapeutic algorithms based on risk stratification by age and other factors in the management of radiological lesions that raise a differential diagnosis between fibrotic lesions and active pulmonary tuberculosis with negative bacteriology.
Las llamadas lesiones fibróticas (old healed tuberculosis) son un hallazgo frecuente en las radiografías de tórax y constituyen una indicación universalmente aceptada de tratamiento de la infección tuberculosa latente (TITL)1,2. No obstante, existe un importante vacío en la literatura reciente sobre estadísticas de TITL de lesiones fibróticas, remontándose los principales trabajos a los años sesenta del siglo pasado3,4 y otros posteriores de la International Union Against Tuberculosis (IUAT)5 y Styblo et al.6 en los años ochenta.
Las lesiones fibróticas se definen como imágenes de tamaño superior a 5mm compatibles con tuberculosis pulmonar (TP) antigua no tratada y en pacientes nunca diagnosticados previamente de TP. Son habitualmente descritas como «bien definidas», «radiológicamente densas», consistentes en nódulos, imágenes lineales sugestivas de fibrosis, con o sin retracción, y bronquiectasias en lóbulos superiores sin imágenes sugestivas de componente alveolar y/o cavitaciones. Pueden incluir el complejo primario calcificado, engrosamiento pleural localizado y/o pinzamiento del seno costofrénico aislado, si bien estos últimos son considerados de menor riesgo y son excluidos de algunas definiciones7,8.
La mayoría de autores exigen una prueba de la tuberculina (TST) con 5 o más milímetros de induración transversal1,5 para el diagnóstico de lesión fibrótica, aunque tanto la TST como los tests de Interferon Gamma Release Assay (IGRA) no tienen una sensibilidad del 100%9. Se ha descrito hasta un 23% de TP con bacteriología confirmada en nuestro medio con TST negativa (13% en la población sin ningún factor de riesgo, 60% en población portadora del VIH)10.
La estabilidad radiológica durante un año fue exigida como requisito para hacer el diagnóstico por la IUAT en 19825, si bien la American Thoracic Society (ATS) en 2003 consideraba suficiente un seguimiento de 3meses si los cultivos de esputo eran negativos y no existía clínica ni variación radiológica11.
Las imágenes radiológicas atribuibles a TP, ya conocida y/o tratada, no se consideran lesiones fibróticas, sino como «secuelas post-TP», si bien en ocasiones se traten ambos conceptos simultáneamente6,12, lo cual puede originar cierta confusión.
La importancia de las lesiones fibróticas reside en 3puntos:
- 1)
Condicionan un futuro riesgo de reactivación de la TP.
- 2)
Un diagnóstico erróneo de lesiones fibróticas puede enmascarar una TP activa con bacteriología negativa, con el riesgo de indicar TITL con monoterapia e inducir resistencias adquiridas, o dejar sin tratamiento a un enfermo. A la inversa, clasificar como enfermo a un portador de lesiones fibróticas conlleva exponer el paciente a toxicidad medicamentosa innecesaria.
- 3)
La radiología de las lesiones fibróticas no es patognomónica de tuberculosis y puede confundirse con otros procesos de diferente etiología que puedan presentarse con los mismos patrones radiológicos.
A continuación se explican estos 3aspectos en el texto.
Riesgo de reactivación de las lesiones fibróticasEl riesgo de reactivación tuberculosa en el estudio auspiciado por la IUAT publicado en 1982, con 28.000 participantes seguidos durante 5 años, fue del 0,286% anual, subdividido en 0,232 y 0,426% según se tratase de lesiones de superficie radiológica inferior o superior a 2cm2, respectivamente5. Styblo et al.6 encontraron una tasa de reactivación anual del 0,103% en 2.895 lesiones fibróticas seguidas durante 3años en Rotterdam en 1984. En estudios de los años setenta en Estados Unidos se refieren tasas de reactivación tan altas como del 0,9% anual en un estudio con 1.992casos y seguimiento de 5años4. Horsburgh13, en un metaanálisis publicado en 2004, analizaba los estudios de cohortes en EE.UU. desde 1949 a 2003, estratificando el riesgo de reactivación de sujetos TST positivos y encontraba para la old healed tuberculosis en el resto de la vida, riesgos desde 66% en menores de 5años con TST de 15mm o más, a 6% en mayores de 65años con TST entre 5 y 9mm. En un análisis posterior de las tasas de reactivación de la infección tuberculosa latente (ITL) en EE. UU. basado en casos de TP con confirmación bacteriológica y que no participaran en clusters por epidemiologia molecular (fueron atribuidos a reactivación endógena y no a transmisión reciente), el mismo autor concluía que las tasas de reactivación habían disminuido a causa de la práctica desaparición de los portadores de lesiones fibróticas en población autóctona14.
No tenemos datos directos de la prevalencia actual de lesiones fibróticas en nuestro país, no siendo extrapolables los de las fotoseriaciones masivas de la campaña de erradicación de la tuberculosis (1965-1973), en la que se halló una prevalencia de un 5% en la población general7, dada la evidente mejoría de la situación epidemiológica desde dicha época. No obstante, en colectivos de indigentes y otros usuarios de servicios sociales la prevalencia puede ser tan alta como del 13,8%15. Tampoco existen datos sistemáticos por países de la prevalencia de lesiones fibróticas en la población general a nivel global, sino datos parciales relativos a revisiones de colectivos. Por ejemplo, en un cribado radiológico de 13.379inmigrantes etíopes en Israel se encontraron 257 (1,9%) portadores de lesiones fibróticas, de los que 15 (5,8%) desarrollaron TP activa en el plazo de un año16. En un estudio publicado en la India entre 726trabajadores sanitarios, se sometió a cribado radiológico a 334, que fueron TST y/o IGRA positivos, hallando 169portadores de nódulos calcificados (23,2% del total) y 37 con otras lesiones compatibles con lesiones fibróticas (5% del total)12. Estas elevadas tasas han de ser relacionadas con la situación epidemiológica de dichos países, pues los datos parciales publicados sugieren que las lesiones fibróticas serían más prevalentes en zonas de alta endemia tuberculosa.
El riesgo de reactivación de unas lesiones fibróticas depende de una serie de factores:
- 1)
El riesgo depende de la antigüedad de las lesiones: disminuyó de manera progresiva en el grupo placebo no tratado al quinto año de seguimiento comparado con el primer año, en el estudio de la IUAT5.
- 2)
El riesgo de reactivación de las lesiones fibróticas en el resto de la vida disminuye sensiblemente con la edad13. Es más probable que sean antiguas en ancianos y, dada la reducida esperanza de vida, la posibilidad de reactivación es menor. Recíprocamente, en jóvenes, la posibilidad de que la lesión sea reciente, combinada con la mayor esperanza de vida, hace que el riesgo de reactivación sea mayor. En el caso de niños, es muy problemático el concepto de lesión fibrótica, pues no puede presuponerse la antigüedad de la lesión y, salvo casos muy concretos, se habrá de considerar como una TP activa y tratarla como tal.
- 3)
El diámetro de la induración de la TST determina mayor riesgo de enfermar, sobre todo si es superior a 15mm13.
- 4)
Si ha habido conversión reciente, y no hay radiología previa antigua, las posibilidades de que las imágenes correspondan a una TP activa son más altas; por otra parte, la conversión es un riesgo independiente por sí misma13,17,18.
- 5)
Cuanto más extensas son las lesiones, mayor carga bacilar puede atribuirse a la tuberculosis inicial, y hay correlación estadística entre la superficie radiológica de las mismas y el riesgo de reactivación5. Si existe cavitación, adenopatías no calcificadas y/o derrame pleural, aunque la bacteriología sea negativa, no debe aceptarse de entrada el diagnóstico de lesiones fibróticas por la elevada posibilidad de actividad tuberculosa.
- 6)
El contacto reciente es un predictor de mayor riesgo para TP activa, independientemente de que haya lesiones fibróticas o no en la radiografía de tórax13,17,18.
- 7)
Entre los factores de inmunodepresión, el VIH es el más importante para desarrollar TP2. Otros factores (trasplantados, tratamiento corticoideo, quimioterapia antineoplásica, diabetes, etc.) pueden tener fuerte relevancia clínica. Los tratamientos anti-TNF son el factor de riesgo más importante después del VIH para la reactivación de la ITL y conllevan la posibilidad de formas de tuberculosis diseminadas19. La inmunosupresión asociada a los trasplantes tiene fuerte relevancia clínica, dada la elevada morbimortalidad en caso de presentarse TP postrasplante. La presencia de lesiones fibróticas no tratadas en un donante, según algunas normativas, podría contraindicar el trasplante pulmonar20.
La indicación de TITL en pacientes sintomáticos o con factores de riesgo exige descartar previamente la TP activa y/u otras patologías por medio de la radiografía convencional y/o la tomografía computarizada (TC) torácica, la bacteriología de esputo espontáneo, esputo inducido, o broncofibroscopia con broncoaspirado y lavado broncoalveolar (BAL) para la detección de Mycobacterium tuberculosis (MTB). La TC torácica puede poner de manifiesto cavitaciones, adenopatías no calcificadas, derrame pleural u otras lesiones no visibles en la radiografía de tórax convencional, e incompatibles con el diagnóstico de lesión fibrótica. Es preceptivo antes de hacer el diagnóstico e indicar TITL, comprobar la estabilidad radiológica en un periodo mínimo de 3meses y esperar el resultado de los cultivos si hubiera expectoración u otras muestras en curso.
Una vez descartada razonablemente la actividad tuberculosa, las pautas de TITL aconsejadas por la ATS son 9meses de isoniazida (9H) o 4 meses de rifampicina (4R), esta última combinada o no con isoniazida1. La IUATLD en los años ochenta del siglo pasado establecía 12meses de isoniazida (12H) como gold standard5. Posteriormente la ATS rebajó la duración a 9meses basándose en consideraciones de tipo analítico sobre los datos de los trabajos originarios1,21. Existen trabajos con la pauta de 4meses con H más R (4HR) que demuestran una efectividad no inferior a la pauta clásica 12H22. Dicha pauta tiene la enorme ventaja de disminuir la posibilidad de aparición de resistencias adquiridas en caso de una TP activa no detectada, además de tener mejor cumplimiento y similar tolerancia.
Interferon Gamma Release Assay y otras técnicas en lesiones fibróticasExiste una escasa experiencia del valor de los IGRA en lesiones fibróticas, si bien se puede considerar su mayor utilidad en relación al TST por la mayor especificidad y probablemente sensibilidad, ya que no estarían tan influidos por la edad, la vacunación con BCG y la inmunodepresión23. Recientemente se ha reportado un 16% de negatividad de TST combinado con IGRA en 193portadores de lesiones fibróticas con tasas de positividad del 54,6 y del 77,7, respectivamente, con concordancia baja (K=0,25). La recomendación de utilización de IGRA o TST en lesiones fibróticas no está tipificada, aunque extrapolando del manejo en pacientes de alto riesgo, probablemente la más correcta sea practicar ambas y considerar la existencia de ITL si alguna es positiva24. Siguiendo este criterio, si el TST es positivo no sería imprescindible practicar el IGRA, que quedaría relegado a los casos TST negativos.
Se acepta que los IGRA no pueden utilizarse para diagnosticar TP activa, sino como un indicativo de ITL23. No obstante, en un estudio del Tuberculosis Network European Trialsgroup25 se ha comunicado la utilidad de los IGRA en el BAL para el diagnóstico de las TP con bacteriología negativa. En dicho estudio, de 347pacientes con radiología compatible con TP y bacteriología negativa de esputo (o ausencia de muestra), se practicó BAL en 228 para determinar M.tuberculosis-specific Elispott (T- SPOT. TB test) y amplificación de ácidos nucleicos de M.tuberculosis (NAAT) en BAL, aparte de los cultivos convencionales para MTB. En total se hallaron 71casos de TP activa (56,3% de ellos con cultivo positivo) para MTB con un valor predictivo positivo (VPP) del Elispot en BAL del 87,2% y valor predictivo negativo (VPN) del 79,9% en TP confirmadas. Si se consideraban las TP diagnosticadas tanto por cultivo como por criterio clínico-radiológico, el VPP resultó del 90% y el VPN del 83%. Así mismo, la ratio de linfocitos activados frente a ESAT-6 y CFP-10 entre Elispot en BAL y sangre estaba aumentada en las TP activas frente a las inactivas. Dichos resultados no se afectaron con el antecedente de TP anterior. Esto coincide con otras publicaciones recientes26, si bien en un estudio de IGRA en BAL de portadores del VIH, al igual que sucede con la determinación en sangre26, se reportó menor sensibilidad y especificidad, debido a la mayor proporción de resultados indeterminados27. La NAAT en esputo ha sido utilizada como método de diagnóstico precoz, tanto en TP con baciloscopia positiva como negativa, con sensibilidad del 79,3% y especificidad de 80,3% en este último caso28. El CDC reporta una sensibilidad entre el 50 y el 80% según estudios en los casos con baciloscopia negativa y cultivo positivo, y describe que en el 20 al 50% de casos, cuando se utiliza la técnica de forma habitual, esta podría condicionar la decisión clínica29. Así mismo, el Xpert® MTB/RIF ha sido utilizado para detectar precozmente TP activas con baciloscopia inicial negativa con una sensibilidad del 75% y una especificidad del 99% en los casos solo con cultivos positivos30. Dichas técnicas pueden ayudar a diferenciar lesiones fibróticas de una TP activa de forma precoz, pero su papel en la práctica clínica habitual, no está definido y el gold standard del diagnóstico de TP sigue siendo el cultivo positivo a MTB.
Orientación diagnóstica y terapéuticaEl diagnóstico diferencial de las lesiones fibróticas incluye todos los procesos pulmonares que pueden cursar con radiología similar a la TP (micobacterias no tuberculosas, histoplasmosis, nocardiosis, coccidiomicosis, fibrosis posneumonía, bronquiectasias de lóbulos superiores, enfermedades intersticiales, sarcoidosis, granulomatosis diversas), y por supuesto, obviamente, la TP activa. La positividad de TST y/o IGRA apoya la etiología tuberculosa pero no es, ni mucho menos, diagnóstica. El mismo debe hacerse por exclusión de otras patologías, después de cuidadosa evaluación clínica y de exploraciones complementarias adecuadas teniendo en cuenta el riesgo relativo de tuberculosis (pertenencia a colectivos de riesgo, inmigrantes de países de alta endemia, contactos de enfermos tuberculosos, inmunodeprimidos), de otras patologías pulmonares y las características típicas de la radiología.
Una vez excluidas razonablemente otras patologías, las posibilidades de actuación, si hay síntomas clínicos sugestivos de actividad tuberculosa, son varias:
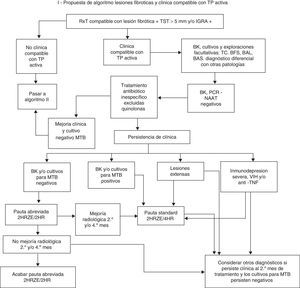
La primera, iniciar tratamiento estándar (2HRZE/4HR) si la baciloscopia inicial es positiva. En los casos en que la baciloscopia inicial sea negativa, la OMS en sus algoritmos de 2007 y 2009 aconseja administrar tratamiento antibiótico inespecífico (excluidas quinolonas para evitar inducción de resistencias del MTB) y valorar la evolución en espera de los cultivos31,32. En los casos en que la radiología sea altamente sugestiva, sean de baja probabilidad otros diagnósticos y no esté claro si se trata de una lesión fibrótica o una TP activa, es preferible iniciar tratamiento estándar con 2HRZE, evaluar el caso a los 2meses y, si los cultivos de esputo son negativos, existe estabilidad radiológica y no hay factores de riesgo, acabar 2meses más con H y R (4meses en total) etiquetando el caso de lesión fibrótica si la radiografía final del 4.°mes permanece inmodificada. La ATS acepta la pauta abreviada de 4meses para tratamiento de TP activa con cultivo negativo11,33, incluso si ha habido mejoría radiológica. De hecho, aconseja re-evaluar el diagnóstico de TP al segundo mes si no hay mejoría radiológica. No obstante, otros programas indican que si ha habido mejoría radiológica en el 2.° y/o 4.°mes, o bien hay otros factores añadidos (lesiones cavitadas y/o extensas, edad juvenil inmunodepresión, etc.), se debe completar la pauta completa de 6meses (2HRZE/4HR) y se debe considerar el caso como una TP activa con bacteriología negativa34, postura que parece más recomendable, dada la falta de estudios controlados (fig. 1).
Propuesta de algoritmo de actuación en lesiones fibróticas y clínica compatible con TP activa.
BAL: lavado broncoalveolar; BAS: broncoaspirado; BFS: broncofibroscopia; BK: baciloscopia de esputo; IGRA: Interferon Gamma Release Assay; MTB: Mycobacterium tuberculosis; NAAT: Nucleic Acid Amplification Test; PCR: Reacción en cadena de la polimerasa; RxT: radiografia de tórax; TC: tomografía computarizada de tórax; TP: tuberculosis pulmonar; TST: Tuberculin Skin Test.
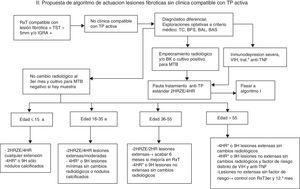
En ausencia de clínica sugestiva de actividad tuberculosa es preceptivo realizar control radiológico pasados 3meses (1 y 3meses en caso de lesiones extensas), en espera de los cultivos si existe muestra (fig. 2). Si no hay cambios radiológicos ni imágenes incompatibles y los cultivos son negativos o no hay muestra, puede razonablemente hacerse el diagnóstico de lesión fibrótica inactiva. Si bien no existe evidencia basada en estudios controlados que diferencien la conducta a seguir en este caso, ya que todas las normativas recogen la indicación de TITL sin más y sin limitaciones, es obvio que el riesgo es muy diferente según los factores asociados (edad, extensión de las lesiones, inmunodepresión, etc.). En todo caso, hay que valorar el balance beneficio/riesgo entre posible reactivación y toxicidad medicamentosa, evitando siempre dar TITL a una posible TP activa. Por dicho motivo, en el presente trabajo se propone una pauta basada en la estratificación de riesgo de reactivación de las lesiones fibróticas por el resto de la vida y por grupos etarios comunicadas por Horbsburg (tabla 1), y la existencia de otros factores de riesgo:
- A)
Para el grupo de edad >55años, dado el mayor riesgo de hepatotoxicidad y menor riesgo de enfermar, se puede aconsejar TITL con la pauta 4HR o 9H en lesiones extensas sin sospecha de actividad. Valorar así mismo TITL 4HR o 9H en lesiones poco extensas si hay factores de riesgo distintos del VIH, tratamiento anti-TNF o trasplantados. Si no hay factores de riesgo y las lesiones son poco extensas, se puede indicar seguimiento clínico-radiológico a los 3 y 12meses.
- B)
Para el grupo de edad entre 36-55años se puede indicar TITL con 4HR o 9H si son lesiones poco extensas sin sospecha de actividad. Si se trata de lesiones extensas, se puede indicar pauta abreviada 2HRZE/2HR, y si hay mejoría radiológica al 2.° y 4.°mes, prolongar pauta hasta 6 meses
- C)
En el grupo de edad de menores de 36años es más prudente considerar a efectos prácticos las supuestas lesiones fibróticas, como una TP de adquisición reciente, e iniciar pauta estándar 2HRZE/4HR. Excepcionalmente, si se trata de lesiones mínimas o nódulos calcificados sin variación radiológica, se puede indicar TITL con 4HR o 9H.
- D)
En niños menores de 15años es muy dudoso que deba aceptarse el concepto de lesión fibrótica inactiva, aunque se trate de lesiones mínimas, y es preferible indicar pauta estándar 2HRZE/4HR, reservando la TITL 4HR o 9H únicamente para los nódulos calcificados.
Propuesta de algoritmo de actuación en lesiones fibróticas sin clínica compatible con TP activa.
*4HR: pauta de elección dado el menor riesgo de inducción de resistencias si no se ha clasificado correctamente el paciente y es portador de una TP activa con bacteriología negativa.
BAL: lavado broncoalveolar; BAS: broncoaspirado; BFS: broncofibroscopia; BK: baciloscopia de esputo; IGRA: Interferon Gamma Release Assay; MTB: Mycobacterium tuberculosis; NAAT: Nucleic Acid Amplification Test; PCR: reacción en cadena de la polimerasa; RxT: radiografia de tórax; TC: tomografía computarizada de tórax; TP: tuberculosis pulmonar; TST: Tuberculin Skin Test.
Riesgo de desarrollar TP activa en el resto de su vida en portadores de lesiones fibróticas en porcentaje (95% intervalo de confianza) según diámetro de induración de la reacción tuberculínica
| Edad (años) | 5-9mm induración | 10-14mm induración | ≥ 15mm induración |
| 0-5 | 16 (6-45) | 53 (22-100) | 66 (34-100) |
| 6-15 | 11 (5-25) | 20 (10-44) | 37 (21-67) |
| 16-25 | 29 (7-100) | 35 (12-100) | 44 (15-100) |
| 26-35 | 25 (6-100) | 31 (10-93) | 39 (14-100) |
| 36-45 | 12 (3-50) | 17 (6-50) | 21 (8-57) |
| 46-55 | 10 (3-40) | 14 (5-40) | 17 (6-46) |
| 56-65 | 8 (2-26) | 11 (4-29) | 13 (5-33) |
| ≥ 66 | 6 (2-19) | 8 (3-20) | 9 (4-24) |
Fuente: Datos procedentes de C. Robert Horsburgh13.
En paciente VIH positivos, en receptores de tratamientos biológicos con anti-TNF de cualquier edad e inmunodeprimidos (trasplantes en tratamiento inmunosupresor, quimioterapia antineoplásica, etc.) no parece prudente aceptar el diagnóstico de lesión fibrótica y es preferible administrar pauta estándar 2HRZE/4HR, dado su elevadísimo riesgo de reactivación. Algunos programas de tuberculosis exigen notificar el motivo de la no iniciación de pauta estándar cuando hay radiología compatible con TP34, debiendo justificar la indicación de quimioprofilaxis, sobre todo en pauta de monoterapia (9H, 12H, 4R). Si se sospechan resistencias bacterianas (contacto reciente con enfermo resistente u otras circunstancias), es preferible o bien iniciar tratamiento completo adecuado al perfil de resistencias sospechadas en pacientes de alto riesgo (niños, inmunodeprimidos, etc.), o bien no dar tratamiento y hacer control clínico-radiológico en el resto.
ConclusiónLa práctica habitual en nuestro medio frente a las lesiones fibróticas es o bien tratarlas como una TP activa y dar tratamiento estándar 2HRZE/4HR, o bien ninguna actuación (a lo sumo seguimiento clínico-radiológico). En muy raros casos se siguen las indicaciones de TITL basadas en los trabajos de hace 3 o más décadas, no encontrándose nuevas publicaciones sobre el tema prácticamente desde 1982. Es patente la necesidad de consensuar dichas indicaciones y adaptar las experiencias publicadas a la práctica clínica actual, teniendo en cuenta los factores de riesgo de reactivación tuberculosa y la posibilidad de confusión con una TP activa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directa o indirectamente con los contenidos del manuscrito.