Describir la experiencia de 10 años con la implantación de prótesis metálicas autoexpansibles (PMAE) Ultraflex™ bajo sedación, con el empleo de broncoscopia flexible para el tratamiento de las estenosis traqueobronquiales malignas en un centro de referencia terciario.
MétodosSe revisaron retrospectivamente las historias clínicas de todos los pacientes a los que se implantó una PMAE entre 1999 y 2009.
ResultadosSe llevó a cabo un análisis de los datos de 68 pacientes a los que se implantó una PMAE Ultraflex™ bajo sedación. Un total de 33 varones y 35 mujeres, de una media de edad de 67,9 años (rango: 35-94), presentaron manifestaciones clínicas consistentes en disnea/dificultad respiratoria (39 pacientes), estridor (16 pacientes) y hemoptisis/disnea (13 pacientes). La etiología de la estenosis fue la siguiente: cáncer de pulmón (46 pacientes), cáncer de esófago (14 pacientes) y otras enfermedades malignas (8 pacientes). La dosis media de midazolam administrada fue de 5mg (rango: 0-10mg). La tráquea fue la localización más frecuente de la implantación de la prótesis, seguida del bronquio principal derecho e izquierdo, respectivamente. Se utilizó laserterapia adyuvante en alguna fase en el 31% del total de casos y se usó quimioterapia y/o radioterapia en al menos el 64% de los pacientes con enfermedades malignas.
La hemoptisis y la migración de la prótesis fueron las complicaciones más frecuentes (5 y 4 pacientes, respectivamente). La media de tiempo de supervivencia en los pacientes con cáncer de pulmón no microcítico a los que se implantaron prótesis fue de 214 días (rango: 5-1.233 días), y la de los pacientes con cáncer esofágico fue de 70 días (rango: 12-249 días). La media de consumo de tabaco en paquetes-años en los individuos con cáncer de pulmón en los que fue necesaria la implantación de una prótesis fue de 37 (rango: 2-100).
ConclusiónLas prótesis Ultraflex proporcionan un tratamiento seguro y eficaz para los pacientes inoperables o con tumores inextirpables en los que no se dispone de ninguna otra terapia alternativa. Tienen un efecto inmediato que proporciona una acción beneficiosa a los pacientes, no solo por el alivio de los síntomas, sino también en algunos casos por la prolongación de la vida. Los datos de supervivencia no son peores que los presentados en otros estudios en los que se han utilizado variedades diferentes de prótesis y distintas técnicas de implantación, lo cual indica su eficacia a más largo plazo. Además, este análisis subraya la viabilidad de prestar este servicio de manera satisfactoria en una unidad respiratoria, sin necesidad de anestesia general.
To describe a 10-year experience of inserting Ultraflex™ self-expanding metal stents (SEMS) under sedation using flexible bronchoscopy for the treatment of malignant tracheobronchial stenosis in a tertiary referral centre.
MethodsMedical notes were retrospectively reviewed for all patients who underwent SEMS insertion between 1999 and 2009.
ResultsA data analysis of 68 patients who had Ultraflex™ SEMS inserted under sedation was completed. Thirty three males and 35 females with a mean age of 67.9 years (range 35-94) presented with features including dyspnea/respiratory distress (39 patients), stridor (16 patients) and hemoptysis/dyspnea (13 patients). Etiology of stenosis included lung cancer (46 patients) esophageal cancer (14 patients) and other malignancies (8 patients). Mean dose of midazolam administered was 5mg (range 0-10mg). The trachea was the most common site of stent insertion followed by the right and left main bronchus, respectively. Adjuvant laser therapy was applied at some stage in 31% of all cases, and chemotherapy and/or radiotherapy was administered to at least 64% of patients with malignant disease.
Hemoptysis and stent migration were the most frequent complications (5 and 4 patients, respectively). The mean survival time of stented non-small cell lung cancer (NSCLC) patients was 214 days (range 5-1233) and that of esophageal malignancy was 70 days (range 12-249). Mean pack-year history of individuals with lung cancer requiring stent insertion was 37 (range 2-100).
ConclusionUltraflex stents offer a safe and effective therapy for patients who are inoperable or unresectable that otherwise would have no alternative therapy. It has an immediate beneficial effect upon patients, not only through symptom relief but, in some, through prolongation of life. Survival data is no worse than other studies using different varieties of stents and insertion techniques indicating its longer-term efficacy. Moreover, this report highlights the feasibility of performing this procedure successfully in a respiratory unit, without the need for general anesthesia.
Cuando se produce una obstrucción de las vías aéreas centrales, los pacientes presentan distrés respiratorio tras horas o días de ahogo. Aunque la resección quirúrgica con reconstrucción es el tratamiento que constituye el patrón de referencia, en muchos pacientes no es posible la extirpación o hay comorbilidades importantes que impiden esta forma de tratamiento. La broncoscopia intervencionista con implantación de prótesis en las vías respiratorias es una forma alternativa de tratamiento que puede salvar la vida a estos pacientes.
Existen múltiples técnicas de broncoscopia intervencionista que facilitan una paliación de la obstrucción de las vías aéreas centrales. En general, la enfermedad benigna se trata con dilatación con balón, con o sin laserterapia1. La enfermedad maligna se trata con vaporización con láser, electrocauterio, braquiterapia, crioterapia, resección de la parte interna del tumor o terapia fotodinámica con o sin implantación de prótesis1. La implantación de prótesis en las vías aéreas tiene también una aplicación útil en las estenosis secundarias a una compresión extrínseca por un tumor, bocio, ganglios linfáticos o anomalías vasculares.
En nuestra unidad hemos utilizado la prótesis Ultraflex™. Se trata de una prótesis de nitinol (aleación de níquel y titanio) autoexpansible, que tiene una flexibilidad elástica superior a la del acero y responde mejor a tensiones como las producidas por la tos. La prótesis, que es resistente a la elongación longitudinal cuando se la comprime externamente, debido a su diseño en malla, es también más fácil de desplegar, adaptar o extraer que otras prótesis metálicas1–3. Describimos aquí nuestra experiencia en la implantación de este tipo de prótesis (recubierta o no) con el empleo de broncoscopia flexible y sedación, y resaltamos los efectos beneficiosos que aporta su uso en el manejo de las estenosis inoperables de las vías aéreas centrales.
Material y métodosEl departamento de medicina respiratoria del Northern General Hospital Sheffield ofrece una asistencia de referencia, de nivel terciario, para la evaluación y el manejo de los pacientes con estenosis traqueobronquial que no con candidatos quirúrgicos. Se revisaron todos los casos de implantación de prótesis metálicas autoexpansibles (PMAE) en nuestro departamento desde 1999. Se revisaron las historias clínicas, los informes de anatomía patológica y las hojas de informe de broncoscopia de cada paciente, con objeto de identificar datos clave como las características demográficas del paciente, la forma de presentación clínica, la indicación para la implantación de la prótesis, la localización y el tamaño de la prótesis, la dosis de sedante administrada, el uso de tratamiento adyuvante, las complicaciones iniciales y el tiempo de supervivencia.
En nuestra unidad se practicó primero a los pacientes una broncoscopia flexible para examinar la localización y el grado de la estenosis antes de la implantación de la prótesis. En todos los pacientes se utilizó una sedación intravenosa con midazolam y se aplicó a la faringe un aerosol de xilocaína tópica. Los pacientes recibieron oxígeno adicional mediante cánulas nasales (2-61/min) y se efectuó una monitorización de la saturación de oxígeno con el empleo de un oxímetro acoplado a una sonda digital. El broncoscopio de fibra óptica se introducía por la boca a través de un protector bucal y se colocaba por encima de la estenosis o la lesión obstructiva de la tráquea o el bronquio principal.
A continuación se introducía una guía flexible a través del canal de biopsia del broncoscopio y se empujaba hasta una posición distal a la región estenótica. Luego se retiraba el broncoscopio sobre la guía, que se mantenía cuidadosamente en posición dentro del árbol traqueobronquial. A continuación se volvía a introducir el broncoscopio por la boca y se colocaba proximalmente a la estenosis. El catéter de aplicación, que contenía la prótesis comprimida, se introducía sobre la guía hasta colocarlo en la zona de la estenosis. Una vez colocada, se liberaba la prótesis de su catéter de aplicación mediante la tracción del hilo de nylon y se ponía al descubierto la malla de nudos de forma circular a lo largo de toda la prótesis3. A continuación se retiraba el catéter del sistema de aplicación. El diámetro de la prótesis requerida se calculó utilizando las imágenes de la tomografía computarizada (TC) torácica previa a la broncoscopia. Se utilizó una terapia adyuvante, como la laserterapia, antes o después de la implantación de la prótesis, según fuera necesario.
La posición de la prótesis se verificó de forma inmediata mediante broncoscopia durante la intervención y mediante radiografía de tórax a las 24h. El ulterior seguimiento a intervalos regulares se llevó a cabo en nuestro centro.
ResultadosSe revisaron las historias clínicas de 68 pacientes (33 varones y 35 mujeres) de una media de edad de 67,9±12,7 años a los que se implantó una prótesis Ultraflex™ entre 1999 y 2009.
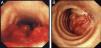
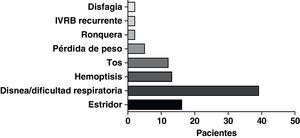
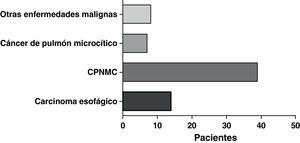
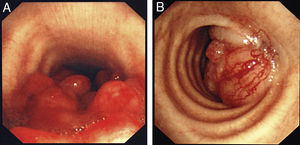
La forma de presentación más frecuente fue una de las siguientes manifestaciones: disnea/dificultad respiratoria (36 pacientes), estridor (15 pacientes) o hemoptisis/disnea (13 pacientes) (fig. 1). Todos los casos tenían una enfermedad inoperable. El estado funcional de la OMS fue de 0-2 en todos los casos, excepto 4 pacientes con un nivel 3 de la OMS. En la mayoría de los pacientes no se dispuso de información sobre el estadio, pero en los que sí la había, aproximadamente el 60% tenían metástasis tumorales en el momento de la implantación de la prótesis. El cáncer más frecuente responsable de la estenosis fue el cáncer de pulmón no microcítico (CPNMC) (39 pacientes), seguido del carcinoma espinocelular del esófago (14 pacientes), el cáncer de pulmón microcítico (CPMC) (7 pacientes) y un caso de cada una de otras varias enfermedades malignas (8 pacientes), como adenoma pleomórfico, mesotelioma, cáncer de tiroides, linfoma no hodgkiniano (LNH), carcinoide atípico, melanoma, cistocarcinoma adenoide y metástasis de adenocarcinoma intestinal (fig. 2). El aspecto broncoscópico correspondía a una compresión externa en 18 pacientes, 6 de los cuales tenían también una infiltración tumoral esofágica en las vías aéreas. En los demás pacientes había un crecimiento tumoral endoluminal lo suficientemente importante como para causar síntomas respiratorios (fig. 3). Aunque se midió y se comentó el grado exacto de afectación endoluminal en las sesiones clínicas multidisciplinares, en la revisión retrospectiva de las historias clínicas no dispusimos de esta información.
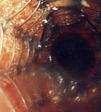
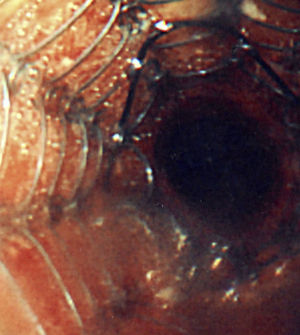
Se utilizó una amplia variedad de tamaños de la prótesis, de entre 2 y 8cm de longitud y de entre 8 y 20mm de anchura. El 94% de las prótesis fueron del tipo no recubierto (fig. 4) en vez de recubiertas.
Se utilizó una terapia adyuvante con láser en 21 pacientes (31%). En al menos 44 pacientes (64,7%) con enfermedades malignas se instauró un tratamiento con quimioterapia y/o radioterapia. Estos datos constituyen una infravaloración, puesto que no dispusimos de todos los datos de oncología, dado el carácter de centro de referencia terciario en el que se desarrolló nuestra participación.
Para la implantación de las prótesis, la media de dosis de midazolam utilizada en el curso de este análisis fue de 5mg (rango: 0-10mg). Tras el despliegue de la prótesis, se obtuvo una expansión satisfactoria con dilatación de la vía aérea en todos los casos. Los síntomas de los pacientes mejoraron inmediatamente después de la expansión de la prótesis en todos los casos (excepto los que experimentaron complicaciones tempranas; véase más adelante), sobre todo en cuanto a la disnea, el estridor y la dificultad respiratoria. Este efecto se puso claramente de manifiesto al preguntar a los pacientes tras la intervención, pero se evidenció también de forma objetiva en ellos por la mejora de las saturaciones de oxígeno en la oximetría.
La localización más frecuente de la implantación de la prótesis fue la tráquea (25 pacientes), seguida del bronquio principal derecho (22 pacientes) y el bronquio principal izquierdo (21 pacientes).
Las complicaciones consistieron en hemorragia originada en el lugar de implantación de la prótesis durante la propia implantación y que obligó a utilizar adrenalina local en un paciente, hemoptisis menor (5 pacientes), migración de la prótesis (4 pacientes), tejido de granulación de carácter grave (3 pacientes), neumonía (2 pacientes), odinofagia, insuficiencia respiratoria, oclusión de la prótesis y fallo del despliegue (un paciente en cada caso). No hubo ningún episodio de formación de fístulas, colapso lobular, neumotórax o muerte súbita.
La hemoptisis menor se resolvió espontáneamente, sin necesidad de otras intervenciones, en todos los casos. La migración de la prótesis se produjo en todos los casos en un plazo de 24h y requirió una nueva broncoscopia flexible para recolocarla. La formación de tejido de granulación de carácter grave requirió una nueva broncoscopia flexible y la ablación con láser de este tejido. Los casos de insuficiencia respiratoria y fallo del despliegue se abordaron inmediatamente en la misma sesión, con resultados satisfactorios. La oclusión de la prótesis por tejido de granulación requirió la extracción de la prótesis y su sustitución mediante broncoscopia rígida.
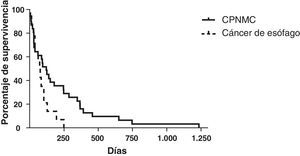
La supervivencia media de los pacientes con CPNMC tratados con implantación de prótesis fue de 214 días (rango: 5-1.233 días) (fig. 5). Los datos disponibles fueron limitados respecto a la supervivencia de los pacientes con carcinoma microcelular. Dos pacientes continuaban con vida (>5años), 2 pacientes tuvieron una supervivencia media de 101 días y no se dispuso de datos de los otros 3 pacientes, dado el carácter de referencia de nivel terciario. La supervivencia media de los pacientes con cáncer de esófago tratados con prótesis fue de 70 días (rango: 12-249 días).
Se documentaron antecedentes de tabaquismo en 40 de los 46 pacientes con cáncer de pulmón. La media de paquetes-año de tabaquismo en estos pacientes en los que fue necesaria la implantación de una prótesis era de 37 (rango: 2-100 paquetes-año).
DiscusiónNuestro análisis retrospectivo del uso de PMAE con broncoscopia flexible es el estudio más amplio en el que se ha analizado la implantación de prótesis de Ultraflex™ bajo sedación con broncoscopia flexible. En estudios previos se ha examinado el uso de broncoscopia rígida bajo anestesia general en este tipo de pacientes, o se han analizado PMAE diferentes como las Gianturco o Wallstent1,2,4–6.
Observamos que la presencia de disnea/dificultad respiratoria y estridor eran las manifestaciones más frecuentes en cuanto a la forma de presentación, y que se debe ser vigilante ante los pacientes con disnea grave inexplicada. Saad et al.6 observaron que los pacientes que atendieron para la implantación de una PMAE (Wallstent y Ultraflex) presentaban predominantemente disnea/dificultad respiratoria (53%), estridor (22%), o la combinación de ambos (19%).
Nuestro análisis puso de manifiesto que la etiología más frecuente de la estenosis de las vías aéreas era el CPNMC (39), seguido del cáncer de esófago (14) y el CPMC (7).
Husain et al.5, que describieron su experiencia en la implantación de PMAE Ultraflex en 66 pacientes con enfermedades benignas y malignas, indicaron también que el carcinoma no microcítico era el tipo de cáncer de pulmón diagnosticado con más frecuencia. Fue aproximadamente 12 veces más común que el CPMC (2 casos). Los cánceres de esófago fueron la causa en 8 de los casos que requirieron la implantación de prótesis. De igual modo, Wilson et al.4 observaron que el CPNMC se daba con una frecuencia casi 10 veces superior a la del cáncer microcítico en sus pacientes que necesitaron la implantación de prótesis.
La localización más frecuente de implantación de prótesis fue la tráquea (27 pacientes), seguida del bronquio principal derecho (25 pacientes) y el bronquio principal izquierdo (23 pacientes). Wilson et al.4 utilizaron PMAE Gianturco con broncoscopia flexible en pacientes con cáncer de pulmón e implantaron la mayor parte de las prótesis en la tráquea, seguida del árbol bronquial derecho e izquierdo. En cambio, Breitenbücher et al.2 implantaron prótesis Ultraflex en 60 pacientes con el empleo de broncoscopia rígida y anestesia general. Las prótesis se implantaron en la tráquea en 5 pacientes, y en el bronquio principal derecho (BPD) y el bronquio principal izquierdo (BPI) en 10 casos cada uno. Stockton et al.7 implantaron PMAE Gianturco con broncoscopia rígida en la tráquea en 47 de sus pacientes, y en los bronquios principales derecho e izquierdo en 43 y 38 pacientes, respectivamente. El tamaño de las prótesis implantadas en nuestros pacientes concuerda con el indicado en otros estudios con PMAE. Utilizamos principalmente prótesis sin recubrimiento que tienen ciertas ventajas respecto a las recubiertas, en cuanto al mantenimiento de la permeabilidad de las vías aéreas en las bifurcaciones y en cuanto a permitir la neoepitelización en la zona en la que la prótesis es incorporada por la capa epitelial a la vía aérea (facilitando una actividad mucociliar casi normal). Las prótesis con recubrimiento impiden el crecimiento del tumor en su interior, pero interrumpen el sistema mucociliar aumentando la acumulación de moco. También pueden ocluir los bronquios principales, por ejemplo si se implantan en la tráquea inferior/bronquio principal porque son necesarias allí o tras sufrir una migración (la migración es más fácil que con las prótesis sin recubrimiento). La mayor parte de las prótesis se implantaron antes de que hubiera una recomendación sobre el tipo de prótesis más apropiado para un determinado trastorno, por ejemplo la Declaración de la FDA de 2005 sobre el uso de PMAE en la enfermedad benigna5. Las prótesis con recubrimiento se utilizaron en mayor medida en los pacientes con cánceres esofágicos, sobre todo en los casos de formación de fístulas.
La dosis media de sedación fue de 5mg de midazolam, lo cual contrasta claramente con la anestesia general utilizada para la broncoscopia rígida. La dosis de sedante no se ha comentado en ningún estudio previo.
Cinco pacientes presentaron una hemoptisis menor como complicación de la implantación de la prótesis, y en otros 4 pacientes hubo una migración de esta. Se produjo una neumonía como complicación en 2 pacientes, con formación de tejido de granulación de carácter grave en 3 casos. Es importante señalar que fue necesaria muy poca intervención adicional en el conjunto de la población tratada. En un paciente que presentó una hemoptisis menor tras la intervención se utilizó adrenalina en el lugar de la hemorragia durante la implantación de la prótesis. No fue necesario ningún otro tratamiento para la hemoptisis menor, y el número de nuevas broncoscopias intervencionistas necesarias fue bajo (3 por tejido de granulación, 4 por migración de la prótesis). Fue precisa una broncoscopia rígida en un paciente con oclusión de la prótesis. La llevó a cabo el equipo cardiotorácico que está de guardia de manera permanente para cualquier complicación que pueda requerir una broncoscopia rígida.
Los pacientes que sobrevivieron durante más de 3 años no presentaron las fracturas de la prótesis que se han comentado en otra publicación5.
Estos datos indican que, globalmente, los pacientes continúan teniendo una buena calidad de vida tras el efecto beneficioso inmediato descrito tras la implantación de la prótesis. Estos efectos beneficiosos no se ven anulados por la necesidad de nuevas hospitalizaciones e intervenciones asociadas a las complicaciones conocidas de la implantación de prótesis, y parece claro que el uso de PMAE Ultraflex™ no aumenta la carga de tratamiento médico en comparación con otras PMAE, ni de hecho con las prótesis de silicona, según se describe aquí.
Se producen complicaciones mayores de manera asociada a la anestesia general necesaria para la broncoscopia rígida cuando se implantan prótesis de silicona o prótesis metálicas de otro tipo. Las prótesis de silicona tienen tasas de migración más altas que las descritas aquí y dan lugar a una interrupción mucociliar que conduce a la retención de secreciones (que se describe en hasta un 27% de los pacientes), infecciones respiratorias recurrentes y tos, que ciertamente deterioran la calidad de vida de los pacientes1.
Madden et al.3 implantaron prótesis Ultraflex bajo anestesia general mediante broncoscopia rígida, y las complicaciones observadas incluyeron halitosis (2 pacientes), retención de esputo y/o infección (5 pacientes) y formación de tejido de granulación (1 paciente). Saad et al.6 implantaron PMAE mediante broncoscopia rígida (20% Ultraflex) y observaron que la traqueobronquitis infecciosa era la complicación más frecuente (15,9%). La formación de granulomas obstructivos en el interior de la prótesis fue su segunda complicación más frecuente (12 de 82 pacientes, 14,6%). Sin embargo, la tasa variaba en función del trastorno subyacente. En caso de enfermedad pulmonar maligna, la formación de tejido de granulación se produjo tan solo en 2 pacientes (4%). Hubo también hemoptisis en 12 de los 82 pacientes, mientras que la migración de la prótesis se produjo en 4 de estos pacientes. Madden et al.8, en sus pacientes tratados con implantación de prótesis Ultraflex mediante broncoscopia rígida por una enfermedad benigna, observaron la formación de tejido de granulación en 11 de los 31 pacientes. Saad et al.6 observaron también una formación de tejido de granulación significativamente superior en los pacientes con enfermedades benignas que en los del grupo de enfermedades malignas (32% frente a 4%). Breitenbücher et al.2 implantaron PMAE Ultraflex mediante broncoscopia rígida en pacientes con enfermedades malignas y observaron una complicación de tapones de moco en el 8% de los casos, así como la migración de la prótesis, la formación de tejido de granulación y la reestenosis del tumor en el 5% de los casos cada una.
Globalmente, en comparación con las prótesis de silicona, las prótesis Ultraflex tienen una menor tasa de migración y de hemoptisis, pero con una tasa más elevada de formación de tejido de granulación2,9–11.
No observamos ningún episodio de neumotórax, colapso lobular o muerte operatoria, que sí se han descrito en otros estudios4,7.
Aunque los datos exactos de supervivencia de los pacientes con CPMC eran incompletos, la media de supervivencia en nuestro estudio para los 39 pacientes con CPNMC fue de 214 días (rango: 5-1.233 días). Breitenbücher et al.2 observaron un tiempo medio de supervivencia de 160 días en sus pacientes con cáncer de pulmón en los que se implantaron PMAE Ultraflex bajo anestesia general, aunque no indicaron el diagnóstico histológico. Wilson et al.4 señalaron que, de los 56 pacientes con cáncer de pulmón a los que implantaron prótesis Ultraflex bajo anestesia local, 5 continuaban con vida tras una media de 207 días (rango: 135-274) y 51 habían fallecido, con una supervivencia media de 77 días (rango: 1-477 días). Stockton et al.7 implantaron PMAE Gianturco mediante broncoscopia flexible en sus pacientes con cáncer de pulmón y observaron un tiempo medio de supervivencia de 142 días (rango: 1-2.571 días). En su estudio hubo una proporción más alta de pacientes con CPMC (25%) en comparación con la del nuestro (<10%). Es importante señalar que nuestra tasa de supervivencia (media: 214 días) fue similar o no inferior a la de otros estudios en los que se implantaron prótesis Dumon, Gianturco o Wallstents mediante broncoscopia rígida2,4,12–14, lo cual sugiere que nuestro servicio es como mínimo igual de seguro y efectivo en cuanto a la selección de los pacientes y los recursos necesarios.
La supervivencia en el cáncer de esófago fue de 70 días (rango: 12-249 días), lo cual puede compararse favorablemente con las cifras indicadas en otros estudios, casi todos ellos con el empleo de broncoscopia rígida y anestesia general15–19. Chan et al.18 y Belleguic et al.16 describieron una supervivencia media de 61 y 107 días, respectivamente, utilizando un tratamiento mediante broncoscopia rígida para las estenosis traqueobronquiales de causa esofágica. Takamori et al.17 son el único otro grupo que ha descrito específicamente el uso de PMAE en las estenosis traqueobronquiales de causa esofágica y han indicado una supervivencia media de 35 días en 10 de sus 12 pacientes. Mroz et al.15 presentaron el uso de PMAE con broncoscopia flexible en todos sus casos de obstrucción de vías aéreas centrales y observaron que el subgrupo de pacientes con cáncer de esófago tenía una supervivencia media de 27 días.
Evidentemente, la comparación de los datos de supervivencia con los de otros estudios resulta extremadamente difícil, puesto que hay variables como la carga tumoral, el estado funcional y las comorbilidades que no son comparables. No obstante, nuestros datos indican que los pacientes a los que se aplica esta intervención no evolucionan peor que los tratados con otras modalidades terapéuticas.
La media de paquetes-año de antecedentes de tabaquismo en los pacientes con cáncer de pulmón fue de 37. Este aspecto del análisis no ha sido comentado en ningún otro estudio.
Las limitaciones de este estudio son su carácter retrospectivo y la falta de una población de control y de datos más objetivos respecto a la calidad de vida/mejora de la función pulmonar. Por lo que respecta a un grupo control no tratado, creemos, como otros autores, que hay dificultades éticas importantes para disponer de un grupo control en estudios sobre la paliación de pacientes con una obstrucción de vías aéreas altas avanzada y con peligro para la vida5.
Nuestro estudio retrospectivo sobre el uso de PMAE Ultraflex con broncoscopia flexible es el más amplio sobre la implantación de PMAE Ultraflex mediante broncoscopia flexible para el tratamiento de las estenosis traqueobronquial inoperables de todas las causas, y resalta la importancia de ofrecer este servicio a los pacientes que padecen dificultad respiratoria y cuya enfermedad es inoperable. La implantación de estas prótesis bajo sedación en vez de anestesia general ha sido un avance para prestar este servicio a esos pacientes. La implantación de prótesis en las vías aéreas no sustituye a la resección traqueobronquial para la enfermedad benigna o maligna, pero sí aporta una paliación inmediata de los síntomas respiratorios y la dificultad respiratoria, con una mejora de la calidad de vida1.
Hay pocos grupos que hayan descrito los resultados de la implantación de prótesis Ultraflex específicamente bajo sedación mediante broncoscopia flexible, y creemos que su efecto inmediato aporta a los pacientes un efecto beneficioso no solo a través del alivio de los síntomas sino también mediante la prolongación de la vida. Además, este estudio resalta la viabilidad de prestar este servicio en una unidad de medicina respiratoria en vez de una unidad cardiotorácica, y en régimen ambulatorio, lo cual hace que sea mucho más accesible, dado que solamente el 6% de los neumólogos de Estados Unidos están capacitados para realizar broncoscopias rígidas y los programas de formación son escasos20,21.