El espectro de la proliferación de células neuroendocrinas pulmonares va de la hiperplasia reactiva al carcinoma de célula pequeña e incluye la hiperplasia difusa idiopática. Se describe un caso de hiperplasia difusa idiopática y se describen las características de dicha entidad según la evidencia publicada. Se trata de una entidad incluida por primera vez en la clasificación de tumores de la OMS en 1999 y considerada precursora de tumores carcinoides. Cursa con mayor frecuencia con disnea y tos, en general lentamente progresivas, obstrucción al flujo aéreo, nódulos pulmonares múltiples y signos radiológicos de atrapamiento aéreo, aunque se han descrito casos asintomáticos sin afectación funcional. Histológicamente se caracteriza por la proliferación de células neuroendocrinas en el epitelio de las vías respiratorias, en muchos casos más allá de la membrana basal formando tumorlets y tumores carcinoides, con frecuencia múltiples. Su pronóstico es favorable en la mayoría de los casos.
The spectrum of pulmonary neuroendocrine cell proliferation ranges from reactive hyperplasia to small cell carcinoma and includes diffuse idiopathic pulmonary neuroendocrine cell hyperplasia. A case is reported and features of this disease are described according to the published evidence. The entity was first included in the WHO classification of tumors in 1999 and is considered a preneoplastic condition for carcinoid tumors. Patients generally report slowly progressive dyspnea and cough, and have airflow obstruction, multiple pulmonary nodules and/or radiological signs of air trapping, although asymptomatic cases with normal pulmonary function have been described. Histologically, it is characterized by neuroendocrine cell proliferation in the airway epithelium, in most cases beyond the basal membrane forming tumorlets and carcinoid tumors that are frequently multiple. The prognosis is favorable in most cases.
El espectro de la proliferación celular con diferenciación neuroendocrina (NE) va de la hiperplasia de células NE al carcinoma de célula pequeña1. El término anglosajón tumorlet designa al agregado de células NE con una morfología similar al tumor carcinoide y un diámetro menor de 5mm1. La hiperplasia difusa idiopática de células NE pulmonares (diffuse idiopathic pulmonary neuroendocrine cell hyperplasia, DIPNECH) es una entidad rara caracterizada por la hiperplasia generalizada y extensa de células NE en la vía aérea periférica sin proceso primario que lo justifique, y es considerada una entidad precursora de tumor carcinoide2. Se describe un caso con tumores carcinoides múltiples sincrónicos y la revisión a propósito del mismo.
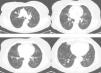
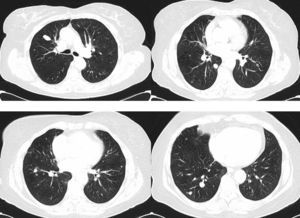
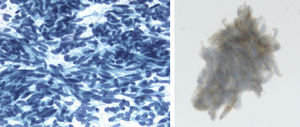
Observación clínicaMujer de 73 años sin antecedentes de interés. Una radiografía de tórax preoperatoria objetivó varios nódulos pulmonares. La paciente se encontraba asintomática. El hemograma y las determinaciones bioquímicas en suero y orina resultaron normales. La TAC torácica mostró múltiples nódulos pulmonares bilaterales de tamaño variable, entre 1 y 10mm, y 2 de mayor tamaño, uno de 20mm en el lóbulo superior derecho y otro de 12mm en el lóbulo inferior derecho (fig. 1). Las pruebas de función respiratoria resultaron normales. Un estudio para buscar un proceso neoplásico primario, que incluyó TAC abdominopélvica, valoración ginecológica y PET-TAC, resultó negativo. Endoscópicamente el árbol bronquial no presentó alteraciones significativas y los estudios citológicos y microbiológicos de las muestras broncoscópicas (aspirado y cepillado bronquiales, y lavado broncoalveolar) resultaron negativos. Se realizó una punción-aspiración del nódulo de mayor tamaño que mostró un tumor fusocelular de bajo grado nuclear e inmunofenotipo neuroendocrino (panqueratinas, cromogranina y CD56 positivos, y vimentina y S-100 negativos; fig. 2). Dada la multifocalidad de las lesiones se planteó el diagnóstico diferencial con metástasis de una neoplasia mesenquimal, melanoma o carcinosarcoma. Se realizó una biopsia por videotoracoscopia, que mostró 2 tumorlets carcinoides de 4 y 3mm de diámetro. Su estudio inmunohistoquímico reveló positividad para CD-56 y TTF-1, y el índice de proliferación celular (Ki67) resultó inferior al 2%. Por la multiplicidad del proceso se descartó un tratamiento quirúrgico, y el tratamiento quimioterápico tampoco se consideró adecuado teniendo en cuenta el índice de proliferación, por lo que se decidió una pauta de observación. A los 24meses se mantenía asintomática, con una función pulmonar normal, y los nódulos se mantenían en su mayoría estables, habiendo crecido mínimamente 2 de los de mayor tamaño (3 y 4mm).
Material de punción-aspiración con aguja fina (PAAF) fijado en alcohol y teñido con Papanicolaou. Frotis muy celular con abundantes células sueltas. Las células son monótonas con núcleos ovalados y redondos, regulares, de cromatina granular sin nucléolo. Estudio inmunocitoquímico: cromogranina positiva (citoplasmática y granular).
Las células NE se sitúan en la base de la mucosa bronquial y bronquiolar. El espectro de la proliferación de células NE va de la hiperplasia al carcinoma de célula pequeña (tabla 1)1. La hiperplasia de células NE se puede manifestar como una matriz lineal de células NE o formando acumulaciones de estas a lo largo del epitelio respiratorio. La proliferación puede sobrepasar la membrana basal formando agregados nodulares de células NE con una morfología similar a la del tumor carcinoide y un diámetro menor de 5mm que se denominan tumorlets. Las primeras descripciones de hiperplasia y tumorlets fueron hallazgos histológicos casuales en el estudio de piezas quirúrgicas obtenidas por diversas patologías pulmonares crónicas como el absceso, las bronquiectasias, la fibrosis quística, la tuberculosis e incluso la bronquitis crónica y el enfisema, por lo que se consideraban un proceso reactivo asociado a la regeneración de las vías áreas y alveolos dañados de forma crónica1,3,10. En 1992 Aguayo et al.3 describieron 6 pacientes sin antecedentes de consumo de tabaco, con las mismas características clínicas, radiológicas y funcionales y un sustrato histológico de hiperplasia generalizada de células NE. Consideraron que presentaban una entidad que denominaron DIPNECH. Basándose en gran medida en esta serie, pero también en otras descripciones posteriores4-6, la OMS la incluyó en la clasificación de tumores de 19997.
Espectro de las proliferaciones y neoplasias neuroendocrinas pulmonares
| Hiperplasia de células NE ytumorlets |
| Hiperplasia de células NE |
| Hiperplasia de células NE asociada a fibrosis y/o inflamación |
| Hiperplasia de células NE adyacente a tumores carcinoides |
| Hiperplasia difusa idiopática de células NE con o sin obstrucción y/o fibrosis de la vía aérea |
| Tumorlets |
| Tumores con morfología NE |
| Carcinoide típico |
| Carcinoide atípico |
| Carcinoma NE de célula grande |
| Carcinoma de célula pequeña |
| Carcinomas de célula no pequeña con diferenciación NE |
| Otros tumores con propiedades NE |
| Blastoma pulmonar |
| Tumor neuroectodérmico primitivo |
| Tumor de célula desmoplásica redonda |
| Carcinomas con fenotipo rabdoide |
| Paraganglioma |
NE: neuroendocrinas.Adaptado de Travis1.
La DIPNECH es más frecuente en mujeres. Davies et al.8 describieron una serie de 19 pacientes de los que 15 (79%) eran mujeres. Entre los 25 casos descritos en una búsqueda sistemática de casos realizada entre 2004 y 2010, 23 (92%) se dieron en mujeres9. La edad media de diagnóstico ronda los 60 años, con un rango amplio (22-79), y es más frecuente en pacientes sin antecedentes de tabaquismo3,6,8,9. Las características epidemiológicas del caso descrito, una mujer no fumadora de 73 años, se ajustan a estas descripciones.
Clínicamente se manifiesta con disnea, tos y sibilancias, con un tiempo de evolución variable, generalmente largo9. Puede existir un diagnóstico previo realizado años antes, con frecuencia asma bronquial10,11. La mayoría de los casos descritos presenta esta sintomatología, pero en la serie de Davies et al.8 10 de los 19 pacientes se encontraban asintomáticos. Con frecuencia existe obstrucción al flujo aéreo o una alteración mixta, pero no es raro que la función pulmonar sea normal8-10. Los nódulos pulmonares son la manifestación radiológica más frecuente, seguida por atenuación en vidrio deslustrado, patrón en mosaico por atrapamiento aéreo secundario a la bronquiolitis constrictiva producida por la hiperplasia, engrosamiento nodular de las paredes bronquiales y bronquiectasias12,13. En el caso descrito la paciente se encontraba asintomática, la función pulmonar era normal y la TAC mostraba numerosos nódulos pulmonares bilaterales, siendo la sospecha inicial metástasis de un primario desconocido. En la serie de Davies et al.8, de los 10 pacientes asintomáticos, 8 presentaban una neoplasia previa.
Histológicamente la DIPNECH se caracteriza por la proliferación generalizada de células individuales dispersas, pequeños nódulos (cuerpos NE) o proliferaciones lineales de células NE limitadas al epitelio bronquial y bronquiolar2. La mayoría de los casos requieren una biopsia quirúrgica para el diagnóstico, pero en presencia de un cuadro clínico, funcional y radiológico compatible, la presencia de hiperplasia de células NE en una biopsia transbronquial se podría considerar suficiente9. En las piezas de resección, algunas vías aéreas pueden aparecer normales y otras mínimamente alteradas y ectásicas, sin evidencia de hiperplasia de células NE en las secciones evaluadas, por lo que a veces la biopsia quirúrgica puede no mostrar evidencia de la hiperplasia de células NE9. En el caso descrito, además de los tumorlets, el parénquima pulmonar evaluado mostraba únicamente mínimas alteraciones y tapones mucosos (un hallazgo presente en más del 50% de la serie de Davies et al.8) sin otra evidencia de hiperplasia de células NE. Por otro lado, la diferenciación entre la proliferación reactiva de células NE, incluyendo su hallazgo casual, y la DIPNECH puede resultar difícil, al ser los hallazgos histológicos superponibles, pero una extensión difusa en una muestra tisular adecuada y/o la presencia de una función pulmonar alterada, evidencia de atrapamiento aéreo en la TAC y/o nódulos pulmonares múltiples, permitirían confirmar la DIPNECH1. Recientemente se han descrito diferencias en el perfil de expresión antigénica de las células NE de proliferaciones reactivas respecto al de la DIPNECH14.
La presencia de tumores carcinoides típicos en la DIPNECH es muy frecuente; en la serie de Davies et al.8, el 47%, y en la revisión de Nassar et al.9, el 40%. A la inversa, la presencia de hiperplasia de células NE y tumorlets en las piezas quirúrgicas de resección de tumores carcinoides es también frecuente. Miller et al. la encontraron en el 76% de una serie de 25 pacientes con un tumor carcinoide periférico resecado6, y Aubry et al.15 en el 77% de una de 28 pacientes con 2 y/o más tumorlets o tumores carcinoides resecados. Por todo ello, la OMS consideró la DIPNECH una entidad precursora de tumores carcinoides ya desde su inclusión en la clasificación de tumores en 19997, y trabajos posteriores lo apoyan16,17.
La evolución es en la mayoría de los casos favorable, con estabilidad clínica, funcional y radiológica durante años8,9. A pesar del mínimo crecimiento de 2 de los tumores, se puede considerar que el caso descrito se ha comportado de esta forma durante el seguimiento de 24 meses realizado hasta ahora. Se ha descrito la progresión en forma de obstrucción progresiva al flujo aéreo hasta la insuficiencia respiratoria4,8,18. También se ha descrito la metástasis, siendo esta última excepcional19.
A pesar de tratarse de un proceso proliferativo, no hay evidencia consistente que apoye el tratamiento quimioterápico. En los casos esporádicos en los que se ha usado, el resultado fue desfavorable3. En los pacientes con obstrucción al flujo aéreo las opciones terapéuticas se centran en un ensayo con esteroides, inhalados o sistémicos, y la opción más recomendable en pacientes asintomáticos con función pulmonar normal es la observación8,9. En caso de tumores carcinoides asociados se puede plantear la resección quirúrgica, y su pronóstico es similar al de tumores carcinoides solitarios resecados16.
En conclusión, la hiperplasia difusa idiopática de células NE pulmonares es una entidad rara que se está describiendo con mayor frecuencia recientemente. A pesar de que la mayoría de los casos descritos son pacientes sintomáticos con alteraciones en la función pulmonar, se debe también incluir en el diagnóstico diferencial de pacientes asintomáticos con función pulmonar normal y alteraciones radiológicas compatibles, especialmente si se trata de mujeres de mediana edad sin antecedentes de consumo de tabaco.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.