La granulomatosis eosinofílica con poliangeítis (GEPA) es una vasculitis sistémica de pequeños y medianos vasos, cuya patogénesis es todavía desconocida. Su prevalencia es de 10-13 casos por millón de habitantes. Se caracteriza por una variedad de anomalías clínicas y de laboratorio, y está asociada en un 40% a anticuerpos p-ANCA MPO1–4.
Los eosinófilos juegan un rol clave en la fisiopatogenia de esta enfermedad, a través de injuria tisular local, producto de liberación de sus proteínas granulares y de citoquinas que perpetúan la inflamación Th2, incluida la IL-5. La IL-5 estimula selectivamente el linaje de eosinófilos en la médula ósea, tiene rol central en la diferenciación, supervivencia y proliferación de eosinófilos periféricos, y promueve su adhesión al endotelio vascular4. El anticuerpo anti-IL-5 mepolizumab es una alternativa terapéutica, este bloquea la unión de la IL-5 con su receptor en el eosinófilo, disminuyendo la producción y supervivencia del mismo5–8. Mepolizumab demostró ser un tratamiento efectivo en pacientes con GEPA con dosis endovenosas de 750mg/mes7–9 y dosis subcutáneas de 300mg/mes5. Presentamos los casos de 3 pacientes con diagnóstico de GEPA que respondieron a mepolizumab en dosis subcutánea de 100mg/mes.
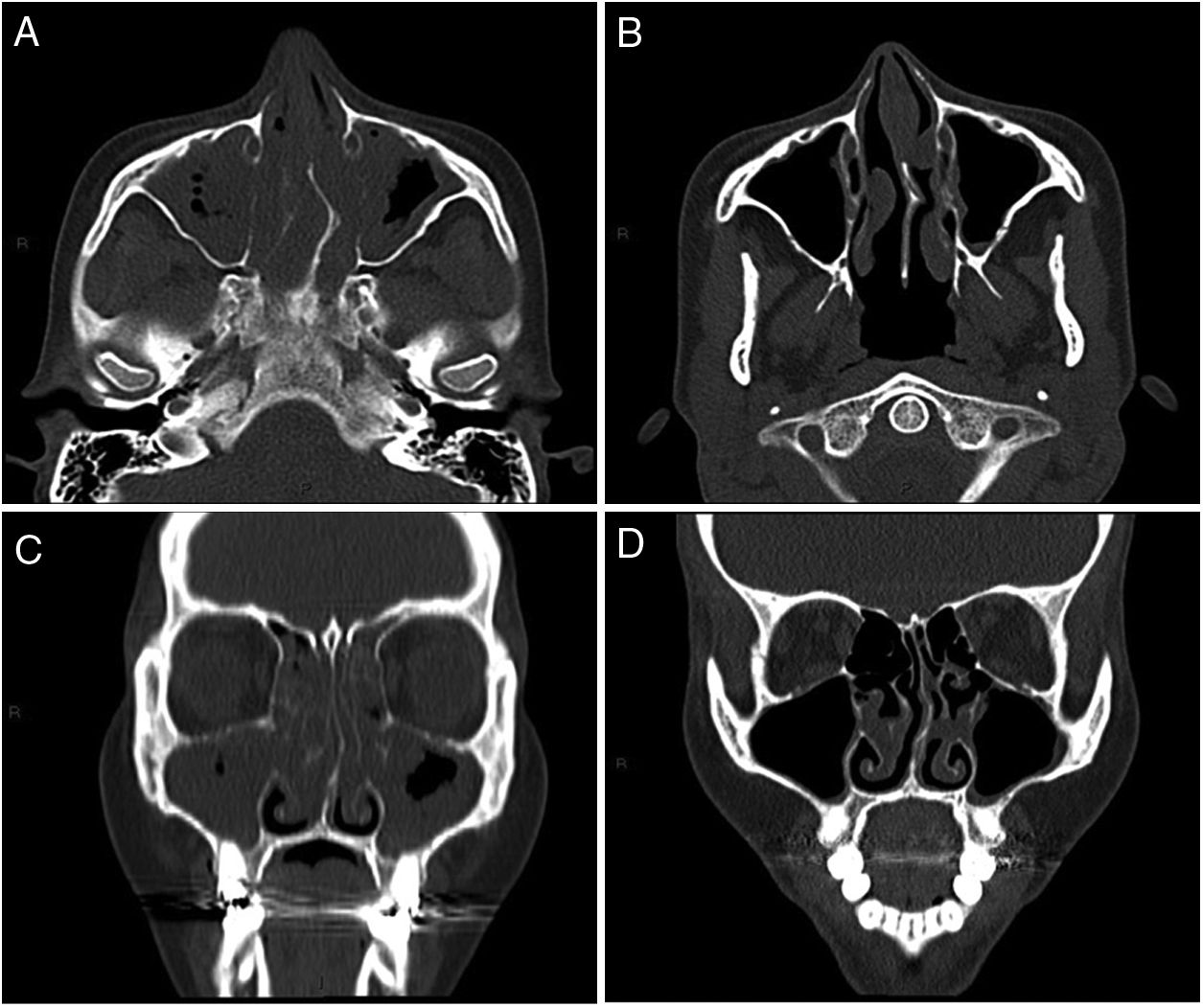
Mujer de 34 años con antecedente de pansinusitis y asma de difícil control. Desde el año 2006 (21 años de edad) presentó crisis frecuentes de broncoespasmos y consultas al servicio de urgencias, 2 internaciones en terapia intensiva. En el año 2011 fue internada por dolor abdominal agudo, en el laboratorio se evidenció eosinofilia periférica (518cél/mm3), elevación de IgE y p-ANCA MPO positivo. Se realizó biopsia endoscópica donde se observó gastroduodenitis eosinofílica. Se diagnosticó GEPA, y se inició tratamiento con meprednisona y azatioprina, el cual fue suspendido por osteonecrosis de ambas rodillas y leucopenia severa. Posteriormente fue tratada secuencialmente con ciclofosfamida, omalizumab y rituximab. Evolucionó con mal control del asma, pansinusitis persistente, vasculitis recurrente en piel, pérdida de peso y ascenso de eosinófilos (1.224cél/mm3). En agosto de 2016 inició tratamiento con mepolizumab 100mg/mes, con franca mejoría clínica, radiológica (fig. 1) y descenso de eosinófilos a 46cél/mm3, las cuales se sostienen hasta el momento.
Tomografía de senos paranasales, corte axial (A y B) y corte coronal (C y D). A y C) Pre-tratamiento con mepolizumab: desviación septal a izquierda. Marcado engrosamiento mucoso de ambos senos maxilares, celdillas etmoidales y ambas fosas nasales. Presencia de exudado a nivel de ambos senos maxilares. B y D) Después de 4 meses de tratamiento con mepolizumab: mínimo engrosamiento de los senos maxilares. Engrosamiento mucoso y formaciones polipoideas de ambas fosas nasales.
Mujer de 59 años con antecedentes de rinosinusitis crónica, angioedema hereditario y asma grave. En 2011 (a los 51 años de edad) fue controlada por fiebre, infiltrados pulmonares radiológicos y eosinofilia periférica (4.128cél/mm3), con ANCA negativo y buena respuesta a meprednisona. En 2013 fue hospitalizada por fiebre, infiltrados pulmonares, miocarditis y derrame pericárdico. Se sospechó GEPA y fue medicada con meprednisona y azatioprina. La paciente continuaba con mal control del asma, eosinofilia periférica, defecto obstructivo moderado en espirometría y leve reducción de la capacidad de difusión. En mayo de 2018 inició tratamiento con mepolizumab 100mg/mes, presentado mejoría sostenida clínica y funcional.
Mujer de 49 años con antecedente de rinosinusitis crónica y asma bronquial. En 2010 (a los 40 años de edad) fue controlada por fiebre y disnea, presentó infiltrados pulmonares alvéolo-intersticiales difusos, eosinofília periférica (1.802 eosinófilos), IgE elevada, con p-ANCA MPO positivo. Se diagnosticó GEPA y se medicó con meprednisona, con recaída al suspender esteroides sistémicos. Fue tratada secuencialmente con esteroides más azatioprina por 2 años, omalizumab durante un año y rituximab un año. La paciente continuó sintomática por lo que se inició tratamiento con mepolizumab 100mg/mes en septiembre de 2018. Presentó pronta y sostenida mejoría clínica y funcional respiratoria.
La GEPA es una vasculitis sistémica que compromete pequeños y medianos vasos, se asocia a asma en general de difícil control. Requiere tratamiento de inducción y mantenimiento con esteroides e inmunomoduladores, con frecuentes recaídas y potenciales efectos adversos graves. El anti-IL-5, mepolizumab, ha sido evaluado recientemente como una nueva alternativa terapéutica con resultados promisorios. En el ensayo de Wechsler et al.5, mepolizumab fue administrado a dosis de 300mg por vía subcutánea cada 4 semanas y se asoció con una menor frecuencia de recaídas y mayor tiempo acumulado en la remisión de la enfermedad que en el grupo placebo, permitiendo reducciones en la dosis de glucocorticoides.
El único estudio randomizado, placebo controlado publicado5 utilizó dosis de mepolizumab de 300mg/mes en pacientes con GEPA, sin evaluar el efecto de dosis inferiores, no encontrando referencias que justifiquen esta dosis. Pouliquen et al.10 evaluaron la respuesta de los eosinófilos en sangre a dosis creciente de mepolizumab, evidenciando una inhibición máxima del 90% de los eosinófilos periféricos a las 12 semanas con dosis subcutánea de mepolizumab de 99mg.
Los 3 pacientes presentados fueron tratados con dosis subcutánea de 100mg/mes logrando disminución en el conteo de eosinófilos periféricos, con mejoría de las manifestaciones pulmonares y extrapulmonares, y permitiendo la retirada de esteroides sistémicos. Estos pacientes mantuvieron en su seguimiento la mejoría, no presentaron recaídas y no requirieron incremento de dosis.
Nuestra publicación es limitada en el número de pacientes, pero abre la posibilidad de utilizar inicialmente dosis menores de mepolizumab en pacientes con GEPA.