Introducción
Un mejor conocimiento de la fibrosis quística (FQ) ha determinado una mejoría sustancial en el pronóstico de esta enfermedad, de modo que la esperanza de vida de estos pacientes es algo superior a 30 años1. Sin embargo, el curso evolutivo de la enfermedad determina un deterioro grave e irreversible de la función pulmonar que condiciona una insuficiencia respiratoria grave, que es la causa más frecuente de mortalidad de estos pacientes. El trasplante pulmonar (TP) se ha consolidado como tratamiento de elección en estos casos2, con una supervivencia a los 5 años en torno al 60%3-5 y una mortalidad perioperatoria entre el 0 y el 10%3-8.
Los factores estudiados como condicionantes de la mortalidad perioperatoria son innumerables, aunque, en general, se han estudiado desde la perspectiva global del TP6. Es por ello que el objetivo de este trabajo ha sido estudiar la mortalidad perioperatoria y los factores que la condicionan en un grupo de pacientes sometidos a un TP por FQ.
Pacientes y métodos
Desde marzo de 1993 hasta junio de 2004 se ha trasplantado en el Servicio de Cirugía Torácica del Hospital Universitario La Fe de Valencia a 57 pacientes diagnosticados de FQ. Se han realizado 55 trasplantes bipulmonares secuenciales, uno cardiobipulmonar y uno hepatobipulmonar.
Se recogieron una serie de datos del donante --sexo, edad, causa de muerte cerebral, días de intubación, presión arterial de oxígeno (PaO2) con fracción inspiratoria de oxígeno (FiO2) del 100% y presión positiva al final de la espiración de 5 cmH2O--; del receptor --sexo, edad, índice de masa corporal (IMC), fracción de eyección del ventrículo derecho (FEVD) y fracción de eyección de ventrículo izquierdo (FEVI)--; del injerto pulmonar --utilización o no de una segunda perfusión por vía retrógrada en banco y tiempo de isquemia (min)--; de la técnica quirúrgica --utilización de circulación extracorpórea (CEC)--, y del postoperatorio inmediato --cociente PaO2/FiO2 al ingresar en la unidad de reanimación, a las 24, 48 y 72 h del implante, existencia o no de fracaso primario del injerto pulmonar (FPIP) y necesidad de reintervención.
Se ha considerado FPIP cuando el cociente de PaO2/FiO2 inspirado fue < 200 mmHg durante las primeras 72 h postimplante o si se precisó ventilación asistida durante más de 5 días debido a la disfunción primaria del pulmón y no por otras causas objetivadas que justificaran su disfunción.
Se consideró rango normal del IMC el comprendido9 entre 18,5-24,9 kg/m2. El punto de corte para definir la FEVD y la FEVI quedó establecido en el 45%10.
Se definió la mortalidad perioperatoria cuando el fallecimiento aconteció como consecuencia del acto anestésico-quirúrgico, independientemente de los días transcurridos.
La supervivencia se estimó mediante el método de Kaplan-Meier. Para determinar qué variables influyeron en la mortalidad perioperatoria se utilizó el modelo de regresión logística. En caso de que alguna variable entrara en regresión, se utilizó, dado lo escaso de la muestra, el test de la probabilidad exacta de Fisher.
Resultados
En cuanto a los donantes, 27 fueron varones y 30 mujeres. La edad media (± desviación estándar) fue de 26,6 ± 11 años (rango: 7-48). La causa de muerte fue por traumatismo craneoencefálico en 32 ocasiones, por accidente cerebrovascular en 22 y en 3 por otra causa. El tiempo medio de intubación fue de 2,4 ± 1,9 días (rango: 1-9). La media de PaO2 con FiO2 del 100% y presión positiva al final de la espiración de 5 cm fue de 480,1 ± 79,1 mmHg (rango: 357-640).
De los 57 pacientes trasplantados, 33 fueron varones y 24 mujeres. La edad media fue de 21,3 ± 8 años (rango: 9-56). La media del IMC fue de 17,7 ± 2,9 kg/m2 (rango: 10,9-24,5), 35 pacientes estaban por debajo de 18,5 kg/m2 y los restantes dentro de la normalidad. La media de la FEVD fue de 36,5 ± 6 (rango: 25-60) y 54 pacientes presentaron valores inferiores al 45%; la media de la FEVI fue de 56,2 ± 7,2 (rango: 40-75) y 4 pacientes tenían valores inferiores al 45%.
En 39 ocasiones se realizó una segunda perfusión pulmonar por vía retrógrada. El tiempo medio de isquemia del primer injerto fue de 210,5 ± 55,6 min (rango: 60-380) y del segundo injerto de 314,1 ± 63,8 min (rango: 150-500).
Precisaron de CEC durante el trasplante 27 pacientes (11 para la realización de ambos injertos y 16 para el implante del segundo pulmón). Hubo que reintervenir a 4 por hemotórax.
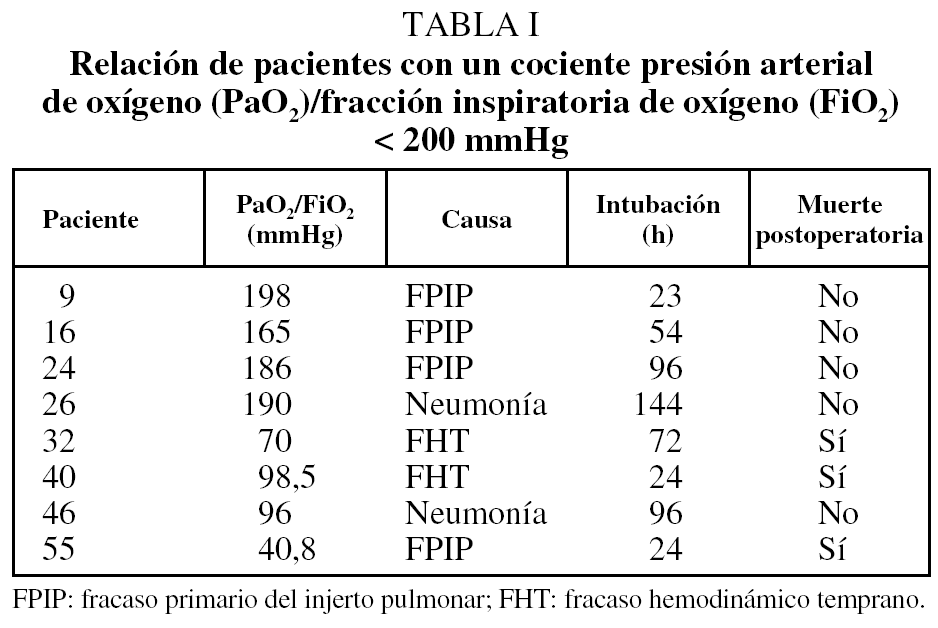
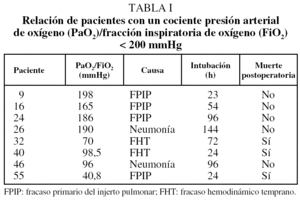
En 8 pacientes (14%) se objetivó un cociente de PaO2/FiO2 inspirado < 200 mmHg en el perioperatorio inmediato; 4 de ellos se catalogaron como FPIP, 2 por una neumonía y 2 por disfunción biventricular. Tres de estos pacientes fallecieron en el perioperatorio (tabla I).
La supervivencia fue del 83,7% al año del TP, del 77,3% al segundo año y del 66,9% al quinto año. Cinco pacientes (8,7%) fallecieron en el perioperatorio; los 3 ya comentados y 2 con un cociente PaO2/FiO2 > 200 mmHg, uno por un shock séptico por Pseudomonas cepacia y otro por un infarto cerebral masivo a los 34 días postrasplante.
Mediante el análisis de regresión logística, el cociente PaO2/FiO2 al ingresar en la unidad de reanimación fue la única variable que condicionó significativamente la mortalidad perioperatoria (p = 0, 0034), ya que de los 8 pacientes en los que se objetivó un cociente de PaO2/FiO2 menor de 200 mmHg, 3 fallecieron (test de Fisher, p = 0,0165).
Discusión
Si bien se ha cuestionado la realización del TP en determinadas enfermedades, en la FQ se ha afianzado como una opción adecuada dada la supervivencia obtenida, con una mortalidad perioperatoria asumible2.
En nuestra experiencia, tanto la supervivencia como la mortalidad perioperatoria están en el rango del registro de la Sociedad Internacional de Trasplante Cardíaco y Pulmonar3 y de otras series quirúrgicas4-8. La mortalidad perioperatoria tras un TP puede estar condicionada por innumerables factores. Sin embargo, la bibliografía existente trata el tema desde la perspectiva del TP en general6 y no hay trabajos dedicados exclusivamente a los pacientes trasplantados de FQ.
En nuestra experiencia, 5 pacientes (8,7%) fallecieron en el perioperatorio. Ninguna de las variables relacionadas con el donante, la preservación pulmonar, el receptor y el trasplante condicionó la mortalidad peri-operatoria. Ésta sólo estuvo relacionada con el cociente PaO2/FiO2 en el primer día del postoperatorio. Se ha comprobado que este hecho es un índice de predicción en la evolución inmediata del paciente trasplantado6,11,12. De los 8 pacientes que presentaron un cociente PaO2/ FiO2 < 200 mmHg, 3 fallecieron en el perioperatorio, mientras que de los 49 con un cociente ≥ 200 mmHg sólo 2 fallecieron en dicho período, uno debido a una sepsis y otro por un infarto cerebral.
El cociente PaO2/FiO2, consensuado como criterio para definir el distrés respiratorio del adulto13, lo utilizan diversos autores14-17 como indicador del FPIP, aunque puede alterarse también por otras causas18.
En nuestra serie, 4 pacientes presentaron un FPIP; uno falleció en las primeras 24 h postrasplante y a los 3 restantes se les pudo extubar en un intervalo comprendido entre las 23 y 96 h postrasplante, lo que pone de manifiesto la dificultad a la hora de definir este cuadro clínico y poder conocer con exactitud su incidencia19. Probablemente haya dos situaciones clínicas distintas. A algunos pacientes se les puede extubar tempranamente, por lo que la etiología podría obedecer a un aumento de la presión hidrostática una vez trasplantado el primer pulmón y obligar a que éste soporte todo el gasto cardíaco como consecuencia del pinzamiento de la arteria pulmonar contralateral para realizar el segundo implante20. Por el contrario, otros pacientes precisan de una intubación más prolongada, probablemente por lesiones de isquemia-reperfusión, resultado de la interacción de potentes mediadores y de distintos tipos celulares21 que determinan el fallecimiento de un porcentaje de pacientes no despreciable.
En 2 de nuestros pacientes que presentaron un mal intercambio de oxígeno se pudo objetivar una neumonía, lo que determinó un soporte ventilatorio por encima de las 72 h. En los 2 pacientes restantes que presentaron un cociente PaO2/FiO2 < 200 mmHg se comprobó un fracaso hemodinámico temprano, y ambos fallecieron. Se ha apuntado que el fallo cardíaco podría ser causa de mortalidad perioperatoria en estos pacientes7.
En la FQ no es infrecuente la hipertensión pulmonar (HTP). Como hemos comentado, un 94,7% de los pacientes de nuestra serie presentó una FEVD < 45%, algo superior a lo apuntado por otros autores10, lo que explicaría la necesidad de utilizar CEC con mayor frecuencia en el TP por FQ que en los TP por otras enfermedades (un 47,36% en nuestra experiencia). La incidencia de la HTP en la FQ está en torno al 30% de los pacientes que van a ser trasplantados y se ha podido comprobar que es un factor que condiciona la mortalidad en lista de espera, por lo que algunos autores22,23 consideran que se debe trasplantar a estos enfermos con carácter prioritario. El problema radica en que se trata de una HTP subclínica en un porcentaje importante de pacientes y que los estudios de ventriculografía isotópica no logran detectarla. Es por ello que algunos autores insisten en que estos pacientes precisan de un valoración cardiológica minuciosa mediante ecocardiografía y que, ante la mínima anomalía, se debería practicar un cateterismo cardíaco derecho24.
Sin embargo, los 2 pacientes de nuestra serie que fallecieron por fracaso cardíaco no tenían clínica previa de HTP y tanto las fracciones de eyección como la ecografía cardíaca fueron normales. Algún autor25 ha podido comprobar que en el TP no es infrecuente la existencia de graves alteraciones hemodinámicas que suelen determinar la muerte del paciente y que se han relacionado con determinados mediadores de la inflamación, como las interleucinas, y que serían también producto de las lesiones de isquemia-reperfusión.
A modo de conclusión, a diferencia de lo que ocurre en otras enfermedades respiratorias, el TP se ha consolidado como tratamiento en la FQ en fase avanzada, de acuerdo con los resultados obtenidos. En cuanto a la mortalidad perioperatoria, no hemos encontrado ningún factor de riesgo preoperatorio. Sólo el cociente PaO2/ FiO2 < 200 mmHg en las primeras horas postrasplante condicionó la mortalidad perioperatoria.