Introducción
Numerosos estudios han investigado la influencia de la utilización de hemoderivados en la supervivencia de los pacientes sometidos a distintos procedimientos quirúrgicos. Desde las primeras publicaciones1,2 que ponían de manifiesto un mejor pronóstico en los pacientes con trasplante renal sometidos a frecuentes transfusiones, se planteó como factor causal de este fenómeno la inmunodepresión provocada por estos productos. Este mismo efecto beneficioso podría, según este fundamento, ser contraproducente en otras enfermedades como el cáncer, donde se favorecería el crecimiento tumoral o el desarrollo de metástasis. Así, autores como Tartter et al3, al recoger los resultados obtenidos en el cáncer de colon y mama diseñaron estudios para analizar esta influencia en el carcinoma broncopulmonar. Desde entonces son múltiples los trabajos publicados con este mismo objetivo y, a pesar del tiempo transcurrido, siguen mostrando resultados dispares. Algunos demuestran una influencia desfavorable en el pronóstico del carcinoma broncopulmonar no anaplásico de células pequeñas (CBNACP) sometido a tratamiento quirúrgico3-8, mientras que otros no refieren variación alguna9-13.
El objetivo de este estudio es valorar la influencia en la supervivencia de nuestros pacientes tras el uso de estos procedimientos terapéuticos, limitándolo a los que se presentaron con una enfermedad en fase inicial y con mayor esperanza de vida, es decir, el estadio I del CBNACP.
Pacientes y métodos
En el período comprendido entre el 1 de enero de 1969 y el 31 de diciembre de 2000 se intervino en el Servicio de Cirugía Torácica del Hospital Universitario La Fe de Valencia a 856 pacientes afectados de un CBNACP con clasificación posquirúrgica de estadio I, según la normativa publicada por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) en 199814. Ningún paciente recibió tratamiento adyuvante a la cirugía. En esta serie no se incluyó a los pacientes cuyo fallecimiento se produjo en el período perioperatorio.
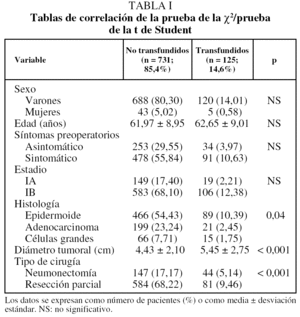
Se analizó, de forma retrospectiva, un conjunto de variables clinicopatológicas y cronológicas: sexo, edad, síntomas pre-operatorios, tiempo de evolución clínica preoperatoria, localización tumoral (central o periférica, izquierda o derecha y localización en el árbol bronquial), características de la resección quirúrgica (amplitud, exéresis parcial, típica o atípica), tipo histológico, grado de invasión y tamaño tumoral, unidades de hemoderivados transfundidas, fecha de intervención y fecha de muerte.
El procedimiento quirúrgico que se aplicó consistió en una resección anatómica pulmonar, siempre que no existiera limitación funcional. Se realizó una linfadenectomía a demanda en función de los hallazgos macroscópicos, y no se práctico una disección ganglionar sistemática. La clasificación histológica que se aplicó fue la que publicó la Organización Mundial de la Salud en 199915. No se realizaron autotransfusiones. Los hemoderivados utilizados fueron en forma de sangre completa o concentrado de hematíes, y los criterios de uso fueron los que definió la Comisión de Hemoterapia del hospital: a) antes de la intervención, en pacientes normovolémicos y con factores de alto riesgo cardiopulmonar o vascular para mantener una cifra de hemoglobina por encima de 8 g/dl; b) durante la intervención con la valoración de la volemia y los valores de hemoglobina en función de las pérdidas, estado hemodinámico y cifras iniciales de hemoglobina, y c) en el postoperatorio, en pacientes normovolémicos y sin evidencias de hemorragia activa, si los valores de hemoglobina eran inferiores a 7 g/dl, siempre y cuando no se asociaran factores de riesgo, edad superior a 70 años o síntomas clínicos evidentes de anemia.
El tiempo medio (± desviación estándar) de seguimiento de los pacientes fue de 17,39 ± 0,66 años, y el estudio finalizó el 31 de diciembre de 2003.
Análisis estadístico
El tratamiento estadístico de los datos comprendió una primera parte descriptiva y una segunda comparativa o inferencial. Se utilizaron el test de la χ2 y el test de la t de Student para correlacionar la variable transfusión con el resto. Se utilizó el método de Kaplan-Meier para la determinación de la probabilidad de supervivencia y las curvas se compararon mediante el test de rangos logarítmicos16. El modelo de Cox de riesgos proporcionales17 se empleó para el análisis multivariante, e incluyó sólo las variables que habían mostrado un nivel de significación p ≤ 0,1 en el análisis univariante.
Resultados
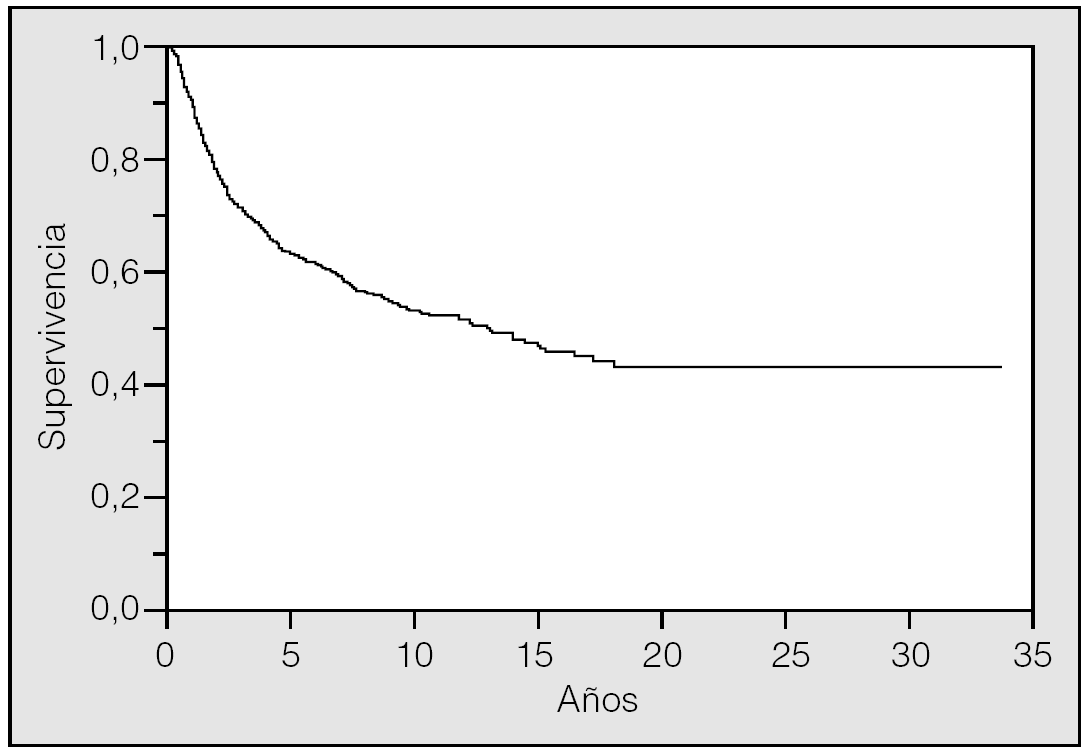
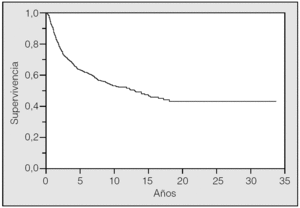
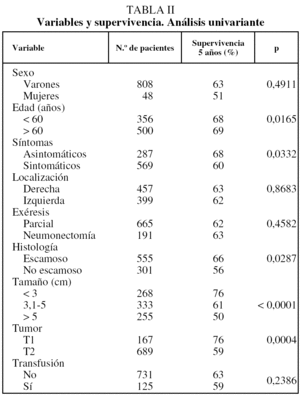
La supervivencia global de la serie fue del 63,35% a los 5 años y del 53,27 a los 10 (fig. 1). Eran varones 808 pacientes (94,4%) y 48 eran mujeres (5,6%). La edad media fue de 62,07 ± 8,95 años (rango: 30-87). En 287 ocasiones (33,5%) el tumor fue un hallazgo casual mientras que 569 (76,5%) presentaron síntomas. Precisaron de una neumonectomía 191 pacientes (22,3%) y 665 (77,7%) requirieron resección parcial. La estirpe histológica epidermoide se presentó en 555 ocasiones (64,8%) y la no epidermoide en 301 (220 adenocarcinomas y 81 de células grandes). El tamaño tumoral medio fue de 4,59 ± 2,23 cm (rango: 0,1-15).
Fig. 1. Supervivencia general de la serie.
De los 856 pacientes, requirieron el uso de hemoderivados 125 (14,6%). De ellos 26 recibieron una unidad, 54 recibieron 2 y 45 tres o más (media, 3,48 ± 4,65; rango: 1-35). La distribución y la significación estadística de los datos de las distintas variables analizadas en función de los 2 grupos de pacientes se muestran en la tabla I.
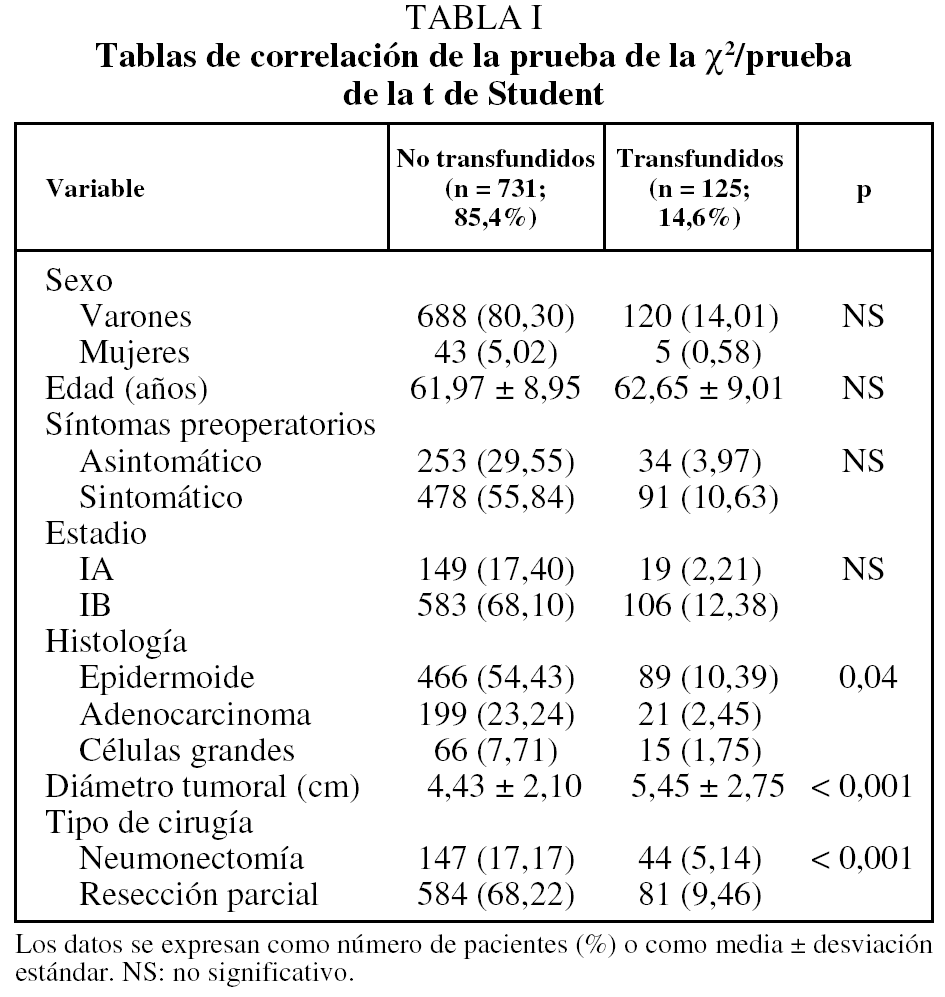
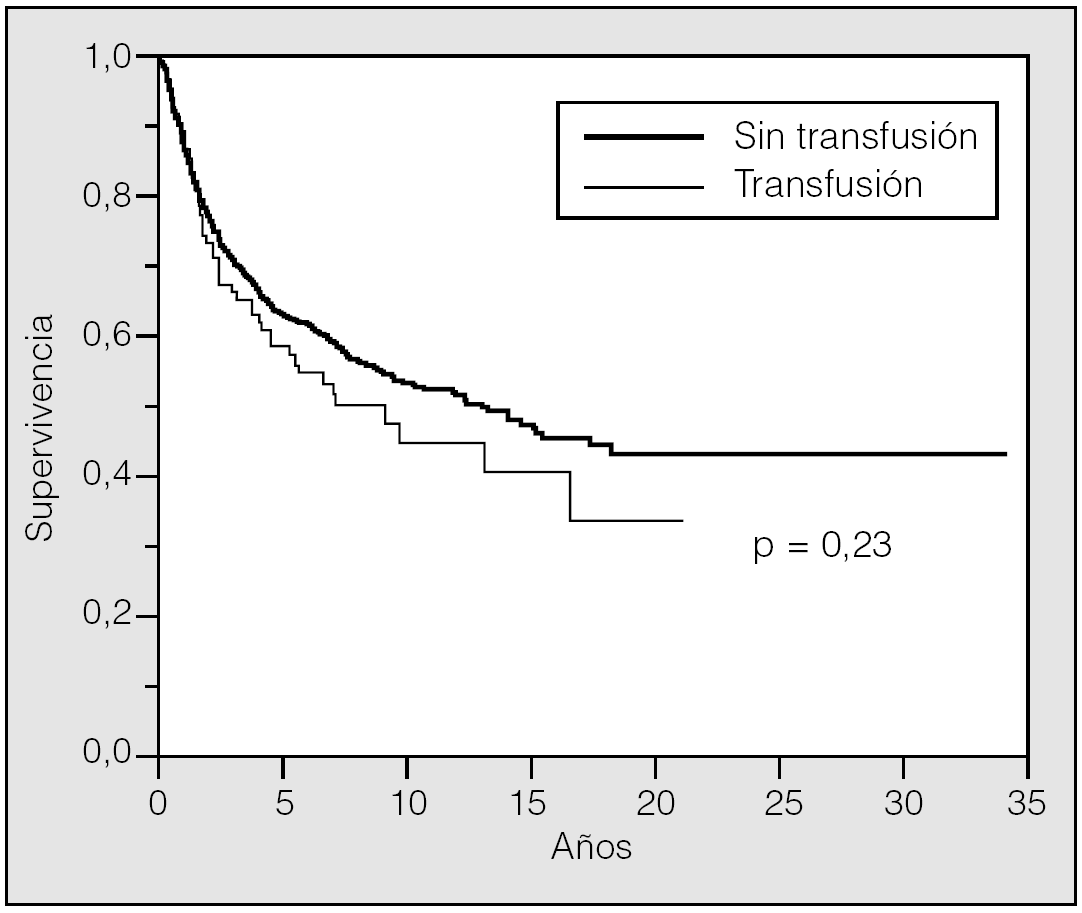
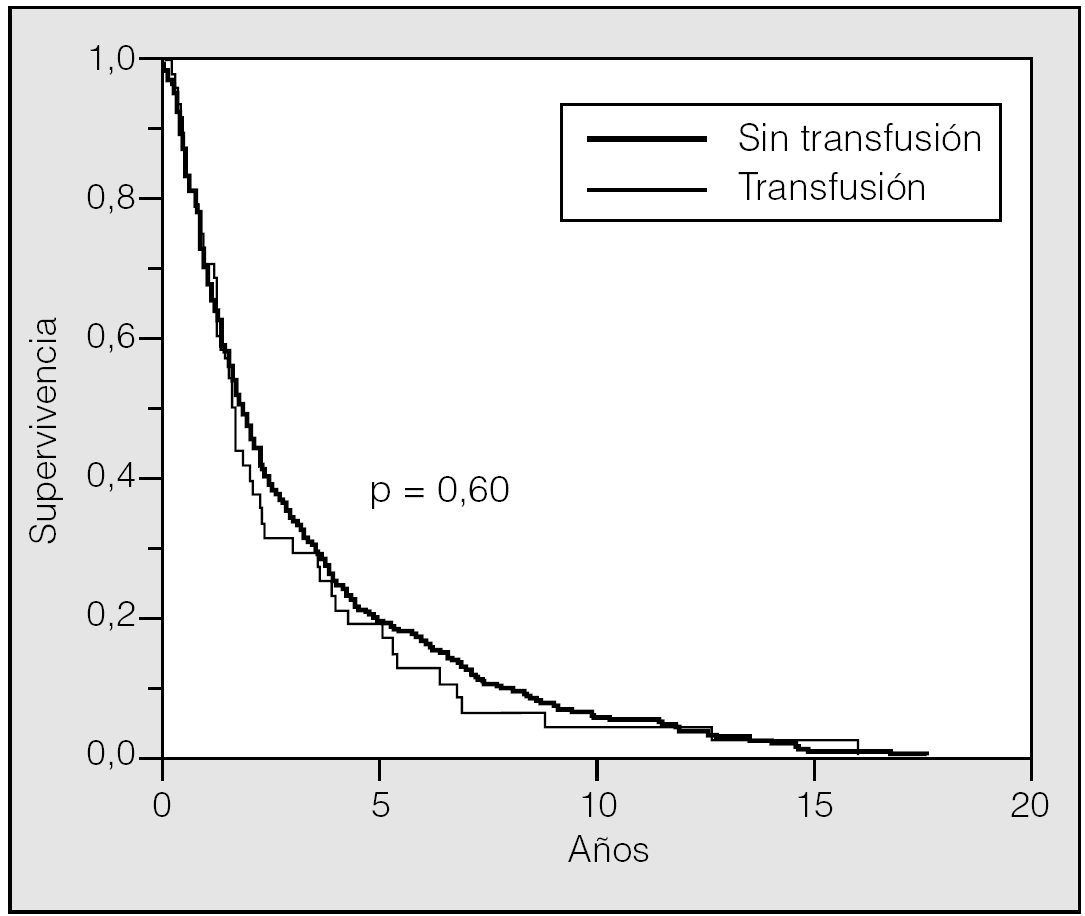
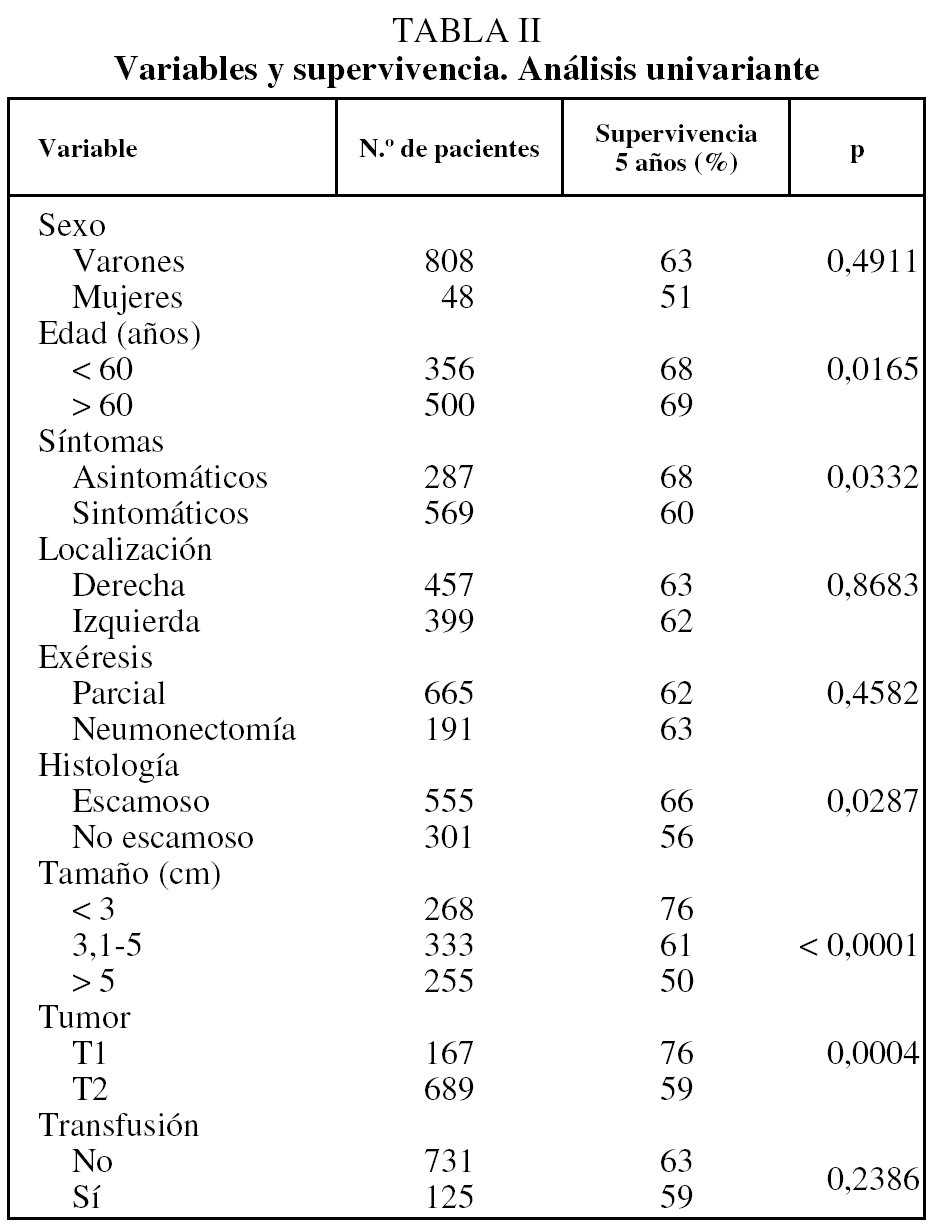
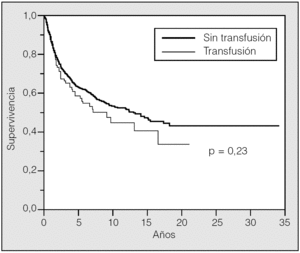
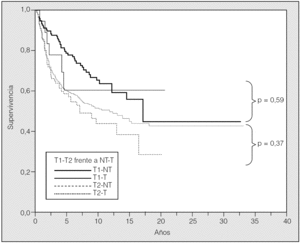
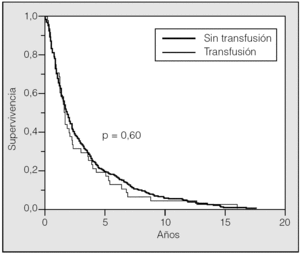
La supervivencia estimada mediante el análisis univariante con respecto a la variable transfusión/no transfusión de hemoderivados fue del 78, el 63 y el 54% a los 2, 5 y 10 años, respectivamente, para el grupo de pacientes no transfundidos, y del 73, el 59 y el 46% para el grupo de transfundidos. La comparación de ambas curvas de supervivencia no mostró diferencias significativas (p = 0,23) (fig. 2). Igualmente el estudio de la variable transfusión, con la separación de las poblaciones clasificadas como T1 o T2, no mostró influencia sobre su pronóstico (fig. 3). Tampoco esta variable mostró una influencia negativa en la supervivencia a la hora de valorar el grupo de pacientes cuya causa de muerte fue atribuible directamente al cáncer (fig. 4). El resto de resultados de las variables analizadas se muestran en la tabla II.
Fig. 2. Supervivencia transfusión-no transfusión.
Fig. 3. Supervivencia T1-T2 frente a transfusión-no transfusión.
Fig. 4. Supervivencia transfusión-no transfusión en pacientes fallecidos por cáncer.
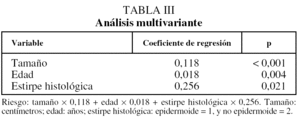
En el análisis multivariante entraron en regresión las variables tamaño tumoral, edad y variedad histológica epidermoide/no epidermoide. En este análisis no se demostró ninguna relación de la transfusión con la supervivencia (tabla III).
Discusión
La necesidad de realizar transfusiones en el perioperatorio de determinados actos quirúrgicos es relativamente frecuente, y más si cabe en la cirugía oncológica. El indudable efecto beneficioso inmediato de estos procedimientos se cuestionó por la presencia, como contrapartida, de efectos secundarios a largo plazo que determinarían un peor pronóstico en estos pacientes; efectos, estos últimos, cuya justificación se basaría en la inmunodepresión observada en pacientes sometidos a trasplante renal y con frecuentes transfusiones de hemoderivados1,2.
La extrapolación de estos hechos a una enfermedad, en nada favorecida por la inmunodepresión, como es el cáncer, hizo que se iniciara una serie de estudios sobre la influencia de la transfusión perioperatoria en distintos tipos de cáncer. A pesar del amplio número de artículos publicados y del tiempo transcurrido desde entonces, continúa sin establecerse una clara relación entre la transfusión y una peor supervivencia. Los metaanálisis de estos estudios ponen de manifiesto los constantes resultados contradictorios y concluyen en una falta de evidencia de esta relación causal18-20.
En esta serie, a pesar de su carácter retrospectivo, se ha analizado una muestra de población con un CBNACP en su fase inicial, y se ha tratado de evitar los múltiples factores asociados a la supervivencia de la enfermedad oncológica extendida4,5,10,11,13,21,22. En el estudio no se observan diferencias en la supervivencia de los pacientes transfundidos y los no transfundidos, incluso cuando se consideran de manera independiente los 2 subgrupos del estadio I (T1N0 y T2N0) o únicamente los pacientes fallecidos por cáncer.
En trabajos centrados en el estadio I del CBNACP encontramos desde concordancias con nuestros resultados, como en el de Pastorino et al9, hasta resultados totalmente contrarios6. Dentro del último grupo se encuadraría el publicado por Nosotti et al8, donde se evalúa, de manera prospectiva, a pacientes clasificados como CBNACP en estadio I y sometidos únicamente a lobectomías, en un intento de homogeneizar al máximo la muestra. Sus resultados reflejan una diferencia estadísticamente significativa, tanto en el estudio univariante como en el multivariante, lo que indica una relación de este peor pronóstico con la presencia de leucocitos en las transfusiones de sangre y lleva a una reflexión sobre el coste-beneficio de la supresión de éstos.
Al igual que en nuestro estudio, otros autores han descrito una correlación directa entre la necesidad de practicar transfusiones en el perioperatorio y la realización de neumonectomías (p < 0,001)10,13, sin apreciar, por el contrario, la relación con el tamaño tumoral (p < 0,001) y el tipo histológico (p = 0,04) que existe en nuestra serie. Al margen de las variables analizadas por cada autor, parece lógica esta relación, ya que tanto los tumores de gran tamaño como los que presentan mayor extensión regional son tributarios de una neumonectomía, con la consecuente agresividad quirúrgica y la mayor pérdida de volemia asociada a la sola extracción del órgano. Sin embargo, estas técnicas no determinan en nuestra serie cambios en la supervivencia (p = 0,45).
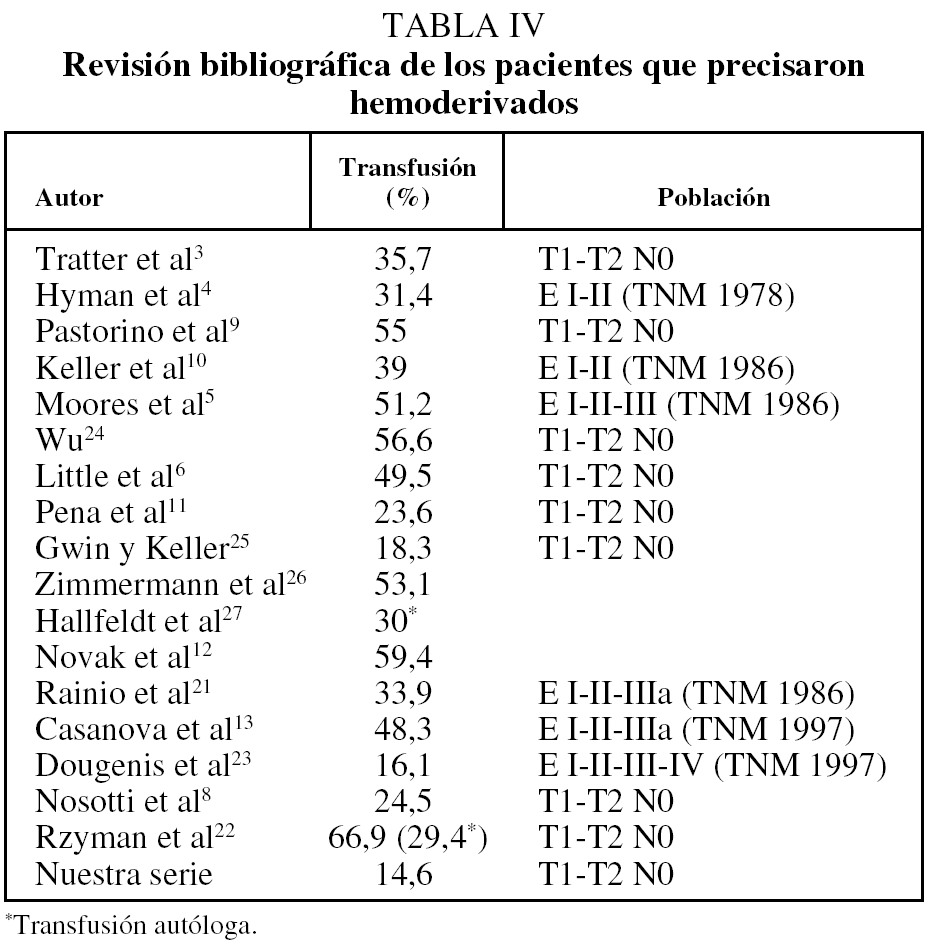
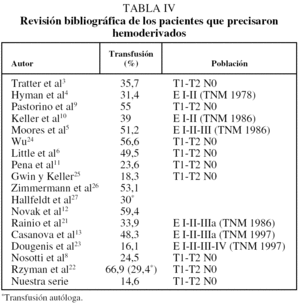
Por último, cabe destacar el elevado porcentaje de pacientes que requirieron hemoderivados en las series consultadas3-6,8-13,21-27 (tabla IV). En nuestra experiencia fueron necesarios en sólo un 14,6%. Coincidiríamos con la línea de trabajo de Dougenis et al23, que, con cifras de un 16,1%, apuntan la necesidad de un nuevo concepto de transfusión y de unos criterios muy selectivos pre, intra y postoperatorios para evitar transfusiones innecesarias, ya que, aparte de ser un factor causante de inmunodepresión, comporta en ocasiones importantes reacciones postransfusionales y es el vehículo de infecciones de alto riesgo como la hepatitis y el virus de la inmunodeficiencia humana. En su estudio prospectivo se establece una serie de recomendaciones para evitar los efectos secundarios de la anemia perioperatoria en estos pacientes. Así, dichos autores recomiendan un estudio inicial de comorbilidad preoperatoria, una minuciosa técnica de hemostasia durante la intervención, una técnica anestésica adecuada con valoración de las pérdidas hemáticas intracampo y un control riguroso de los débitos de drenaje y de los valores de hemoglobina en las primeras horas del postoperatorio. Como conclusión, establecen como valores subsidiarios de transfusión las cifras de hemoglobina entre 8,5 y 10 g/dl en función de la comorbilidad del paciente.
En conclusión, en el estudio de nuestra serie de CBNACP en estadio I no se ha encontrado ningún tipo de diferencia en la supervivencia de los pacientes que requirieron transfusión de hemoderivados a lo largo del perioperatorio, por lo que no parece asociarse un peor pronóstico con el uso de estos productos. Sí se ha comprobado que su utilización es más frecuente en función del tamaño tumoral, el tipo histológico y la necesidad de practicar una neumonectomía. Sin embargo, se debe cambiar el concepto de reposición de pérdida hemática y protocolizar su utilización sobre la base de criterios clinicoanalíticos más estrictos que eviten transfusiones innecesarias y, por tanto, los diversos riesgos a corto y largo plazo a ellas asociados.