En la clasificación TNM, los factores determinantes del factor T en el carcinoma pulmonar no microcítico apenas han variado con el tiempo y todavía se basan únicamente en características anatómicas. Nuestro objetivo fue estudiar la influencia en la supervivencia de estos y otros factores de tipo morfopatológico.
MétodosSe incluyeron 263 pacientes sometidos a resección pulmonar por carcinoma pulmonar no microcítico en estadio I patológico y diámetro ≤3cm. Se realizó un estudio de supervivencia y de estimación del riesgo competitivo observando variables clínicas, quirúrgicas y patológicas, siguiendo los métodos de análisis actuarial y de incidencia acumulativa, respectivamente. Posteriormente, se creó un modelo de riesgo de acuerdo con los resultados.
ResultadosLa supervivencia fue de 79,8 y 74,3% a los 5 y 10 años, respectivamente. Los factores con mejor pronóstico, estadísticamente significativo según el método actuarial fueron: presencia de síntomas, hábito tabáquico, FEV1>60%, número de ganglios resecados >7, tipo histológico escamoso, ausencia de invasión vascular, ausencia de invasión pleural visceral y presencia de invasión bronquial lobar proximal. La edad <50 años rozó la significación estadística. En el análisis multivariante entraron en regresión la invasión pleural visceral y la invasión vascular. El estudio de riesgo competitivo mostró una probabilidad de muerte por cáncer de 14,3 y 35,1% en 5 y 10 años, respectivamente. Las variables significativas en los análisis univariante y multivariante fueron similares excepto el FEV1>60%.
ConclusionesLa presencia de invasión pleural visceral y la invasión vascular determina la supervivencia o el riesgo de muerte por carcinoma pulmonar no microcítico ≤3cm y permiten elaborar un modelo predictivo de riesgo.
In TNM classification, factors determining the tumor (T) component in non-small cell lung cancer have scarcely changed over time and are still based solely on anatomical features. Our objective was to study the influence of these and other morphopathological factors on survival.
MethodsA total of 263 patients undergoing lung resection due to stage I non-small cell lung cancer ≤3cm in diameter were studied. A survival analysis and competing-risk estimate study was made on the basis of clinical, surgical and pathological variables using actuarial analysis and accumulative incidence methods, respectively. A risk model was then generated from the results.
ResultsSurvival at 5 and 10 years was 79.8 and 74.3%, respectively. The best prognostic factors were presence of symptoms, smoking habit and FEV1>60%, number of resected nodes>7, squamous histology, absence of vascular invasion, absence of visceral pleural invasion and presence of invasion more proximal than the lobar bronchus. All these were statistically significant according to the actuarial method. The factor “age<50 years” was close to the margin of statistical significance. Pleural invasion and vascular invasion were entered in the multivariate analysis. The competing-risk analysis showed a probability of death due to cancer of 14.3 and 35.1% at 5 and 10 years, respectively. Significant variables in the univariate and multivariate analyses were similar, with the exception of FEV1>60%.
ConclusionsPleural invasion and vascular invasion determine survival or risk of death due to non-small cell lung cancer ≤3cm and can be used for generating a predictive risk model.
En la clasificación TNM, promovida por la AJCC y la UICC para el carcinoma pulmonar no microcítico (CPNM), el descriptor T no había variado prácticamente desde 1974 hasta 2009. En la 7.ª y última revisión, avalada por IASLC, uno de los puntos novedosos ha sido la modificación del factor T en el estadio I. El estadio IA continúa reservado para tumores con un tamaño ≤3cm, sin invasión de la pleura visceral (IPV) o sin evidencia de invasión proximal a un bronquio lobar (ILP), atelectasia o neumonitis. Sin embargo, un nuevo punto de corte en 2cmha determinado dos nuevos subgrupos, T1aN0M0 para los ≤2cm y T1bN0M0 para los comprendidos entre 2,1-3cm. El estadio IB también ha variado en función de tamaño tumoral; se incluirían como T2aN0M0 los de ≤3cm pero con IPV o ILP o atelectasia o neumonitis y los de 3,1-5cm. Los comprendidos entre 5,1-7cm se clasificarían T2bN0M0 y los >7cm como T3N0M0, pasando a engrosar el estadio IIB1,2.
Sin embargo, otros condicionantes del descriptor T como la IPV, la ILP o la manifestación radiológica del tumor, han permanecido inalterables, habiéndose pospuesto el estudio de su implicación pronóstica para una futura revisión3,4.
Igualmente, otros factores pronósticos, sobre todo de tipo morfológico y molecular, que pudieran condicionar la supervivencia, no han sido tenidos en cuenta en la clasificación TNM. Factores como la estirpe histológica, el grado de diferenciación tumoral, la invasión vascular (IV) tumoral, la presencia de necrosis, etc.5,6, o de carácter molecular7 son motivo de interés a la hora de establecer el pronóstico y los posibles tratamientos con intencionalidad adyuvante5,7–9.
El propósito de nuestro estudio es la validación del nuevo modelo de estadificación propuesto para los CPNM con un diámetro máximo de 3cm y clasificados en estadio I, y la búsqueda de otros factores pronósticos, tanto clínicos como morfológicos, no recogidos en el actual sistema de clasificación TNM, a fin de confeccionar un modelo de riesgo para estos pacientes.
Material y métodoEl periodo de estudio comprendió entre el 1 de enero de 1990 y el 31 de diciembre de 2009. Se incluyeron, de forma prospectiva, los datos clínico-quirúrgicos de 268 pacientes consecutivos afectos de un CPNM con un diámetro máximo de 3cm y clasificados en estadio I patológico. Todos ellos sometidos, en un único centro sanitario, a una resección pulmonar anatómica (lobectomía, bilobectomía o neumonectomía), excluyéndose las sublobares, con intencionalidad curativa. Las piezas anatomopatológicas fueron revisadas para este estudio por un único anatomopatólogo.
Fueron excluidos 5 pacientes fallecidos en el período perioperatorio, ya que el objetivo del estudio fue la valoración de factores pronósticos que pudieran condicionar la supervivencia a largo plazo. Los 263 pacientes restantes fueron seguidos evolutivamente durante un período mínimo de 12 meses (mediana: 5,31 años [0,23-21,46]). El seguimiento finalizó el 31 de diciembre de 2010, quedando establecido el censor el 1 de enero de 2011.
Variables clínicasSe analizaron un conjunto de variables demográficas como el sexo y la edad, esta última tratada de forma continua y dicotomizada a través de cortes de estudio en los 50, 60 y 70 años. Entre las variables clínicas se incluyeron los distintos tipos de síntomas en el momento del diagnóstico de la enfermedad y la comorbilidad asociada al paciente y su categorización y ordenación según el índice de Charlson10. También se consideró el hábito tabáquico, categorizándose en no fumadores, fumadores y ex fumadores. Dentro de la valoración preoperatoria, se estudiaron el FEV1 y la FVC, expresado como el valor porcentual del teórico y la relación FEV1/FVC, la presencia de un ECG anormal, la localización radiológica tumoral, tanto en la lateralidad pulmonar como en la localización lobar o su situación central o periférica. La fibrobroncoscopia nos permitió definir su visualización bronquial y la afectación del eje bronquial principal.
Se estudiaron distintas variables asociadas al procedimiento quirúrgico como la amplitud de la resección, su ampliación a estructuras anatómicas vecinas y la necesidad de utilizar técnicas de angio o broncoplastia. Se analizó el número de ganglios resecados en la exéresis.
Variables anatomopatológicasEl estudio de la estirpe histológica de la tumoración se realizó según la clasificación de la OMS de 2004, categorizándose el grado de diferenciación en bien, moderada o pobremente diferenciado. En el caso de los carcinomas escamosos se valoró la queratinización y la presencia de puentes intercelulares. En los adenocarcinomas se basó en criterios convencionales de arquitectura tumoral y atipias citológicas.
El tamaño tumoral se estimó en función de su diámetro máximo y fue tratado como variable continua y categorizado según puntos de corte en 1 y 2cm. El grado de invasión de la pleural visceral se realizó en función de la propuesta de la IASLC4, basada en los estudios de Hammar11. Se determinó la presencia o ausencia de IV, invasión linfática, invasión perineural y necrosis tumoral.
Análisis estadísticoLos datos de las distintas variables fueros recogidos en soporte informático, utilizando para análisis estadístico el lenguaje y entorno de programación RStudio v0.97.320, usando los paquetes maxstat v0.7-17, survival v2.37-2, Design 2.3-0, prodlim v1.3.7 y cmprsk v2.2-6.
Para el cálculo de la supervivencia se utilizó el método de análisis actuarial de Kaplan-Meier y para establecer comparaciones los test de log-rank. Fueron considerados eventos no censurados la muerte por cáncer o desconocida, asumiendo esta última también como cáncer. Los datos fueron considerados estadísticamente significativos con un valor p<0,05. Las variables con una p<0,10 fueron incluidas en el análisis multivariante usando el método de riesgo proporcional de Cox para eventos temporales (observaciones incompletas).
Utilizando los coeficientes de regresión de las variables seleccionadas en el análisis multivariante, se calculó el riesgo de cada uno de los pacientes y se establecieron distintos grupos de riesgo en función de la presencia o ausencia de las variables pronósticas. Las curvas actuariales de estos grupos fueron construidas con el método de Kaplan-Meier y comparadas mediante el test de tendencia. En el caso de que este fuera significativo se compararon las distintas curvas de forma pareada con el test de log-rank.
El estimador de Kaplan-Meier es el método no paramétrico más utilizado para calcular la supervivencia sin necesidad de que el evento analizado haya sucedido en todos los casos (observación incompleta). Sin embargo, la utilización de modelos que tienen en cuenta la presencia de riesgos que compiten con el evento a analizar, en nuestro caso mortalidad por causas no debidas a CP, permite estimaciones más precisas de la supervivencia y, además, estimar el riesgo de muerte por otras causas. El método de incidencia acumulativa (riesgo competitivo) satisface estas expectativas y ha sido por ello también elegido para el análisis de la supervivencia12.
Para el análisis de la incidencia acumulativa, se consideraron eventos competitivos la mortalidad por otra causa, incluida la mortalidad por un segundo CP. Los datos fueron considerados estadísticamente significativos cuando el valor de p<0,05. Las variables con un valor de p<0,10 fueron incluidas en el análisis multivariante usando el método de Fine y Gray para la incidencia acumulativa13.
ResultadosLas características y valores del estudio descriptivo de la serie quedan reflejadas en la tabla 1. Un 43,7% de pacientes seguían vivos en el momento del cierre del estudio, habiendo fallecido 49 por causas relacionadas con su proceso tumoral (18,6%) y 6 por causas desconocidas. La causa de muerte fue distinta al CP en 93 pacientes (35,3%), siendo la causa un segundo carcinoma metacrónico en 23. No existió pérdida de seguimiento de ningún caso (tabla 2).
Análisis descriptivo de la serie
| n | % | × | δ | ||
|---|---|---|---|---|---|
| Sexo | Hombre | 226 | 85,9 | ||
| Mujer | 37 | 14,1 | |||
| Edad (años) | 62,5 | 8,8 | |||
| Sintomatología | Asintomático | 151 | 57,4 | ||
| Sintomáticos | 112 | 42,6 | |||
| Tabaquismo | Fumador activo | 121 | 46,0 | ||
| Ex fumador | 108 | 41,1 | |||
| No fumador | 34 | 12,9 | |||
| Comorbilidad | Diabetes mellitus | 20 | 10,6 | ||
| Hipertensión arterial | 79 | 30,0 | |||
| Cardiopatía | 33 | 16,7 | |||
| Arteriopatía periférica | 37 | 14,1 | |||
| EPOC | 33 | 12,5 | |||
| Neoplasias | 47 | 17,9 | |||
| I. renal crónica | 4 | 1,5 | |||
| Hepatopatía | 19 | 7,2 | |||
| Índice de Charlson | 0 | 90 | 34,2 | ||
| 1 | 71 | 27,0 | |||
| 2 | 63 | 24,0 | |||
| 3 | 20 | 7,6 | |||
| 4 | 12 | 4,6 | |||
| 5 | 5 | 1,9 | |||
| 6 | 2 | 0,8 | |||
| Espirometría | FEV1/FVC<0,7 | 33 | 12,5 | ||
| FEV1<0,6 | 27 | 10,2 | |||
| ECG | Normal | 233 | 88,6 | ||
| Patológico | 30 | 11,4 | |||
| Lóbulo | Bronquio principal derecho | 2 | 0,8 | ||
| Lóbulo superior derecho | 89 | 33,8 | |||
| Bronquio intermediario | 4 | 1,5 | |||
| Lóbulo Medio | 13 | 4,9 | |||
| Lóbuloinferior. derecho | 36 | 13,7 | |||
| Bronquio principal izquierdo | 10 | 3,8 | |||
| Lóbulo superior izquierdo | 79 | 30,1 | |||
| Lóbulo inferior izquierdo | 30 | 11,4 | |||
| Toracotomía | Derecha | 144 | 54,8 | ||
| Izquierda | 119 | 45,2 | |||
| Amplitud de exéresis | Lobectomía | 228 | 86,7 | ||
| Bilobectomía | 11 | 4,2 | |||
| Neumonectomía | 24 | 9,1 | |||
| Típica/atípica | Típica | 256 | 97,3 | ||
| Ampliada segmento lobar | 3 | 1,1 | |||
| Broncoplastia | 3 | 1,1 | |||
| Angioplastia | 1 | 0,4 | |||
| Tipo histológico | Epidermoide | 115 | 43,7 | ||
| Adenocarcinoma | 134 | 50,9 | |||
| Anaplásico de c. grandes | 14 | 5,3 | |||
| Tamaño tumoral (cm) | 2,2 | 0,7 | |||
| Diferenciación tumoral | G1 | 123 | 46,8 | ||
| G2 | 92 | 35,0 | |||
| G3 | 48 | 18,2 | |||
| Invasión linfática | Sí | 56 | 21,3 | ||
| No | 207 | 78,7 | |||
| Invasión perineural | Sí | 33 | 12,5 | ||
| No | 230 | 87,5 | |||
| Necrosis | Sí | 182 | 69,2 | ||
| No | 81 | 30,8 | |||
| Invasión vascular | Sí | 60 | 22,8 | ||
| No | 203 | 77,2 | |||
| Invasión pleural | pl0 | 229 | 87,1 | ||
| pl1 | 32 | 12,1 | |||
| pl2 | 2 | 0,8 | |||
| T1 | T1a | 72 | 27,4 | ||
| T1b | 105 | 39,9 | |||
| T2a | Bronquial | 42 | 16 | ||
| IPV | 34 | 12,9 | |||
| Cisura | 10 | 3,8 |
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio máximo en el 1er segundo; FVC: capacidad vital forzada; IPV: invasión de la pleura visceral.
Causas de muerte
| Recaída local | 5 | 1,9 |
| Recaída locorregional | 8 | 3 |
| Recaída a distancia | ||
| Sistema nervioso central | 12 | 4,5 |
| Varios niveles | 11 | 4,1 |
| Hueso | 7 | 2,6 |
| Pulmón | 4 | 1,5 |
| Hígado | 1 | 0,3 |
| Suprarrenal | 1 | 0,3 |
| Desconocida | 6 | 2,3 |
| Cardiovasculares | ||
| Infarto agudo de miocardio | 13 | 5,3 |
| Accidente vascular cerebral | 7 | 2,6 |
| Aneurisma aorta | 3 | 1,1 |
| Insuficiencia cardíaca | 3 | 1,1 |
| Cor pulmonale | 1 | 0,3 |
| Tromboembolismo pulmonar | 1 | 0,3 |
| Isquemia intestinal | 1 | 0,3 |
| Respiratorias | ||
| Neumonía | 10 | 3,8 |
| EPOC | 6 | 2,2 |
| Otras | ||
| Accidente de tráfico | 2 | 0,7 |
| Sepsis urinaria | 1 | 0,3 |
| Insuficiencia renal terminal | 1 | 0,3 |
| Neoplásicas | ||
| Vejiga | 5 | 1,9 |
| Recto | 2 | 0,7 |
| Laringe | 2 | 0,7 |
| Próstata | 2 | 0,7 |
| Amígdala | 1 | 0,3 |
| Hipofaringe | 1 | 0,3 |
| Esófago | 1 | 0,3 |
| Gástrica | 1 | 0,3 |
| Tráquea | 1 | 0,3 |
| Hepatocarcinoma | 1 | 0,3 |
| Melanoma | 1 | 0,3 |
| Hematológicas | 2 | 0,7 |
| Segundo CP metacrónico | 23 | 8,7 |
CP: cáncer pulmonar; EPOC: enfermedad pulmonar obstructiva crónica.
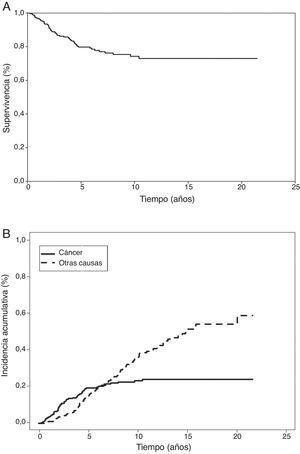
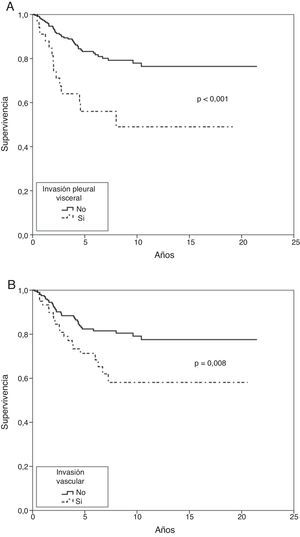
En el análisis actuarial de Kaplan-Meier, la probabilidad de supervivencia cáncer-específica fue del 79,8 y del 74,3% a los 5 y 10 años respectivamente (fig. 1). No se observaron diferencias cuando se examinó en punto de corte del tamaño en 2cm ni al analizar los subgrupos T1 y T2, o T1a, T1b y T2a. Mostraron significación estadística como factores de buen pronóstico la presencia de síntomas (p=0,040), la historia previa de fumador (p=0,037), un FEV1>60% (p=0,032) y la resección de más de 7 ganglios durante la exéresis (p=0,035). La edad <50 años rozó la significación estadística (p=0,050). En cuanto a las variable anatomopatológicas fueron significativas con una mayor supervivencia la estirpe histológica epidermoide (p=0,042), la ausencia de IV (p=0,008), la falta de IPV (p<0,001) y la ILP (p=0,004), (tabla 3).
Análisis univariante: método de Kaplan-Meier vs. incidencia acumulativa método de Gray
| n | 5 a (%) | KM (p) | 1-KM | 5 a (%) | IA (p) | |
|---|---|---|---|---|---|---|
| Sexo | ||||||
| Hombre | 226 | 80,8 | 0,370 | 19,2 | 18,2 | 0,256 |
| Mujer | 37 | 73,5 | 26,5 | 25,8 | ||
| Edad (años) | ||||||
| ≤ 50 | 21 | 94,4 | 0,050 | 5,6 | 5,3 | 0,118 |
| > 50 | 242 | 78,4 | 21,6 | 20,3 | ||
| ≤ 60 | 106 | 80,1 | 0,754 | 19,9 | 19,0 | 0,977 |
| > 60 | 157 | 79,9 | 20,1 | 19,0 | ||
| ≤ 70 | 206 | 79,7 | 0,703 | 20,3 | 19,1 | 0,795 |
| > 70 | 57 | 80,2 | 19,8 | 18,8 | ||
| Síntoma | ||||||
| Asintomático | 151 | 77,4 | 0,040 | 22,6 | 21,6 | 0,038 |
| Sintomático | 112 | 83,0 | 17,0 | 15,8 | ||
| Tabaquismo | ||||||
| Nunca | 34 | 74,7 | 0,064 | 25,3 | 24,9 | 0,034 |
| Historia de fumador | 229 | 80,6 | 19,4 | 18,2 | ||
| Nunca | 34 | 74,7 | 0,037 | 25,3 | 24,9 | 0,021 |
| Fumador | 121 | 74,9 | 25,1 | 12,9 | ||
| Ex fumador | 108 | 86,3 | 13,7 | 22,5 | ||
| Índice de Charlson | ||||||
| 0 | 90 | 80,4 | 0,641 | 19,6 | 18,5 | 0,788 |
| > 0 | 173 | 79,5 | 20,5 | 19,4 | ||
| ≤ 2 | 224 | 79,0 | 0,723 | 21,0 | 20,1 | 0,929 |
| > 2 | 39 | 85,7 | 14,3 | 13,2 | ||
| EPOC | ||||||
| FEV1/FVC<70% | 33 | 72,0 | 0,564 | 28,0 | 24,9 | 0,692 |
| FEV1/FVC ≥ 70% | 230 | 80,9 | 19,1 | 18,2 | ||
| FEV1<60% | 27 | 58,0 | 0,032 | 42,0 | 36,1 | 0,069 |
| FEV1 ≥ 60% | 236 | 82,0 | 18,0 | 17,0 | ||
| ECG | ||||||
| Normal | 233 | 80,5 | 0,640 | 19,5 | 18,45 | 0,771 |
| Patológico | 30 | 74,5 | 25,5 | 23,84 | ||
| Extensión de resección | ||||||
| Resección parcial | 239 | 78,7 | 0,100 | 21,3 | 20,2 | 0,083 |
| Neumonectomía | 24 | 90,8 | 9,2 | 8,5 | ||
| Lobectomía | 228 | 78,2 | 0,126 | 21,8 | 20,6 | 0,119 |
| Bilobectomía | 11 | 88,9 | 11,1 | 11,1 | ||
| Neumonectomía | 24 | 90,8 | 9,2 | 8,5 | ||
| Ganglios linfáticos | ||||||
| ≤ 7 | 212 | 77,3 | 0,035 | 22,7 | 31,3 | 0,033 |
| > 7 | 51 | 91,9 | 8,1 | 8,0 | ||
| Tipo histológico | ||||||
| Escamoso | 115 | 84,9 | 0,113 | 15,1 | 14,5 | 0,103 |
| Adenocarcinoma | 134 | 75,9 | 24,1 | 22,6 | ||
| Células grandes | 14 | 77,1 | 22,9 | 22,1 | ||
| Escamoso | 115 | 84,9 | 0,042 | 15,1 | 14,5 | 0,037 |
| No escamoso | 148 | 76,1 | 23,9 | 22,5 | ||
| Adenocarcinoma | 134 | 75,9 | 0,036 | 24,1 | 22,6 | 0,040 |
| No adenocarcinoma | 129 | 83,9 | 16,1 | 15,4 | ||
| Tamaño tumoral | ||||||
| ≤ 2cm | 109 | 77,4 | 0,330 | 22,6 | 20,7 | 0,381 |
| > 2cm | 154 | 81,1 | 18,9 | 18,1 | ||
| ≤ 1cm | 23 | 80,7 | 0,827 | 19,3 | 17,6 | 0,767 |
| > 1cm - ≤ 2cm | 86 | 78,4 | 21,6 | 19,9 | ||
| > 2cm | 154 | 80,3 | 19,7 | 18,9 | ||
| Diferenciación tumoral | ||||||
| G1 | 123 | 82,4 | 0,986 | 17,6 | 16,7 | 0,980 |
| G2 | 92 | 77,3 | 22,7 | 21,7 | ||
| G3 | 48 | 77,4 | 22,6 | 20,5 | ||
| Invasión linfática | ||||||
| No | 207 | 82,0 | 0,115 | 18,0 | 17,0 | 0,114 |
| Sí | 56 | 71,9 | 28,1 | 26,7 | ||
| Invasión perineural | ||||||
| No | 230 | 80,7 | 0,763 | 19,3 | 18,2 | 0,688 |
| Sí | 33 | 74,0 | 26,0 | 24,9 | ||
| Necrosis | ||||||
| No | 81 | 81,8 | 0,526 | 18,2 | 17,0 | 0,596 |
| Sí | 182 | 79,0 | 21,0 | 20,0 | ||
| Invasión cisural | ||||||
| No | 253 | 79,0 | 0,395 | 21,0 | 19,8 | 0,427 |
| Sí | 10 | 80,0 | 20,0 | 0,0 | ||
| Invasión vascular | ||||||
| No | 203 | 82,4 | 0,008 | 17,6 | 16,4 | 0,007 |
| Sí | 60 | 71,3 | 28,7 | 27,8 | ||
| Invasión pleural | ||||||
| No | 229 | 83,2 | 0,000 | 16,8 | 15,8 | 0,000 |
| Sí | 34 | 56,0 | 44,0 | 42,4 | ||
| Factor T | ||||||
| T1 | 177 | 82,0 | 0,332 | 18,0 | 17,0 | 0,296 |
| T2 | 86 | 75,4 | 24,6 | 23,4 | ||
| T1a | 72 | 80,4 | 0,400 | 19,6 | 17,9 | 0,402 |
| T1b | 105 | 82,8 | 17,2 | 16,4 | ||
| T2a | 86 | 75,4 | 24,6 | 23,4 | ||
| T2 (invasión pleural) | 34 | 56,0 | 0,004 | 44,0 | 42,4 | 0,003 |
| T2 (bronquial proximal) | 42 | 84,6 | 15,4 | 14,5 | ||
Se ha incorporada la columna 1-KM para poder comparar los resultados de KM con IA.
EPOC: enfermedad pulmonar obstructiva crónica. FVC: capacidad vital forzada. FEV1: volumen espiratorio máximo en el 1.er segundo; IA: incidencia acumulativa; KM: Kaplan Meyer
En el análisis de riesgo proporcional de Cox entraron en regresión solo dos variables, la IPV (p=0,001) y la IV (p=0,023), (tabla 4 y fig. 2).
Análisis multivariante: método de riesgo proporcional de Cox vs. método de Fine-Gray
| Multivariante (Cox) | Multivariante (Fine-Gray) | |||||
|---|---|---|---|---|---|---|
| B | p | HR (95% IC) | β | p | HR (95% IC) | |
| Invasión vascular | 0,644 | 0,023 | 1,90 (1,09–3,32) | 0,628 | 0,020 | 2,33 (1,10–3,18) |
| Invasión pleural | 1,022 | 0,001 | 2,77 (1,50–5,13) | 0,962 | 0,001 | 3,24 (1,46–4,68) |
HR: hazard ratio; IC: intervalo de confianza.
De forma paralela, la aplicación del análisis de incidencia acumulativa, estimó el riesgo de muerte por cáncer en el 19,4 y 23,2% a los 5 y 10 años respectivamente (fig. 1). Al analizar la muerte por otra causa, como evento competitivo, el riesgo de muerte por el mismo fue de 14,3 y 35,1% a los 5 y 10 años. Siendo importante señalar que la probabilidad de muerte por cáncer y no cáncer se iguala a los 6,3 años. Momento a partir del cual el riesgo de muerte es mayor por causas no relacionadas con el cáncer (fig. 1).
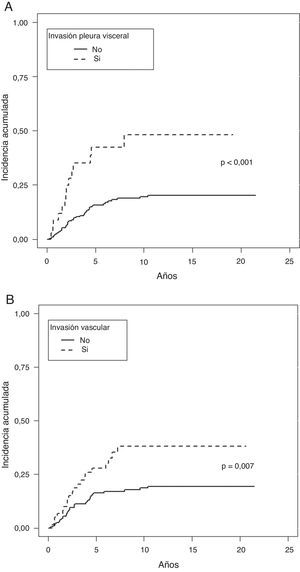
En la estimación del cáncer como causa de muerte, tampoco se observaron diferencias al analizar el tamaño tumoral, ni los subgrupos definidos en el TNM como T1a, T1b y T2a. Sí fueron factores protectores la presencia de síntomas (p=0,038), la historia de tabaquismo (p=0,034), un número de ganglios extirpados mayor de 7 (p=0,033), la estirpe histológica epidermoide (p=0,037), la ausencia de IV (p=0,007) o de IPV (p<0,001) y la ILP (p=0,003), (tabla 3).
En el análisis multivariante de Fine-Gray entraron igualmente en regresión la IPV (p=0,001) y la IV (p=0,020), (tabla 4 y fig. 3).
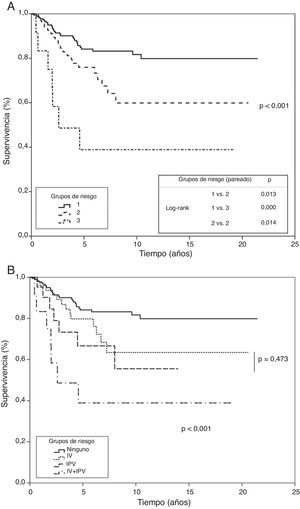
Se elaboró un modelo de riesgo considerando la ausencia o presencia, junto con el producto de su factor β, de cada una de las dos variables que entraron en regresión en el estudio multivariante y se aplicó a la población de estudio. Ello permitió diferenciar tres grupos; uno de bajo riesgo cuando no presentaban ninguna de las variables, uno de riesgo moderado cuando presentaban uno u otra de ellas, y un último de alto riesgo cuando aparecían las dos simultáneamente. Los tres grupos mostraron significación al aplicar los test de tendencia y long-rank, comparando por pares cada uno de ellos. Se estimó una probabilidad de supervivencia a los 5 y 10 años de un 84 y 81% en el primer grupo, de un 75 y 59% en el segundo y del 38% en el tercero (p<0,001), (fig. 4).
Grupos de riesgo en función de análisis multivariante (método de riesgo proporcional de Cox). Curvas de supervivencia de los grupos de riesgo construidos según las variables significativas en estudio multivariante. A) Grupo 1: ausencia de invasión de pleura visceral e invasión vascular; grupo 2: presencia de invasión de pleura visceral o invasión vascular; grupo 3: presencia de invasión de pleura visceral e invasión vascular. Test de tendencia y comparación de curvas por pares. B) Análisis del grupo de riesgo intermedio contemplando por separado la invasión de pleura visceral o la invasión vascular.
En la actualidad, la estadificación tumoral basada en el sistema TNM es la norma aceptada para determinar el tratamiento y estimar el pronóstico en el CPNM, pero permanece sin cambios la implicación de otros factores no anatómicos que pudieran condicionar la supervivencia. En este estudio hemos observado como dos variables morfopatológicas, la IPV y la IV, condicionan de manera independiente dicha supervivencia y pueden determinar un modelo de predicción de riesgo en los CPNM ≤3cm.
La supervivencia fue de 79,8 y del 74,3% a los 5 y 10 años, respectivamente, cifras equiparables a la comunicada por otros autores5,14–16. Con respecto al análisis de incidencia acumulativa, no existen series para poder comparar nuestros resultados (riesgo de muerte por cáncer de 19,4 y 23,2% a los 5 y 10 años), pero sí nos ha permitido identificar qué factores no tumorales compiten con el CP en el pronóstico y cómo a partir de los 6,3 años, estos son predominantes.
Desde un punto de vista global, y salvo excepciones17, la nueva clasificación TNM ha sido validada. Sin embargo, es escasa la literatura disponible en cuanto a tumores con un diámetro máximo de 3cm N0M0 y con resultados contradictorios. Ye et al.18 y Suzuki et al.19, comprobaron que los tumores clasificados como T1aN0M0 gozaban de mejor pronóstico que los T1bN0M0. Por el contrario, Li et al.20 no encontraron ni diferencias entre ambos grupos ni con los clasificados como T2aN0M0, mostrando un pronóstico superponible al estadio IA. Nuestros resultados coinciden plenamente con este último trabajo, no habiéndose validado la nueva clasificación TNM. Hemos de recordar que, en nuestra experiencia, 34 tumores que invadían la pleura visceral, y por tanto clasificados como T2a, presentaron un pronóstico significativamente peor que 42 tumores también clasificados como T2a por su localización en el eje bronquial, siendo la supervivencia de estos últimos superponibles a los clasificados como T1a y T1b.
Llama la atención en este estudio la mejor supervivencia en pacientes ex fumadores y sintomáticos. El papel del tabaquismo como factor pronóstico es ambiguo aunque sí existen referencias en la literatura que reportan una mejor supervivencia tras el abandono previo del tabaco21. Por otro lado, la detección más precoz y mayoritariamente asintomática en la última década del estudio y el cambio en la forma histológica predominante, el adenocarcinoma, con un peor pronóstico, podrían ser la causa de una peor supervivencia en los pacientes asintomáticos.
El tamaño tumoral ha sido objeto de innumerables trabajos encaminados a valorar su implicación pronóstica. Desde la revisión de Nesbitt et al.22 que ponían de manifiesto que los tumores clasificados en estadio I y con diámetro ≤3cm no tenían un pronóstico homogéneo, múltiples trabajos comprobaron que el tamaño condicionaba el pronóstico15,23,24. Ello determinó el establecimiento de 2cm como punto de corte en la última clasificación TNM. Sin embargo, al igual que en nuestros resultados, algún trabajo ha puesto de manifiesto que el tamaño no tiene impacto alguno en el pronóstico25,26. Sin embargo, sí que comprobamos que desempeña un papel en el riesgo competitivo, ya que a menor tamaño tumoral es mayor la probabilidad de muerte por otra causa distinta al CP.
La IPL permanece como criterio para clasificar el descriptor T como T2a. Es muy escasa la bibliografía que trate su valor pronóstico y la existente27,28 no ha demostrado impacto alguno en la supervivencia, tal y como sucede en nuestra experiencia.
El valor pronóstico de la IPV ha sido motivo de polémica, con resultados controvertidos probablemente debido a la falta de un criterio morfológico consensuado para clasificar el grado de IPV. La IASLC4ha establecido unas recomendaciones basadas en los estudios de Hammar et al.11 que permiten establecer comparaciones más certeras e identificar la IPV como un factor independiente de mal pronóstico en el CP9,29,30, coincidiendo con nuestros resultados.
En nuestra experiencia, la IPV fue la primera variable que entró en regresión en el análisis multivariante, tanto en el modelo de Fine-Gray como en el cálculo del riesgo proporcional de Cox. La IPV fue también un factor competitivo por cuanto que su ausencia determinó una mayor probabilidad de muerte por otra causa.
En resumen, en nuestro estudio el tamaño tumoral con un punto de corte en 2cm no condicionó la supervivencia de los dos grupos que configuran el estadio IA. En los tumores clasificados como T2aN0M0 existió un grupo con un peor pronóstico, aquellos con IPV, con una supervivencia a los 5 años del 56%, mientras que la IPL mostró una supervivencia (84,6%) equiparable a los T1aN0M0. No obstante, con la estimación del riesgo competitivo se comprobó que el riesgo de mortalidad por una causa no tumoral fue mayor en los pacientes clasificados como T1 y en los T2 por afectación bronquial.
Dentro de los factores no anatómicos, nuestro estudio de las variables anatomopatológicas mostró una influencia significativa en la supervivencia en la presencia de IV. Dato presente tanto en el análisis univariante como en el multivariante, siendo el segundo factor que entró en regresión como factor pronóstico independiente, tanto cuando se estimó según el análisis de Fine-Gray como cuando se utilizó el cálculo de riesgo proporcional de Cox.
Aunque los primeros estudios realizados sobre factores histológicos hablaban de la influencia de la invasión de los vasos linfáticos en la supervivencia y no de la IV31,32, trabajos publicados más recientemente33 coinciden con nuestros resultados, considerando la IV como un factor que determina, de manera independiente, la supervivencia en el estadio I, e incluso proponen este factor como posible incorporación al acrónimo T en la clasificación TNM34. Resultados similares reportan otros autores, aunque muestran también como factor pronóstico la invasión linfática, hecho que no aconteció en nuestra serie35–37.
La IV podría incluso, junto a la IPV y la afectación linfática, determinar el periodo libre de enfermedad en este estadio I35,38,39.
Como hemos podido comprobar la estimación de la supervivencia depende de múltiples factores y aunque el TNM se sigue mostrando útil como herramienta en cuanto a la toma de decisión terapéutica en el CPNM en estadios precoces, este no logra configurar un grupo de pacientes con un pronóstico homogéneo, por ello creemos de interés abordar el problema desde una perspectiva multivariante. Si bien puede resultar complicado elaborar modelos de riesgo de tipo molecular7,40, puesto que no todos los grupos pueden disponer de una tecnología más o menos compleja, sí es cierto que el problema puede ser abordado desde una perspectiva clínico-patológica5,8. En nuestra experiencia, y a pesar de la limitación que supone no haber validado nuestro modelo en una población independiente, la estimación del riesgo a partir del grado de IPV y de la IV, logra diferenciar tres grupos con un pronóstico significativamente distinto. Nuestros resultados coinciden, en buena medida, con los publicados con Maeda et al.5,9. Estos autores comprobaron mediante análisis multivariante que, en tumores en estadio I y con un diámetro máximo de 3cm, la IPV y la IV junto con el grado de diferenciación tumoral fueron las variables que determinaron la supervivencia.
ConclusionesEl análisis y consideración de factores pronósticos clínicos y morfopatológicos, al margen de determinar o no cambios en las próximas clasificaciones TNM, podrían tener, en nuestra opinión, un efecto de aplicación más inmediato. Su presencia podría condicionar el inicio de nuevas líneas de investigación en cuanto a la necesidad de aplicar tratamientos complementarios a la cirugía en estos estadios iniciales del CPNM, incluso aun cuando el tamaño tumoral sea pequeño y no hayan signos de afectación más allá del propio parénquima pulmonar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.