La enfermedad de injerto contra huésped crónica (EICHc) es una enfermedad multisistémica con alta morbimortalidad que aparece como complicación entre un 30 y un 70% de los trasplantes de progenitores hematopoyéticos (TPH) alogénicos1. La bronquiolitis obliterante (BO) es la manifestación pulmonar de la EICHc, y habitualmente se manifiesta como fibrosis y cicatrización de la pequeña vía aérea distal y obstrucción fija al flujo aéreo1,2. Clínicamente cursa con disnea, intolerancia al ejercicio y tos no productiva1,3. Las manifestaciones clínicas son inespecíficas, y muchos pacientes son asintomáticos inicialmente, por lo que el diagnóstico de esta enfermedad puede establecerse de forma tardía. Se estima una incidencia del 2-5% en los pacientes que reciben TPH alogénico y del 6% en pacientes ya diagnosticados de EICHc1,4,5, no obstante publicaciones recientes sugieren un incremento. Así en el estudio de Chien et al. se mostró una prevalencia global de BO del 5,5%, del 10% en pacientes que sobrevivieron al menos un año y del 16% en pacientes ya diagnosticados de EICHc6,7.
El objetivo de este trabajo fue describir la prevalencia, las características clínicas y espirométricas, así como la supervivencia de los pacientes con TPH que han desarrollado BO en los últimos 10 años. Los Servicios de Hematología y Neumología del Hospital de La Princesa colaboran desde hace años en el seguimiento conjunto de estos enfermos. Se realizó un estudio observacional retrospectivo de los 289 TPH realizados en el Hospital de la Princesa, entre enero de 2009 y junio de 2018, seleccionando finalmente 42 pacientes que fueron diagnosticados de BO. Se recogieron las siguientes variables: edad en el momento del trasplante, género, enfermedad hematológica de base, función pulmonar al diagnóstico de BO, así como la función previa y posterior al trasplante, aislamientos microbiológicos, hallazgos radiológicos, evolución clínica, afectación de otros órganos y supervivencia media. Así mismo se valoró si hubo diferencias en la supervivencia a razón del género, aislamientos microbiológicos o afectación solo pulmonar o de otros órganos.
De los 42 pacientes con BO, 23 eran varones y 19 mujeres. La prevalencia de BO fue del 14,8%. La edad media al trasplante fue de 48,39±12,74 años. El TPH se realizó mayoritariamente por leucemia aguda mieloblástica (34,8%), síndrome mielodisplásico (28,3%) y leucemia aguda linfoblástica (13%). El 52,4% de los pacientes fueron exfumadores con un índice paquete/año de 22,26±13,52. El porcentaje medio del FEV1 previo al trasplante fue del 96,28%±11,55, al diagnóstico de la BO del 64,6%±24,43, a los 6 meses del 66,86%±31,08 y a los 12 del 69,37%±25,94. Solo en 19 de los pacientes se realizó cultivo de esputo, siendo en 10 casos positivos para Aspergillus fumigatus, en 7 para Pseudomonas aeruginosa y en 2 para Haemophilus influenzae y Stenotrophomonas maltophilia. Los hallazgos en la tomografía computarizada (TC) de tórax fueron vidrio deslustrado y bronquiectasias en el 56,4%, infiltrados alveolares en el 30,8%, atrapamiento aéreo en el 15,4% y engrosamiento peribronquial y nódulos peribronquiales en el 12,8%. Ningún paciente presentó imágenes compatibles con fibroelastosis pleuropulmonar.
En 11 pacientes, la EICHc fue exclusivamente pulmonar, mientras que en el resto de los pacientes (74,4%), la afectación pulmonar se asoció a la de otros órganos. El órgano más frecuentemente afectado fue la piel, en 24 casos, seguido de daño ocular en 20, oral en 17 y hepático en 17.
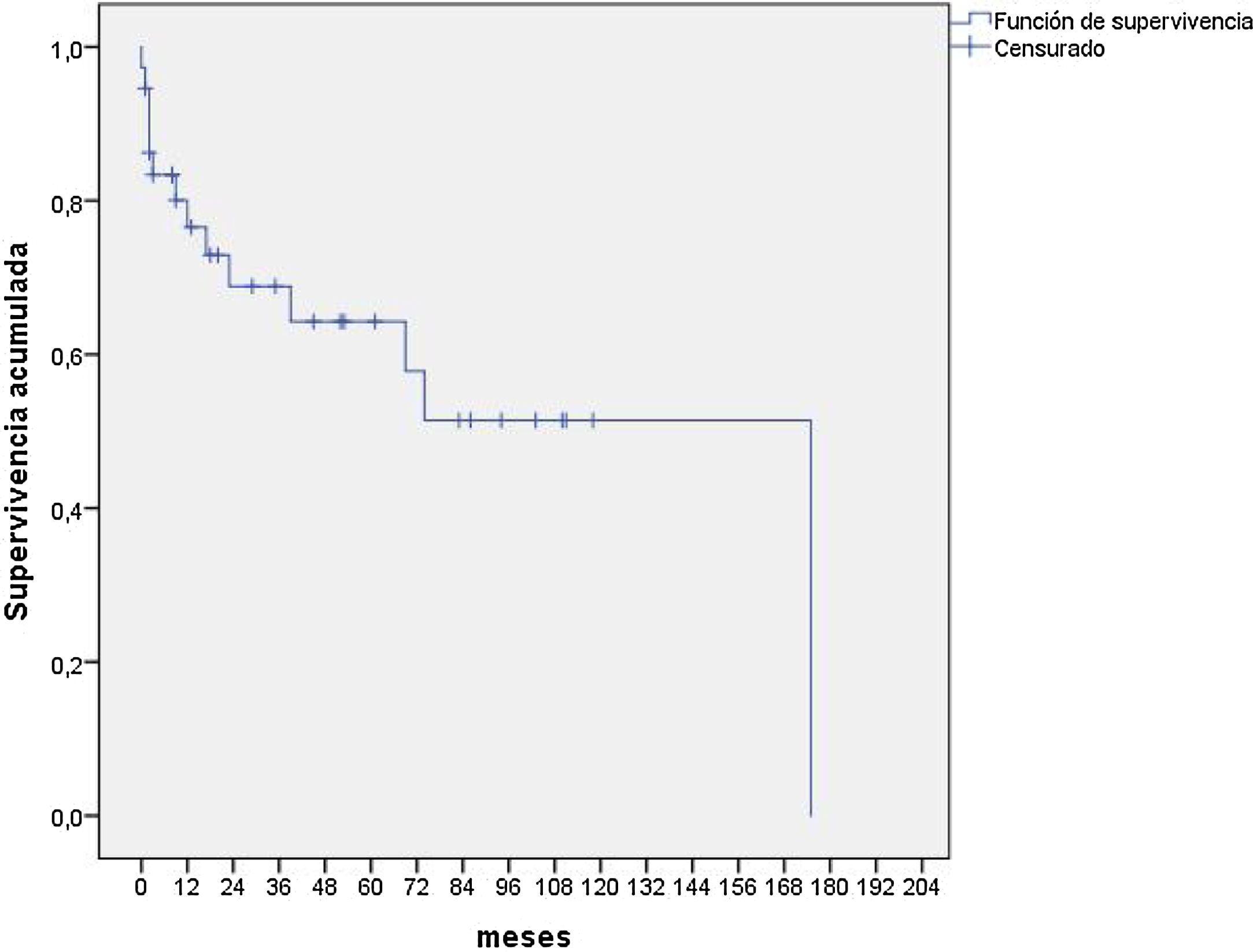
Diecisiete pacientes fallecieron, 4 se perdieron en el seguimiento y 24 permanecían vivos en el momento del estudio. Las causas del exitus fueron respiratorias en el 76,4% de los pacientes y neurológicas y digestivas en el 11,7%, en ambos casos. En la figura 1 se observa que la mediana de supervivencia de estos pacientes fue de 175 meses. No se observaron diferencias en la supervivencia según el género, los aislamientos microbiológicos o la afectación del órgano.
En este estudio, hemos analizado la prevalencia y las características clínica de la BO en el TPH. La prevalencia de BO en nuestro hospital fue del 14,8% algo mayor que la que se describe en otros estudios, quizás debido a un diagnóstico más precoz. En trabajos previos el porcentaje de FEV1 al diagnóstico osciló entre el 40 y el 59, mientras que en el nuestro fue del 64,6%, por lo que pensamos que pudieron diagnosticarse y tratarse pacientes con afectación más leve. A pesar de todo, la mortalidad fue elevada, y la mediana de supervivencia de 175 meses. Como limitaciones del trabajo, destacamos el número de pacientes, así como la temporalidad de la inclusión de los enfermos, por lo que fue difícil analizar todos los factores que pudieron influir en la mortalidad.
El National Institutes of Health (NIH) en el año 2015, modificó los criterios previos del 2009, estableciendo que en presencia de alguna característica de la EICHc, el diagnóstico clínico de síndrome de la BO se establecía si se cumplían cada uno de los siguientes criterios: FEV1/FVC <70% y un FEV1<75% del predicho con un deterioro ≥10% del FEV1 en menos de 2 años, ausencia de infección activa del tracto respiratorio en el momento del diagnóstico evidenciada por síntomas, radiografía de tórax o TC de tórax y estudios microbiológicos (cultivo de esputo, broncoaspirado o lavado broncoalveolar) y uno de los siguientes: presencia de atrapamiento aéreo en los cortes de espiración, engrosamiento de pequeña vía aérea o bronquiectasias en la TC alta resolución de tórax o evidencia de atrapamiento aéreo en las pruebas de función respiratoria, volumen residual (VR)>120% del predicho o VR/capacidad pulmonar total (TLC)>90%. Si el enfermo ya tenía diagnóstico de EICH por la afectación de algún órgano, entonces solo el primero de los 3 criterios era necesario para el diagnóstico de la BO. Si la BO era la única manifestación clínica, se requeriría una biopsia pulmonar para establecer el diagnóstico.
Para la detección de la BO es preciso realizar pruebas de función respiratoria y TC de tórax con cortes en espiración. Algunos estudios proponen realizar pruebas funcionales respiratorias cada 3 meses en los 2 primeros años tras el TPH. Si durante ese periodo de tiempo se diagnostica BO, recomiendan seguimiento trimestral. Por el contrario, en aquellos pacientes sin BO tras 2 años, proponen realizar controles espirométricos solo si presentan síntomas respiratorios1,8.
Recientemente, la European Society for Blood and Marrow Transplantation ha publicado un documento de consenso donde se recogen las recomendaciones de profilaxis y tratamiento de la EICH9. Para el manejo de la BO, recomiendan la terapia FAM: fluticasona inhalada 440μg/2 veces al día, azitromicina 250mg/3 veces a la semana y montelukast 10mg/una vez al día. Así mismo, aconsejan retirar azitromicina una vez alcanzado el control de la BO, ya que se ha descrito la posibilidad de recidiva de la enfermedad hematológica de base asociada a tratamientos prolongados9.
En este trabajo, concluimos que la BO es una complicación de la EICHc con alta mortalidad, rondando el 45%, que afecta en un 15% a los TPH alogénicos. Puede aparecer sola o asociada a otros órganos, por lo que su manejo debe ser multidisciplinar. Es de suma importancia el papel del neumólogo en el seguimiento de estos pacientes, siendo necesario realizar pruebas funcionales de forma reglada tras el TPH, así como estudios radiológicos y microbiológicos si presentan síntomas respiratorios, con el objetivo de diagnosticar y tratar precozmente la BO.