Introducción
El asma infantil es una enfermedad heterogénea, y se han descrito 3 tipos de síndromes que cursan con bronquitis sibilantes1: a) bronquitis sibilantes precoces y transitorias que se asocian a infecciones respiratorias y se limitan a los 3-5 primeros años de vida; b) bronquitis sibilantes de base no atópica, relacionadas con infecciones virales, que pueden persistir hasta los 11-13 años (asma no atópica), y c) bronquitis sibilantes asociadas a sensibilización alérgica, que corresponderían al fenotipo clásico de asma (asma atópica).
La incidencia de bronquitis sibilantes recurrentes en niños menores de 4 años es muy elevada, hasta un 34% en algunos estudios2. Alrededor de un 60% de estos niños corresponden al grupo de bronquitis sibilantes transitorias, un 20% al grupo de asma no atópica y aproximadamente el 20% serán finalmente diagnosticados de asma atópica3.
Actualmente el diagnóstico de asma en los niños de este grupo de edad es eminentemente clínico, apoyado en los antecedentes familiares y personales de atopia4,5. Debido a la importancia que tiene realizar un tratamiento precoz del asma, se está trabajando desde distintos puntos de vista (epidemiología, exploración funcional respiratoria, marcadores de la inflamación) para identificar tempranamente los niños con alto riesgo de continuar siendo asmáticos.
La hiperrespuesta bronquial es un rasgo característico del asma en niños mayores y adultos, y guarda una estrecha relación con la gravedad de los episodios de sibilancias en niños de 8 a 15 años6, aspecto que no se ha demostrado de forma clara en niños de 0 a 6 años7.
Para poder llegar al diagnóstico funcional de asma en los niños pequeños sería necesario demostrar la presencia de hiperrespuesta bronquial, pero su medida es difícil, ya que no pueden realizar las pruebas de función pulmonar o de provocación bronquial habituales en los niños mayores y adultos.
En niños mayores y adultos, para estudiar la hiperrespuesta bronquial se emplea la prueba de provocación bronquial con metacolina, en la que se valora la disminución del volumen espiratorio forzado en el primer segundo como variable de respuesta. Sin embargo, en niños pequeños estas pruebas no están estandarizadas, principalmente debido a cuestiones relacionadas con la seguridad y tolerancia de la prueba, y al escaso conocimiento de la respuesta broncoconstrictora normal en niños sanos.
La mayoría de los estudios sobre la hiperrespuesta bronquial en los niños pequeños se ha realizado utilizando como medida de la respuesta broncoconstrictora técnicas de función pulmonar en las que es preciso sedarlos, como la técnica de la compresión toracoabdominal rápida determinando el flujo máximo a capacidad residual funcional8,9, la pletismografía, la oscilometría de impulsos y las resistencias por oclusión10-12.
Se han desarrollado otras técnicas que no precisan sedación para valorar la respuesta broncoconstrictora: la medición de la presión transcutánea de oxígeno13,14 y el método de la auscultación traqueal15,16. Este último se ha validado en niños mayores, en los que se ha encontrado una buena correlación con los resultados de la provocación bronquial utilizando como variable de respuesta el volumen espiratorio forzado en el primer segundo17-19.
Con estas premisas, hemos realizado un estudio para valorar cuál es la respuesta a la metacolina en niños sanos, menores de 4 años de edad, mediante el método de la auscultación traqueal, con la finalidad de establecer un patrón de respuesta normal y determinar la seguridad de la prueba en los niños de esta edad.
Población y métodos
Para la realización del estudio se seleccionó a niños sanos procedentes del área de Barcelona, con edades comprendidas entre 6 meses y menos de 4 años. Se excluyó a aquéllos con antecedentes de prematuridad o bajo peso al nacer, los afectados de enfermedades cardiovasculares y/o pulmonares (incluidas las bronquitis sibilantes), y los niños con antecedentes familiares de atopia o tabaquismo pasivo. El estudio fue aprobado por el Comité de Ética en Investigación Clínica local y la inclusión de los niños se hizo tras informar a los padres y obtener su consentimiento por escrito.
Se realizó una prueba de provocación bronquial con metacolina utilizando el método de la respiración a volumen corriente durante 2 min. En esta técnica el aerosol se genera con un nebulizador de flujo continuo. Se nebulizaron 3 ml de soluciones de cloruro de metacolina (Provocholine®, Methapharm Inc., Brantford, Ontario, Canadá) diluidas en suero salino fisiológico, que el niño inhalaba respirando a volumen corriente durante 2 min20. Para realizar la prueba de metacolina debían cumplirse los siguientes requisitos: no haber presentado un cuadro catarral de vías altas en las 3 semanas anteriores, saturación basal de oxígeno del 95% o superior, auscultación respiratoria normal y ausencia de taquipnea. La prueba se realizó con el niño o niña en brazos del padre o la madre y durante la misma se creó un ambiente de juego con libros y muñecos adecuados a su edad.
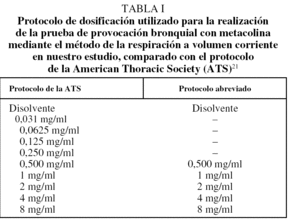
Se siguieron, con algunas modificaciones, las recomendaciones de la American Thoracic Society (ATS) para la realización de la prueba de broncoprovocación con metacolina en niños colaboradores y adultos21. En el protocolo de la ATS se utilizan concentraciones crecientes de metacolina, desde 0,031 mg/ml hasta 8 mg/ml, doblando la concentración en cada ocasión. De esta forma, incluyendo la administración del disolvente, el resultado es un total de 10 nebulizaciones. Dada la dificultad práctica de utilizar este número elevado de nebulizaciones en los niños pequeños, se confeccionó un protocolo abreviado, partiendo de concentraciones de 0,5 mg/ml (de forma que se emplearon únicamente 6 nebulizaciones, como se observa en la tabla I).
Las soluciones de cloruro sódico y de metacolina se administraron con un nebulizador y una mascarilla facial, empleando como fuente de nebulización una botella de aire comprimido que trabajaba a 15 psi de presión (1 bar). Se utilizó un nebulizador Micromist® (Hudson RCI, Temecula, Ca, EE.UU.), que proporciona un diámetro aerodinámico de masa media entre 1 y 3,6 µm. Se calibró el nebulizador para calcular el flujo de aire comprimido necesario para proporcionar un débito de 0,13 ml/min ± el 10%. Se calculó que un flujo de 4 l/min producía un débito dentro del rango requerido (0,13 ml/min ± el 10%).
La valoración de la respuesta al estímulo con la metacolina se realizó mediante el método de la auscultación traqueal modificado16. Se considera una respuesta positiva a una determinada concentración de metacolina (PCwheeze) cuando: se auscultan sibilancias claras en la tráquea o el tórax, la saturación de hemoglobina (SaO2) desciende un 5% o más sobre la SaO2 basal, o aumenta la frecuencia respiratoria un 50% o más sobre el valor basal.
Tras cada nebulización se auscultó la tráquea, la parte anterosuperior e inferoposterior del tórax, en fases de 20 s, y durante los 3 min siguientes se midieron cada minuto tanto la frecuencia respiratoria como la cardíaca y la SaO2. Si no había una respuesta positiva, se proseguía con la siguiente nebulización, hasta llegar a la concentración máxima de 8 mg/ml. En los casos con respuesta positiva se administró al niño salbutamol nebulizado.
Análisis estadístico
Para poder realizar los cálculos numéricos de la PCwheeze en los niños en que no se obtuvo respuesta con una concentración de metacolina de 8 mg/ml, se supuso que ésta era de 16 mg/ml.
El análisis estadístico de los datos obtenidos se realizó con el programa Medcalc® versión 8.1.1.0.
Para estudiar la normalidad de la distribución de las variables se aplicó la prueba de normalidad de Kolmogorov-Smirnov. Para realizar las comparaciones entre 2 grupos de variables cuantitativas se aplicó el test no paramétrico de la U de Mann-Whitney. La comparación entre las variables cualitativas se realizó mediante la prueba exacta de Fisher. Se estudió la relación entre variables cuantitativas mediante el coeficiente de correlación de Pearson. Se consideraron significativos valores de p < 0,05.
Resultados
Se realizó la prueba de broncoprovocación con metacolina a 16 niños (8 varones y 8 niñas) de 8 a 47 meses de edad (media: 23,9 meses; desviación estándar: 12,2 meses), cuyas características demográficas se resumen en la tabla II. En todos ellos pudo completarse la prueba. Ésta fue negativa en 11 casos (68,75%) que no demostraron respuesta tras inhalar la dosis máxima de metacolina (8 mg/ml). En 5 casos (31,25%) los niños presentaron algún signo de positividad a una concentración de metacolina de 8 mg/ml.
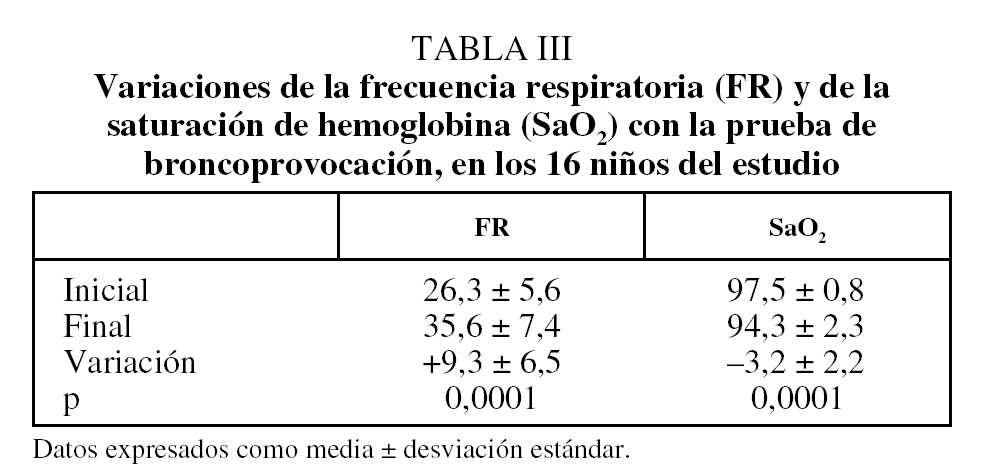
Suponiendo un valor de 16 mg/ml para los casos sin respuesta a la metacolina, el valor medio de la PCwheeze del grupo fue de 13,5 mg/ml (intervalo de confianza del 95%, 11,17-15,49). La concentración inferior que provocó una respuesta en nuestra serie sería de 8 mg/ml calculando un intervalo de referencia del 95% de una cola, mediante un método no paramétrico de percentiles, ya que los valores de metacolina en el grupo control no siguen una distribución normal (test de Kolmogorov-Smirnov: p = 0,003). No hubo relación entre la edad de los niños y la PCwheeze (r = 0,01; p = 0,98), ni diferencias en la respuesta según el sexo (p = 0,6).
La prueba se consideró positiva en 4 casos debido a la aparición de sibilancias traqueobronquiales (en uno junto a disminución de la SaO2) y en un caso a descenso aislado de la SaO2 mayor del 5%. La SaO2 descendió en los 16 niños un promedio del 3,2% (tabla III) y en ningún caso disminuyó por debajo del 93%. No se detectaron polipnea ni tiraje significativos en ningún caso. El incremento medio de la frecuencia respiratoria fue de 9,3 respiraciones/min (tabla III).
Durante la prueba presentaron tos 7 niños, de los que 4 respondieron luego a concentraciones de metacolina de 8 mg/ml. La tos apareció en la concentración previa a la positividad (4 mg/ml). Un niño cuya prueba de provocación fue positiva no presentó tos. En 3 niños ésta apareció en las últimas nebulizaciones, sin que presentaran criterios de positividad. No hubo pues relación entre la aparición de tos y la PCwheeze (p = 0,12).
Discusión
Hemos demostrado en nuestro estudio que la determinación de la respuesta bronquial a la metacolina utilizando la respiración a volumen corriente y el método modificado de la auscultación es factible y segura para realizar esta prueba a niños sanos menores de 4 años de edad, sin necesidad de recurrir a la sedación. Hemos comprobado que un 68% de los niños no presentan hiperrespuesta bronquial, mientras que aproximadamente un tercio reacciona a la metacolina sólo a la concentración máxima de 8 mg/ml. La prueba se muestra sencilla, y no precisa colaboración activa por parte de los niños.
El método fue factible, pues todos los niños incluidos fueron capaces de realizar la prueba en su totalidad.
Son numerosos los inconvenientes que pueden dificultar la realización de esta prueba en los niños pequeños: la falta de entendimiento de la prueba, la incomodidad que provoca la mascarilla facial necesaria para la nebulización, la sensación irritante que provoca la metacolina, junto con la aparición de tos, la sensación de dificultad respiratoria creciente que puede presentar el niño antes de que la prueba sea positiva y el cansancio producido por el tiempo necesario para realizarla. Para salvar estos inconvenientes es fundamental la colaboración de los padres del niño o la niña, que permanecen a su lado, y favorecer un ambiente amigable y de juego. También utilizamos una modificación del protocolo de la ATS21 para reducir la duración y así mejorar el cumplimiento22,23. Según el protocolo de la ATS, el niño debería realizar 10 inhalaciones para llegar al final de la prueba, cosa que difícilmente toleran de forma adecuada los lactantes, sobre todo en las últimas dosis. Para acortar el protocolo se puede: a) empezar a una concentración superior de metacolina, dado que la mayoría de respuestas positivas, salvo que los sujetos sean muy hiperreactivos, aparece por encima de la concentración de metacolina de 2 mg/ml; b) utilizar un incremento de la concentración o dosis en inhalaciones sucesivas superior al habitual, que suele ser del doble de la concentración o dosis anterior, y c) disminuir el tiempo de administración de la dosis. De esta forma, se considera que en pacientes con asma bronquial de carácter leve en fase estable que no precisan tratamiento con corticoides inhalados el riesgo de broncoconstricción grave iniciando la prueba con dosis o concentraciones mayores de metacolina es mínimo, mientras que en pacientes inestables es necesario iniciarla con las dosis o concentraciones mínimas21.
Dado que los niños sanos tienen un riesgo teóricamente bajo de presentar broncoconstricción, decidimos iniciar el test con una concentración superior (0,5 mg/ml, con inhalación previa del suero salino isotónico) y posteriormente, si no había clínica alguna, se usaron incrementos del doble de la concentración en las siguientes inhalaciones, lo que representa un total de 6 nebulizaciones. Esto favoreció la colaboración de los niños y contribuyó a mejorar el cumplimiento y la motivación. Aunque algunos autores proponen la realización de pruebas de broncoprovocación cortas con menor número de dosis de metacolina, incurren en el riesgo de provocar una broncoconstricción grave24. Nosotros, utilizando el protocolo acortado, no tuvimos ningún caso de crisis grave de broncoconstricción ni ninguna disminución importante de la SaO2.
La sensación irritante de las vías aéreas que ocasiona la metacolina y que a veces provoca tos puede alterar al niño y/o a la familia. Sin embargo, la tos puede no ser un signo de obstrucción de las vías aéreas. En nuestro trabajo la presentó el 44% de los niños, de forma independiente a la aparición de broncoconstricción. La tos con frecuencia precede a la obstrucción de la vía aérea, a veces aparece en alguna de las nebulizaciones de metacolina de forma aislada y cede al acabar su inhalación. Como señalan algunos autores16, posiblemente la tos indique un efecto dosis-respuesta de la metacolina como irritante de los receptores de la tos bronquiales y pulmonares más que un resultado de la broncoconstricción.
Además de factible, la prueba se ha mostrado segura. Para valorar la respuesta a la metacolina, junto a la auscultación hemos añadido al protocolo, como proponen Springer et al16, otros 2 criterios de respuesta: un descenso de la SaO2 del 5% o superior y el incremento de la frecuencia respiratoria (el doble de la basal o más).
Desde el punto de vista clínico, no se ha objetivado ninguna complicación en las 16 pruebas realizadas en niños sanos. Los 2 descensos de la SaO2 observados fueron del 93%, se autolimitaron al interrumpir la administración de metacolina y las cifras se normalizaron totalmente tras la nebulización de salbutamol, al igual que ocurrió en los 4 casos que presentaron sibilantes. Estos datos coinciden con otros estudios publicados que consideran también que es una prueba segura16,25-27. Únicamente Wilson et al28, en un estudio en niños de 5 años, encontraron que este método podía ser peligroso, aunque posteriormente su trabajo ha recibido críticas por parte de varios autores19,26 debido a problemas en la metodología utilizada que podían llevar a conclusiones equívocas.
La fiabilidad y utilidad de la prueba para valorar la respuesta a la metacolina se han validado previamente en estudios con niños colaboradores, donde se ha observado que la PCwheeze tiene una buena correlación con la PC20 (mediante espirometría) y es, pues, útil en la evaluación de la hiperrespuesta bronquial15,17,19,29. También se ha validado mediante la comparación de los resultados obtenidos con la auscultación con fonendoscopio y el análisis automatizado de sonidos pulmonares, lo que eliminaría la posible subjetividad del observador; también en este caso se ha observado una buena concordancia entre ambas técnicas25,30.
Al estudiar la hiperrespuesta bronquial en niños pequeños es esencial disponer de valores de normalidad en los niños sanos. Se ha comentado que los niños pequeños, al tener sus vías aéreas un menor calibre, podrían presentar una reacción aumentada a la metacolina y mostrar una "hiperrespuesta bronquial fisiológica". Otro factor importante que debe considerarse es la diferente dosis de metacolina en relación con el tamaño corporal que pueden recibir los niños pequeños en comparación con los niños mayores y adultos, y entre ellos. Al utilizar siempre una dosis estándar, en lugar de una dosis adaptada por el peso o la superficie corporal, los niños más pequeños recibirían una dosis proporcionalmente mayor, lo que podría hacer que reaccionaran con más intensidad a una misma dosis de metacolina31. Sin embargo, en el intervalo de edad que hemos estudiado no hubo diferencias en la respuesta entre los niños de diferentes edades. Sí encontramos que una parte de los niños sanos (un tercio en nuestra serie) puede reaccionar a la metacolina a concentraciones de 8 mg/ml, por lo que debería considerarse, según nuestros datos, una respuesta positiva únicamente por debajo de esta cifra. Estos resultados son similares a los de Guirau et al32 en niños menores de 2 años; dichos autores proponen un punto de corte de 4 mg/ml para considerar una respuesta positiva.
Por último, es importante utilizar una técnica estandarizada, que tenga en cuenta el tipo de nebulizador, el flujo utilizado y sobre todo la calibración del nebulizador para conseguir un mismo débito19. De estos factores puede depender en gran manera la cantidad de metacolina inhalada y, por tanto, la respuesta final del individuo. La adaptación del protocolo de la ATS21 facilita utilizar un protocolo estándar en los niños pequeños y obtener resultados comparables entre los diferentes estudios.
Creemos que el método de la auscultación traqueal modificado constituye una técnica segura y fiable para el estudio de la hiperrespuesta bronquial en los niños menores de 4 años sin necesidad de utilizar sedación. Disponer de valores de normalidad en esta edad es un punto de partida para la realización e interpretación de estudios en niños de esta edad afectados de asma bronquial, bronquitis sibilantes u otras enfermedades como la displasia broncopulmonar, lo que permitirá profundizar en su fisiopatología.
Estudio financiado con las siguientes ayudas: Beca SEPAR 2001, Beca Fundació Òscar Ravà de la FUCAP 2001 y Beca Fundació Goll i Gorina.
Correspondencia:
Dr. A. Moreno Galdó.
Unidad de Neumología Pediátrica y Fibrosis Quística.
Hospital Universitari Vall d'Hebron.
Pg. Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: amoreno@vhebron.net
Recibido: 21-12-2005; aceptado para su publicación: 2-8-2006.