La iniciativa global para el asma (GINA) ya desde su primera publicación en el año 1995, ilustró el tratamiento del asma utilizando la imagen de una escalera en la que cada peldaño significa un nivel de tratamiento acorde con la gravedad del paciente1. Este enfoque ha sido adoptado por la Guía Española para el Manejo del Asma (GEMA)2 y de gran valor para enfatizar el papel de la inflamación en la patogenia de la enfermedad, utilizar pruebas objetivas para el diagnóstico, generalizar el uso de medicación antiinflamatoria y destacar el importante papel de la educación. Sin embargo, el mejor entendimiento de la heterogeneidad del asma y su biología han desvelado ciertas limitaciones en las recomendaciones de las guías:
- La publicación del estudio GOAL en el año 2004 supuso la implantación de una estrategia de escalada progresiva del tratamiento del asma para lograr su control sin tener en cuenta la curva de dosis-respuesta para los corticosteroides inhalados (CI)3. En ensayos clínicos con propionato de fluticasona controlados con placebo, se observó que el 80% del beneficio clínico obtenido con 1.000 μg/día se lograba con dosis de 70–180 μg/día y el 90% con dosis de 100–250 μg/día4; dos estudios con budesonida, aleatorizados sin brazo placebo, en los que los autores examinaron dosis del fármaco > 800 μg/día, indicaron que había (si acaso) un mínimo beneficio clínico adicional con dosis de 3.200 μg/día en comparación con 1.600 μg/día, o de 1.600 μg/día en comparación con 400 μg/día5.
Reddel et al. apreciaron que hay un gran porcentaje de pacientes asmáticos sobretratados (aproximadamente el 50%), que pueden alcanzar menores dosis del CI si se mantienen los agonistas β-adrenérgicos de larga duración (LABA), y que esto ocurre sin aumento de parámetros inflamatorios como la fracción de óxido nítrico en el aire exhalado (FENO) o el recuento de eosinófilos en el esputo6. Si bien es cierto que GINA y GEMA recomiendan reducir la dosis de medicación una vez alcanzado el control, lo cierto es que esto se hace menos de lo debido: Se ha observado que el 85% de los cambios en la medicación implican un aumento contra sólo un 15% de reducciones7.
Estos son datos relevantes por cuanto sabemos que dosis altas de CI conllevan efectos adversos, que podríamos considerar dosis altas ≥ 500 μg/día de propionato de fluticasona o equivalente8 y que esto se podría evitar utilizando biomarcadores de inflamación T2 para ajustar el tratamiento9,10. Green et al. demostraron que usar el recuento de eosinófilos en el esputo para el ajuste terapéutico permitía reducir exacerbaciones en pacientes con asma moderada-grave en comparación con el seguimiento de las recomendaciones de las guías sin que ello redundase en una mayor dosis de corticoides. Es decir, con la misma dosis se logró un mejor control, evitando futuras escaladas terapéuticas en un porcentaje importante de pacientes9. Otro estudio demostró la capacidad discriminativa de la FENO (con un punto de corte de 30 ppb) para predecir la respuesta a un incremento de dosis de CI en asmáticos graves, lo que permitió evitar una sobredosificación de estos10.
- Hoy sabemos que la respuesta inflamatoria no es la misma en todos los asmáticos y que puede cambiar a lo largo del tiempo en un mismo individuo. El estudio seminal del Woodruff et al. mostraron que sólo respondían a un CI aquellos asmáticos (con una forma leve de la enfermedad) que expresaban genes Th2 en las células del epitelio bronquial11. Estos datos fueron corroborados en el estudio SIENA, en el que se evidenció una mayor respuesta clínica a mometasona que a placebo en pacientes con ≥ 2% eosinófilos en el esputo, pero no en pacientes por debajo de este umbral12. Por otra parte, es bien conocido que la respuesta a los CI está atenuada en pacientes asmáticos que fuman13. Una caracterización biológica más detallada de los pacientes permitiría evitar que los clínicos actúen aumentando el tratamiento antiinflamatorio en pacientes que no responderán a dosis altas y, por tanto, evitar efectos adversos sin beneficio.
- La GINA y GEMA recomiendan un aumento terapéutico en caso de que no se logre el control del asma y muestran una tabla de equipotencia de los CI, pero no tienen en cuenta un cambio en los principios activos o en los dispositivos. Sin embargo, no todos los fármacos son iguales. Hay grandes diferencias en la potencia y en el índice terapéutico entre los diferentes CI14 y probablemente también en los LABA. Aunque faltan estudios comparativos entre diferentes CI, la experiencia clínica nos dice que es posible alcanzar el control sustituyendo un fármaco por otro sin necesidad de aumentar la dosis.
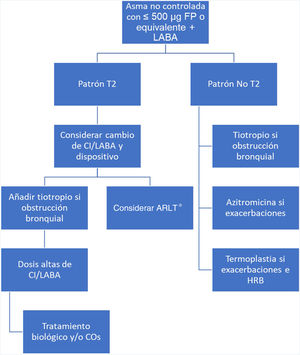
Señalar defectos de un plan estratégico es relativamente sencillo, pero proponer una alternativa no lo es tanto. Creemos que la propuesta de la figura 1 podría ser adecuada, ya que tendría en cuenta el sustrato biológico, consideraría la diferencia farmacológica entre los diferentes CI e introduciría otros fármacos controladores antes de llegar a dosis potencialmente peligrosas. Este enfoque se centra en los pacientes que pueden ser «sobretratados» con mayor probabilidad, es decir, los que no alcanzan un control con 500 μg de propionato de fluticasona o equivalente. Adoptarlo supone diferenciar con precisión qué pacientes tienen un patrón biológico T2, lo que nos obliga a utilizar biomarcadores (FENO, eosinófilos en esputo) que, o bien no tienen un punto de corte firmemente establecido (FENO) o son técnicamente dificultosos (esputo inducido). El empleo de la FENO está más extendido y es más factible, y quizás un punto de corte de 20-30 ppb podría ser razonable de acuerdo con los estudios disponibles14,15. El uso de un broncodilatador como el tiotropio estaría restringido a pacientes con obstrucción bronquial o con un valor de FEV1 por debajo del mejor valor personal. Para que esta estrategia sea más que una propuesta debería ser contrastada frente al punto de vista que defienden las guías en un estudio prospectivo, abierto, con dos brazos.
Algoritmo terapéutico para el tratamiento del asma no controlada con dosis elevadas de corticoide inhalado.
FP: Propionato de fluticasona; LABA: Agonistas β-adrenérgicos de larga duración; T2: Inflamación mediada por células T helper tipo 2 (Th2) o por células linfoides innatas tipo 2 (CLI-2); CI: Corticosteroides inhalados; ARLT: Antagonistas de los receptores de leucotrienos (*: especialmente indicados en pacientes en los que predomina la alteración inflamatoria frente a la alteración funcional en pacientes con afectación de vía aérea superior, alergia clínicamente relevante o enfermedad respiratoria exacerbada por ácido acetilsalicílico); COs: Corticosteroides orales; HRB: Hiperrespuesta bronquial.
-LPLL ha recibido honorarios y apoyo no financiero de NOVARTIS, becas y honorarios de ASTRA-ZENECA, honorarios y apoyo no financiero de GSK, becas, honorarios y apoyo no financiero de TEVA, honorarios y apoyo no financiero de BOEHRINGER-INGELHEIM, becas y honorarios de CHIESI, honorarios de SANOFI, apoyo no financiero de de MENARINI, honorarios y apoyo no financiero de MUNDIPHARMA, y honorarios y apoyo no financiero de de ESTEVE no relacionados con este artículo.
-VP, en los últimos tres años, ha recibido honorarios como conferenciante en reuniones patrocinadas de AstraZeneca, Boehringer-Ingelheim, MSD y Chiesi. Ha recibido ayudas para asistir a congresos de AstraZeneca, Chiesi y Novartis. Ha sido consultor para ALK, AstraZeneca, Boehringer, MSD, Mundipharma y Sanofi. Y ha recibido financiación o becas para proyectos de investigación de diversas agencias gubernamentales y fundaciones sin ánimo de lucro, así como de AstraZeneca, Chiesi y Menarini.
-S Quirce ha organizado actividades formativas y de consultoría y ha recibido honorarios como conferenciante de ALK, AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Leti, Novartis, Regeneron Pharmaceuticals, Sanofi y Teva.