La hipoxia tisular estimula la producción de eritropoyetina (EPO) que tiene como principal función estimular la eritropoyesis. El SAHS es una entidad caracterizada por la presencia de episodios repetidos de hipoxemia durante el sueño.
ObjetivoAnalizar si dicha hipoxemia es un estímulo suficiente para incrementar la excreción urinaria de EPO. Si la respuesta fuera positiva, valorar si el tratamiento con presión continua positiva de la vía aérea (CPAP) la inhibiría.
MétodosSe han estudiado 25 sujetos con sospecha de SAHS, a los que se les realizó un estudio polisomnográfico. En todos ellos se determinaron los niveles de EPO en la primera orina de la mañana (uEPO), así como los niveles de creatinina y hemoglobina en sangre. En los pacientes con SAHS grave se repitieron las mismas determinaciones tras el tratamiento con CPAP.
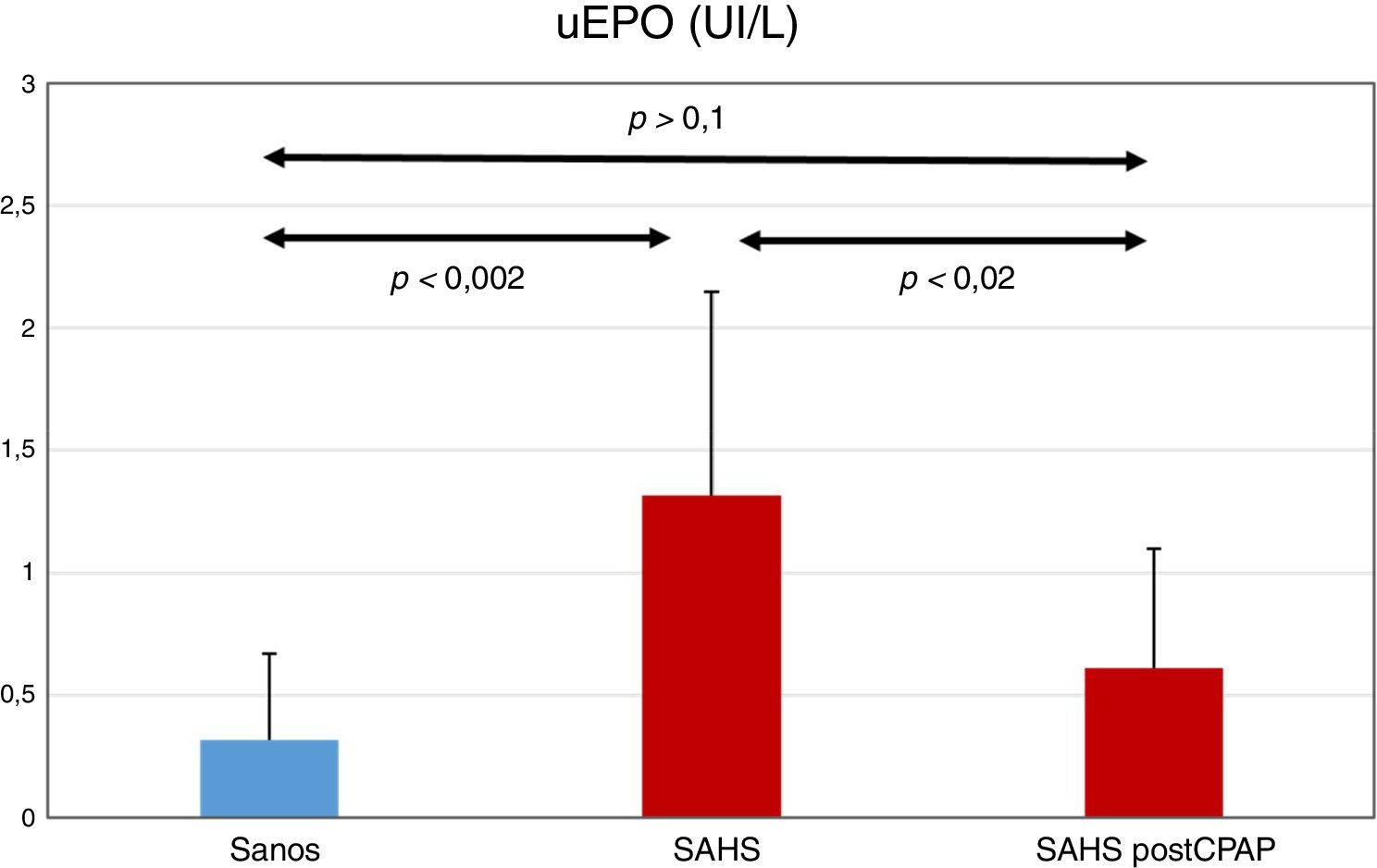
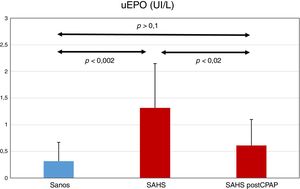
ResultadosDoce sujetos fueron diagnosticados de SAHS grave (media ± SD, IAH de 53,1 ± 22,7). La creatinina y la hemoglobina fueron normales en todos los sujetos. La uEPO fue cuatro veces superior en el grupo SAHS respecto a los controles (1,32 ± 0,83 vs. 0,32 ± 0,35 IU/l, p < 0,002). El tratamiento con CPAP descendió la uEPO hasta 0,61 ± 0,49 IU/l (p < 0,02), acercándose al valor de los sujetos sanos. No se observó una relación dosis-respuesta entre la gravedad de las alteraciones de la PSG y los valores de uEPO.
ConclusionesLos pacientes con SAHS grave muestran un incremento en su excreción de uEPO, que se normaliza tras el tratamiento con CPAP.
Tissue hypoxia stimulates the production of erythropoietin (EPO), the main effect of which is, in turn, to stimulate erythropoiesis. Sleep apnea-hypopnea syndrome (SAHS) is an entity characterized by repeated episodes of hypoxemia during sleep.
ObjectiveTo analyze whether hypoxemia stimulated increased urinary excretion of EPO, and if so, to evaluate if treatment with continuous positive airway pressure (CPAP) can inhibit this phenomenon.
MethodsWe studied 25 subjects with suspected SAHS who underwent a polysomnography study (PSG). EPO levels in first morning urine (uEPO) and blood creatinine and hemoglobin were determined in all patients. Patients with severe SAHS repeated the same determinations after CPAP treatment.
ResultsTwelve subjects were diagnosed with severe SAHS (mean ± SD, AHI 53.1 ± 22.7). Creatinine and hemoglobin levels were normal in all subjects. uEPO was 4 times higher in the SAHS group than in the control group (1.32 ± 0.83 vs. 0.32 ± 0.35 UI/l, p <.002). CPAP treatment reduced uEPO to 0.61 ± 0.9 UI/l (p <.02), levels close to those observed in healthy subjects. No dose-response relationship was observed between severity of PSG changes and uEPO values.
ConclusionsPatients with severe SAHS show increased uEPO excretion, but this normalizes after treatment with CPAP.
El síndrome de apneas-hipopneas del sueño (SAHS) es una enfermedad muy prevalente en la población adulta1, que a consecuencia de múltiples y repetidos episodios de obstrucción de la vía aérea superior produce disrupción del sueño, microdespertares, hipoxemia e hipercapnia de duración e intensidad variable durante el sueño2. Su impacto sobre la calidad de este, la calidad de vida relacionada con la salud, la somnolencia diurna y la morbimortalidad cardiovascular han sido ampliamente estudiados2. Sin embargo, los intentos para conocer la repercusión de la hipoxemia intermitente producida por el SAHS sobre la eritropoyesis han sido escasos, y en general muestran resultados divergentes.
La EPO humana es una hormona glicoproteica de 30,4 kDa, compuesta por una única cadena de 165 aminoácidos a la que están unidos cuatro glicanos. Los riñones son la principal fuente de EPO aunque su RNA mensajero (mRNA) también se ha detectado en el hígado, bazo, médula ósea, pulmón y cerebro. La concentración circulante de EPO se incrementa exponencialmente con el descenso de la presión parcial y contenido tisular de oxígeno (PtiO2 y CtiO2, respectivamente) que a su vez dependen del flujo local sanguíneo, la concentración de hemoglobina (Hb), la presión parcial de oxígeno en la sangre arterial (PaO2) y la afinidad Hb-O2. Sin embargo, y comparado con otros órganos, la PtiO2 y la CtiO2 en la corteza renal se ven poco afectadas por los cambios en el flujo sanguíneo, por lo que es muy apropiada para la regulación de la producción de EPO.
En la médula ósea, la EPO promueve la supervivencia, proliferación y diferenciación de progenitores eritrocíticos, particularmente las unidades formadoras de sus colonias. Desde que se incrementa la producción de EPO hasta que entran más reticulocitos al torrente sanguíneo pasan aproximadamente 4 días. Esta hormona tiene un metabolismo hepático y es eliminada por la orina3.
Diversos estudios han intentado demostrar que los episodios de hipoxia intermitente característicos del SAHS estimulan la producción de EPO, pero los resultados obtenidos son diversos. Por ejemplo, Cahan et al. demostraron que la EPO se eleva en plasma durante el día4 en los pacientes con SAHS e hipoxemia. Posteriormente comprobaron que el tratamiento con CPAP normaliza estos incrementos5. Otros autores han demostrado resultados similares, aunque solo en SAHS graves y no en leves-moderados6 o han reportado incrementos discretos de la EPO7. Sin embargo, estos resultados no han podido ser reproducidos por autores como Mckeon et al.8, Pokala et al.9, Ryan et al.10 y Ciftci et al.11.
Recientemente Zhang et al.12 han intentado clarificar estos resultados parciales y contradictorios publicando un metaanálisis que incluye un total de 9 estudios y 407 pacientes en los que se había evaluado los niveles plasmáticos de EPO. Concluyen que la EPO plasmática es significativamente superior en pacientes con SAHS que en sujetos normales. Además, comprueban que dentro del grupo de pacientes con SAHS la EPO plasmática es superior en pacientes con complicaciones cardiovasculares y, sorprendentemente, en sujetos con un índice de masa corporal < 30.
La disparidad de resultados en el efecto que tiene el SAHS sobre los niveles de EPO en plasma permite proponer la hipótesis de que la determinación de uEPO podría ser un marcador más sensible que la EPO plasmática. Más concretamente si se analiza la primera orina de la mañana que concentra la excreción de, al menos, parte de la noche. Esta hipótesis se plantea teniendo en cuenta tres consideraciones: 1) la EPO se excreta por vía urinaria3, 2) su pico máximo de producción se produce a primera hora de la madrugada4 y 3) el estímulo hipóxico del SAHS se produce durante la noche.
Así, el objetivo principal del presente estudio fue comprobar si el SAHS es un estímulo suficiente para incrementar la concentración de uEPO en la primera orina de la mañana. Como objetivo secundario y siempre que el primario se cumpliera, se planteó el comprobar si en tratamiento con CPAP, al eliminar el estímulo hipóxico del SAHS, es capaz de disminuir la concentración matinal de uEPO.
Material y métodosLos sujetos participantes en el estudio, remitidos a la unidad Multidisciplinar de Trastornos del Sueño de nuestra institución por sospecha de SAHS, fueron reclutados de forma consecutiva. El estudio fue aprobado por el comité local de ensayos e investigación clínica (CEIC) y todos los sujetos incluidos firmaron el consentimiento informado. Las variables clínicas, demográficas y antropométricas se obtuvieron en el momento del estudio polisomnográfico, que se efectuó a todos los participantes en el estudio. Los pacientes con saturación en reposo baja (SatO2 ≤ 92%) por cualquier patología subyacente, pacientes con SAHS no tributarios de tratamiento con CPAP y/o con enfermedades renales y hepáticas fueron excluidos del estudio.
DiseñoEs un estudio con una fase inicial de tipo observacional y una segunda de intervención. En la primera etapa, y a tenor de los resultados de la PSG, se obtuvieron dos grupos de individuos: control (n=13) y pacientes con SAHS grave (n=12). De acuerdo con nuestro objetivo secundario los componentes del grupo SAHS eran todos tributarios al tratamiento con CPAP. Tras un periodo de 3 a 6 meses de tratamiento fueron revaluados en la segunda fase.
Estudio del sueñoLa evaluación del SAHS fue realizada por personal médico especialista en las patologías del sueño. Incluyó el test de somnolencia de Epworth13 y la realización e interpretación de una PSG. En ella se registró electroencefalograma, electrooculograma, electromiograma, electrocardiograma, movimientos torácicos y abdominales, flujo nasobucal, pulsioximetría, movimientos de piernas y posición corporal (equipo eXea Series 5, Bitmed, Zaragoza, España).
El promedio de apneas e hipoapneas obstructivas por hora se definió como índice de apnea-hipoapnea (IAH), mientras que el promedio de desaturaciones (disminución de ≥ 3%) por hora se definió como índice de desaturación (IDH). El porcentaje de tiempo durante el estudio con la SatO2 inferior al 90% se definió con CT90%. Se estableció el diagnóstico de SAHS a partir de un IAH >10, considerándose como grave con un IAH > a 30. El grupo de pacientes con SAHS recibió tratamiento con CPAP graduada de forma automática (equipo Autoset S9 y software ResScan, ResMed, San Diego, EE. UU.), para decidir la presión óptima. El IAH residual se obtuvo durante la graduación automática.
Determinación de la eritropoyetina urinariaLa uEPO se cuantificó utilizando un kit EPO ELISA comercialmente disponible (STEMCELL Technologies, Vancouver, Canadá). Siguiendo las instrucciones del fabricante se adaptó el kit, inicialmente desarrollado para muestras de suero, para ser utilizado en muestras de orina. Dichas muestras (15ml) se concentraron antes de la cuantificación por 10 veces mediante ultrafiltración (MWCO 30 kDa). La curva de calibración también se diluyó adecuadamente en PBS (phosphate buffered saline) y se sometió al mismo procedimiento de ultrafiltración.
El dispositivo de ultrafiltración fue Amicon Ultra-15 (Merck Millipore, Darmstadt, Alemania), con un corte de peso molecular de 30 kDa. Se activó añadiendo 15mL de agua MilliQ y se centrifugó a 4.000g durante 1-2min a 20°C. A todas las muestras se les añadieron 1,5ml de tampón Tris-HCl 3,75M a pH 7,4 y 300μl de Complete Protease Inhibitor Cocktail (Sigma-Aldrich, St. Louis, EE. UU.). Posteriormente, se agitaron suavemente y se sonicaron durante 5 min para facilitar el paso a través del dispositivo de filtración y se centrifugaron a 4.000g durante 15 min a 20°C. El sobrenadante se filtró en vacío a través de un dispositivo Steriflip de 0,22μm (Merck Millipore, Darmstadt, Alemania).
El filtrado de cada muestra se transfirió al dispositivo activado antes mencionado. Lo retenido se lavó dos veces con 15ml de tampón Tris-HCl 50mM, a pH 7,4 suplementado con 300μl Complete ™ y se centrifugaron a 4.000×g durante 25min a 20°C hasta obtener aproximadamente 200μl. Se transfirió entonces a un nuevo tubo de Eppendorf y se mantuvo a -20°C hasta el análisis de EPO.
Siguiendo las instrucciones del fabricante del kit ELISA, las muestras se diluyeron 10 veces con el tampón B suministrado antes de la aplicación sobre la placa de micropocillos anti-EPO. En las muestras de ensayo que mostraban valores de absorbancia fuera de escala, se realizó una dilución extra con tampón B, y se analizaron de nuevo junto con los patrones. Los coeficientes de variación intraensayo e interensayo fueron <15%. El análisis de datos se realizó automáticamente con el software MyAssays (MyAssays Ltd., Brighton, East Sussex, Reino Unido).
Análisis estadísticoLos datos se expresan como media ± desviación estándar. Las diferencias clínicas entre los tres grupos se analizaron mediante la prueba t de Student, la prueba U de Mann-Whitney, la prueba Chi-Square o la prueba exacta de Fisher, según correspondió. La correlación entre los valores de IAH, IDH, CT90%, SatO2 media y SatO2 mínima y los niveles de uEPO se midieron mediante la prueba de correlación de Spearman. Todas las pruebas estadísticas se consideraron estadísticamente significativas con valores de p < 0,05. Hemos calculado el tamaño de la muestra con tamaño de universo de 1.000 pacientes, un nivel de confianza del 90%, un precisión del 10% y una proporción del 50%. La n así calculada era de 60 pacientes en dos grupos.
Los datos fueron analizados con la versión 22 de SPSS (IBM Corp., Armonk, EE. UU.).
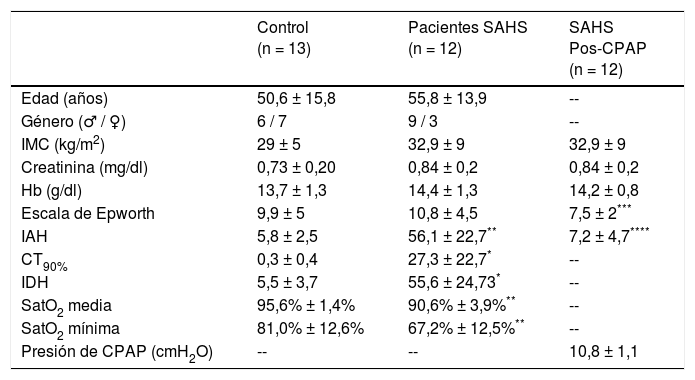
ResultadosPoblaciónUn total de 31 sujetos fueron inicialmente considerados para su inclusión. De estos, 25 fueron finalmente incluidos en el estudio. Los 6 restantes fueron excluidos debido a su renuncia a participar, por tener una baja SatO2 basal o un alto nivel de creatinina sérica. Las características clínicas de la población se resumen en la tabla 1. De los 25 pacientes estudiados, 12 fueron diagnosticados de SAHS, con una media de IAH de 56,1 ± 22,7, IDH de 53,6 ± 24,3, CT90% de 27,3% ± 22,7%, SatO2 media de 90,6% ± 3,9% y SatO2 mínima 67,2% ± 12,4%. Como era de esperar, estas variables fueron mayores en los pacientes con SAHS respecto de los controles. No se observaron diferencias significativas en edad, índice de masa corporal y niveles de creatinina y hemoglobina entre los dos grupos. La somnolencia medida con la escala de Epworth no fue estadísticamente diferente entre el grupo control (9,9 ± 5) y el de SAHS (10,8± 4,5). Sin embargo, en este último grupo descendió significativamente tras el tratamiento con CPAP (7,5 ± 2) (tabla 1).
Población: datos clínicos y polisomnográficos
| Control (n = 13) | Pacientes SAHS (n = 12) | SAHS Pos-CPAP (n = 12) | |
|---|---|---|---|
| Edad (años) | 50,6 ± 15,8 | 55,8 ± 13,9 | -- |
| Género (♂ / ♀) | 6 / 7 | 9 / 3 | -- |
| IMC (kg/m2) | 29 ± 5 | 32,9 ± 9 | 32,9 ± 9 |
| Creatinina (mg/dl) | 0,73 ± 0,20 | 0,84 ± 0,2 | 0,84 ± 0,2 |
| Hb (g/dl) | 13,7 ± 1,3 | 14,4 ± 1,3 | 14,2 ± 0,8 |
| Escala de Epworth | 9,9 ± 5 | 10,8 ± 4,5 | 7,5 ± 2*** |
| IAH | 5,8 ± 2,5 | 56,1 ± 22,7** | 7,2 ± 4,7**** |
| CT90% | 0,3 ± 0,4 | 27,3 ± 22,7* | -- |
| IDH | 5,5 ± 3,7 | 55,6 ± 24,73* | -- |
| SatO2 media | 95,6% ± 1,4% | 90,6% ± 3,9%** | -- |
| SatO2 mínima | 81,0% ± 12,6% | 67,2% ± 12,5%** | -- |
| Presión de CPAP (cmH2O) | -- | -- | 10,8 ± 1,1 |
Los datos se presentan como valores medios ± desviación estándar.
CT90%: porcentaje de tiempo nocturno con saturación de oxígeno < 90%; Hb: hemoglobina en suero; IAH: índice apnea-hipopnea por hora; IDH: índice de desaturaciónes (3%) por hora; IMC: índice de masa corporal; SatO2 media: valor medio de la saturación de oxígeno durante la noche; SatO2 mínima: valor mínimo de la saturación de oxígeno durante la noche.
La presión media de CPAP que se aplicó como tratamiento a los pacientes con SAHS fue de 10,8 ± 1,1 cmH2O, y el IAH residual tras un periodo de 3 a 6 meses de tratamiento fue de 7,2 ± 4,7 cmH2O.
En el grupo control, 2 pacientes tenían alteraciones cardiovasculares asociadas, en ambos casos eran arritmias supraventriculares. En el grupo con SAHS, 3 pacientes eran hipertensos y uno tenía una enfermedad pulmonar obstructiva crónica de grado moderado. Ninguno era fumador activo.
Niveles de uEPOLos valores de uEPO fueron mayores en el grupo SAHS en comparación con el grupo control: 1,32 ± 0,83 frente a 0,32 ± 0,35 UI / L, respectivamente (p < 0,002). El tratamiento con CPAP disminuyó la concentración de uEPO hasta 0,61 ± 0,49 UI / L (p < 0,02), valor no estadísticamente diferente al inicial del grupo control (p > 0,1) (fig. 1).
No se encontró ninguna correlación significativa entre las variables polisomnográficas que definen la gravedad de la enfermedad (IAH, IDH, CT90%, SatO2 media y SatO2 mínima) y los niveles de uEPO.
DiscusiónEste estudio demuestra que los pacientes con SAHS tienen incrementada la concentración de uEPO en la primera orina de la mañana en comparación con sujetos controles. Por otra parte, la aplicación de CPAP como tratamiento del SAHS disminuye la uEPO hasta niveles similares a los de los sujetos sanos.
Estos resultados son concordantes con los obtenidos por Cahan et al.4 y Winnicki et al.6, que comprobaron que los pacientes con SAHS grave incrementan la concentración plasmática de EPO. Cahan et al.5 demostraron posteriormente que el tratamiento con CPAP es capaz de normalizar dicho incremento de concentración. La aportación más importante del presente estudio es que este comportamiento, conocido en plasma12, se observa también en orina, que es un muestra más fácil y menos invasiva de obtener.
En la población estudiada, el incremento de la uEPO no se tradujo en un incremento relevante de la concentración de hemoglobina en sangre, aunque los valores medios en el grupo SAHS eran ligeramente superiores a los del grupo control (tabla 1). Este es un resultado esperado ya que la policitemia secundaria es un hallazgo raro en pacientes con SAHS y solo se observa en aproximadamente el 1% de los casos14. Solo en grandes muestras de pacientes, como la publicada por Hoffstein et al.15 (624 enfermos), se alcanzan diferencias muy discretas, pero significativas, respecto de los sujetos sanos.
El efecto del tratamiento con CPAP, disminuyendo la excreción de uEPO, es concordante con el observado por este mismo tratamiento sobre la policitemia14 que también la normaliza. Recientemente Song et al.16, en un artículo pendiente de publicación, demuestran que la CPAP corrige la hipoxia intermitente producida por el SAHS, inhibe la producción de EPO y además pone en marcha la neocitólisis. Este es el principal mecanismo responsable de la rápida normalización del número de glóbulos rojos al eliminar el estímulo de la hipoxia intermitente.
Un dato, hasta cierto punto sorprendente de nuestro estudio, es que no se han hallado correlaciones entre las variables que habitualmente se utilizan para cuantificar la gravedad del SAHS (IAH, IDH, CT90%, SatO2 media y SatO2 mínima) y la concentración de uEPO en el grupo de pacientes con SAHS. Probablemente esto es así porque estas variables no son un buen indicador del nivel de PtiO2 en la corteza renal que es el estímulo necesario para incrementar la producción de EPO. Es bien conocido que el SAHS se asocia a edad avanzada e hipertensión, lo que puede producir disfunción endotelial10 y con el tiempo afectar la circulación, especialmente la cerebral17. Estos cambios en la circulación local pueden justificar que variables sistémicas como el IAH, IDH, CT90%, SatO2 media y SatO2 mínima no sean un buen reflejo de lo que está pasando a nivel de la PtiO2 en la corteza renal.
Pero no hace falta que existan cambios estructurales crónicos en la circulación local para comprobar diferentes comportamientos de la PtiO2 en distintos tejidos en presencia de apneas. Los estudios de Almendros et al. demuestran en un modelo murino de apneas obstructivas que la PtiO2 cerebral se incrementa con las apneas18, fenómeno que no ocurre en el tejido muscular y en la grasa visceral19. Estos autores comprueban que esta respuesta diferencial cerebral es dependiente de la hipercapnia que se produce durante las apneas y no se observa en un modelo de hipoxia intermitente sin hipercapnia19. Todos estos factores, estado estructural de la circulación local, presencia o no de hipercapnia y el grado de respuesta de la circulación local a la hipercapnia parecen ser factores importantes para determinar la PtiO2 a nivel de la corteza renal que no pueden ser medidos simplemente con el IAH, IDH, CT90%, SatO2 media y SatO2 mínima y podrían justificar la falta de correlación con la uEPO. En este sentido es probable especular que otras variables como la PO2 transcutánea o la espectroscopia de infrarrojos (near-infrared spectroscopy)20 pudieran dar una información más cercana a la PtiO2 real en este tipo de pacientes21.
De todas formas, cabe también destacar que la muestra de este estudio fue calculada y ha sido suficiente para demostrar los 2 objetivos principales que nos propusimos, pero es insuficiente si lo que pretendemos es encontrar correlaciones entre las variables polisomnográficas y la uEPO. Si se plantea ese objetivo hace falta, además de otra tecnología, una muestra mayor.
Cabe destacar que el grupo de pacientes con SAHS eran graves y probablemente esta característica ayuda a encontrar diferencias de la uEPO respecto a sujetos controles. Sin embargo, estos datos no permiten predecir si ocurrirá lo mismo en pacientes SAHS leves o moderados. Un estudio específico para cuantificar la uEPO en esta población es necesario.
En definitiva, el presente estudio demuestra que en un grupo de pacientes con SAHS grave la uEPO está claramente incrementada en comparación con la observada en el grupo control. La determinación en la orina matinal de esta hormona se plantea como una aproximación sencilla para futuros trabajos. Además, el tratamiento con CPAP fue capaz de disminuir este incremento hasta niveles cercanos a la normalidad. Probablemente hagan falta más estudios con población más amplia e incorporando otras variables fisiológicas y biológicas para determinar mejor los mecanismos e implicaciones clínicas de estos hallazgos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.