El principal factor de riesgo del cáncer de pulmón es el tabaco, cuyo consumo varía según la edad y el sexo. El objetivo de este trabajo es describir la tendencia de la mortalidad por cáncer de pulmón por sexo y edad desde 1980 hasta 2013 en España.
MétodosSe utilizaron los datos de mortalidad por cáncer de pulmón (código 162 para la novena revisión de la Clasificación Internacional de Enfermedades y códigos C33 y C34 para la décima revisión) y los datos de población proporcionados por el Instituto Nacional de Estadística. Se calcularon las tasas de mortalidad bruta, truncada, ajustada por edad y específicas por edad y se estimó el cambio porcentual anual (CPA) mediante un modelo de regresión joinpoint.
ResultadosLa tasa ajustada por edad aumentó significativamente de 1980 a 1991 entre hombres (CPA=3,12%) y descendió significativamente desde 2001 hasta 2013 (CPA=−1,53%), con un patrón similar observado para tasas específicas según grupos de edad. Entre mujeres, la tasa ajustada por edad aumentó desde 1989 (CPA de 1989 a 1997=1,82%), con un aumento más pronunciado desde 1997 hasta el final del estudio en 2013 (CPA=4,41%).
ConclusionesLas tendencias divergentes en la prevalencia de tabaco podrían explicar el aumento de la mortalidad por cáncer de pulmón entre las mujeres españolas desde los inicios de los años noventa. Se deberían implementar políticas de salud pública enfocadas a ayudar a la reducción del consumo de tabaco entre las mujeres fumadoras, y detener el aumento de la mortalidad por cáncer de pulmón.
The main risk factor for lung cancer is smoking, a habit that varies according to age and sex. The objective of this study was to explore trends in lung cancer mortality by sex and age from 1980 to 2013 in Spain.
MethodsWe used lung cancer mortality (International Classification of Diseases code 162 for the 9th edition, and codes C33 and C34 for 10th edition) and population data from the Spanish National Statistics Institute. Crude, truncated, age-adjusted mortality and age-specific mortality rates were assessed through joinpoint regression to estimate the annual percent change (APC).
ResultsAge-adjusted mortality rate significantly increased from 1980 to 1991 among men (APC=3.12%) and significantly decreased between 2001 and 2013 (APC=−1.53%), a similar pattern was observed in age-specific rates. Among women, age-adjusted mortality rate increased from 1989 (APC 1989-1997=1.82%), with the greatest increase observed from 1997 until the end of the study in 2013 (APC=4.41%).
ConclusionsDiverging trends in the prevalence of smoking could explain the increase in the rate of lung cancer-related mortality among Spanish women since the early 1990s. Public health policies should be implemented to reduce tobacco consumption in women and halt the increase in lung cancer mortality.
Las enfermedades no transmisibles son la principal causa de morbimortalidad en los países desarrollados1–3. El consumo de tabaco está altamente asociado con el riesgo de mortalidad de las enfermedades no transmisibles, como también ocurre con el consumo excesivo de alcohol, una mala dieta y la falta de actividad física1,3. Por otra parte, el consumo de tabaco es la principal causa de muertes evitables a nivel mundial4, siendo el principal factor de riesgo del cáncer de pulmón5. En el año 2000 se estimó que 4,83 millones de muertes prematuras en todo el mundo eran atribuibles a fumar, y un 17% de ellas fueron causadas por el cáncer de pulmón6. En España, se ha estimado que el 31% de las 53.155 muertes ocurridas en 2006 atribuibles al consumo de tabaco fueron por cáncer de pulmón7. Además, se estimó que para el año 2014 la incidencia del cáncer de pulmón en España sería de 22.455 casos para los hombres y 5.404 casos para las mujeres, con una tasa ajustada por la población mundial de 51,7 y 11,8 por cada 100.000 hombres y mujeres, respectivamente8.
La tendencia temporal del consumo de tabaco podría predecir la incidencia y la mortalidad por cáncer de pulmón9. Sin embargo, el largo intervalo de tiempo entre el inicio del consumo de tabaco y la aparición o diagnóstico del cáncer de pulmón hace de esta enfermedad un mal indicador para evaluar el resultado de la implementación de las políticas de control de tabaquismo actuales: cuando la prevalencia del consumo de tabaco desciende, la mortalidad debida al cáncer de pulmón puede crecer todavía, por el efecto de los niveles previos de tabaquismo.
El inicio del hábito tabáquico y su permanencia difiere con respecto al sexo y a la edad. En España, se han observado diferencias según el sexo en la prevalencia de consumo de tabaco, siendo mayor siempre en hombres, aunque se haya estancado e incluso disminuido en los últimos años mientras ha aumentado el consumo entre las mujeres10. En este sentido, el Índice de Desigualdad de Género (IDG) refleja la pérdida en desarrollo potencial debido a la desigualdad entre hombres y mujeres mediante la medición de 3 dimensiones: la salud reproductiva, el empoderamiento y el mercado laboral. Se ha observado una alta correlación (r=−0,99) entre el IDG y la ratio entre las mujeres y los hombres fumadores en el periodo 1960-2010, y mientras el IDG disminuye, la ratio se ha acercado a un valor de 111. La asociación entre el consumo de tabaco por sexos y la desigualdad de género, y el hecho de que esta disminuya en España, podría suponer para las mujeres un aumento en la incidencia de los cánceres relacionados con el tabaco, especialmente el cáncer de pulmón, y un posterior aumento en la mortalidad por estas causas.
Estas diferencias en la prevalencia del consumo de tabaco según el sexo hacen destacar la importancia de examinar la mortalidad del cáncer de pulmón en las últimas décadas en España. El objetivo de este trabajo es describir y comparar las tendencias por sexo en la mortalidad del cáncer de pulmón en España entre los años 1980 y 2013.
MétodosSe utilizaron los datos de mortalidad disponibles en el Instituto Nacional de Estadística12 para el periodo de estudio (1980-2013) y fueron estratificados por sexo, grupo de edad (18 grupos, desde 0 a 4 años de edad hasta 85 o más años de edad), y causa principal de muerte codificada según la novena y la décima edición de la Clasificación Internacional de Enfermedades (CIE)13, dependiendo del año de los datos (CIE-9 desde 1980 a 1998 y CIE-10 desde 1999 a 2013). Para este estudio se usaron los códigos considerados para el cáncer de pulmón en las 2 ediciones (el código 162 para la CIE-9 y los códigos C33 y C34 para la CIE-10). Para calcular la población a lo largo del periodo de estudio se usaron los datos del censo (1981, 1991, 2001 y 2011) y las estimaciones del Instituto Nacional de Estadística para los años intercensales12.
Se calculó la tasa bruta de mortalidad (TBM), la tasa truncada de mortalidad (TTM) (desde los 45 a los 74 años de edad), la tasa ajustada por edad de mortalidad (TAEM) a la población mundial estándar para el periodo 2000-202514 por el método directo y las tasas de mortalidad específicas por edad (para los siguientes grupos: menos de 45 años, desde 45 hasta 54 años, de 55 a 64 años, de 65 a 74 años y para 75 o más años de edad). Todas las tasas se presentan «por 100.000 personas-año».
Se ha usado el modelo de regresión joinpoint para describir los cambios en la tendencia de las diferentes tasas de mortalidad15. Se identificaron los años en que la tendencia cambió (joinpoints) y se estimó la tendencia antes del primer joinpoint, entre 2 joinpoints y después del último joinpoint mediante el cambio porcentual anual (CPA) de las tasas. Se limitó el modelo a un máximo de 2 joinpoints, que significarían 3 tendencias diferentes. Todos los análisis se hicieron usando el software Jointpoint Regression Program, versión 4.016.
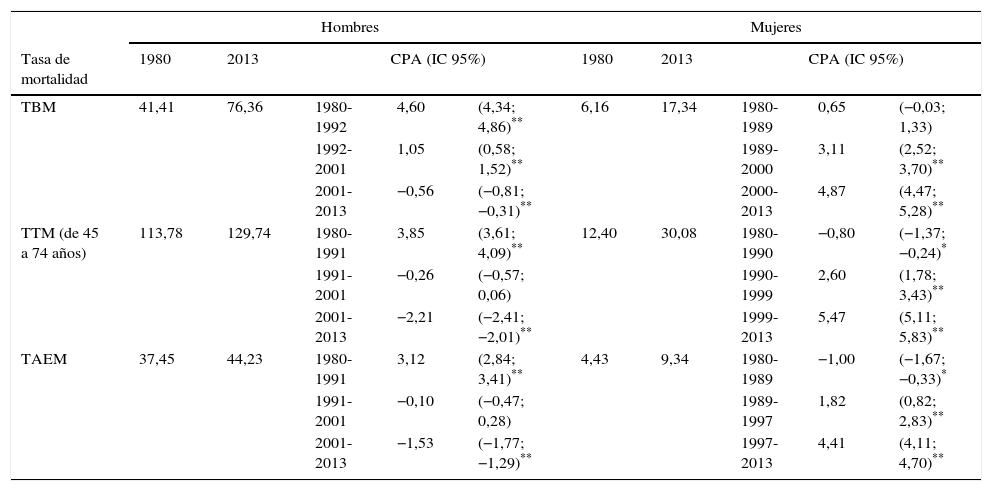
ResultadosLa tabla 1 muestra la TBM, la TTM y la TAEM para hombres y mujeres. En los hombres se observaron 3 tendencias temporales para la TBM, la TTM y la TAEM. La TBM mostró una tendencia creciente hasta 2001 y un decrecimiento estadísticamente significativo a partir de entonces (CPA=−0,56%). Para la TTM (grupos de edad de 45 a 74 años) la tendencia decreciente se observa desde 1992, y en la misma línea se refleja en la TAEM. En mujeres, también se observaron 3 tendencias temporales para la TBM, la TTM y la TAEM; sin embargo, se observó un aumento en todas las tasas consideradas desde los inicios de los noventa (tabla 1), mostrando un aumento de la TTM y de la TAEM estadísticamente significativo de alrededor de un 5% desde finales de los noventa (TTM 5,42% desde el año 1999 y TAEM 4,41% desde 1997).
Tasa de mortalidad bruta, truncada y ajustada por edad de cáncer de pulmón y análisis joinpoint según sexo en España (1980-2013)
| Hombres | Mujeres | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Tasa de mortalidad | 1980 | 2013 | CPA (IC 95%) | 1980 | 2013 | CPA (IC 95%) | ||||
| TBM | 41,41 | 76,36 | 1980-1992 | 4,60 | (4,34; 4,86)** | 6,16 | 17,34 | 1980-1989 | 0,65 | (−0,03; 1,33) |
| 1992-2001 | 1,05 | (0,58; 1,52)** | 1989-2000 | 3,11 | (2,52; 3,70)** | |||||
| 2001-2013 | −0,56 | (−0,81; −0,31)** | 2000-2013 | 4,87 | (4,47; 5,28)** | |||||
| TTM (de 45 a 74 años) | 113,78 | 129,74 | 1980-1991 | 3,85 | (3,61; 4,09)** | 12,40 | 30,08 | 1980-1990 | −0,80 | (−1,37; −0,24)* |
| 1991-2001 | −0,26 | (−0,57; 0,06) | 1990-1999 | 2,60 | (1,78; 3,43)** | |||||
| 2001-2013 | −2,21 | (−2,41; −2,01)** | 1999-2013 | 5,47 | (5,11; 5,83)** | |||||
| TAEM | 37,45 | 44,23 | 1980-1991 | 3,12 | (2,84; 3,41)** | 4,43 | 9,34 | 1980-1989 | −1,00 | (−1,67; −0,33)* |
| 1991-2001 | −0,10 | (−0,47; 0,28) | 1989-1997 | 1,82 | (0,82; 2,83)** | |||||
| 2001-2013 | −1,53 | (−1,77; −1,29)** | 1997-2013 | 4,41 | (4,11; 4,70)** | |||||
CPA: cambio porcentual anual; IC 95%: intervalo de confianza al 95%; TAEM: tasa ajustada por edad de mortalidad; TBM: tasa bruta de mortalidad; TTM: tasa truncada de mortalidad.
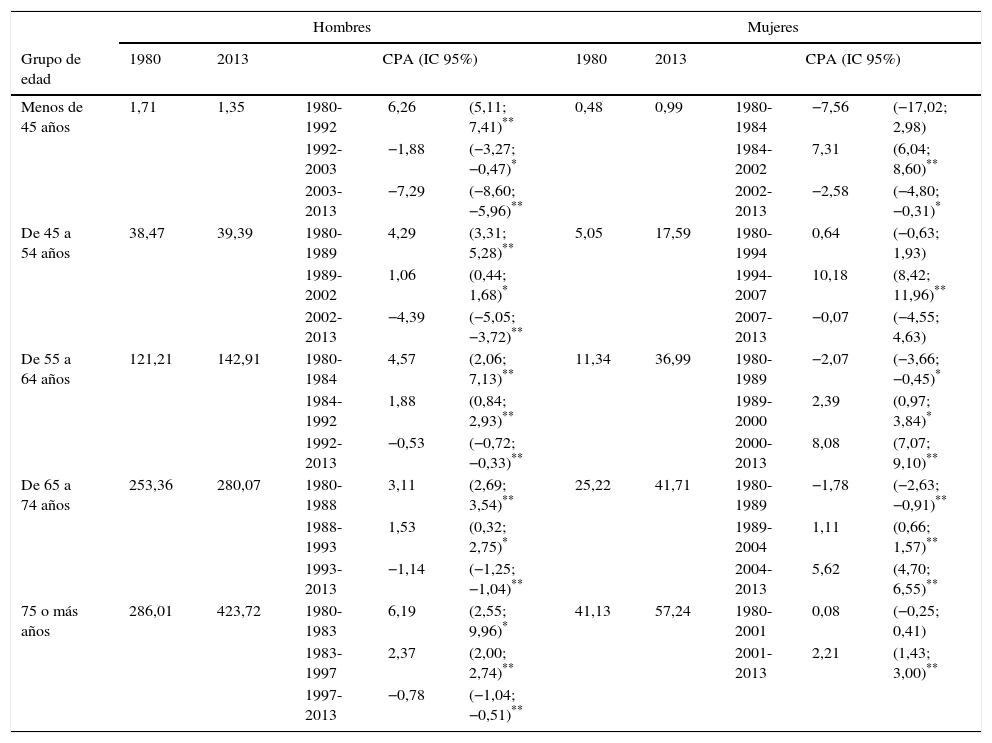
El análisis de la tendencia temporal de las tasas de mortalidad por cáncer de pulmón en determinados grupos de edad se presenta en la tabla 2. Entre los hombres se observa una tendencia decreciente desde mediados de los noventa, excepto para el grupo de 45 a 54 años, que solo desciende desde el año 2002. El descenso es mayor entre los hombres más jóvenes (menos de 45 años: −7,29% desde 2003; de 45 a 54 años: 4,39% desde 2002) y menor entre los más mayores (75 o más años: −0,78% desde 1997; de 65 a 74 años: −1,14% desde 1993). Entre mujeres de menos de 55 años, las tasas de mortalidad por cáncer de pulmón aumentaron durante un cierto periodo de tiempo y empezaron a nivelarse durante el intervalo 2002-2007 (CPA=7,31% de 1984 a 2002 entre las más jóvenes de 45 años y CPA=10,18% en el periodo de 1994 a 2007 entre mujeres de 45 a 54 años, tabla 2). Casi desde finales de los ochenta, la tasa de mortalidad por cáncer de pulmón aumentó significativamente entre mujeres de 55 años y mayores, detectándose un máximo aumento a partir de 2000 (CPA=8,08% de 2000 a 2013 entre los 55 y los 64 años; CPA=5,62% de 2004 a 2013 entre los 65 y los 74 años; CPA=2,21% de 2001 a 2013 entre mujeres de 75 o más años).
Tasa de mortalidad específica por grupos de edad de cáncer de pulmón y análisis joinpoint según género en España (1980-2013)
| Hombres | Mujeres | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Grupo de edad | 1980 | 2013 | CPA (IC 95%) | 1980 | 2013 | CPA (IC 95%) | ||||
| Menos de 45 años | 1,71 | 1,35 | 1980-1992 | 6,26 | (5,11; 7,41)** | 0,48 | 0,99 | 1980-1984 | −7,56 | (−17,02; 2,98) |
| 1992-2003 | −1,88 | (−3,27; −0,47)* | 1984-2002 | 7,31 | (6,04; 8,60)** | |||||
| 2003-2013 | −7,29 | (−8,60; −5,96)** | 2002-2013 | −2,58 | (−4,80; −0,31)* | |||||
| De 45 a 54 años | 38,47 | 39,39 | 1980-1989 | 4,29 | (3,31; 5,28)** | 5,05 | 17,59 | 1980-1994 | 0,64 | (−0,63; 1,93) |
| 1989-2002 | 1,06 | (0,44; 1,68)* | 1994-2007 | 10,18 | (8,42; 11,96)** | |||||
| 2002-2013 | −4,39 | (−5,05; −3,72)** | 2007-2013 | −0,07 | (−4,55; 4,63) | |||||
| De 55 a 64 años | 121,21 | 142,91 | 1980-1984 | 4,57 | (2,06; 7,13)** | 11,34 | 36,99 | 1980-1989 | −2,07 | (−3,66; −0,45)* |
| 1984-1992 | 1,88 | (0,84; 2,93)** | 1989-2000 | 2,39 | (0,97; 3,84)* | |||||
| 1992-2013 | −0,53 | (−0,72; −0,33)** | 2000-2013 | 8,08 | (7,07; 9,10)** | |||||
| De 65 a 74 años | 253,36 | 280,07 | 1980-1988 | 3,11 | (2,69; 3,54)** | 25,22 | 41,71 | 1980-1989 | −1,78 | (−2,63; −0,91)** |
| 1988-1993 | 1,53 | (0,32; 2,75)* | 1989-2004 | 1,11 | (0,66; 1,57)** | |||||
| 1993-2013 | −1,14 | (−1,25; −1,04)** | 2004-2013 | 5,62 | (4,70; 6,55)** | |||||
| 75 o más años | 286,01 | 423,72 | 1980-1983 | 6,19 | (2,55; 9,96)* | 41,13 | 57,24 | 1980-2001 | 0,08 | (−0,25; 0,41) |
| 1983-1997 | 2,37 | (2,00; 2,74)** | 2001-2013 | 2,21 | (1,43; 3,00)** | |||||
| 1997-2013 | −0,78 | (−1,04; −0,51)** | ||||||||
CPA: cambio porcentual anual; IC 95%: intervalo de confianza al 95%.
Nuestros datos muestran un diferente patrón, incluso opuesto, en la mortalidad por cáncer de pulmón en relación con el sexo de los individuos en España. Aunque la mortalidad por cáncer de pulmón es todavía mayor en hombres que en mujeres, desde los años noventa la tasa de mortalidad por cáncer de pulmón ha descendido entre los hombres, pero ha aumentado entre las mujeres. Un patrón similar entre sexos se ha observado en la incidencia para cáncer de pulmón en algunos países del norte y del oeste de Europa17. El único estudio realizado en España que ha comparado recientemente datos de incidencia y mortalidad por cáncer en la región de Cataluña mostró resultados similares para el cáncer de pulmón hasta 200718. Más precisamente, la mortalidad por cáncer de pulmón fue unas 7 veces mayor en hombres a principios del 2000, y alrededor de 4 veces mayor una década después17,19,20.
El consumo de tabaco es la principal causa de cáncer de pulmón21. Por esta razón, las diferencias en el patrón entre sexos observadas en nuestro estudio podrían ser explicadas por la epidemia del tabaco en España. Aunque la prevalencia de consumo de tabaco ha sido superior en hombres que en mujeres, la brecha se ha reducido durante las últimas décadas: mientras en 1995 la prevalencia en hombres era el doble que la de las mujeres (48,9 vs. 22,5%)22, en la última Encuesta Nacional de Salud Española de 2011-2012 se mostraron menores diferencias en la prevalencia entre sexos (27,9% en hombres y 20,2% en mujeres)23. El aumento en las tasas de mortalidad por cáncer de pulmón en mujeres durante los años más recientes puede ser explicado porque ha pasado alrededor de 40 años desde los años setenta, cuando la prevalencia de consumo de tabaco en mujeres inició su despegue, pasando de un 5,8% en 1970 hasta un 15,0% en 1980, hasta llegar a un 26% en 1990, cuando se estabilizó hasta empezar a descender a partir del 200022,24. Por esta razón, en España, desde 2001 el porcentaje de muertes atribuibles al tabaco está decreciendo en hombres y aumentando en mujeres7. Estos resultados están en línea con la situación del consumo de tabaco en la Europa del Sur, donde entre mujeres es un fenómeno relativamente reciente, mientras en el norte de Europa la prevalencia de consumo de tabaco en mujeres alcanzó su máximo décadas atrás25–27.
Otras causas que han podido influir en la tendencia de la incidencia y la mortalidad por cáncer de pulmón son las mejoras en el diagnóstico y en el tratamiento, o la contaminación laboral o medioambiental. Pero a diferencia del tabaco, estos factores han tenido el mismo comportamiento para hombres y mujeres, por lo que no explicarían sus diferencias.
Dicho todo esto, y dada la fuerte asociación entre la desigualdad por sexos y el consumo de tabaco11, parece justificado, por lo menos, plantear la relación entre el sexo y la mortalidad por cáncer de pulmón. Ha sido cuando la desigualdad entre sexos ha disminuido que se han aproximado las tasas de consumo de tabaco de hombres y de mujeres. Incluso desde la industria del tabaco se ha dado la imagen de asociar el consumo de tabaco con cierto empoderamiento de la mujer28. Por lo tanto, aunque en nuestro estudio no hemos realizado un análisis por sexos, nuestra hipótesis es que las diferencias encontradas en la mortalidad por cáncer de pulmón entre hombres y mujeres se pueden asociar a una diferencia debida al sexo. En este sentido, para poder contrastar esta hipótesis de las diferencias por sexo en la mortalidad por cáncer de pulmón se deberían haber incorporado variables sociodemográficas (nivel educativo, ocupación, clase social, etc.) o haber utilizado instrumentos para medir adecuadamente el rol de género, como el IDG. Sin embargo, en nuestro trabajo no hemos realizado un análisis incorporando variables sociodemográficas o instrumentos para medir el rol de género, por lo que es una limitación para poder relacionar las diferencias observadas en la tendencia de la mortalidad por cáncer de pulmón entre hombres y mujeres con el género. Por ello, se necesitan más estudios para confirmar esta hipótesis.
Es difícil identificar el momento en el que las tasas de mortalidad en las mujeres van a alcanzar su máximo y empezar a nivelarse. Nuestros datos muestran que todas las tasas calculadas han crecido en los últimos años (con la excepción de las mujeres de menos de 45 años). La prevalencia de consumo de tabaco se está reduciendo ligeramente, según los resultados observados en la Encuesta Nacional de Salud Española (desde el 22,5% de 1995 hasta el 20,2% de 2012), pero los 30-40 años que aproximadamente pasan entre el consumo de tabaco y la muerte por cáncer de pulmón pueden explicar que la mortalidad por cáncer de pulmón siga creciendo al menos durante unos cuantos años más. De hecho, la incidencia todavía está creciendo en todos los datos recogidos19. Estudios realizados en otros países como Australia, Holanda, Reino Unido o los EE. UU. muestran una convergencia en el porcentaje de muertes en hombres y en mujeres, atribuibles al tabaco, por cáncer de pulmón29.
Desde los ochenta el cáncer de mama ha sido la primera causa de muerte por cáncer en mujeres, mostrando un incremento hasta principios de los noventa y descendiendo a un ritmo del 1,8% anual desde mediados de dicha década, siendo atribuible dicho descenso al efecto conjunto de avances en el tratamiento y el diagnóstico precoz, este último como consecuencia de la implementación de los programas poblacionales de cribado de cáncer de mama30. Cabe destacar que la franja de edades considerada para el cribado de mama (50-64 años) encaja con el aumento de la mortalidad por cáncer de pulmón que hemos observado en nuestro estudio, que empieza alrededor de los 50 años de edad. En este sentido, recomendamos que los programas de cribado poblacional de cáncer de mama incluyan campañas de promoción de la salud para promover el abandono del consumo de tabaco entre las mujeres fumadoras invitadas a participar en el cribado para reducir el riesgo del cáncer de pulmón. Algunos estudios31–33 han descrito el fenómeno de la hipótesis del endurecimiento en el consumo de tabaco (hardening en inglés): mientras que la sociedad desaprueba de manera creciente el consumo de tabaco, los fumadores restantes muestran una mayor dependencia a la nicotina y una desmotivación más alta para dejar el tabaco. Sin embargo, no existe una evidencia fuerte de que realmente en los fumadores restantes ocurra este endurecimiento34,35. De acuerdo con este fenómeno, las mujeres fumadoras invitadas al cribado de cáncer de mama podrían ser más reluctantes a dejar el tabaco. Por esta razón, podrían necesitar más ayuda para dejar de fumar y, en algunos casos, tratamiento farmacológico o terapia sustitutiva de la nicotina en sus diferentes formas36 para tratar de combatir la dependencia física a la nicotina.
Una limitación de los estudios basados en certificados de defunción es que pueden estar influidos por la calidad de los registros de mortalidad, incluyendo problemas en la validez y fiabilidad de los datos. Sin embargo, algunos estudios han demostrado una alta calidad en la certificación de la mortalidad en España y los datos del registro de mortalidad son confiables, con mayor confianza en las principales causas de muerte, como el cáncer, y en los principales tipos de cáncer, como el de pulmón37,38. Otro problema relacionado con los certificados de defunción es el uso, en el periodo de estudio, de 2 sistemas de clasificación, la CIE-9 y la CIE-10. Se ha obtenido, para el caso del cáncer de pulmón, una concordancia en el número de muertes registradas superior al 98% entre los 2 sistemas39. Además, el registro de mortalidad es completo y cubre todo el territorio. Una debilidad inherente a nuestro estudio puede derivar de utilizar la mortalidad del cáncer de pulmón como el indicador de la presencia de la enfermedad, debido a la alta letalidad de este cáncer. En este sentido, sería más apropiado obtener datos de la incidencia de la enfermedad para poder estimar también la carga en cuanto a morbilidad de esta enfermedad. Otra limitación de este estudio son los cambios durante el periodo estudiado de la distribución por edades de la población, especialmente los causados por movimientos migratorios, tan importantes en las últimas décadas. Sin embargo, el uso de tasas ajustadas y truncadas minimiza este potencial sesgo.
En conclusión, nuestro estudio muestra diferencias según el sexo en la tendencia de la mortalidad por cáncer de pulmón en España. Estas diferencias en la tendencia pueden ser explicadas por el aumento del consumo de tabaco entre las mujeres en las últimas décadas y el descenso en los hombres. Por ello, se debería promocionar el abandono del consumo de tabaco entre las mujeres fumadoras que participan en los programas de cribado poblacional de cáncer de mama en España.
AutoríaJMMS concibió el estudio. JCMS preparó la base de datos y la analizó. JMMS y RC revisaron con él los resultados. Todos los autores (JCMS, RC, CLM, LGP y JMMS) contribuyeron a la interpretación de los resultados. JCMS escribió el primer borrador del manuscrito, que fue revisado críticamente por JMMS. Todos los autores (JCMS, RC, CLM, LGP y JMMS) contribuyeron significativamente en sus versiones posteriores y han aprobado la versión final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.