Los tumores neuroendocrinos pulmonares (TNP) abarcan un amplio espectro de tumores que incluyen los carcinoides típicos (CT) y atípicos (CA), el carcinoma neuroendocrino de células grandes (CNCG) y el carcinoma microcítico de pulmón (CMP). Aunque ninguna variedad puede considerarse benigna, los CA y CT tienen un potencial metastásico mucho menor, habitualmente se diagnostican en estadios tempranos y la mayoría son subsidiarios de tratamiento quirúrgico. Se dispone de varias pautas de quimioterapia (QT) en caso de recidiva o en estadios avanzados, aunque la evidencia científica es insuficiente. Los CNCG, encuadrados en la clasificación actual junto a los carcinomas de células grandes, tienen rasgos moleculares, conducta biológica y perfil de sensibilidad a la QT que los asemejan más a los CMP. Con frecuencia su diagnóstico anatomopatológico es difícil, pese al uso de técnicas de inmunohistoquímica, y pueden ser necesarias muestras quirúrgicas. Las pruebas diagnósticas a utilizar son similares a las empleadas en otros tumores de pulmón, con algunas diferencias en cuanto al trazador óptimo que se usa en la tomografía de emisión de positrones. La nueva clasificación TNM es de utilidad en la estadificación de estos tumores. El síndrome carcinoide, muy infrecuente en los TNP, puede dar síntomas de difícil control que requieren medicación especial con análogos de la somatostatina y otros fármacos. En general, y con la excepción del CMP, se necesitan nuevos ensayos que den respuesta a numerosos interrogantes sobre el mejor tratamiento a aplicar en cada estirpe y cada estadio.
Pulmonary neuroendocrine tumors (PNT) encompass a broad spectrum of tumors including typical carcinoid (TC) and atypical (AC) tumors, large-cell neuroendocrine carcinoma (LCNEC) and small-cell lung cancer (SCLC). Although no variety can be considered benign, AC and TC have a much lower metastatic potential, are usually diagnosed in early stages, and most are candidates for surgical treatment. Several chemotherapy (CT) regimens are available in the case of recurrence or in advanced stages, although scientific evidence is insufficient. LCNEC, which is currently classified alongside large-cell carcinomas, have molecular features, biological behavior and CT sensitivity profile closely resembling SCLC. Pathological diagnosis is often difficult, despite the availability of immunohistochemical techniques, and surgical specimens may be necessary. The diagnostic tests used are similar to those used in other lung tumors, with some differences in the optimal tracer in positron emission tomography. The new TNM classification is useful for staging these tumors. Carcinoid syndrome, very rare in PNT, may cause symptoms that are difficult to control and requires special therapy with somatostatin analogs and other drugs. Overall, with the exception of SCLC, new trials are needed to provide a response to the many questions arising with regard to the best treatment in each lineage and each stage.
Las células neuroendocrinas derivan de células primitivas pluripotenciales y se caracterizan por la producción de neurotransmisores y carecer de axones o sinapsis. Dan lugar a tumores en diversos órganos que se clasifican en 3 grupos según la procedencia embrionaria de los mismos en el tracto gastrointestinal: anterior, medio y posterior. Además del pulmón, diversas regiones del aparato digestivo pueden dar origen a este tipo de tumores1,2. Los tumores neuroendocrinos pulmonares (TNP) representan aproximadamente el 25-30% de los cánceres primitivos de pulmón (CP). De todos ellos, el 80% son carcinomas anaplásicos de células pequeñas o microcíticos (CMP), el 12% carcinomas neuroendocrinos de células grandes (CNCG) y el 8% restante, tumores carcinoides, típicos (CT) y atípicos (CA), siendo estos últimos los menos frecuentes3-5. El pronóstico de estos tumores es muy variable, como se verá más adelante, y aunque algunos, como los CT, tienen buenas expectativas de vida, no se debe emplear el calificativo de «benignos», pues todos tienen potencial metastásico3. Actualmente se clasifican, según el grado de malignidad, en: de bajo grado (CT), de grado intermedio (CA) y de alto grado (CNCG y CMP) (tabla 1). La última clasificación de tumores pulmonares de la Organización Mundial de la Salud, de 2004, incluye además otras entidades, como la hiperplasia difusa de células neuroendocrinas idiopática (HDCNI) y los tumorlets (equivalente en castellano a tumores pequeños o tumorcillos)6-8. Estos últimos son acumulaciones de células neuroendocrinas, habitualmente localizadas en las vías aéreas, que rebasan la membrana basal y se asemejan a los carcinoides, aunque su diámetro es <0,5cm. Suelen ser hallazgos incidentales que no ocasionan síntomas7. En cuanto a la HDCNI, aunque su significación e historia natural no se conoce bien, para algunos representa la manifestación más temprana de enfermedad neuroendocrina y la consideran como lesión preneoplásica8. Estas lesiones suelen asociarse a lesiones broncopulmonares crónicas, como bronquiectasias y fibrosis, por lo que, en este contexto, se consideran lesiones reactivas. Más raramente aparecen en pulmones previamente normales, en cuyo caso existe la posibilidad de evolucionar hacia tumores carcinoides3.
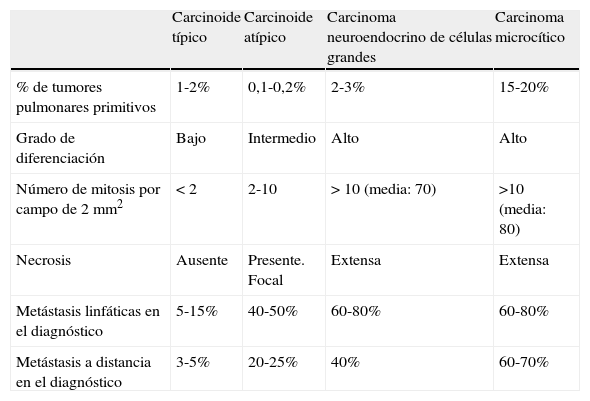
Características de los tumores pulmonares neuroendocrinos
| Carcinoide típico | Carcinoide atípico | Carcinoma neuroendocrino de células grandes | Carcinoma microcítico | |
| % de tumores pulmonares primitivos | 1-2% | 0,1-0,2% | 2-3% | 15-20% |
| Grado de diferenciación | Bajo | Intermedio | Alto | Alto |
| Número de mitosis por campo de 2 mm2 | < 2 | 2-10 | > 10 (media: 70) | >10 (media: 80) |
| Necrosis | Ausente | Presente. Focal | Extensa | Extensa |
| Metástasis linfáticas en el diagnóstico | 5-15% | 40-50% | 60-80% | 60-80% |
| Metástasis a distancia en el diagnóstico | 3-5% | 20-25% | 40% | 60-70% |
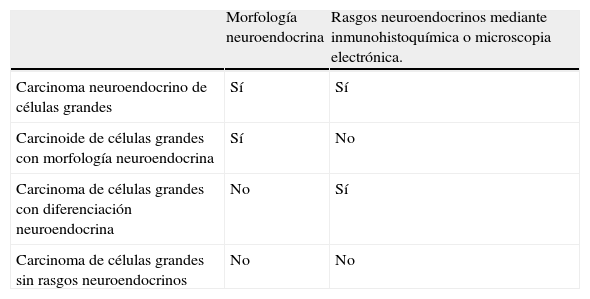
Con respecto a la clasificación histológica de estos tumores, en la tabla 1 se muestran algunos criterios que permiten definir los diferentes tipos. A menudo es preciso examinar muestras quirúrgicas para establecer el diagnóstico, especialmente con respecto al CNCG. Cuando solo se dispone de pequeñas biopsias, obtenidas por fibrobroncoscopia, el diagnóstico preciso puede ser muy difícil. Además del número de mitosis, la presencia/ausencia de necrosis y la estructura del tumor, diversos marcadores neuroendocrinos detectados mediante inmunohistoquímica, como cromograninaA, sinaptofisina o CD56 y otras alteraciones moleculares pueden facilitar su identificación3,7,9. El CNCG no siempre muestra todos los rasgos que caracterizan a su estirpe, de modo que, si consideramos al grupo de los carcinomas de células grandes en general, hay un variado espectro posible de diferenciación neuroendocrina6,7 (tabla 2). Junto a los mencionados marcadores, recientemente se ha indicado la utilidad del marcador de proliferación Ki-67, que puede ayudar a distinguir entre tumores de bajo y alto grado, especialmente en caso de disponer solo de biopsias pequeñas o muestras citológicas3,8. Pese al uso de estas técnicas, el diagnóstico diferencial patológico es a menudo difícil y requiere una cuidadosa evaluación por patólogos experimentados8. Estudios recientes indican que el CNCG, debido a su relativa rareza y dificultad diagnóstica, puede estar subestimado, y aunque clínica y morfológicamente con frecuencia imita al carcinoma de pulmón no microcítico (CPNM) convencional, sus características biológicas y pronósticas son diferentes y, lo que es más importante, su sensibilidad a diversas pautas de quimioterapia (QT) parece ser más próxima a la del CMP9.
Rasgos morfológicos y diferenciación neuroendocrina en los carcinomas pulmonares de células grandes
| Morfología neuroendocrina | Rasgos neuroendocrinos mediante inmunohistoquímica o microscopia electrónica. | |
| Carcinoma neuroendocrino de células grandes | Sí | Sí |
| Carcinoide de células grandes con morfología neuroendocrina | Sí | No |
| Carcinoma de células grandes con diferenciación neuroendocrina | No | Sí |
| Carcinoma de células grandes sin rasgos neuroendocrinos | No | No |
Los TNP de bajo grado aparecen en edades más tempranas (edad media de 40 a 50años) que la mayoría de CP, sin clara asociación con el consumo de tabaco o el género, mientras que los de alto grado se diagnostican preferentemente en varones con edad superior a 60años y la relación con el hábito tabáquico es muy estrecha. Los tumores carcinoides tienen localización central en el 75% de los casos y los síntomas iniciales más frecuentes son tos, hemoptisis, sibilancias, neumonía recurrente o dolor torácico2,5. Los síndromes paraneoplásicos son infrecuentes: el síndrome carcinoide, que se considera característico, es más común en los de localización gastroentérica, mientras que solo se manifiesta clínicamente en el 1-3% de los de origen pulmonar. Otros, como el síndrome de Cushing (1-2% de casos), acromegalia, etc., son aún más infrecuentes. Sin embargo, cuando se realiza una exhaustiva evaluación endocrinológica en los pacientes, pueden encontrarse datos de hipersecreción hasta en el 15%, aunque sin manifestaciones clínicas en la mayoría5.
Los carcinoides pulmonares de localización periférica suelen detectarse de modo incidental. Los CNCG y los CMP, debido a su conducta biológica más agresiva y a su mayor propensión a producir metástasis, a menudo se diagnostican en estadios avanzados. EL CMP da lugar con frecuencia a síndromes paraneoplásicos de diversa naturaleza (endocrinos, neuromusculares, hematológicos, etc.), siendo el más común el síndrome de secreción inadecuada de hormona antidiurética, que puede presentarse hasta en el 40% de los casos10.
Diagnóstico y estadificaciónAl igual que otros CP más comunes, el punto de partida para la sospecha diagnóstica suele ser la detección de una imagen anómala en la radiografía de tórax. Las demás pruebas de imagen a realizar para delimitar las características anatómicas del tumor y posibles metástasis a distancia, incluyendo tomografía computarizada (TC) de tórax, resonancia magnética, gammagrafías, etc., también son similares, por lo que las guías disponibles sobre diagnóstico y estadificación del CP en general11-13 son aplicables a estos pacientes. La obtención de muestra se obtiene generalmente a través de fibrobroncoscopia, ya que la mayoría de los tumores son de localización central. En caso de localización periférica, una biopsia o punción transtorácica puede ser la primera opción, aunque ya se ha comentado la posible limitación de las muestras citológicas y biopsias pequeñas para un diagnóstico preciso. Por ello, una vez examinada la muestra, puede ser necesario realizar una segunda prueba para obtener un espécimen mayor.
Con respecto a la estadificación, existen algunos rasgos biológicos específicos de los tumores carcinoides que condicionan la eficacia de pruebas como la tomografía de emisión de positrones (PET). Estos tumores, de lento crecimiento, muestran baja captación de glucosa, por lo que la PET con 18F-fluordeoxiglucosa es de escasa utilidad, especialmente en los CT2. Sin embargo, se han desarrollado nuevos radiofármacos trazadores, como el 111In-octreótido o el 68Ga-DOTATATE, que, debido a su especial afinidad por los receptores de la somatostatina, habitualmente presentes en los tumores de bajo grado, son de gran utilidad para el diagnóstico y la estadificación5. En un reciente estudio se analizó, mediante PET/CT, la utilidad de ambos trazadores, 18F-fluordeoxiglucosa y 68Ga-DOTATATE, en un grupo de tumores neuroendocrinos de diverso grado. Los autores encontraron una afinidad inversa por ambos radiofármacos para los tumores de bajo y alto grado. Estos últimos mostraban gran avidez por la 18F-fluordeoxiglucosa y escasa por el 68Ga-DOTATATE, mientras que en los de bajo grado sucedía lo contrario14. Este radiotrazador, aunque no disponible aún en muchos centros, se considera actualmente de gran valor para planificar la intervención y para detectar recidivas en los carcinoides de bajo grado.
Como se comentará más adelante, la opción terapéutica más común en los TNP de bajo grado es la cirugía, mientras que en los de alto grado esta no es posible en la mayoría de casos, debido a la rápida diseminación del tumor. Sin embargo, en ambos grupos resulta de utilidad la misma clasificación según el grado de extensión anatómica (TNM). La última edición de esta clasificación TNM, además de una mayor precisión, ha mostrado una mayor universalidad, de modo que su valor pronóstico se ha podido comprobar también en los CMP y en los carcinoides15-18.
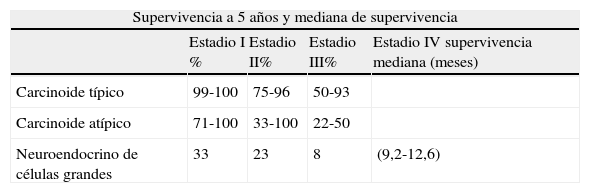
PronósticoComo ya se ha comentado, el espectro de los TNP abarca una variedad de tumores con importantes diferencias desde el punto de vista anatomopatológico, biológico y clínico. En consecuencia, también hay grandes diferencias en cuanto a las expectativas de vida. Así, los tumores carcinoides se diagnostican en su mayoría en estadios TNMI y II, son susceptibles en su mayoría de tratamiento quirúrgico y más del 90% sobreviven a los 5años; por el contrario, la mayoría de los CNCG y los CMP se presentan habitualmente en estadios avanzados, son candidatos a tratamiento con QT y radioterapia, y la supervivencia a largo plazo es muy baja (tabla 3)2,9,19.
Supervivencia de los tumores pulmonares neuroendocrinos
| Supervivencia a 5 años y mediana de supervivencia | ||||
| Estadio I % | Estadio II% | Estadio III% | Estadio IV supervivencia mediana (meses) | |
| Carcinoide típico | 99-100 | 75-96 | 50-93 | |
| Carcinoide atípico | 71-100 | 33-100 | 22-50 | |
| Neuroendocrino de células grandes | 33 | 23 | 8 | (9,2-12,6) |
| Enfermedad limitada % mediana (meses) | Enfermedad extendida % mediana (meses) | |
| Carcinoma microcítico | 20-25 (18-24) | < 10%a (10) |
Con respecto a los carcinoides, el grupo español de tumores neuroendocrinos (EMETNE), al analizar las datos de supervivencia en una amplia serie de casos intervenidos, encontró que el subtipo histológico, la presencia/ausencia de afectación ganglionar mediastínica y de metástasis a distancia fueron los factores de mayor influencia pronóstica20,21. Otros autores, dentro del subgrupo de CA, hallaron que un alto índice de mitosis, el tamaño del tumor primario >3,5cm y el sexo femenino fueron indicadores independientes de peor pronóstico22.
En cuanto a los CNCG, dadas las dificultades existentes para el diagnóstico patológico y su escasa frecuencia, hay pocos estudios que analicen factores pronósticos, aunque el estadio TNM parece tener valor a este respecto5,9. Si bien la supervivencia entre los pacientes operados varía ampliamente en función del estadio, parece que, a igualdad de estadio, los pacientes con CNCG tienen menos expectativas que los portadores de CPNM9. Finalmente, sobre los CMP se conocen desde hace tiempo abundantes estudios sobre índices pronósticos23. En esta revisión solo mencionaremos la conveniencia de aplicar también aquí la nueva clasificación TNM, aunque siga teniendo todavía valor práctico la simple y tradicional subdivisión en 2 grupos: enfermedad limitada o extendida, según la enfermedad se circunscriba a un hemitórax o se extienda más allá del mismo.
TratamientoSi se excluyen los CMP, los TNP representan una pequeña proporción de los cánceres primitivos de pulmón, y los distintos tipos muestran una gran heterogeneidad biológica. Ello explica que no dispongamos de ensayos clínicos suficientes que comparen grupos numerosos y homogéneos de pacientes, por lo que muchas de las pautas terapéuticas que se comentarán a continuación carecen de suficiente evidencia científica. Con la excepción de los CMP, hay pocos estudios aleatorizados que avalen las pautas actualmente en uso. Ello no quiere decir que no haya indicaciones firmes y avaladas por la experiencia, como la cirugía de resección en la mayoría de los tumores carcinoides, generalmente diagnosticados en estadios TNMI y II, dada la excelente supervivencia que depara la resección. Comentaremos a continuación por separado el tratamiento de los diversos grupos de TNP.
Tumores carcinoidesLos CT y CA, de bajo e intermedio grado, respectivamente, son subsidiarios casi siempre de tratamiento quirúrgico, y la mayoría de ellos, en estadios TNMI y II, tienen alta expectativa de vida (tabla 3)2,5,20,21. La lobectomía es el tipo de resección más comúnmente practicada, aunque en tumores centrales pueden realizarse resecciones «en manguito» para conservar parénquima pulmonar2,19. En pacientes ancianos con mala función pulmonar y tumores periféricos las resecciones menores, como la segmentectomía o resección «en cuña», pueden ser la única opción, si bien no se consideran oncológicamente adecuadas por el potencial metastásico de estos tumores, pequeño pero real19. La tasa de recidiva varía entre el 5 y el 30% y es mayor para los CA y para los que tienen afectación ganglionar mediastínica2,19,20. Por ello, en estos casos se recomienda la aplicación de tratamiento adyuvante con QT y/o radioterapia torácica (RTT), aunque su eficacia no está demostrada2,5,19,24. No hay claras y fundadas recomendaciones sobre la actitud a seguir en caso de resección incompleta, recidiva a distancia o incluso en aquellos raros casos en los que el tumor carcinoide se presenta desde el principio en un estadio lo suficientemente avanzado (TNMIIIB o IV) como para ser considerado irresecable. Una guía reciente aconseja RTT para los CT con afectación mediastínica y combinación de QT y RTT para los CA25, aunque el grado de evidencia es bajo. La pauta de QT más utilizada se ha basado en derivados del platino y etopósido (similar a la estándar en el CMP), aunque también se han publicado experiencias limitadas con otros fármacos, como estreptozotocina, doxorubicina junto a 5-fluorouracilo, temozolamida o everolimus5,25,26. La tasa de respuestas favorables obtenidas (la mayoría, remisiones parciales) no superó el 20-30% en las mejores series4,5,19,26.
Con respecto al tratamiento sintomático del síndrome carcinoide, se han empleado análogos de la somatostatina, como el octreótido o derivados similares (lanreótido) por sus efectos antisecretores. Se usan por vía intramuscular y han mostrado moderada eficacia en el control de síntomas, aunque no carecen de efectos adversos1,2,5. En pacientes con tumores neuroendocrinos del tracto gastrointestinal avanzados y sintomáticos, un reciente ensayo aleatorizado demostró mejores resultados con la combinación de octreótido y everolimus (fármaco inhibidor de vías metabólicas implicadas en la patogénesis de estos tumores, como la m-TOR) que con octreótido aislado27. También se ha ensayado el interferón-alfa28 y combinaciones de interferón con el antiangiogénico bevacizumab29. Sin embargo, dada la escasa experiencia disponible, atribuible a la rareza del cuadro, y el hecho de que estas pautas no carecen de efectos adversos, parece aconsejable remitir los pacientes potencialmente candidatos a centros especializados en dicho tratamiento5.
Carcinoma neuroendocrino de células grandesComo se comentó más arriba, el CNCG comparte algunos rasgos morfológicos con otras estirpes y a menudo es difícil de identificar, especialmente cuando solo se dispone de muestras pequeñas de biopsia. Aunque el CNCG está clasificado dentro del grupo de los carcinomas de células grandes no microcíticos, su perfil molecular y su conducta biológica lo asemejan más al CMP9,30, En cualquier caso, para los estadios TNMI y II, la cirugía es considerada el tratamiento estándar2,5,31. Sin embargo, la pobre supervivencia a largo plazo (entre el 27 y el 67% a los 5años para los operados en estadioi31) sugiere la conveniencia de tratamiento adyuvante multimodal con QT y/o RTT. Diversos análisis retrospectivos han hallado mejor supervivencia en los pacientes que recibieron QT adyuvante basada en derivados del platino y etopósido, pauta similar a la considerada estándar en los CMP9,31. Un estudio japonés prospectivo parece confirmar estos resultados, al observar disminución de la tasa de recurrencias y elevada supervivencia a 5años en los que recibieron tratamiento adyuvante31.
Dado que el CNCG se presenta la mayoría de veces en estadios avanzados, la QT es la única opción terapéutica. Debido a las dificultades diagnósticas de tipificación y a la confusión derivada de su lugar en la clasificación histológica de los CP, algunas guías terapéuticas recientes parecen no hacer diferencias entre esta variedad y otros CPNM25. Sin embargo, varios análisis retrospectivos coinciden en el hallazgo de una mejor supervivencia y tasa de respuestas frente a pautas de QT similares a las usadas en el CMP (cisplatino y etopósido) que frente a las que se emplean en el CPNM9,32-34. Un reciente ensayo faseii observó una tasa de remisiones parciales de 46,7% con una pauta de irinotecán y cisplatino35, porcentaje muy similar al 50-60% referido en estudios previos32-34. Estos datos recientes sugieren que los CNCG son sensibles a los mismos agentes que se emplean en el CMP, aunque la tasa de respuestas es algo inferior en los primeros. Por último, aunque se desconoce la frecuencia de mutaciones del receptor del factor de crecimiento epidérmico (EGFR) en estos tumores, su determinación podría ser de utilidad terapéutica, como se observó en un caso de CNCG con mutación positiva y excelente respuesta al gefitinib36.
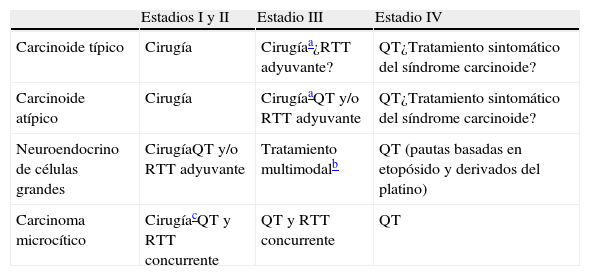
En la tabla 4 se presenta un esquema simplificado de las opciones terapéuticas.
Tratamiento de los tumores neuroendocrinos pulmonares
| Estadios I y II | Estadio III | Estadio IV | |
| Carcinoide típico | Cirugía | Cirugíaa¿RTT adyuvante? | QT¿Tratamiento sintomático del síndrome carcinoide? |
| Carcinoide atípico | Cirugía | CirugíaaQT y/o RTT adyuvante | QT¿Tratamiento sintomático del síndrome carcinoide? |
| Neuroendocrino de células grandes | CirugíaQT y/o RTT adyuvante | Tratamiento multimodalb | QT (pautas basadas en etopósido y derivados del platino) |
| Carcinoma microcítico | CirugíacQT y RTT concurrente | QT y RTT concurrente | QT |
En lo que respecta al CMP, mucho más frecuente, se dispone de numerosas guías terapéuticas basadas en amplios ensayos aleatorizados25,37. Actualmente la cirugía se considerada reservada para una mínima proporción de casos, que se presentan con aceptable estado general y en estadioi tras una evaluación minuciosa orientada a descartar posibles metástasis ocultas (menos del 3% del total de CMP)37. En el resto de pacientes con enfermedad limitada al tórax (EL), el tratamiento de elección se basa en la combinación concurrente de QT y RTT (tabla 4). Se aconseja aplicar la radioterapia precozmente (desde el primero o segundo ciclo) y en modalidad hiperfraccionada (2veces al día) y administrar QT basada en algún derivado del platino más etopósido, cada 21días y durante 4-6ciclos en total. En caso de enfermedad extendida (metástasis pulmonares contralaterales y/o extratorácicas) (EE), se dará QT basada en etopósido asociado a platino o irinotecán. La irradiación craneal profiláctica en caso de respuesta objetiva, completa o parcial, se considera indicada hoy tanto en caso de EL como EE25,37, debido a la elevada frecuencia de recidivas en el sistema nervioso central. Finalmente, y en lo que respecta a las nuevas terapias dirigidas o específicas anti-diana, ninguna de las ensayadas ha mostrado eficacia en esta variedad de CP37.
Puesto que los TNP, con excepción de los CMP, representan una exigua proporción dentro del conjunto de los CP, abarcan subtipos con rasgos biológicos muy diferentes y a menudo son difíciles de tipificar histológicamente, es explicable que no dispongamos de evidencia científica suficiente en la que basar las recomendaciones terapéuticas. Para conseguir este objetivo, como ya se propuso en reuniones de la IASLC9, será de especial importancia la colaboración internacional de los diferentes registros existentes, lo que podría permitir llevar a cabo ensayos clínicos con número suficiente de pacientes.
FinanciaciónNo existen fuentes de financiación en relación con este trabajo.
Conflicto de interesesNo existen conflictos de intereses en relación con este trabajo.