El diagnóstico de la infección tuberculosa latente (ITL) mediante IGRA sigue generando debate. La experiencia empleando dos pruebas IGRA de manera simultánea es escasa. El objetivo de este estudio es comparar los resultados de dos versiones de QuantiFERON-TB Gold (In-Tube/Plus) con los de T-SPOT.TB y analizar la eficacia de esta estrategia dual (T-SPOT.TB + QTF) para el diagnóstico de la ITL en población con alguna condición inmunosupresora.
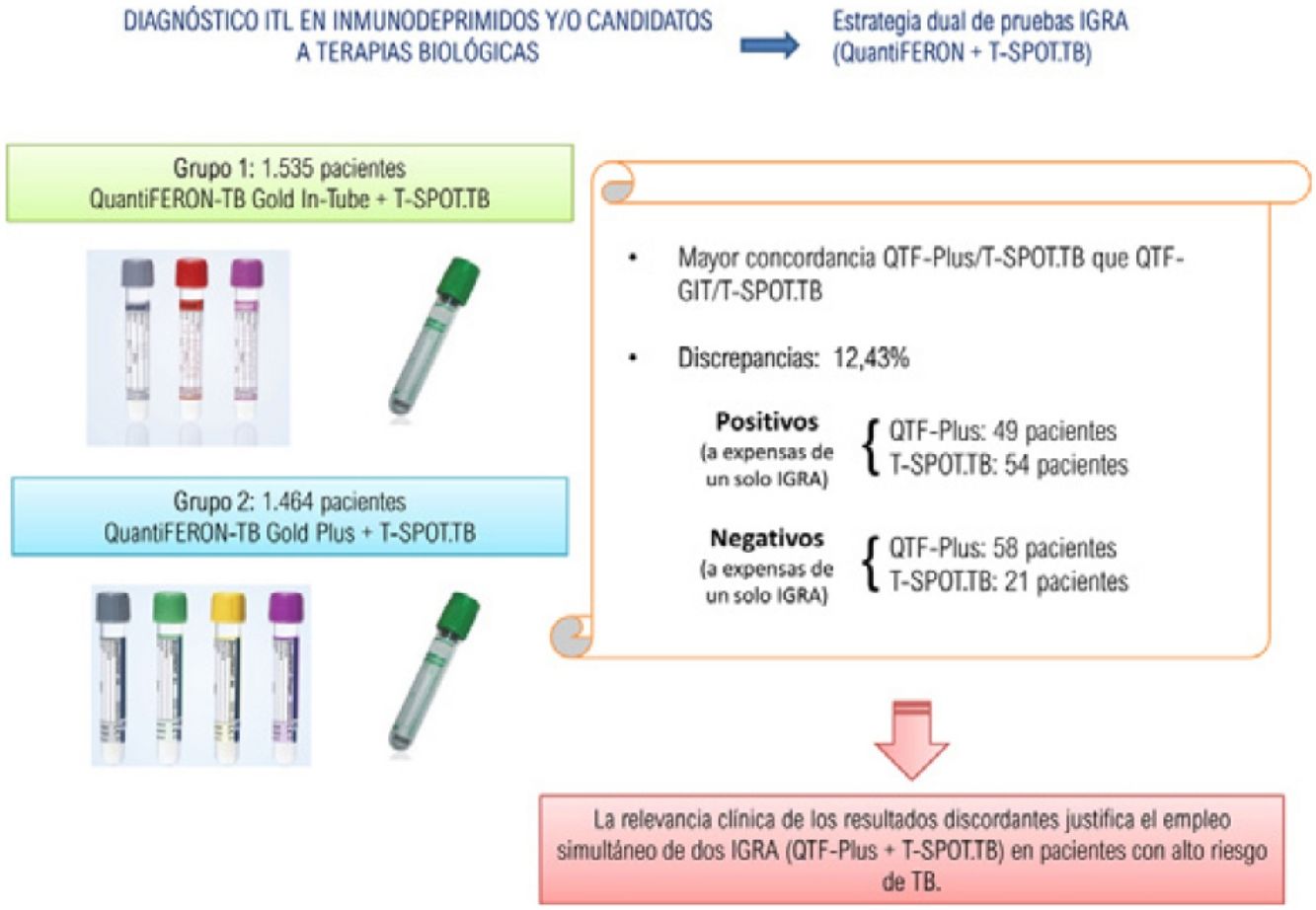
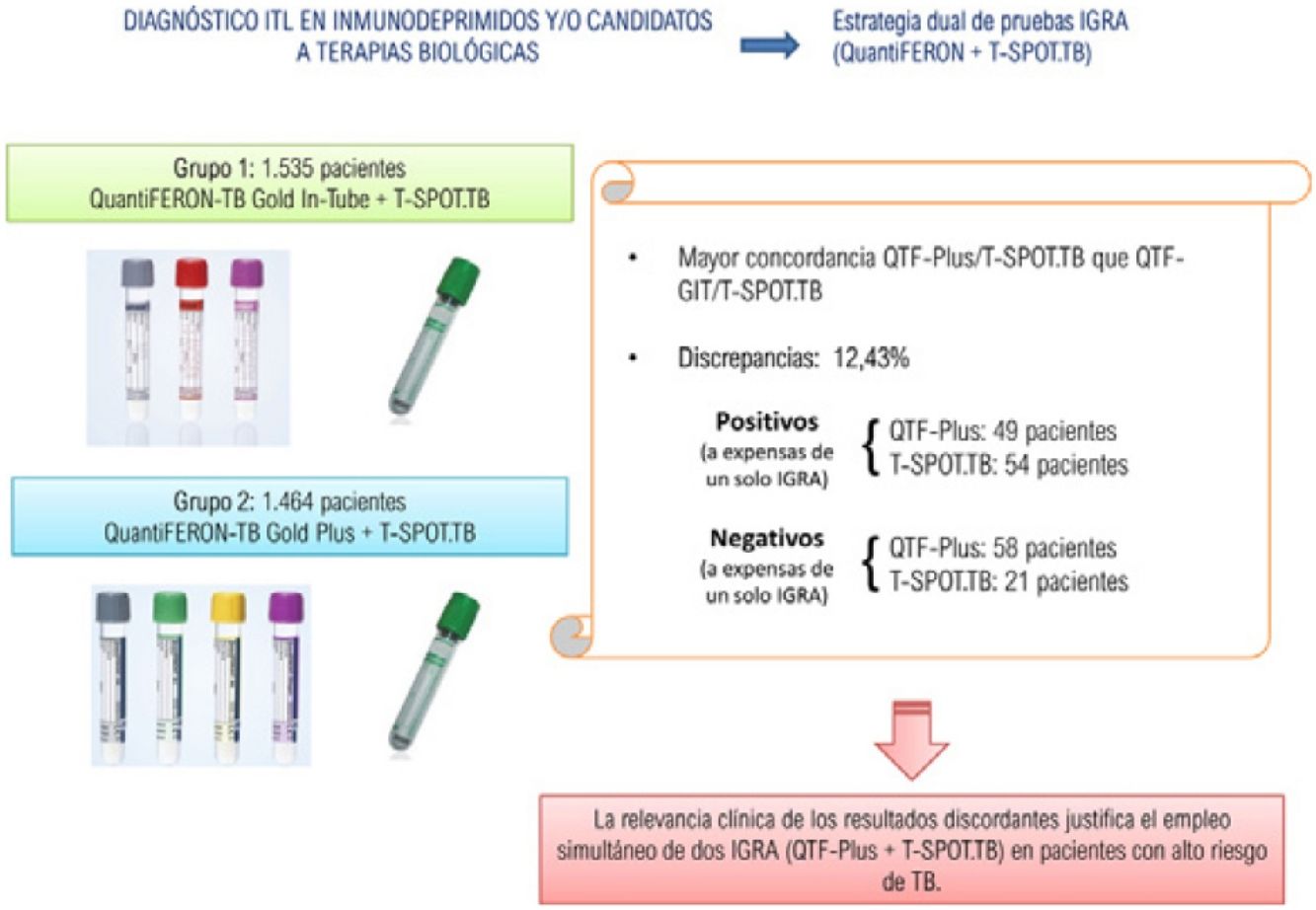
MétodosEstudio prospectivo (mayo 2015-junio 2017) que incluye 2.999 pacientes inmunodeprimidos y/o candidatos a terapias biológicas, a los que se les realizó de manera simultánea dos IGRA: grupo-1 (1.535 pacientes): T-SPOT.TB + QuantiFERON-TB Gold-In-Tube (QTF-GIT); grupo-2 (1.464 pacientes): T-SPOT.TB + QuantiFERON-TB Gold Plus (QTF-Plus).
ResultadosLa concordancia entre QTF-GIT y T-SPOT.TB fue del 83,19% (κ = 0,532). Las proporciones de resultados positivos, negativos e indeterminados fueron, respectivamente: 14,33 vs. 17,06%; 82,41 vs. 74,46%; y 3,25 vs. 8,46%. La concordancia entre QTF-Plus y T-SPOT.TB fue del 87,56% (κ=0,609). Las proporciones de resultados positivos, negativos e indeterminados fueron, respectivamente: 15,02 vs. 15,36%; 82,92 vs. 79,37%; y 2,04 vs. 5,25%. Las discordancias entre T-SPOT.TB y QTF-Plus fueron del 12,43%, que implicaban que había 103 pacientes positivos y otros 79 pacientes negativos a expensas exclusivamente de uno de los dos IGRA.
ConclusionesSe evidenció una mayor concordancia entre QTF-Plus y T-SPOT.TB que entre QTF-GIT y T-SPOT.TB. Sin embargo, creemos que la proporción de resultados discordantes entre T-SPOT.TB y QTF-Plus es lo suficientemente relevante clínicamente como para justificar el empleo simultáneo de dos IGRA en este grupo específico de pacientes.
The diagnosis of latent tuberculous infection (LTI) by IGRA continues to generate debate. Experience in the simultaneous use of 2 IGRA tests is scant. The aim of this study was to compare the results of 2 versions of QuantiFERON-TB Gold (In-Tube/Plus) with those of T-SPOT.TB, and to analyse the effectiveness of a dual strategy (T-SPOT.TB + QTF) for the diagnosis of LTI in an immunosuppressed population.
MethodsWe conducted a prospective study (May 2015-June 2017) that included 2,999 immunosuppressed patients and/or candidates for biologics, in whom 2 simultaneous IGRA tests were performed: Group 1 (1535 patients): T-SPOT.TB + QuantiFERON-TB Gold-In-Tube (QTF-GIT); Group 2 (1464 patients): T-SPOT.TB + QuantiFERON-TB Gold Plus (QTF-Plus).
ResultsThe concordance between QTF-GIT and T-SPOT.TB was 83.19% (κ=0.532). The percentage of positive, negative, and indeterminate results were, respectively: 14.33% vs. 17.06%; 82.41% vs. 74.46%; and 3.25% vs. 8.46%. The concordance between QTF-Plus and T-SPOT.TB was 87.56% (κ=0.609). The percentage of positive, negative, and indeterminate results were, respectively: 15.02% vs. 15.36%; 82.92% vs. 79.37%; and 2.04% vs. 5.25%. Discrepancies between T-SPOT.TB and QTF-Plus were 12.43%, suggesting that 103 patients were positive and another 79 were negative due exclusively to 1 of the 2 IGRAs.
ConclusionsGreater concordance was found between QTF-Plus and T-SPOT.TB than between QTF-GIT and T-SPOT.TB. However, we believe that the proportion of discrepancies between T-SPOT.TB and QTF-Plus is sufficiently important from a clinical point of view to justify the simultaneous use of 2 IGRA in this specific patient group.
La tuberculosis (TB) sigue siendo, a pesar de tener un tratamiento eficaz, la primera causa de mortalidad infecciosa a nivel mundial. Como el mayor reservorio para desarrollar TB activa es la población infectada (una cuarta parte de la población mundial), la OMS recomienda la utilización de pruebas de cribado de la infección tuberculosa latente (ITL) en el marco de su estrategia «End-TB», en la que fija como objetivos para el año 2035 una reducción del 95% en las muertes por tuberculosis y del 90% en la tasa de incidencia mundial con respecto a lo registrado en 20151. Para ello, entre otras muchas medidas, resultará imprescindible una correcta identificación y manejo clínico de las personas con ITL.
El diagnóstico de la ITL se realiza mediante pruebas inmunológicas que detectan la sensibilización del individuo a antígenos que expresa M. tuberculosis, en ausencia de hallazgos clínicos y/o radiológicos compatibles con enfermedad tuberculosa activa. No existe una prueba de referencia para el diagnóstico de la ITL, por lo que la prueba de la tuberculina (PT) y las pruebas IGRA (interferon gamma release assay), solas o en combinación, son las técnicas utilizadas habitualmente para diagnosticar de forma indirecta esta infección. La PT tiene limitaciones bien conocidas2: resultados falsos negativos en pacientes inmunodeprimidos y resultados falsos positivos en sujetos vacunados con BCG o sensibilizados con micobacterias no tuberculosas. Hace algo más de una década se introdujeron las pruebas IGRA, que miden la producción de interferón gamma (IFN-γ) en respuesta a antígenos específicos CFP-10 y ESAT-6. Hay dos tipos de IGRA disponibles: QuantiFERON™ (QTF) (Qiagen) y T-SPOT.TB™ (Oxford Immunotec).
La interpretación de los resultados de las pruebas IGRA es objetiva, aunque también están sometidas a fuentes de variabilidad que podrían influir en los resultados3. En general, se recomienda la utilización de los IGRA en países de baja incidencia debido a su alta especificidad. Sin embargo, ni los IGRA ni la PT diferencian entre ITL y tuberculosis activa y tienen un valor predictivo positivo de progresión a enfermedad inferior al 5%4-6.
En nuestro país, en el caso concreto de pacientes inmunodeprimidos, dos documentos de consenso, uno elaborado por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)7 y otro multidisciplinar sobre la prevención y el tratamiento de la tuberculosis en pacientes candidatos a tratamiento biológico8, recomiendan realizar cribado de ITL con la PT y un IGRA. La guía de la American Thoracic Society/Infectious Diseases Society of America/Centers for Disease Control and Prevention recomienda la utilización de pruebas duales (PT + IGRA) en aquellos casos con alta probabilidad de infección y/o progresión a enfermedad2. Estas recomendaciones están basadas en la evidencia acumulada con la versión QuantiFERON TB Gold-In-Tube™ (QTF-GIT).
La nueva versión QuantiFERON TB Gold Plus (QFT-Plus, cuarta generación de QuantiFERON) se diferencia de QTF-GIT en que incorpora un segundo tubo con antígenos modificados para estimular la respuesta de linfocitos T CD8+. Estudios previos han evidenciado un incremento de la sensibilidad en pacientes inmunodeprimidos9, así como en pacientes de edad avanzada10. Se ha postulado que una mayor liberación de IFN-γ en el tubo TB2 respecto al TB1 podría deberse a una infección reciente.
Hasta la fecha, los estudios con QTF-Plus se han llevado a cabo principalmente en el contexto de pacientes con tuberculosis activa11,12, en estudios de contactos de tuberculosis13 o en cribado de ITL14-16; en estos grupos de población, QTF-Plus ha demostrado un rendimiento equivalente al de QTF-GIT. La evidencia publicada en pacientes con alguna condición inmunosupresora ha sido menor17.
El objetivo de este estudio es comparar los resultados de QTF-GIT y QTF-Plus, y confrontarlos con los resultados de T-SPOT.TB, así como evaluar la aportación al cribado de la ITL de una estrategia que emplea los dos IGRA de manera simultánea en los pacientes inmunodeprimidos y/o candidatos a terapias biológicas.
MétodosEstudio prospectivo que incluye a pacientes a los que se les realizó de manera simultánea ambos IGRA (grupo 1: T-SPOT.TB y QTF-GIT desde mayo de 2015 hasta junio de 2016; grupo 2: T-SPOT.TB y QTF-Plus desde julio de 2016 hasta junio de 2017) por tener alguna condición inmunosupresora o un riesgo individual elevado para desarrollar tuberculosis, como los pacientes inmunodeprimidos, con enfermedades crónicas inflamatorias inmunomediadas candidatos a terapias biológicas, con enfermedades hematológicas o VIH positivo.
Este estudio observacional cuenta con el dictamen favorable emitido por el Comité de Ética de la Investigación del Principado de Asturias, así como la aprobación de la Exención del Consentimiento Informado por parte de dicho comité de ética.
En Asturias (un millón de habitantes; tasa de incidencia de TB de 10 casos/100.000 habitantes), el diagnóstico de la infección tuberculosa mediante IGRA se realiza de manera centralizada en la Unidad de Referencia Regional de Micobacterias del Hospital Universitario Central de Asturias, en coordinación con los laboratorios de microbiología del Servicio de Salud del Principado de Asturias. El 21 de mayo de 2015, la Dirección General de Salud Pública (Consejería de Sanidad del Principado de Asturias) publicó la circular 04/2015, que actualizaba los procedimientos para el diagnóstico de la infección tuberculosa en nuestra C.A.18 y que, en el caso de pacientes inmunodeprimidos y/o candidatos a terapias biológicas, recomienda realizar, de manera simultánea, dos técnicas IGRA (QuantiFERON y T-SPOT.TB).
A todos los pacientes incluidos en nuestro estudio se les realizaron dos pruebas IGRA:
QuantiFERON TB Gold, basado en un ELISA (enzyme-linked immunosorbent assay), mide la cantidad de IFN-γ liberado en el plasma tras una estimulación con antígenos específicos. Hemos utilizado la versión disponible en cada uno de los periodos analizados: 1) desde mayo de 2015 hasta junio de 2016: QTF-GIT, consta de 3 tubos: control negativo (Nil), control positivo (Mitogen) y tubo con antígenos ESAT-6, CFP-10 y TB7.7 (Antigen); 2) desde julio de 2016 hasta junio de 2017: QFT-Plus, consta de 4 tubos: Nil, Mitogen, tubo TB1 (contiene péptidos ESAT-6 y CFP-10 optimizados para generar respuesta a partir de linfocitos T-helper CD4+) y tubo TB2 (mismos péptidos optimizados para inducir respuestas tanto de CD4+ como de linfocitos T-citotóxicos CD8+).
T-SPOT.TB, basado en un ELISPOT (enzyme-linked immunospot assay), cuantifica el número de células efectoras T. Para ello, se extraen células mononucleares de sangre periférica y se estimulan con los antígenos ESAT-6 y CFP-10, de manera individualizada en dos pocillos separados (se precisan además dos pocillos para los controles positivo y negativo); posteriormente, en la segunda parte del procedimiento, se cuantifican las células que hayan liberado IFN-γ, que aparecerán como manchas (spots) en el fondo de los pocillos.
Para realizar las pruebas IGRA se siguieron las recomendaciones de los fabricantes. Los resultados de QTF se interpretaron como: positivos, cuando la respuesta al antígeno (tubo Antigen en la versión QTF-GIT, TB1 o TB2 en la versión QTF-Plus) menos el valor de Nil fue ≥ 0,35 UI/mL y ≥ 25% del valor de Nil; negativos, cuando la respuesta antigénica menos el valor de Nil fue < 0,35 UI/mL o < 25% del valor de Nil; indeterminados, cuando a) el valor de Nil fue > 8 UI/mL o b) la respuesta antigénica menos el valor Nil fue < 0,35 UI/mL o < 25% del valor de Nil y el valor de Mitogen fue < 0,5 UI/mL. Los resultados de T-SPOT.TB se interpretaron como: positivos, cuando la diferencia de manchas o spots, con respecto al control nulo, en cualquiera de los pocillos con antígeno (ESAT-6 (panel A) o CFP-10 (panel B)) fue ≥ 8 spots; negativos, cuando esa diferencia era inferior a 8 spots; indeterminados, cuando a) el control nulo tenía > 10 spots o b) el mitógeno tenía < 20 spots.
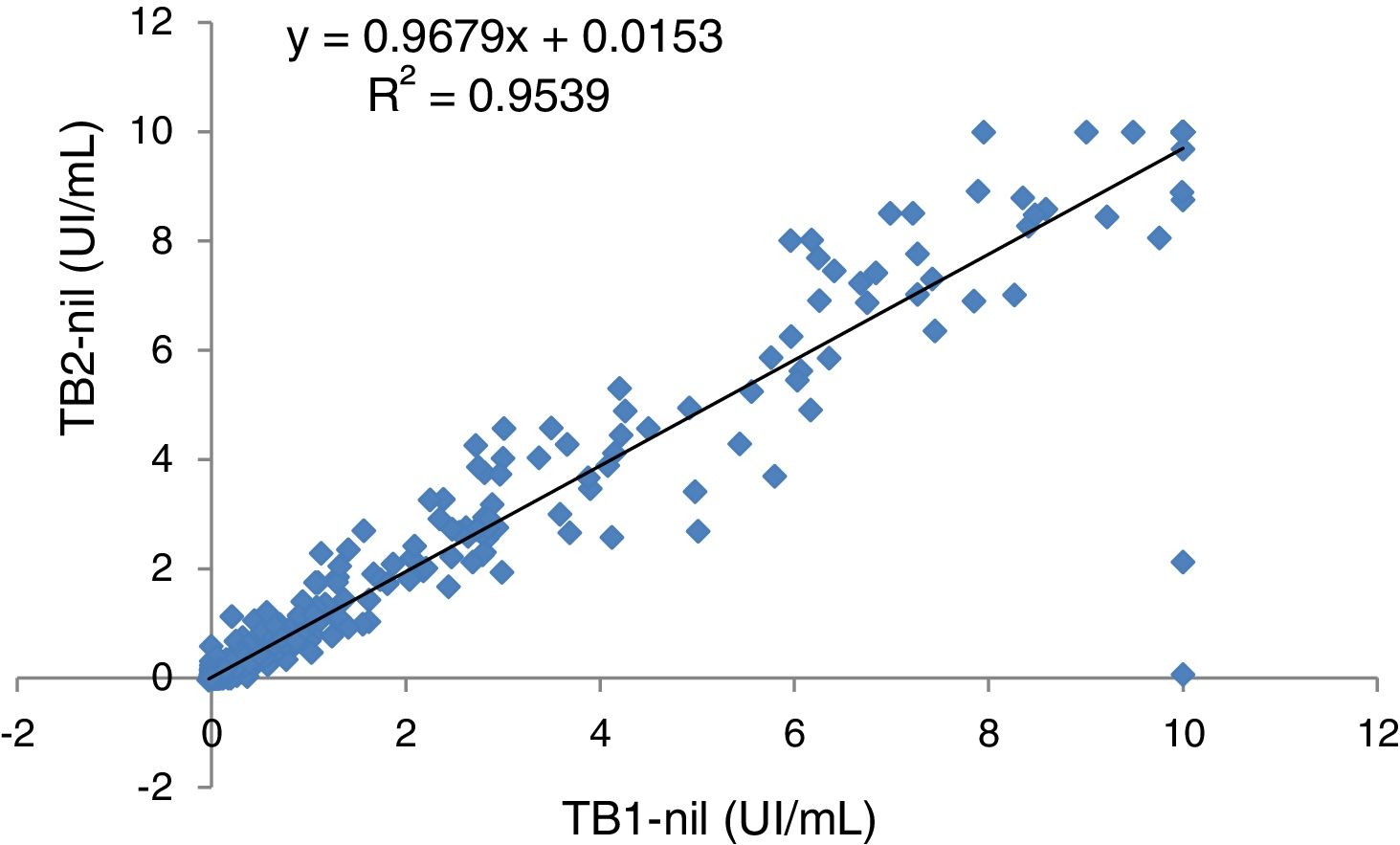
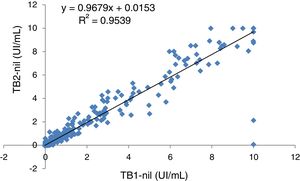
Los análisis estadísticos se realizaron con la interfaz de software libre R Studio. Se utilizó el coeficiente Kappa de Cohen (κ) con intervalos de confianza (IC) del 95% para evaluar la concordancia entre las dos versiones de QTF y el T-SPOT.TB. Los κ fueron interpretados según la clasificación de Landis y Koch: 0,01-0,20 corresponde a una fuerza de concordancia débil; 0,21-0,40 regular; 0,41-0,60 moderada; 0,61-0,80 buena; 0,80-1,00 excelente. La prueba de la χ2 se usó para comparar las características demográficas de los pacientes incluidos en cada periodo de estudio. El análisis de regresión lineal se empleó para representar la cantidad de IFN-γ liberado en cada uno de los tubos TB1 y TB2 de QTF-Plus.
ResultadosSe incluyeron un total de 2.999 pacientes, 1.535 durante el primer periodo y 1.464 durante el segundo periodo del estudio. Las características demográficas de los sujetos y el origen de la patología que condicionaba el estado de inmunodepresión se muestran en la tabla 1, sin observarse diferencias significativas entre ambos grupos de pacientes. En conjunto, los pacientes con procesos digestivos (44%) y hematológicos (25-26%) generaron el 70% de la demanda diagnóstica de estudios IGRA duales (T-SPOT.TB + QTF-GIT o T-SPOT.TB + QTF-Plus).
Características demográficas de los pacientes y origen de la patología que condicionaba el estado de inmunodepresión y/o indicación de terapia biológica
| Primer periodo (n = 1.535) | Segundo periodo (n = 1.464) | p | |
|---|---|---|---|
| Sexo | |||
| Hombre | 783 (51,0%) | 736 (50,3%) | NS |
| Mujer | 752 (49,0%) | 728 (49,7%) | NS |
| Edad | |||
| 0-14 | 57 (3,7%) | 63 (4,3%) | NS |
| 15-24 | 83 (5,4%) | 96 (6,6%) | NS |
| 25-34 | 181 (11,8%) | 173 (11,8%) | NS |
| 35-44 | 329 (21,4%) | 253 (17,3%) | < 0,005 |
| 45-54 | 311 (20,3%) | 347 (23,7%) | < 0,05 |
| 55-64 | 326 (21,2%) | 274 (18,7%) | NS |
| > 65 | 248 (16,2%) | 258 (17,6%) | NS |
| Origen de la condición inmunosupresora | |||
| Digestiva | 676 (44,0%) | 653 (44,6%) | NS |
| Hematológica | 389 (25,3%) | 383 (26,2%) | NS |
| Reumatológica | 177 (11,5%) | 154 (10,5%) | NS |
| Dermatológica | 98 (6,4%) | 87 (5,9%) | NS |
| VIH | 55 (3,6%) | 61 (4,2%) | NS |
| Otros | 140 (9,1%) | 126 (8,6%) | NS |
NS: no significativo
El porcentaje de pacientes con un resultado IGRA positivo (QTF y/o T-SPOT.TB) durante el primer y segundo periodo fue del 20,06% (308/1.535) y 18,71% (274/1.464), respectivamente. Los resultados globales de las pruebas IGRA correspondientes a cada periodo se exponen en la tabla 2.
Resultados globales de las pruebas IGRA correspondientes a cada periodo (QTF-GIT vs. T-SPOT.TB y QTF-Plus vs. T-SPOT.TB, respectivamente)
| Primer periodo | ||||
|---|---|---|---|---|
| QTF-GIT | Total T-SPOT.TB | |||
| Positivo | Negativo | Indeterminado | ||
| T-SPOT.TB | ||||
| Positivo | 174 | 79 | 9 | 262 (17,06%) |
| Negativo | 27 | 1.089 | 27 | 1.143 (74,46%) |
| Indeterminado | 19 | 97 | 14 | 130 (8,46%) |
| Total QTF-GIT | 220 (14,33%) | 1.265 (82,41%) | 50 (3,25%) | 1.535 |
| Segundo periodo | ||||
|---|---|---|---|---|
| QTF-Plus | Total T-SPOT.TB | |||
| Positivo | Negativo | Indeterminado | ||
| T-SPOT.TB | ||||
| Positivo | 171 | 49 | 5 | 225 (15,36%) |
| Negativo | 34 | 1107 | 21 | 1.162 (79,37%) |
| Indeterminado | 15 | 58 | 4 | 77 (5,25%) |
| Total QTF-Plus | 220 (15,02%) | 1.214 (82,92%) | 30 (2,04%) | 1.464 |
QTF-GIT: QuantiFERON TB Gold In-Tube; QTF-Plus: QuantiFERON TB Gold Plus.
La concordancia global entre QTF-Plus y T-SPOT.TB fue superior a la registrada entre QTF-GIT y T-SPOT.TB (87,57% (1.282/1.464), κ = 0,609 [IC 95% 0,560-0,657] vs. 83,19% (1.277/1.535), κ = 0,532 [IC 95% 0,486-0,578]), también en el apartado de resultados positivos (κ = 0,727 [IC 95% 0,677-0,777] vs. κ = 0,671 [IC 95% 0,619-0,722]).
En lo que se refiere a las discordancias QTF (GIT o Plus) y T-SPOT.TB, el porcentaje de resultados entre QTF (GIT o Plus) positivo/T-SPOT.TB negativo o indeterminado, así como de QTF (GIT o Plus) indeterminado/T-SPOT.TB negativo, fue prácticamente idéntico en el primer y segundo periodo (3% vs. 3,3% y 1,7% vs. 1,4%, respectivamente), mientras que en el caso de resultados T-SPOT.TB positivo/QTF (GIT o Plus) negativo o indeterminado, el porcentaje se redujo de un 5,7% (QTF-GIT) a un 3,6% (QTF-Plus) (tabla 3).
Comparación resultados concordantes y discordantes entre IGRA durante los dos periodos estudiados (QTF-GIT/T-SPOT.TB vs. QTF-Plus/T-SPOT.TB)
| QTF-GIT/T-SPOT.TB | QTF-Plus/T-SPOT.TB | |||
|---|---|---|---|---|
| N | % | N | % | |
| Concordancia global | 1.277 | 83,19 | 1.282 | 87,57 |
| QTF positivo/T-SPOT.TB positivo | 174 | 11,34 | 171 | 11,68 |
| QTF negativo/T-SPOT.TB negativo | 1.089 | 70,94 | 1.107 | 75,61 |
| QTF indeterminado/T-SPOT.TB indeterminado | 14 | 0,91 | 4 | 0,27 |
| Discordancia global | 258 | 16,81 | 182 | 12,43 |
| QTF positivo/T-SPOT.TB negativo o indeterminado | 46 | 3,00 | 49 | 3,35 |
| T-SPOT.TB positivo/QTF negativo o indeterminado | 88 | 5,73 | 54 | 3,69 |
| QTF negativo/T-SPOT.TB indeterminado | 97 | 6,32 | 58 | 3,96 |
| T-SPOT.TB negativo/QTF indeterminado | 27 | 1,76 | 21 | 1,43 |
| TOTAL | 1.535 | 100 | 1.464 | 100 |
QTF-GIT: QuantiFERON TB Gold In-Tube; QTF-Plus: QuantiFERON TB Gold Plus; QTF: hace referencia indistintamente a cualquiera de las dos versiones de QuantiFERON TB Gold (GIT o Plus).
Los resultados individualizados de los tubos TB1 (estimulación CD4+) y TB2 (estimulación CD4+ y CD8+) de QTF-Plus evidenciaron un grado de concordancia entre ambos del 98,22% (1.438/1.464, κ = 0,927 [IC 95% 0,899-0,955]). El número de resultados positivos fue ligeramente mayor en TB1 que en TB2 (14,41% (211/1.464) vs. 13,87% (203/1.464)). La tasa de discordancia global fue del 1,77% (26/1.464), con 17 casos TB1 positivo/TB2 negativo y 9 TB1 negativo/TB2 positivo.
El análisis de regresión lineal de los valores de IFN-γ registrados en los tubos TB1 y TB2 mostró una correlación alta entre las lecturas de los mismos (fig. 1). Los valores promedio de IFN-γ (UI/mL) registrados en las muestras con resultado positivo en al menos uno de los dos tubos se presentan de manera individualizada en la tabla 4. En nuestra serie no encontramos ningún caso en el que las diferencias entre las lecturas de TB2 y TB1 fueran superiores a 0,6 UI/mL (límite fijado para establecer diferencias significativas y excluir la variabilidad intratest19).
Valores promedio de IFN-γ detectados en tubos TB1 y TB2 de QTF-Plus en las muestras con resultado QTF positivo en al menos uno de los dos tubos. Se presentan desglosados en relación al resultado obtenido con T-SPOT.TB
| N | TB1 (UI/mL) | TB2 (UI/mL) | TB2-TB1* | |
|---|---|---|---|---|
| QTF-Plus positivo/T-SPOT.TB positivo | 171 | 4,26 [0,19-10,00] | 4,17 [0,03-10,00] | N/A |
| TB1 positivo/TB2 positivo | 155 | 4,60 [0,37-10,00] | 4,57 [0,36-10,00] | N/A |
| TB1 positivo/TB2 negativo | 11 | 1,29 [0,35-10,00] | 0,19 [0,03-0,34] | N/A |
| TB1 negativo/TB2 positivo | 5 | 0,28 [0,19-0,34] | 0,43 [0,35-0,68] | 0,15 |
| QTF-Plus positivo/T-SPOT.TB negativo o indeterminado | 49 | 1,78 [0,00-10,00] | 1,95 [0,25-10,00] | 0,17 |
| TB1 positivo/TB2 positivo | 39 | 2,14 [0,35-10,00] | 2,35 [0,35-10,00] | 0,21 |
| TB1 positivo/TB2 negativo | 6 | 0,41 [0,35-0,58] | 0,30 [0,25-0,32] | N/A |
| TB1 negativo/TB2 positivo | 4 | 0,25 [0,00-0,32] | 0,54 [0,35-0,75] | 0,29 |
| TOTAL positivos TB1 y TB2 | TB1: 211 | 3,86 [0,35-10,00] | 3,96 [0,35-10,00] | 0,10 |
| TB2: 203 |
N/A: no aplicable.
Nuestro estudio se llevó a cabo en una región en la que se aplica una estrategia diagnóstica con dos IGRA de manera simultánea (QTF + T-SPOT.TB) en el contexto de pacientes inmunodeprimidos y/o candidatos a terapias biológicas. Hemos comparado los resultados de dos versiones diferentes de QTF que fueron contrastados con los de T-SPOT.TB.
En conjunto, hemos observado una mayor concordancia global de QTF-Plus con respecto a T-SPOT.TB, con una reducción en el número de resultados discordantes QTF negativo o indeterminado/T-SPOT.TB positivo. En el caso concreto de los resultados IGRA positivos, el grado de concordancia entre QTF-Plus y T-SPOT.TB (κ = 0,727) fue superior al registrado entre QTF-GIT y T-SPOT.TB durante el primer periodo (κ = 0,671).
En dos estudios comparativos recientes entre pruebas IGRA, realizados en 154 pacientes con artritis reumatoide20 y en 92 trasplantados renales21, se encontraron grados de concordancia muy similares entre QTF-Plus y T-SPOT.TB (κ = 0,51) y entre QTF-GIT y T-SPOT.TB (κ = 0,48) en el apartado de resultados IGRA positivo, aunque conviene reseñar que el número de estos últimos era muy bajo, probablemente porque se trataba de series con un número de pacientes muy reducido.
A pesar de esto, creemos que un porcentaje de discordancias del 12,43% entre QTF-Plus y T-SPOT-TB, que implicaba que 103 pacientes eran positivos a expensas exclusivamente de uno de los dos IGRA (49 QTF-Plus; 54 T-SPOT.TB), justifican nuestra estrategia dual de pruebas IGRA en pacientes inmunodeprimidos; además en otros 79 pacientes el resultado negativo también lo fue a partir solamente de uno de los dos IGRA (58 QTF-Plus; 21 T-SPOT.TB), siendo el otro indeterminado.
Se ha descrito una mayor proporción de resultados IGRA indeterminados en población inmunocomprometida22,23. Latorre et al.24 encontraron que eran más frecuentes en los pacientes con enfermedad de Crohn con respecto a los que tenían enfermedades reumáticas y psoriasis. En nuestro estudio, los resultados indeterminados fueron menos frecuentes con QTF-Plus que con QTF-GIT, circunstancia también recogida en otros dos estudios japoneses, en los que pasan del 5,2% con QTF-GIT al 0,7% con QTF-Plus20,21.
Por este motivo, también consideramos que el uso simultáneo de dos IGRA (QTF y T-SPOT.TB) mejora la eficiencia en el cribado de ITL en pacientes de riesgo, ya que los resultados indeterminados de uno de los IGRA se correspondieron mayoritariamente con un resultado válido del otro IGRA; de hecho, en menos del 1% de los pacientes (14 pacientes durante el primer periodo y cuatro en el segundo) se obtuvieron resultados indeterminados a la vez en los dos IGRA.
Por otra parte, en la literatura a menudo se cita que los valores predictivos negativos de las pruebas IGRA son muy elevados, y respecto al valor predictivo positivo, existen estudios publicados en los que encuentran que T-SPOT.TB es un mejor predictor de progresión a enfermedad tuberculosa que QTF-GIT y PT5,6. Una de las limitaciones de nuestro estudio es que no disponemos de información relativa al seguimiento de los pacientes, lo que, por el momento, no nos permite determinar si el menor número de discordancias evidenciado entre T-SPOT. TB y QTF-Plus podría implicar mejores valores predictivos de progresión a enfermedad de QTF-Plus, respecto a los recogidos en la literatura con QTF-GIT. Sin embargo, conviene tener presente que, en ausencia de un gold standard de infección tuberculosa, no es posible establecer de manera precisa la seguridad de una prueba diagnóstica. En este sentido, creemos que nuestro estudio pone en evidencia que, en un número significativo de pacientes con alguna condición inmunosupresora, se obtienen resultados discordantes (positivo/negativo) entre pruebas IGRA realizadas de manera simultánea y sin que se identifiquen motivos técnicos que lo justifiquen (conviene recordar que estas pruebas incluyen controles negativos y positivos).
En cuanto a la aportación del segundo tubo TB2 en QTF-Plus, al igual que en otros estudios9,10, también se tradujo en un incremento del rendimiento diagnóstico. Respecto a la respuesta específica CD8+ asociada a tuberculosis activa23 y a una mayor exposición a M. tuberculosis en estudios de contactos13, cuando comparamos en nuestra serie los valores medios de IFN-γ no encontramos diferencias TB2-TB1 superiores a 0,6 UI/mL (no achacables a la variabilidad intratest19).
El grado de concordancia entre TB1 y TB2 en nuestra serie fue excelente (κ=0,927), similar al de otros estudios17,20. Aunque, globalmente, observamos unos valores medios de IFN-γ superiores en TB2, dicha diferencia no fue significativa, ni pudo asociarse a ningún grupo de población determinado. En un estudio reciente en el que incluían a 317 pacientes inmunodeprimidos17 los investigadores encontraron un alto grado de concordancia entre TB1 y TB2, pero observaron además una mayor respuesta de IFN-γ en TB2, en concreto en los candidatos a trasplante de órgano sólido, lo que les lleva a concluir que QTF-Plus podría suponer una mejora para el diagnóstico de ITL en dichos pacientes.
ConclusionesEn el cribado de ITL en población con alguna condición inmunosupresora, los resultados de QTF-Plus presentaron una mayor concordancia con T-SPOT.TB respecto a los resultados de QTF-GIT. Además, se observó una reducción significativa en la tasa de discordancia entre QTF-Plus y T-SPOT.TB, así como de los resultados QTF indeterminados.
Como hasta el momento no se ha establecido la razón de las discordancias entre las diferentes pruebas de cribado de ITL, nuestra experiencia aconseja realizar, siempre que sea factible, todas las pruebas diagnósticas disponibles en los grupos con más riesgo de enfermar como son los pacientes inmunodeprimidos y/o candidatos a terapias biológicas, en los que cualquier resultado positivo debería ser considerado evidencia de ITL. Por ello, creemos que el porcentaje de resultados positivos discordantes entre T-SPOT.TB y QTF-Plus, aunque menores a los observados con QTF-GIT, así como el número de resultados indeterminados con T-SPOT.TB (muy superior a los registrados con QTF-Plus), son lo suficientemente relevantes en el diagnóstico de la ITL como para justificar el empleo simultáneo de QTF-Plus y T-SPOT.TB en este grupo específico de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La Red de Laboratorios de Microbiología del SESPA incluye los Servicios de Microbiología de: Hospital de Jarrio, Hospital Carmen y Severo Ochoa, Hospital Universitario San Agustín, Hospital Universitario de Cabueñes, Hospital de Jove, Hospital Grande Covián, Hospital Álvarez-Buylla, Hospital Valle del Nalón y Hospital Universitario Central de Asturias (HUCA).