En una estrategia de manejo de la enfermedad pulmonar obstructiva crónica (EPOC) basada en fenotipos clínicos sería deseable que todos los pacientes pudieran adscribirse al menos a un fenotipo sin adscribirse a otro. El objetivo de este trabajo fue evaluar si todos los pacientes tienen un fenotipo y sólo uno asignado según la actual guía española de la EPOC (GesEPOC 2017) y evaluar los criterios que los definen.
MétodoEl estudio Time-based Register and Analysis of COPD Endpoints (TRACE; clinicaltrials.gov NCT03485690) es una cohorte prospectiva de pacientes con EPOC en visitas anuales desde 2012 que recoge los fenotipos GesEPOC. A pesar de que GesEPOC recomienda no fenotipar a los pacientes considerados de bajo riesgo, se realizó un análisis de los criterios de identifican los fenotipos en alto y bajo riesgo, comparando la distribución de los fenotipos y sus criterios en estos dos grupos.
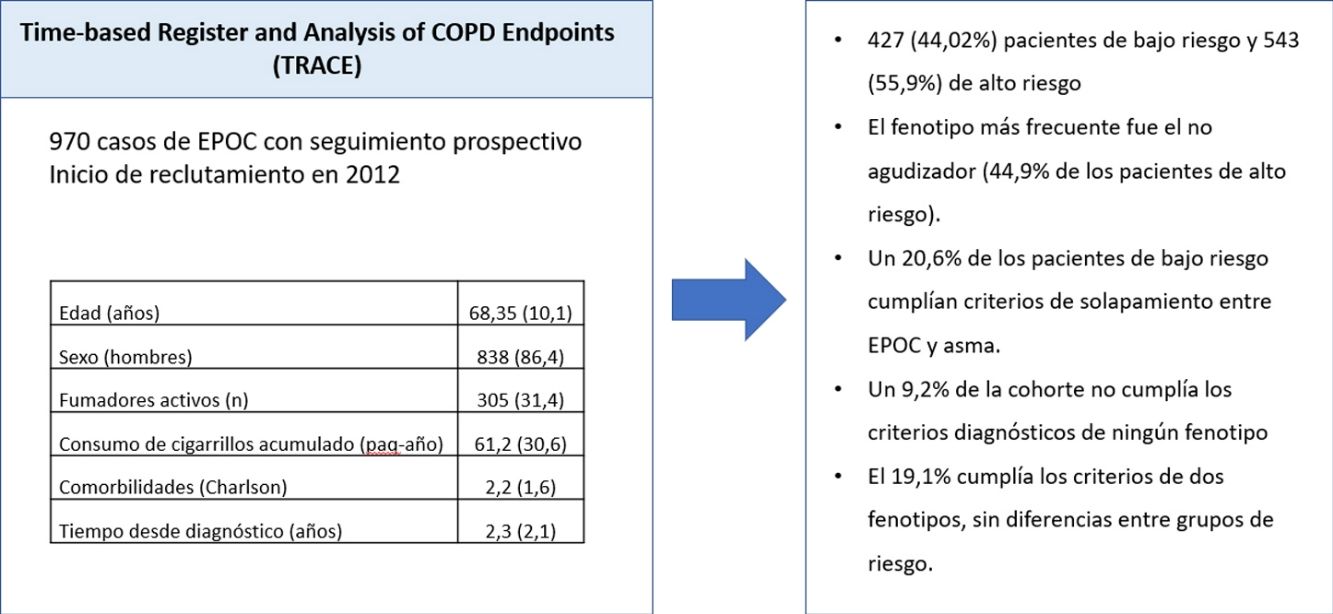
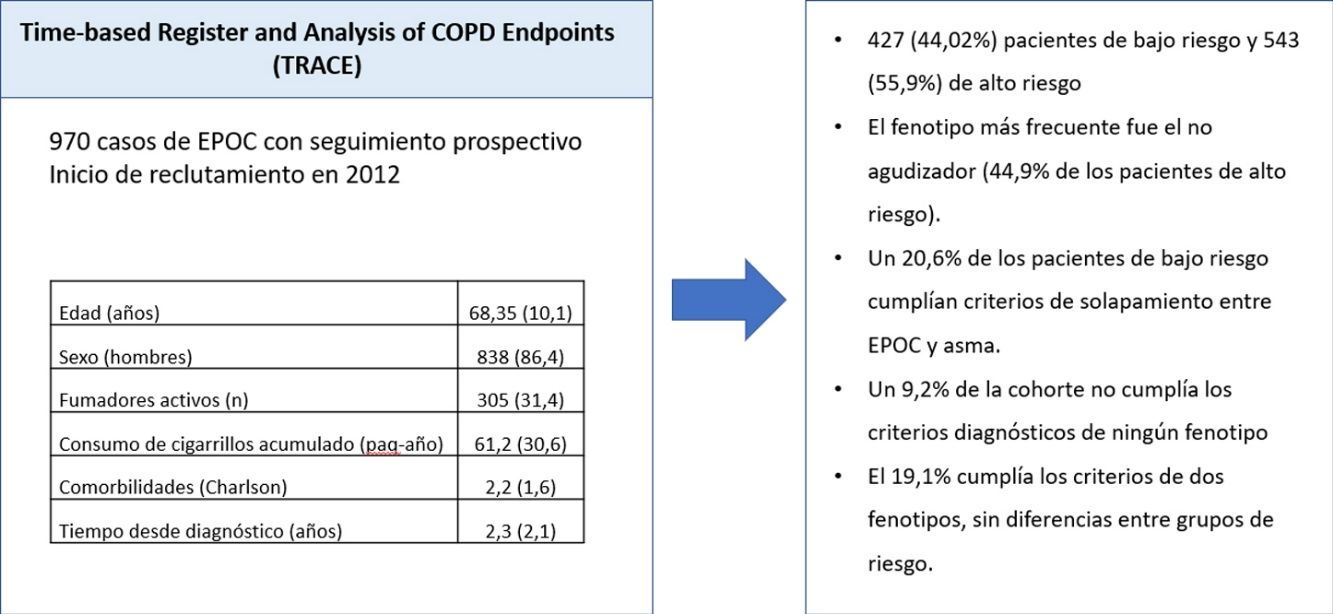
ResultadosLa cohorte incluye 970 pacientes con diagnóstico confirmado de EPOC, divididos en 427 (44,02%) pacientes de bajo riesgo y 543 (55,9%) de alto riesgo. El fenotipo más frecuente fue el no agudizador (44,9% de los pacientes de alto riesgo). Un 20,6% de los pacientes de bajo riesgo cumplían criterios de solapamiento entre EPOC y asma. Un 9,2% de la cohorte no cumplía los criterios diagnósticos de ningún fenotipo y el 19,1% cumplía los criterios de dos fenotipos, sin diferencias entre grupos de riesgo.
ConclusionesNuestros datos ponen de manifiesto algunas de las debilidades de la actual estrategia basada en fenotipos clínicos, existiendo solapamiento en algunos casos y pacientes sin fenotipos.
In a clinical phenotype-based management strategy for COPD, it would be preferable to at least assign all patients to a phenotype, but to a single phenotype only. The aim of this study was to evaluate whether all patients are assigned to one and only one phenotype using the Spanish COPD guidelines (GesEPOC) and to evaluate the criteria that define these categories.
MethodThe Time-based Register and Analysis of COPD Endpoints study (TRACE; clinicaltrials.gov NCT03485690) is a prospective cohort of COPD patients attending annual visits since 2012, which collects GesEPOC phenotypes. Although the GesEPOC recommends that patients considered to be at low risk are not phenotyped, an analysis of the criteria for identifying high- and low-risk phenotypes was performed, comparing the distribution of phenotypes and the criteria applied between these 2 groups.
ResultsThe cohort included 970 patients with a confirmed diagnosis of COPD, divided into 427 (44.02%) low-risk and 543 (55.9%) high-risk patients. The most frequent phenotype was the non-exacerbator (44.9% of high-risk patients). Overall, 20.6% of low-risk patients met criteria for asthma-COPD overlap syndrome, while 9.2% of the cohort did not meet the diagnostic criteria for any phenotype, and 19.1% met the criteria for 2 phenotypes, with no differences between risk groups.
ConclusionsOur data highlight some of the weaknesses of the current clinical phenotype strategy, revealing overlapping categories in some cases, and patients to whom no phenotype was assigned.
En las últimas décadas, el avance en el conocimiento de la patogenia de la enfermedad pulmonar obstructiva crónica (EPOC), la mejor caracterización de los pacientes y la disponibilidad de nuevas opciones terapéuticas han cambiado notablemente el manejo de esta enfermedad. Consecuentemente, los documentos de recomendaciones sobre el diagnóstico y tratamiento de la EPOC han ido modificando sus recomendaciones tratando de avanzar hacia una medicina más personalizada en su manejo clínico. Los dos principales documentos sobre el manejo de la EPOC en España, el documento de la Global Initiative for Obstructive Lung Disease (GOLD) y la Guía Española de la EPOC (GesEPOC), aportan visiones distintas pero ambas enfocadas hacia esta personalización del tratamiento1,2. En concreto, GesEPOC establece un algoritmo de tratamiento por fenotipos clínicos desde su primera versión en 20123 con una actualización mayor en 20171 en la que se introducía el concepto de riesgo para la categorización inicial de los pacientes, antes de establecer su fenotipo clínico. La introducción del concepto de fenotipo clínico, acuñado para la EPOC en 20104, ha supuesto un giro considerable en el abordaje de la enfermedad, permitiendo una aproximación a la vez intuitiva para el clínico y cercana a la realidad de los pacientes, por lo que ha tenido una considerable implementación en España5 y ha sido adoptada en otros países6.
Sin embargo, algo no explícitamente indicado en GesEPOC, pero implícitamente sugerido en el concepto de fenotipo es que sería deseable que, en una guía basada en fenotipos, todos los pacientes pudieran adscribirse al menos a un fenotipo concreto. Además, debido a las implicaciones de la distinta estrategia terapéutica para cada fenotipo, sería igualmente deseable que cada paciente tuviera un solo fenotipo al que adscribirse. Sin embargo, hasta el momento estas dos condiciones no se han estudiado en una cohorte de pacientes EPOC. El estudio Time-based Register and Analysis of COPD Endpoints (TRACE) es una cohorte de vida real de seguimiento prospectivo que, entre otras variables, recoge los fenotipos propuestos por GesEPOC así como muchas de las variables individuales que los conforman7. Consecuentemente, la cohorte TRACE podría permitir evaluar los fenotipos de GesEPOC de manera más detallada. El objetivo del presente estudio fue analizar la distribución de fenotipos clínicos en pacientes con EPOC con objeto de evaluar su distribución, así como estudiar los criterios en los que se basan mediante el análisis de la cohorte TRACE.
MétodoLa metodología de TRACE se ha publicado previamente7. Brevemente, TRACE (clinicaltrials.gov NCT03485690) es un estudio observacional prospectivo de cohortes no intervencionista de un solo centro. La muestra se compone únicamente de pacientes con EPOC, identificados presencialmente según los criterios diagnósticos actuales1. El protocolo no preespecifica ningún criterio de exclusión, excepto por la reversibilidad completa de las pruebas de la función pulmonar durante el seguimiento.
La inclusión de pacientes comenzó en enero de 2012. Tras la identificación de los casos, los pacientes son seguidos prospectivamente en las visitas anuales sine die hasta que fallecen o se pierden para el seguimiento. Todos los sujetos reciben sus medicamentos prescritos e intervenciones terapéuticas a lo largo del estudio con cualquier cambio en la medicación que se ordene por el médico responsable, de acuerdo con el estado clínico del paciente. Durante las visitas anuales, se registra información clínica, funcional, radiológica y analítica utilizando un cuestionario estandarizado para todas las visitas. El resultado clínico principal a evaluar es la supervivencia. Los objetivos secundarios incluyen disnea, medida por escala mMRC, el número de exacerbaciones moderadas o graves definidas según GesEPOC y la evaluación funcional respiratoria.
Las variables recogidas son: sociodemográficas (género, edad), antecedentes de tabaco, comorbilidades, presentación clínica en situación estable durante el año anterior (incluida la evaluación de la disnea, producción de tos y esputo, color del esputo si está presente y sibilancias auto-referidas), exacerbaciones y hospitalizaciones en el año anterior, tratamiento farmacológico y no farmacológico actual y pruebas complementarias, incluyendo, al menos, radiología torácica simple, espirometría pre y post-broncodilatadora y resultados analíticos (eosinófilos de sangre, alfa1-antitripsina, proteína C reactiva e IgE total). La tos y la expectoración crónicas identificaban a pacientes con bronquitis crónica con los límites temporales actualmente aceptados en GesEPOC 20171. Para el resto de los criterios clínicos se adoptaron los definidos por GesEPOC 20171.
El presente análisis se centra en la evaluación de los fenotipos clínicos, según GesEPOC 20171. A pesar de que GesEPOC recomienda no fenotipar a los pacientes considerados de bajo riesgo, el presente análisis realizó la determinación de los criterios de identifican los fenotipos independientemente de si eran pacientes de alto o bajo riesgo. Para la identificación de los fenotipos agudizadores y no agudizadores se contemplaron los mismos criterios propuestos por GesEPOC 2017. Para el fenotipo de solapamiento entre asma y EPOC (ACO) se consideraron ambos criterios propuestos por GesEPOC (eosinófilos > 300 células/μL o broncorreversibilidad ≥ 15% y 400 mL), recogiéndose los casos que cumplían uno o los dos criterios8. Debido a que la cohorte TRACE no realiza sistemáticamente tomografía computarizada de alta resolución ni determinación de volúmenes pulmonares o capacidad de difusión en todos los casos, el diagnóstico del fenotipo agudizador con enfisema se realizó en aquellos pacientes agudizadores frecuentes con un patrón mixto en la espirometría (con un patrón obstructivo y restrictivo) junto con un índice de masa corporal (IMC) < 25 kg/m2 o bien agudizadores frecuentes con un patrón espirométrico obstructivo puro y un IMC < 21 kg/m2.
ÉticaEl presente protocolo ha sido aprobado por el Portal de Ética de la Investigación Biomédica de Andalucía (actas 08/2015 y 07/2017). Durante el estudio, no recogían datos personales que puedan ser usados para identificar a los pacientes. Los datos obtenidos se mantienen bajo estricta confidencialidad (Ley Orgánica 3/2018, del 5 de diciembre de Protección de Datos de Carácter Personal y Garantía de Derechos Digitales, LOPDGDD) y sólo el investigador principal del proyecto tiene acceso a los mismos. Los casos se anonimizan y se numeran con un código para garantizar la confidencialidad de los datos. Debido a la naturaleza no-intervencionista del estudio, se ha renunciado al consentimiento informado ya que no se llevan a cabo pruebas diagnósticas ni intervenciones terapéuticas fura de la práctica clínica. El comité ético fue notificado de esta circunstancia, claramente reflejada en el protocolo y aprobó el procedimiento.
Plan estadísticoEl análisis de datos se realizó utilizando el software IBM SPSS Statistics (IBM Corporation, Armonk, Nueva York), versión 26. Para la descripción de las variables se han usado estimadores de centralización y dispersión que se adapten a la naturaleza de cada variable y su distribución. La distribución de los fenotipos y las variables que los componen se estudiaron comparando los pacientes de alto y bajo riesgo. Las diferencias entre estos grupos se analizaron utilizando la prueba t de Student para datos independientes (después de la verificación de la igualdad de varianzas con la prueba de Levene) o la prueba de X2 (o el test exacto de Fisher si corresponde). El nivel de significación estadística se establece en 0,05.
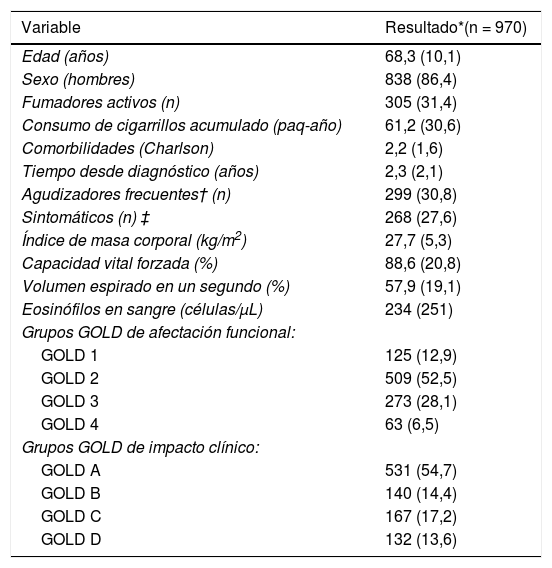
ResultadosEl presente análisis está formado por 970 pacientes de la cohorte TRACE con diagnóstico confirmado de EPOC. Los datos descriptivos de la muestra están referidos en la tabla 1. Se trata de una cohorte de pacientes mayoritariamente hombres, en la séptima década de la vida de promedio, con un tercio de los pacientes fumadores activos, con representación de todos los grupos de afectación clínica y funcional según GOLD.
Descripción de los pacientes incluidos en el estudio
| Variable | Resultado*(n = 970) |
|---|---|
| Edad (años) | 68,3 (10,1) |
| Sexo (hombres) | 838 (86,4) |
| Fumadores activos (n) | 305 (31,4) |
| Consumo de cigarrillos acumulado (paq-año) | 61,2 (30,6) |
| Comorbilidades (Charlson) | 2,2 (1,6) |
| Tiempo desde diagnóstico (años) | 2,3 (2,1) |
| Agudizadores frecuentes† (n) | 299 (30,8) |
| Sintomáticos (n) ‡ | 268 (27,6) |
| Índice de masa corporal (kg/m2) | 27,7 (5,3) |
| Capacidad vital forzada (%) | 88,6 (20,8) |
| Volumen espirado en un segundo (%) | 57,9 (19,1) |
| Eosinófilos en sangre (células/μL) | 234 (251) |
| Grupos GOLD de afectación funcional: | |
| GOLD 1 | 125 (12,9) |
| GOLD 2 | 509 (52,5) |
| GOLD 3 | 273 (28,1) |
| GOLD 4 | 63 (6,5) |
| Grupos GOLD de impacto clínico: | |
| GOLD A | 531 (54,7) |
| GOLD B | 140 (14,4) |
| GOLD C | 167 (17,2) |
| GOLD D | 132 (13,6) |
GOLD: Global Initiative for Obstructive Lung Disease; MRC Medical Research Council.
Según los grupos de riesgo de GesEPOC, la muestra se dividía en 427 (44,02%) pacientes de bajo riesgo y 543 (55,9%) de alto riesgo. La distribución de fenotipos según los grupos de riesgo aparece en la tabla 2. Debido al solapamiento de fenotipos descrito más abajo, el sumatorio de fenotipos superaba el número de casos por grupo. Por definición, los pacientes de bajo riesgo eran no agudizadores, pero había un 20,6% de los casos que cumplían los criterios de ACO. El número de pacientes con ACO era significativamente mayor en el grupo de bajo riesgo.
Distribución de los fenotipos según grupos de riesgo
| Bajo riesgo(n = 427) | Alto riesgo(n = 543) | Valor p * | |
|---|---|---|---|
| No agudizador | 427 (100) | 244 (44,9) | < 0,001 |
| ACO | 88 (20,6) | 85 (15,7) | 0,045 |
| Agudizador con enfisema | 0 (0) | 43 (7,9) | < 0,001 |
| Agudizador con bronquitis crónica | 0 (0) | 181 (33,3) | < 0,001 |
Valores expresados en frecuencias absolutas (relativas) referidas al total de pacientes en cada grupo de riesgo.
El análisis más detallado de los criterios concretos para los fenotipos ACO y agudizador con enfisema se presenta en la tabla 3. Para el fenotipo ACO, la mayoría de los pacientes no compartían los criterios de eosinófilos en sangre y broncorreversibilidad según los puntos de corte de GesEPOC. Los pacientes de bajo riesgo presentaban significativamente más casos con aumento de eosinófilos que los de alto riesgo, así como también una broncorreversibilidad significativamente más frecuente. El criterio de patrón mixto con IMC < 25 kg/m2 era más frecuente en el alto riesgo.
Descripción de la frecuencia de los componentes de cada uno de los fenotipos
| Bajo riesgo(n = 427) | Alto riesgo(n = 543) | Valor p * | |
|---|---|---|---|
| Criterios de ACO | |||
| Eosinófilos > 300 células/μL | 76 (31,0) | 81 (23,0) | 0,029 |
| Broncorreversibilidad ≥ 15% y 400 mL | 12 (2,8) | 7 (1,3) | < 0,001 |
| Ambos criterios | 0 (0) | 3 (0,6) | 0,007 |
| Criterios de enfisema | |||
| Patrón mixto + IMC < 25 kg/m2 | 12 (2,8) | 69 (12,7) | < 0,001 |
| Patrón obstructivo + IMC < 21 kg/m2 | 15 (3,5) | 24 (4,4) | 0,475 |
Valores expresados en frecuencias absolutas (relativas) referidas al total de pacientes en cada grupo de riesgo. IMC: índice de masa corporal
El solapamiento entre fenotipos está reflejado en la tabla 4. En 90 (9,2%) casos no se identificaron ninguno de los criterios definitorios de alguno de los fenotipos. Estos pacientes eran agudizadores frecuentes que no tenían bronquitis crónica ni cumplían con los criterios de enfisema establecidos en este protocolo. La mayoría de los casos tenían un solo fenotipo con una frecuencia significativamente mayor para el grupo de bajo riesgo. En 186 (19,1%) casos se identificaban dos fenotipos y un caso cumplía los criterios identificativos de tres fenotipos (todos menos el no agudizador). La distribución de los pacientes con dobles fenotipos está resumida en la tabla 5. La combinación más frecuente era la asociación de ACO con no agudizador seguida de la asociación de ACO con agudizador con bronquitis crónica y los dos fenotipos agudizadores.
Número de fenotipos en cada grupo de riesgo
| Bajo riesgo(n = 427) | Alto riesgo(n = 543) | Valor p * | |
|---|---|---|---|
| 0 fenotipos | 0 (0) | 90 (16,6) | < 0,001 |
| 1 fenotipos | 339 (79,4) | 354 (65,2) | < 0,001 |
| 2 fenotipos | 88 (20,6) | 98 (18,0) | 0,315 |
| 3 fenotipos | 0 (0) | 1 (0,2) | 0,375 |
Valores expresados en frecuencias absolutas (relativas) referidas al total de pacientes en cada grupo de riesgo.
Distribución de los pacientes con fenotipos dobles
| Bajo riesgo(n = 88) | Alto riesgo(n = 98) | Valor p * | |
|---|---|---|---|
| ACO y agudizador con enfisema | 0 (0) | 2 (2,0) | 0,178 |
| ACO y agudizador con bronquitis crónica | 0 (0) | 27 (27,6) | < 0,001 |
| ACO y no agudizador | 88 (100) | 44 (44,9) | < 0,001 |
| Agudizador con bronquitis crónica y enfisema | 0 (0) | 25 (25,5) | < 0,001 |
Valores expresados en frecuencias absolutas (relativas) referidas al total de pacientes en cada grupo de riesgo.
El presente estudio refleja la distribución de los fenotipos de la EPOC dividiendo sus resultados en pacientes con alto y bajo riesgo, según la definición de GesEPOC 20171. Nuestros resultados indican que 1) los pacientes de bajo riesgo pueden tener un fenotipo ACO; 2) hay un porcentaje de pacientes que no se ajustan a ningún fenotipo clínico y 3) existen pacientes que cumplen los criterios de más de un fenotipo.
La introducción de los fenotipos clínicos, como base para el manejo de la EPOC, fue sugerida por un grupo de investigadores internacionales en 20104 y fue finalmente implementada por GesEPOC en 20123. Desde entonces, su uso se ha extendido por España y por otros países, como una forma de hacer una medicina más centrada en el paciente. Sin embargo, hasta ahora no se habían evaluado la cumplimentación de sus criterios y la identificación en una cohorte amplia de pacientes. Nuestros resultados sugieren que la definición de estos fenotipos debería refinarse más para conseguir que todos los pacientes estén representados en algún fenotipo y puedan ser adscritos a un y sólo un fenotipo. Las consecuencias de tener una asignación confusa son evidentes, puesto que estarían recibiendo tratamientos que no son óptimos para su enfermedad.
El presente trabajo tiene algunas consideraciones metodológicas que deben ser tenidas en cuenta para la correcta interpretación de los resultados. En primer lugar, la muestra ha sido seleccionada de una consulta externa monográfica de EPOC, lo que constituye un sesgo de selección. Aunque los datos incluyen pacientes con todos los grados de afectación funcional y clínica, es posible que un estudio en Atención Primaria diera una visión distinta. En segundo lugar, aunque GesEPOC 2017 no es exacta en los puntos de corte para identificar un paciente considerado como enfisematoso1, si recalca la necesidad de identificar este enfisema por pruebas funcionales o por tomografía computarizada de alta resolución. En nuestro caso, al no disponer de esta información hemos tenido que hacer una aproximación a los pacientes potencialmente enfisematosos. Para esto hemos seleccionado a los pacientes con un componente restrictivo en la espirometría y sin obesidad y a aquellos con una disminución marcada del IMC. Aunque esta aproximación no sea la recogida por GesEPOC, probablemente sea una buena aproximación a este fenotipo. La identificación del paciente enfisematoso es clara en casos concretos, pero más complicada en la mayoría de los pacientes con EPOC puesto que la mayoría de los pacientes tienen una presentación clínica combinada con afectación de la vía aérea y afectación del parénquima en forma de enfisema9. La idea de GesEPOC 2017 es identificar pacientes predominantemente enfisematosos mediante hallazgos clínico/radiológico/funcionales. Además, este fenotipo se asocia con un IMC reducido. De hecho, debido a la estrecha relación entre el fenotipo puramente enfisematoso clásico y la pérdida de masa muscular, la disminución del IMC sería un buen marcador para ayudar a identificar a pacientes muy enfisematosos o con un predominio de afectación parenquimatosa10. Por este motivo, a falta de una mejor manera de identificarlos con nuestros datos, nos basamos en el IMC y en la presencia de un componente restrictivo no justificado por una obesidad como marcadores indirectos de este fenotipo. Es cierto que los datos, por tanto, pueden dejar escapar pacientes que con un estudio más completo hubieran sido catalogados de enfisema, pero, por otro lado, incluso haciendo esta selección más conservadora hemos podidos mostrar nuestros resultados. Por tanto, sería esperable que, identificando pacientes con enfisema de manera más correcta, existiera un mayor solapamiento de fenotipos lo que sustenta nuestros hallazgos. En tercer lugar, GesEPOC 2017 reconoce que existe un ACO en dos circunstancias, cuando se cumplen los criterios recogidos en nuestra cohorte y cuando coexisten EPOC y asma, los dos diagnósticos en un mismo paciente. TRACE es una cohorte de paciente con EPOC sin asma. Es posible que, en una cohorte que incluya pacientes menos seleccionados con ambos diagnósticos, los criterios de ACO tendrían probablemente una distribución distinta y probablemente un solapamiento entre fenotipos mayor del reflejado en nuestros resultados.
A pesar de que GesePOC 2017 recomienda no fenotipar a pacientes considerados de bajo riesgo1, estos pacientes también tienen fenotipos clínicos. Parece lógico esperar que los pacientes de bajo riesgo sean no agudizadores, ya que uno de los criterios para el concepto de bajo riesgo es el número de agudizaciones y hospitalizaciones. Sin embargo, nuestros datos indican que los pacientes con bajo riesgo sí pueden tener un fenotipo ACO según los propios criterios de GesEPOC 2017. Esta circunstancia clínica es esperable. Si los pacientes con ACO responden bien a los corticoides inhalados, se quedarían sin síntomas y sin agudizaciones y con una mejor función pulmonar, por lo que pueden permanecer como un paciente en bajo riesgo11. Sin embargo, contrario a las recomendaciones de GesEPOC 2017, estos pacientes no deberían dejar de recibir corticoides inhalados12. Estos casos son los que algunos autores describen como pacientes bien controlados. Aunque el concepto de control en la EPOC fue propuesto hace pocos años13, parece identificar bien aquellos pacientes que tienen un bajo impacto de la enfermedad mantenido en el tiempo con el tratamiento. Por tanto, sería posible replantear el concepto de alto y bajo riesgo, más como un buen o mal control que puede modificarse con el tiempo, que como una clasificación de pacientes con vista a la elección del tratamiento.
Otra situación detectada en el presente trabajo es la identificación de pacientes que no cumplen ninguno de los criterios de los fenotipos propuestos por GesEPOC 2017. Aunque en nuestra cohorte la mayoría de los pacientes tenían un fenotipo adscrito, un porcentaje sin fenotipos del 9,2% de pacientes de la cohorte general y el 16,6% de los pacientes de alto riesgo sin fenotipo no es una cifra menor. Estos casos eran pacientes agudizadores que no cumplían criterios de bronquitis crónica, enfisema o ACO. El estudio COPD History Assessment in Spain (CHAIN) identifica un 2,3% de pacientes en esta circunstancia14, lo que sugiere que existe un margen de mejora para identificar estos fenotipos. Aunque la bronquitis crónica se asocia a agudizaciones frecuentes15, no todos los pacientes agudizadores tienen tos y expectoración crónicas. Es posible que empleando otros criterios de enfisema más adecuados se redujera el número de pacientes sin fenotipo, pero aún seguirían existiendo pacientes que se agudizan sin bronquitis crónica ni enfisema como indica GesEPOC 2017.
Un hallazgo para la discusión es la coincidencia en un solo paciente de más de un fenotipo. Aunque la mayoría tenían adscritos sólo un fenotipo, en torno al 20% cumplían los criterios de más de uno y, anecdóticamente, un paciente cumplía criterios de los tres fenotipos (excluyendo el no agudizador). De manera interesante, GesEPOC 2017 reconoce que puede haber casos de difícil clasificación, que compartan características propias de más de un fenotipo. En estos casos, GesEPOC 2017 recomienda prestar atención al problema más importante para el paciente1. Este dato resulta revelador, puesto que en una clínica habitual genera dudas, ya que dependiendo de la percepción clínica del médico encargado puede optar por asignar uno u otro fenotipo a su juicio, con las consecuencias directas para la elección del tratamiento. La asociación del ACO con el no agudizador en el bajo riesgo ya se ha comentado y probablemente tenga más relación con un buen control de la enfermedad que con un fenotipo clínico. Sin embargo, la relación entre ACO y agudizador con bronquitis crónica es interesante. Es sabido que los pacientes con asma también pueden experimentar criterios clínicos de bronquitis crónica16 y ser agudizadores si no tienen un tratamiento óptimo, por lo que no debe resultar raro encontrar esta asociación. Es conocido que los pacientes agudizadores frecuentes con bronquitis crónica, son diferentes en su impacto clínico a los pacientes con ACO17, pero el impacto clínico de la coexistencia de ambos fenotipos no se ha explorado. La relación entre asma y enfisema está escasamente estudiada, pero ha sido descrita y constituye un reto de investigación actual18. Finalmente, la identificación de pacientes que tienen criterios clínicos de bronquitis crónica y datos de enfisema es también frecuente. Es conocido que los fenotipos clásicos de bronquitis crónica y enfisema19 representan los dos extremos del espectro de presentación de la EPOC, mientras que la realidad clínica nos muestra que la mayoría de los pacientes tienen un componente de afectación parenquimatosa y otro de afectación de la vía aérea en diverso grado20, por lo que es esperable que algunos pacientes presenten ambos criterios fenotípicos.
En conclusión, los fenotipos clínicos han supuesto un avance hacia la implementación de una medicina más personalizada, más enfocada a las necesidades de los pacientes y más intuitiva para el clínico. Sin embargo, nuestros datos ponen de manifiesto algunas de las debilidades de estos fenotipos. Consecuentemente, aun siendo los fenotipos clínicos un buen punto de partida, probablemente haya llegado el momento de dar un nuevo paso con una concepción distinta de la enfermedad y que consiga mantener el espíritu de medicina centrada en el paciente de manera que sea intuitiva para el clínico y aplicable en el día a día con los recursos y el tiempo disponible. Recientemente, se ha propuesto el abordaje de la enfermedad basado en rasgos tratables21, y comienzan a dibujarse alguna iniciativa que recoge la mayoría de estos rasgos en una sola propuesta22. No sabemos si el futuro irá por mejorar los fenotipos clínicos, cambiar hacia una estrategia basada en rasgos tratables u otra iniciativa distinta, pero seguro que estará lleno de retos que los próximos proyectos podrán ir despejando en el camino hacia la medicina personalizada en la EPOC.
FinanciaciónEl proyecto TRACE (clinicaltrials.gov NCT03485690) ha sido financiado con una beca no condicionada de Laboratorios Gebro Phama (Barcelona, España).
Conflicto de interesesJose Luis Lopez-Campos ha recibido honorarios en los últimos tres años por impartir conferencias, asesoría científica, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, CSL Behring, Esteve, Ferrer, Gebro, GlaxoSmithKline, Grifols, Menarini, Novartis, Rovi y Teva.