La obesidad, bien conocida como factor de riesgo cardiovascular, puede asimismo comportar una importante afectación respiratoria. Las alteraciones respiratorias relacionadas con la obesidad abarcan desde la simple alteración de la función ventilatoria, sin consecuencias sobre el intercambio gaseoso, hasta la situación más grave, la insuficiencia respiratoria hipercápnica característica del síndrome de obesidad hipoventilación. Más recientemente se ha señalado la presencia de un incremento de prevalencia de asma de probable etiología multifactorial pero en el que puede desempeñar un papel importante la inflamación. La hipoventilación en el sujeto obeso es el resultado de complejas interacciones que implican a las alteraciones de la mecánica ventilatoria y a anomalías del control ventilatorio. Otras dos entidades (enfermedad pulmonar obstructiva crónica y síndrome de apnea hipopnea del sueño [SAHS]), frecuentemente presentes en los pacientes obesos, pueden potenciarla o agravarla. La prevalencia de hipoventilación en el obeso se encuentra subestimada y es frecuente que el diagnóstico sólo se establezca con motivo de una exacerbación o cuando el paciente es estudiado por sospecha de SAHS. El manejo ventilatorio de estos pacientes, mediante CPAP o ventilación no invasiva (VNI) dependerá de la situación clínica subyacente y de la presencia o no de otra comorbilidad. Tanto la VNI como la CPAP han mostrado su eficacia no sólo en el control de las alteraciones gasométricas, sino también en la mejora de la calidad de vida y en la supervivencia de los pacientes.
Obesity, well known as a cardiovascular risk factor, can also lead to significant respiratory complications. The respiratory changes associated with obesity extend from a simple change in respiratory function, with no effect on gas exchange, to the more serious condition of hypercapnic respiratory failure, characteristic of obesity hypoventilation syndrome. More recently, it has been reported that there is an increased prevalence of asthma which is probably multifactorial in origin, but in which inflammation may play an important role. Hypoventilation in the obese subject is the result of complex interactions that involve changes in the ventilatory mechanics and anomalies in breathing control. Two other conditions (COPD and sleep apnea-hypopnea syndrome [SAHS], often present in obese patients, can trigger or aggravate it. The prevalence of hypoventilation in the obese is under-estimated and the diagnosis is usually established during an exacerbation, or when the patient is studied due to suspicion of SAHS. Ventilatory management of these patients includes either CPAP or NIV. The choice of one or another will depend on the underlying clinical condition and whether or not there is another comorbidity. Both NIV and CPAP have demonstrated their effectiveness, not only in the control of gas exchange, but also in improving the quality of life and survival of these patients.
Es nocivo para la salud ingerir más alimento que el necesario para conservar la constitución corporal normal, mientras al mismo tiempo no se realiza el ejercicio necesario para contrarrestar dichos excesos. Hipócrates 400 a de C
Aun cuando la obesidad es reconocida en nuestros días como un problema de acuciante actualidad, su arranque se remonta al origen de las especies y se encuentra en el umbral mismo de la supervivencia. En efecto, uno de los principios básicos de supervivencia esta dictado por la necesidad de alimentarse, de almacenar energía y de mantenerse lo más inactivo posible a fin de conservarla. Probablemente por ello, la historia de la lucha contra la obesidad sea la historia de un fracaso. Conocemos perfectamente sus causas y su manejo terapéutico es en teoría extremadamente sencillo: no es necesaria ninguna innovación científica ni conocimientos academicistas para su tratamiento. Pese a ello, la obesidad se encuentra en franco aumento al punto de constituir en nuestros días un creciente problema de salud pública, motivado tanto por el elevado número de sujetos que la presentan como por la comorbilidad que la acompaña. Mientras que es bien reconocido el papel de la obesidad como factor de riesgo cardiovascular, resulta mucho menor la atención que se le presta como causa de enfermedad respiratoria.
Epidemiología de la obesidadLa obesidad se clasifica en términos de severidad a partir del índice de masa corporal (IMC) medido en kg/m2, en moderada (IMC 30-35), severa (IMC 35-40) y masiva o mórbida (IMC>40kg/m2). Un IMC entre 25 y 29,9kg/m2 se considera sobrepeso. La obesidad es hoy día un problema mayor de salud pública en el mundo. Datos recientes indican que 25-30% de la población del Occidente desarrollado presenta de obesidad. En Francia, datos del estudio ObEpi demostraron un incremento de la prevalencia de obesidad en la población mayor de 15 años que pasó del 8,2% en 1997 al 14,5% en 2009. De manera proporcional, se incrementó la prevalencia de obesidad masiva, la cual pasó del 0,3% en 1997 al 1,3% en 20091,2. Datos provenientes de España, obtenidos a partir de la Encuesta Nacional de Salud y publicados recientemente, muestran un incremento similar3. La obesidad es una causa mayor de morbilidad y, por ejemplo, en el año 2000 en los Estados Unidos fue causa directa o indirectamente de aproximadamente 400.000 decesos y determinó el 7% del gasto en salud4,5.
Obesidad y enfermedad respiratoriaHace apenas un par de décadas que las complicaciones respiratorias vinculadas a la obesidad han comenzado a ocupar un espacio importante en las publicaciones médicas. Sin embargo, la literatura de ficción se anticiparía a la ciencia: ya en 1836, Charles Dickens nos presentaría en su folletín The posthumous paper of the Pickwick Club6 la que sería, sin duda, la mejor caracterización del individuo obeso con indudables problemas respiratorios: “... and on the box sat a fat and red-faced boy, in a state of somnolence... the fat boy rose, opened his eyes, swallowed a huge piece of pie he had been in the act of masticating when he fell asleep... Joe-dams the boy he's gone to sleep again” The posthumous paper of the Pickwick Club, (Charles Dickens, 1836).
Debieron pasar más de 150 años para que Bickelmann et al7 encontraran una explicación fisiopatológica al fenotipo de Joe, ese «niño obeso, rosado y roncador con la respiración entrecortada, eternamente somnoliento», al describir la presencia de apneas e hipoventilación alveolar en ese tipo de individuos. Sugirieron para ese cuadro clínico el nombre de «síndrome de Pickwick», como homenaje al gran escritor. A partir de este momento, se desarrolla el conocimiento fisiopatológico de las implicaciones respiratorias de la obesidad.
Obesidad y función pulmonarLa obesidad resulta en una disminución de la distensibilidad toraco-pulmonar, en particular de la pared torácica, como consecuencia de la restricción impuesta a la expansión de la caja torácica y del diafragma. Aunque también presente, la caída en la distensibilidad pulmonar es menos importante y reconoce un doble mecanismo: aumento del volumen sanguíneo pulmonar y colapso alveolar como consecuencia del cierre de la pequeña vía aérea, en particular en las bases pulmonares8.
Las presiones bucales máximas son en general normales, pero pueden encontrarse disminuidas en los casos de obesidad masiva. Similar es el caso de la resistencia de los músculos respiratorios, que se ve alterada solamente en caso de obesidad masiva9. Como consecuencia de este conjunto de anomalías, el trabajo ventilatorio se incrementa, de manera que en los pacientes con IMC > 40 la VO2 en reposo puede alcanzar hasta el 16% de la VO2 total, mientras que raramente excede el 3% en el sujeto no obeso10.
Las alteraciones de la mecánica ventilatoria van a verse reflejadas en el estudio de los volúmenes pulmonares:
Efectos sobre los volúmenes estáticosLa anomalía funcional más frecuente en el obeso es la disminución del volumen de reserva espiratoria (ERV) con conservación del volumen residual, hecho más marcado en decúbito dorsal y que resulta en una disminución de la capacidad residual funcional8. Se ha demostrado que esta disminución del ERV tiene una correlación exponencial con el incremento del IMC11. La capacidad pulmonar total (TLC) se encuentra en general conservada, salvo en la obesidad masiva donde pueden verse reducida hasta de un 20%. A igual IMC, esta anomalías son mas importantes en sujetos con obesidad androide o centrípeta que en aquellos con obesidad ginecoide12. Una reducción de la TLC por debajo del 80% debe hacer pensar en un trastorno respiratorio asociado. La pérdida de peso se acompaña en general de una normalización de los volúmenes y capacidades pulmonares13,14.
Efectos sobre los volúmenes movilizables y flujosMientras la capacidad vital (VC) está en general conservada, el volumen espiratorio forzado en el primer segundo (FEV1) puede encontrarse levemente reducido en los pacientes con obesidad severa, aunque en general el ratio FEV1/VC es normal en ausencia de enfermedad asociada. Sin embargo el flujo espiratorio máximo 25-75% puede encontrarse significativamente disminuido, en particular en los sujetos masculinos con obesidad severa, reflejando una obstrucción de la pequeña vía aérea en particular en las bases15.
Prueba de difusión en la obesidad:La prueba de difusión de monóxido de carbono es en general normal o muestra un ligero incremento, consecuencia del aumento del volumen sanguíneo pulmonar16.
Obesidad y comportamiento ventilatorio durante el ejercicioEn comparación con sujetos normales sin sobrepeso, los individuos obesos presentan, para un mismo nivel de ejercicio, una mayor VO2 y una mayor ventilación minuto a expensas de un aumento de la frecuencia respiratoria, en tanto que el volumen corriente disminuye («respiración rápida y superficial»)17,18. De igual manera puede constatarse una reducción del umbral anaeróbico y de la VO2 máxima17,19, que en los sujetos con obesidad masiva puede alcanzar niveles equivalentes a los de un sujeto con disfunción ventricular severa20.
Intercambio gaseoso en la obesidadLos gases en sangre arterial (GSA) se encuentran con frecuencia alterados en los obesos y dicha anormalidad es proporcional al IMC. Dos mecanismos fisiopatológicos principales pueden explicar estas anomalías del intercambio gaseoso: un desequilibrio ventilación perfusión, responsable de hipoxemia aislada y una hipoventilación alveolar, responsable del denominado «síndrome obesidad hipoventilación» (SOH).
Mecanismos implicados en la hipoxemiaLa hipoxemia aislada es la anomalía mas frecuente del intercambio gaseoso en la obesidad y puede encontrarse hasta en un 30% de los pacientes. Esta hipoxemia, generalmente leve, se presenta con frecuencia solamente en el decúbito, o es agravada por él, como consecuencia de un incremento en dicha posición, de la desigualdad ventilación-perfusión7,8. Esta anomalía reconoce un doble mecanismo a la vez capilar y alveolar: al aumento del flujo sanguíneo regional en las bases, consecuencia de la hipervolemia característica de la obesidad, que incrementa el flujo sanguíneo pulmonar y favorece el reclutamiento capilar, se le suma la existencia de áreas alveolares infraventiladas como consecuencia del colapso de la pequeña vía aérea. La hipoxemia es más frecuente y más severa en los casos de obesidad masiva (IMC>40) y parece correlacionar con la reducción del ERV21.
Mecanismos de la hipoventilación en el obeso. ¿No puede respirar o no quiere respirar?La hipoventilación alveolar está presente en aproximadamente el 10% de los sujetos obesos4. Comparado con el sujeto obeso simple, sin complicación respiratoria, el sujeto hipercápnico se caracteriza por una menor distensibilidad del sistema respiratorio total, menor ERV, y TLC, y un patrón ventilatorio anormal (aumento de la frecuencia respiratoria, disminución del volumen corriente, mientras el Ti/Ttot permanece sin cambios), menor fuerza y resistencia de los músculos respiratorios, y una respuesta ventilatoria a la hipercapnia marcadamente deprimida o al menos inapropiada8,9. Por ello, no sorprende que el trabajo ventilatorio y el costo energético de la ventilación estén incrementados en estos pacientes, lo que puede conducir a una mayor predisposición a la fatiga de los músculos respiratorios10.
La hipoventilación del obeso es multifactorial e incluye una diversidad de mecanismos frecuentemente intrincados22–24 (tabla 1). Sin embargo, no se conoce el mecanismo exacto y permanece sin aclarar por qué algunos obesos hipoventilan, mientras la gran mayoría no lo hacen. Se han barajado dos hipótesis fundamentales. La primera, «hipótesis de la sobrecarga mecánica», postula que la hipoventilación es secundaria a la limitación mecánica producto de la disminución de la distensibilidad toraco-pulmonar10. Esta teoría de que los obesos «no pueden respirar» presenta dos limitaciones fundamentales. En primer lugar, existe una pobre correlación entre el IMC y el grado de hipoventilación. Por otra parte, tampoco existe una correlación entre el IMC y la distensibilidad torácica.
Mecanismos fisiopatológicos potencialmente implicados en la génesis del fallo respiratorio en el obeso
| Fallo respiratorio hipoxémico |
| Incremento del gradiente PAO2/PaO2 secundario al desequilibrio V/Q (en particular en las bases pulmonares) como consecuencia de: |
| -Status hipervolémico e hiperdinámico (hiperperfusión) |
| -Cierre de la vía aérea y colapso alveolar |
| Fallo respiratorio hipercapnico |
| Control ventilatorio alterado o inapropiado |
| Disminución de la compliance tóraco-pulmonar |
| Compensación inapropiada de la carga ventilatoria |
| Incremento de la resistencia de la VAS y de la carga inspiratoria umbral |
| Respuesta disminuida a las cargas elásticas y resistivas |
| Incremento del trabajo ventilatorio y del costo en oxigeno de la respiración |
| Disminución de la fuerza y la resistencia de los músculos respiratorios |
| Desacople excito-contractil |
| Fatiga muscular respiratoria (periférica y/o “central”?) |
| Disfunción diafragmática secundaria a: |
| -Incremento de la deposición de tejido adiposo |
| -Desventaja mecánica (relación longitud-tensión inadecuada) |
| Modificación del patrón ventilatorio (respiración rápida y superficial) |
| Incremento de la resistencia del sistema respiratorio |
| Incremento de la VCO2 |
| Condiciones coexistentes |
| SAHS o síndrome de aumento de resistencia de la VAS |
| EPOC |
| Condiciones agravantes |
| Posición supina |
| Sueño REM |
La segunda teoría, «hipótesis de la hiporreactividad de los centros ventilatorios», postula la incapacidad del centro respiratorio de responder fisiológicamente a un aumento de la PaCO2. Se ha visto que, si bien estos sujetos presentan un impulso ventilatorio basal incrementado, la respuesta de la P0.1 (reflejo de la actividad del centro respiratorio) y de la ventilación ante un incremento de la PaCO2 se encuentra disminuida o resulta al menos inapropiada25,26. También se ha observado una reducida actividad del EMG diafragmático al estímulo hipercápnico27. Sin embargo, estas alteraciones no se encuentran en todos los obesos con hipoventilación, lo que sugiere la existencia de al menos dos fenotipos diferentes8,28. Se ha postulado que la alteración del control de la ventilación obedezca a mecanismos genéticos, pero esto no está claro, puesto que estudios llevados a cabo en familiares de pacientes con SOH muestran un comportamiento normal de los centros respiratorios29. Por otra parte, no se puede descartar que las alteraciones en el control de la ventilación no fueran la causa sino la consecuencia de la hipoxemia y/o de la hipercapnia crónica30, e incluso que se tratase de una respuesta adaptativa a la sobrecarga mecánica, para evitar un trabajo respiratorio excesivo21. Para estos autores, los obesos «no quieren respirar».
Comorbilidad e hipoventilaciónDos otras entidades (EPOC y apnea del sueño) frecuentemente presentes en los pacientes obesos pueden potenciar o agravar la hipoventilación alveolar. Al igual que la obesidad mórbida, la EPOC incrementa el trabajo ventilatorio, modifica la mecánica respiratoria y disminuye la eficiencia de los músculos respiratorios. En consecuencia, la coexistencia de una EPOC puede contribuir a la hipercapnia en los sujetos obesos, y en esos pacientes, por lo general, la magnitud del aumento de la PaCO2 es inversamente proporcional al grado de reducción del FEV1. En cuanto al síndrome de apnea del sueño, merece ser desarrollado aparte.
Obesidad y asmaDado que la prevalencia de asma y la de obesidad se han incrementado en los últimos años, numerosas publicaciones han examinado la posibilidad de un vínculo epidemiológico entre ambos desordenes. Estudios transversales de cohorte, realizados tanto en niños y adolescentes como en adultos, han revelado una asociación significativa entre obesidad y asma, mostrando un riesgo relativo de 1,4 a 2,2 de asma en sujetos obesos, con una marcada relación «dosis-efecto» dado que la prevalencia de asma aumenta en proporción al IMC31–34. No obstante, no puede deducirse de ellos una relación causa efecto, dado que la mayoría de dichos estudios no pudo demostrar que la obesidad precede al desarrollo de la enfermedad bronquial. Varios estudios longitudinales han confirmado estos resultados, encontrando un riesgo relativo de asma de 1,6 a 2,7 en la población de obesos32,35–38. Sendos metaanálisis publicados que analizaron ambos tipos de estudios39,40 confirmaron esta tendencia y mostraron una asociación más marcada en la mujer que en el varón. Sin embargo, dado que la mayoría de estos estudios define la presencia de asma a partir de síntomas auto referidos y no a un diagnostico definido por criterios clínico-inmuno-fisiológicos estrictos, no queda claro hoy día si la obesidad realmente implica un riesgo mayor de asma, o si simplemente produce modificaciones fisiológicas que pueden remedar sus síntomas41.
Distintos factores podrían explicar esta asociación42. Como ya hemos mencionado, la obesidad induce alteraciones en la mecánica ventilatoria, tal como la disminución de los volúmenes pulmonares y la reducción del diámetro de la pequeña vía aérea11, ambas condiciones capaces de generar un tendencia a la broncoconstricción y la hiperreactividad bronquial y, aun en ausencia de ellos, generar un incremento de la sensación de disnea. De la misma manera, otras condiciones que complican frecuentemente la obesidad, tales como el reflujo gastroesofágico y los trastornos respiratorios del sueño, representan factores de confusión. Otra de las hipótesis encuentra sus bases en el contexto inflamatorio que acompaña a la obesidad. Ha sido bien documentado que el tejido adiposo tiene funciones inmunitarias y que la obesidad se acompaña de un estado de inflamación sistémica43. El tejido adiposo en exceso produce citocinas, algunas de las cuales (TNF-α, IL 6, IL10, exotoxina) han sido implicadas en la respuesta inflamatoria en la vía aérea de los pacientes asmáticos44. Dos sustancias en particular, específicamente producidas por el tejido adiposo, parecen tener una importancia mayor. La primera, la leptina, de estructura similar a la IL-6, desempeña un papel fundamental en la inflamación en estos sujetos, regulando los niveles de otras citocinas y la proliferación y activación de linfocitos T y monocitos45. Ha sido asociada a un aumento de la inflamación bronquial en modelos animales, incrementando los niveles de otras citocinas y de inmunoglobulina E, así como la hiperreactividad bronquial a ciertos alérgenos46. La segunda, la adiponectina, parece tener efectos opuestos pero tiene la particularidad de ser la única hormona adiposa cuyos niveles se encuentran reducidos en los pacientes obesos, lo que sugiere un papel potencial en la génesis del asma en estos pacientes47.
Un tercer mecanismo potencial hace referencia a un aumento de la hiperreactividad bronquial en los sujetos obesos. Sin embargo, en este aspecto, los resultados publicados son contradictorios y la mayor parte de los estudios refutan esta hipótesis48–50.
Por último, dos hipótesis adicionales han sido evocadas para explicar esta asociación: la primera postula una potencial activación de genes comunes que codifiquen la predisposición a ambas enfermedades. A favor de esta hipótesis se han identificado regiones específicas del genoma que están relacionadas tanto con el asma como con la obesidad (p. ej., los cromosomas 5q, 6 y 12 q42). La segunda privilegia una eventual influencia hormonal, que explicaría el ya señalado incremento de esta asociación en la población femenina42.
En suma, existen datos epidemiológicos robustos que confirman la vinculación entre obesidad y asma. No obstante, esta relación parece compleja y multifactorial y el o los mecanismos exactos que la explican aún no han sido elucidados.
Apnea del sueño, obesidad e hipoventilaciónEl síndrome de apnea hipopnea obstructiva del sueño (SAHS) se caracteriza por episodios reiterados de obstrucción completa o parcial de la vía aérea superior (VAS) durante el sueño, causantes de una fragmentación del mismo y asociados a somnolencia diurna51. Se trata de una condición frecuente que afecta al 3-4% de la población adulta52 y la obesidad constituye su principal factor de riesgo. Dos tercios de los pacientes con SAHS son obesos53. Por otro lado, más de la mitad de la población de obesos mórbidos presentan SAHS54. Una explicación es que los sujetos obesos, en particular aquellos con obesidad troncular presentan un aumento en los depósitos de tejido adiposo en el paladar blando, la lengua y la pared posterior y lateral de la orofaringe. Este incremento disminuye el área faríngea, aumenta la presión extraluminal y modifica la colapsabilidad de la VAS. Además, la alteración de las características elásticas del pulmón, secundaria a la reducción del volumen pulmonar, acrecienta la tendencia al colapso55. Por último, algunas comorbilidades frecuentes en estos pacientes, como la diabetes, pueden provocar una neuropatía de los músculos dilatadores faríngeos favoreciendo la aparición de apneas55. Cerrando un círculo vicioso, hipótesis recientes sugieren también una potencial contribución del SAHS en la perpetuación de la obesidad en estos pacientes. Los mecanismos implicados podrían ser de diverso orden. En primer lugar, la somnolencia diurna puede traducirse en una disminución de la actividad diurna con la consiguiente disminución del consumo metabólico. En este sentido, Basta et al56 demostraron recientemente que existe una correlación estrecha entre el índice de apnea hipopnea (IAH) y el grado de actividad diurna. También se ha demostrado una alteración del metabolismo glucídico e incluso, que la reducción del sueño delta por un lado, y los episodios repetidos de activación simpática consecuencia de las apneas por otro, puede producir un estado de insulinorresistencia, y que ese mecanismo explicaría la mayor propensión a la diabetes de estos sujetos57,58. Cabe pensar que la corrección de las apneas durante el sueño tenga algún efecto benéfico sobre la reducción del peso en estos pacientes, pero esto no se ha demostrado53.
Síndrome obesidad hipoventilación y síndrome de apnea hipopnea obstructiva del sueño: el juego de las diferenciasEl SOH es comúnmente definido como la combinación de obesidad (IMC>30kg/m2) e hipercapnia diurna (PaCO2>45mmHg)30. Se postula que el SOH no representa sino un estadio evolutivo avanzado del SAHS. Sin embargo, la relación exacta entre estas dos condiciones, y en particular la contribución del SAHS a la aparición de hipercapnia, no está clara. Incluso existe controversia en la definición de SOH, de manera que algunos autores sugieren que el SAHS debería formar parte de la definición del SOH, mientras que otros las consideran entidades aparte59,60.
Los primeros basan su razonamiento en las similitudes entre ambas condiciones. En primer lugar, el 90% de los obesos hipercápnicos presentan un SAHS23,24, mientras que del 11 al 15% de los pacientes obesos con SAHS presentan hipercapnia, cifra que se eleva a 23-27% cuando el IMC es > 4023. Tanto el SAHS como la obesidad son considerados estados inflamatorios crónicos asociados a un riesgo cardiovascular incrementado55. Por otro lado, a igual IMC, el SAHS es más frecuente en los obesos hipercápnicos que en los no hipercápnicos. Por último, la hipercapnia es más frecuente en los pacientes con SAHS que en los controles normales apareados por edad y sexo, pero también en los pacientes SAHS obesos que en los no obesos54.
La aparición de hipercapnia en el SAHS podría explicarse como consecuencia de una respuesta ventilatoria inadecuada post-apnea. Esto reflejaría la incapacidad de los músculos respiratorios de hacer frente al incremento de la carga que supone el aumento de resistencia de las VAS61,62. Se ha demostrado un incremento significativo de la resistencia de la VAS y del trabajo ventilatorio en la posición decúbito en los pacientes SAHS hipercápnicos comparado a los no hipercápnicos, incremento más marcado aun en presencia de obesidad63,64. De hecho, se ha observado que el valor de PaCO2 en sujetos con SAHS hipercápnicos es directamente proporcional al cociente entre la duración de la apnea y el periodo interapnea («apnea/interapnea ratio») e inversamente proporcional a la magnitud de la respuesta ventilatoria post-apnea61,62. La hipercapnia sería consecuencia de un desequilibrio entre la hipoventilación generada por la apnea y la hiperventilación compensatoria. Por otra parte, esta disminución de la respuesta ventilatoria post-apnea podría no ser la consecuencia de una disfunción de los músculos respiratorios, sino representar una adaptación encaminada a preservar la calidad de sueño evitando los «microdespertares» motivados por el sobreesfuerzo inspiratorio, de manera que el SOH correspondería a un «grado avanzado» de SAHS. En consonancia con esta hipótesis, un estudio publicado recientemente demostró, en un grupo de pacientes con diagnóstico de SOH «puro» (en los cuales la polisomnografía (PSG) había eliminado inicialmente el diagnóstico de SAHS), la aparición de apneas obstructivas tras la corrección de la hipoventilación alveolar65. La hipótesis de los autores es que la ventilación no invasiva (VNI), al restituir la sensibilidad del centro respiratorio a la CO2, podría desenmascarar el mecanismo primitivo de la hipoventilación, esto es el SAHS.
Otros autores rechazan esta identidad entre SAHS y SOH. Su argumento es que el SOH se define por la presencia de hipercapnia en un sujeto obeso tras exclusión de otras causas de insuficiencia respiratoria, incluidas entre ellas el SAHS, puesto que esta condición puede per se determinar hipercapnia60. Esto los conduce a postular la hipótesis de dos mecanismos independientes (pero a su vez interdependientes) de producción de hipercapnia en estos sujetos: uno dependiente de la obesidad y otro de las apneas.
En resumen, en los sujetos obesos, el desarrollo de hipercapnia depende del balance relativo entre la severidad de los eventos obstructivos de la VAS y la importancia de la hipoventilación no apneica. De dicha manera, estos pacientes podrían dividirse en dos subgrupos: aquellos con coexistencia de SAHS y aquellos sin SAHS. Por ello, parece mas lógico no incluir al SAHS dentro de la entidad SOH y restringir esta apelación a sujetos en los cuales el único mecanismo responsable de la hipoventilación es la obesidad misma y a aquellos en los que la hipercapnia persiste después de corregir la apneas durante el sueño mediante un tratamiento regular por CPAP60. En esta dirección, se ha propuesto modificar la denominación del SOH acuñándose los siguientes términos: hipoventilación vinculada a la obesidad (HVO)60, síndrome de hipoventilación del sueño (SHS)30 o SOH sin SAHS66. Esta entidad quedaría definida en dos situaciones: a) presencia de hipercapnia en un sujeto obeso sin SAHS ni EPOC (HVO «puro», SHS «puro» o SOH sin SAHS) y b) persistencia de hipercapnia en pacientes obesos con SAHS a pesar de un tratamiento con CPAP, (HVO combinado con SAHS, SHS combinado con SAHS o SOH con SAHS).
El papel de la leptina: ¿una explicación hormonal para la hipoventilación?Como ya se ha mencionado, continúa sin esclarecer la causa última por la que algunos individuos obesos desarrollan hipoventilación y otros no, habiéndose implicado, en los últimos años, el posible papel de la leptina, una hormona producida principalmente por el tejido adiposo. La leptina, cuyos receptores se encuentran principalmente en el hipotálamo, está implicada en numerosas acciones fisiológicas67,68. Sin embargo, su acción principal parece encontrarse en la regulación del peso corporal. Se ha visto que sus niveles plasmáticos se correlacionan con la masa adiposa69 y funcionaría como un sistema de contrarregulación negativa, activando receptores específicos que disminuyen el apetito e incrementan el gasto energético67. Investigaciones recientes sugieren también un papel de la leptina en el control ventilatorio. Experiencias llevadas a cabo en ratones con déficit genético de leptina mostraron una alteración marcada del control ventilatorio con desarrollo de insuficiencia respiratoria70. Esta disfunción del control ventilatorio se agrava durante el sueño y en particular durante el periodo REM. Además, estos animales presentan una modificación en las características de la miosina, que hace al diafragma menos resistente a la fatiga71. Estas modificaciones no aparecen en los animales sin déficit congénito de leptina y a los que se les induce una obesidad artificialmente. Por otra parte, revierten tras la administración de leptina.
Se ha postulado que la leptina desempeñaría un papel similar en la génesis del SOH en el varón, de manera que si, fisiológicamente, niveles elevados de esta hormona en el sujeto obeso tendrían como objetivo estimular los centros respiratorios como respuesta al incremento de la carga ventilatoria, un déficit de leptina podría ser la clave para el desarrollo de SOH. Sin embargo, el déficit de leptina en el humano obeso es extremadamente raro, constatándose, por el contrario, altos niveles circulantes de dicha hormona. De dicha manera, podría postularse que la hipoventilación resultaría en dichos sujetos de un estado de resistencia a la leptina72. Dado que la leptina ejerce su acción ventilatoria a través de receptores hipotalámicos, se ha especulado que dicha «leptino-resistencia» podría deberse a una anomalía del transporte de leptina al SNC o a una alteración a nivel del receptor central73. En favor de la primera hipótesis, ha sido demostrado que la relación leptina LCR/plasma disminuye a medida que el IMC aumenta74, lo que abogaría en favor de una saturación del sistema de transporte a altos niveles de leptina circulante.
Algunos datos de la literatura sustentan el papel de la leptina en el control de la ventilación del paciente obeso. Se ha constatado que el nivel de leptina predice mejor la presencia de SOH que el IMC75, independientemente de la existencia o no de apneas durante el sueño. Por otra parte, en estos pacientes, el tratamiento con VNI corrige los niveles elevados de leptina postulándose que, al corregirse la hipoventilación, se reduciría la «necesidad» de altos niveles de leptina para luchar contra la mayor carga ventilatoria76.
Mucho mayor es la evidencia que relaciona la leptina con el SAHS. Así, se ha demostrado que la hipoxemia intermitente es un potente estimulante de la liberación de leptina, independientemente del nivel de obesidad77. Esto puede explicar por qué a igual peso corporal los pacientes con SAHS tienen mayores niveles de leptina que los individuos sin SAHS78, como asimismo la correlación encontrada entre los niveles de leptina y la severidad del SAHS medido en términos del índice de apnea-hipopnea79.
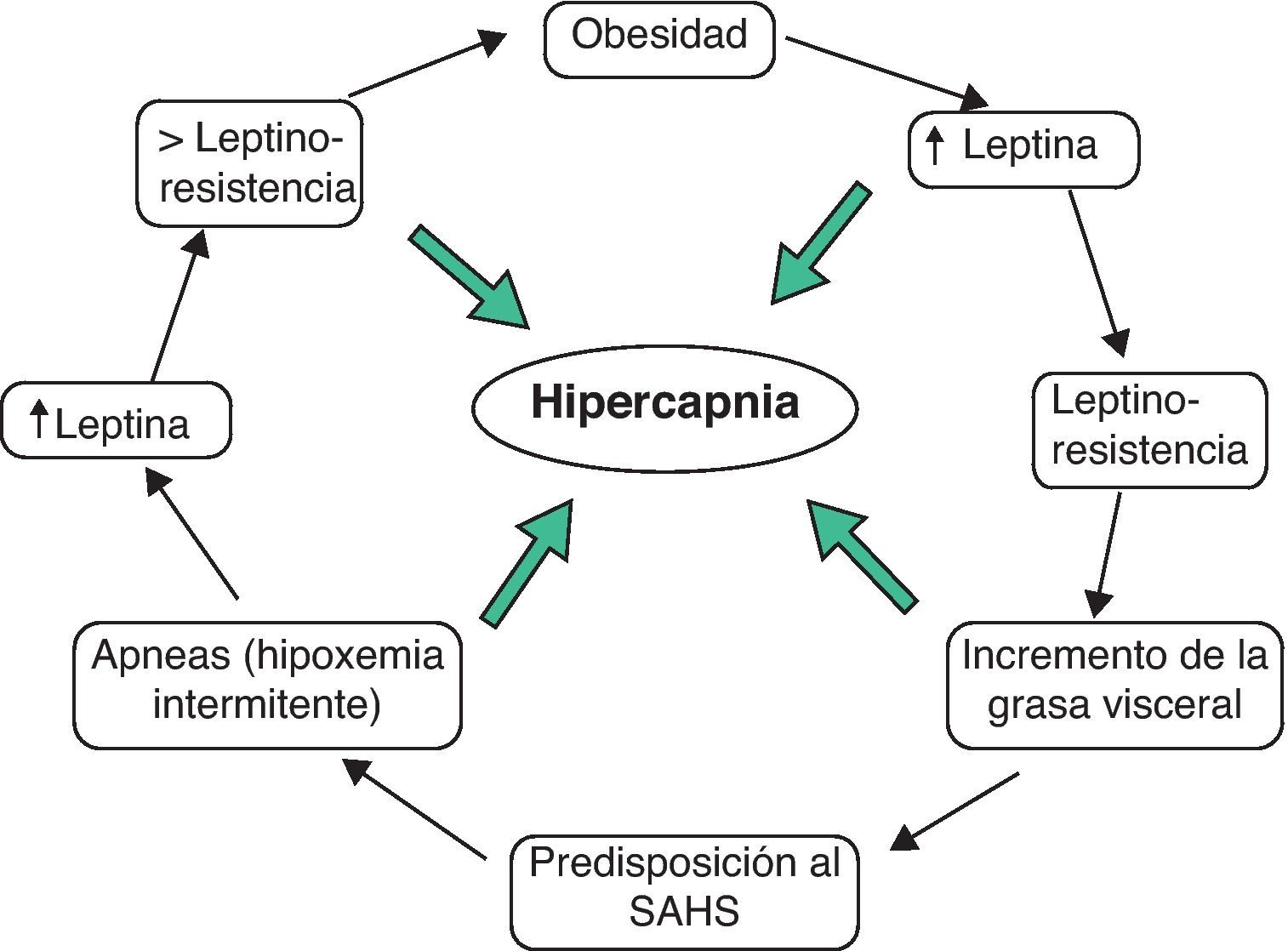
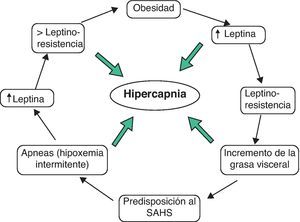
Cerrando un círculo, los niveles altos de leptina van a favorecer la distribución centrípeta de la grasa corporal, una de cuyas características es el incremento del depósito graso en el cuello y en la región de la vía aérea. Esto favorecería la aparición de obstrucción de la VAS durante el sueño79. De hecho, el tratamiento con CPAP, además de reducir los niveles de leptina en los pacientes con SAHS80, también disminuye el nivel de grasa visceral en dichos pacientes81. Por último, en pacientes con SAHS se han observado niveles de leptina significativamente más elevados en los pacientes hipercápnicos que en los no hipercápnicos, y esto independientemente del IMC82. Estos hallazgos podrían sugerir que las anomalías en el metabolismo de la leptina constituirían el nexo de unión entre las dos complicaciones respiratorias más relevantes de la obesidad: el SAHS y el SOH, pudiendo tratarse en ambos casos de condiciones asociadas a resistencia a la leptina (fig. 1).
En resumen, se puede postular la hipótesis de dos tipos de obesos con riesgo de desarrollar anomalías respiratorias: los raros casos de pacientes con déficit «verdadero» de leptina (con niveles bajos en plasma y SNC) y aquellos, muchos mas frecuentes, con niveles altos de leptina en plasma pero proporcionalmente bajos en LCR. Esta hipótesis vuelve a establecer un importante nexo entre SAHS y SOH pero, a la vez, abren una fascinante vía: la del posible rol de potenciales análogos de la leptina capaces de atravesar la barrera hematoencefálica en el manejo de las consecuencias respiratorias de la obesidad.
Sueño y respiración en el sujeto obesoEl sueño constituye el período de fragilidad por excelencia del sistema respiratorio y agrava los dos mecanismos responsables de insuficiencia respiratoria en el sujeto obeso. El decúbito supino incrementa la alteración V/Q, agravando la hipoxemia. En cuanto a la hipoventilación, todos los mecanismos potencialmente causantes de ésta alcanzan su máxima expresión durante la noche. El control ventilatorio depende de tres mecanismos: el primero, de localización bulbar y naturaleza automático, es causante de mantener la continuidad de la ventilación y asegurar las adaptaciones homeostáticas. El segundo, de localización suprapontina corresponde al control consciente, voluntario. A este último se suma el estímulo ventilatorio propio de la vigilia, dependiente de la activación del sistema activador reticular ascendente. Estos dos últimos mecanismos se encuentran abolidos durante el sueño. Por consiguiente, el control ventilatorio en este periodo obedece exclusivamente a los mecanismos de control automático dependientes de las aferencias metabólicas (en particular la pCO2) y de los receptores de estiramiento y, tal como se ha dicho anteriormente, el centro respiratorio presenta una respuesta inapropiada a la CO2 en un porcentaje importante de estos pacientes25,26. A esto hay que añadir la potencial aparición durante el sueño de episodios de apnea e hipopnea, y el incremento de la carga ventilatoria consecuencia del decúbito, ambas situaciones capaces de favorecer el desarrollo de hipercapnia.
Cuando se practica una PSG en un sujeto obeso, pueden identificarse 5 tipos diferentes de desórdenes ventilatorios pueden identificarse28,83 (tabla 2): episodios obstructivos de la VAS, apneas e hipopneas centrales, una hipoventilación central (también llamada «hipoventilación del sueño»), una hipoventilación «obstructiva» y, por último, episodios de hipoxemia, secundarios a desigualdad V/Q. Estas anomalías pueden ser ya reveladas por una oximetría nocturna, manifestándose como picos de desaturación en los dos primeros casos, y como una desaturación continua en los restantes. Ante una desaturación continua, el desarrollo paralelo de hipercapnia permite diferenciar ambos tipos de hipoventilación de una agravación de la hipoxemia debida a alteración V/Q. Los episodios de hipoventilación central son la consecuencia de una disminución del impulso ventilatorio inducido por el sueño, sobre todo en fase REM28. Este estadio se caracteriza por una hipotonía muscular generalizada, pero con preservación de la actividad diafragmática. Como se ha dicho antes, existen evidencias que la fuerza muscular y la resistencia del diafragma se encuentran disminuidas en los sujetos obesos lo que favorece la aparición de hipercapnia. En cuanto a la hipoventilación obstructiva, corresponde a periodos sostenidos de disminución de la ventilación debidos a una obstrucción parcial de la VAS83. Ambos tipos de hipoventilación pueden diferenciarse en la poligrafía ventilatoria por el análisis de la curva de flujo: mientras la hipoventilación central se caracteriza por una disminución de la amplitud del flujo conservando un aspecto redondeado (flujo «no limitado») y acompañado de una disminución proporcional, en fase, de la amplitud de las bandas toraco-abdominales, la hipoventilación obstructiva se caracteriza por un aspecto de limitación de flujo inspiratorio (aspecto «en Plateau») acompañado, en general, de un contraste de fase en las bandas toraco-abdominales. La identificación de los dos patrones comporta valor terapéutico puesto que, mientras que la hipoventilación central requerirá soporte ventilatorio, en el caso de la obstructiva puede ser suficiente incrementar los niveles de presión positiva continua (CPAP) (o de la presión espiratoria positiva (PEP) en el caso que el paciente se encuentre bajo ventilación a doble nivel de presión)83.
Clasificación de los desórdenes ventilatorios durante el sueño en el sujeto obeso
| Apneas y/o hipopneas obstructivas |
| Apneas centrales |
| Desaturación continua en oxígeno |
| Con hipercapnia nocturna |
| Hipoventilación central («hipoventilación del sueño») |
| Hipoventilación «obstructiva» |
| Sin hipercapnia nocturna |
| Agravación de la desigualdad V/Q |
Para detalles véase el texto.
Se debe tener en cuenta que la somnolencia puede estar presente en ausencia de trastornos respiratorios del sueño hasta en un 35% de los sujetos obesos, lo que pone en relieve el probable rol de la obesidad per se en la génesis de los trastornos de vigilancia diurna presentes en esta población28,54.
Diagnóstico de insuficiencia respiratoria en el sujeto obesoLas manifestaciones clínicas de la hipoventilación van a depender de numerosos factores: el grado de obesidad, la presencia de comorbilidad como EPOC y SAHS y, por supuesto, del grado de hipoventilación.
Pese a lo característico que resulta un gran obeso con hipoventilación, es frecuente el diagnóstico inadecuado. En un estudio de cohorte realizado en un hospital general, 31% de pacientes con un IMC>35 internados por causas diversas, presentaron una hipoventilación que pasó inadvertida y casi la mitad de los pacientes con un IMC>50 presentaron hipercapnia diurna84.
En general, el diagnóstico de hipoventilación en un sujeto obeso frecuentemente se sospecha en dos situaciones: en curso de una exacerbación o durante el estudio de un posible SAHS. En cuanto a la exacerbación, se considera la existencia de un SOH ante un paciente obeso que, en presencia de una infección respiratoria banal, desarrolla una situación desproporcionada de insuficiencia respiratoria. La confirmación diagnóstica exige la realización de una gasometría, una exploración funcional completa y una PSG. Con respecto a la segunda situación, el SOH puede pasarse por alto si no se realizan GSA, aunque puede sospecharse ante la aparición de una saturación de O2 reducida, mismo si una SaO2 «normal» no elimina la posibilidad de una hipoventilación nocturna, en particular en pacientes sin patología broncopulmonar subyacente85.
De cara a la detección precoz, en ausencia de hipercapnia diurna, un exceso de base elevado puede ser el testimonio de una hipoventilación nocturna, sobre todo si además existe un SAHS24.
Tratamiento de las complicaciones respiratorias del sujeto obesoLa pérdida de peso es la primera medida terapéutica en el manejo del paciente obeso. Una pérdida de 5 a 10% del peso corporal puede mejorar las pruebas de función respiratoria la mecánica ventilatoria, la PaO2 y la PaCO2 y, en presencia de SAHS, reducir dramáticamente el IAH13,55. En el caso concreto del asma, una reducción de peso tiene un efecto relevante en la reducción de la disnea, el número de ataques de asma y la mejoría de la calidad de vida en estos pacientes y mejora la obstrucción de la pequeña vía aérea86. Ha sido estimado que entre un 15 y un 38% de los casos de asma en el adulto podrían prevenirse con medidas de control de la obesidad87. Sin embargo, la pérdida de peso alcanzada mediante medidas dietéticas suele ser difícil de obtener. La cirugía bariátrica puede cambiar el pronóstico respiratorio en estos pacientes. Datos recientes indican que se asocia a una mejoría significativa a largo plazo de los volúmenes pulmonares, de los gases arteriales, de la policitemia, de la hipertensión pulmonar88 y del control del asma89. También contribuye a una mejoría parcial o total del SAHS90.
La cirugía bariátrica conlleva un riesgo no desdeñable de morbimortalidad perioperatoria en los pacientes portadores de SOH91, siendo recomendable iniciar asistencia ventilatoria no invasiva antes de la cirugía, la cual debe mantenerse tras la extubación a fin de reducir al mínimo las complicaciones peri operatorias. También hay que señalar la recurrencia de la obesidad entre 3 y 7 años tras la cirugía92.
Tratamiento de la insuficiencia respiratoriaIndependientemente de las medidas encaminadas al control del peso, el manejo terapéutico de estos pacientes hace necesario el uso de técnicas de soporte ventilatorio. Este tendrá como objetivo corregir a la vez los trastornos respiratorios durante del sueño, la hipercapnia diurna pero también la hipoxemia residual que suele persistir tras la corrección de la hipoventilación alveolar. El manejo terapéutico inicial de estos pacientes dependerá de la situación clínica en que se encuentra el paciente y de los resultados de la PSG.
En el caso de insuficiencia respiratoria aguda y fuera de las situaciones de riesgo vital inmediato (shock, encefalopatía severa, fallo multiorgánico), la VNI debe considerarse como tratamiento de primera línea en el manejo del fallo ventilatorio en estos pacientes63.
Hoy en día, los respiradores mas utilizados para el manejo ventilatorio de estos pacientes son los barométricos y el modo presión soporte + PEP, o ventilación con presión positiva «binivel» es el modo más utilizado. Es frecuente que se requiera inicialmente la adición de oxígeno suplementario a fin de mantener una SaO2 adecuada. El manejo de estos pacientes puede llevarse a cabo en una unidad de cuidados críticos respiratorios, en una unidad de cuidados intermedios o en planta de hospitalización, dependiendo de la severidad del cuadro clínico, de las posibilidades del centro asistencial y de la experiencia y la competencia del equipo medico en el manejo de la VNI93,94. Una vez estabilizada la condición clínica, estos pacientes serán externados bajo el modo ventilatorio más adecuado sobre la base de los resultados de la EFR y la PSG95.
En el caso del paciente hipercápnico diagnosticado en situación estable (ausencia de acidosis), la elección del modo ventilatorio inicial dependerá de dos factores: de la coexistencia o no de SAHS y de la severidad de la hipercapnia. Si la PaCO2 es < 50mmHg, y la PSG confirma el diagnóstico de SAHS, la mayoría de los autores acuerdan en comenzar por un tratamiento por CPAP. Además de corregir las apneas, esta terapéutica puede restaurar la normocapnia diurna. Sin embargo, en un número significativo de pacientes, la hipercapnia persiste pese a un tratamiento adecuado con CPAP. En dicho caso, debe asumirse que la hipercapnia responde a un mecanismo diferente del SAHS, esto es la obesidad per se, que perpetúa la hipoventilación. Dichos pacientes requieren un soporte capaz de incrementar la ventilación más que una simple estabilización de la VAS, y en dicho caso es lógico proponer la adición de una asistencia inspiratoria, esto es el cambio a una VNI96.
En pacientes con una PaCO2>50mmHg, la terapéutica inicial debe orientarse hacia la VNI, aunque una vez alcanzada la eucapnia es recomendable realizar una PSG diagnóstica y de existir un SAHS pasible de tratamiento pasar a una CPAP, puesto que se ha demostrado que más de un tercio de los pacientes tratados inicialmente por VNI pueden ser transferidos a CPAP con un buen control en el largo plazo97,98.
Pese al esquema terapéutico propuesto, predecir qué paciente responderá a una CPAP y cuál necesitará una asistencia ventilatoria es, con frecuencia, difícil. En algunas series se han identificado como factores predictores de respuesta insuficiente a la CPAP la presencia de un IMC elevado, un síndrome restrictivo más severo, un mayor grado de hipoxemia nocturna y cifras más elevadas de PaCO298–100. Esto pone en evidencia el carácter multifactorial de la hipercapnia y refleja la contribución relativa de los diferentes mecanismos fisiopatológicos.
En los pacientes en los cuales la PSG no muestra un SAHS significativo, la VNI es la terapéutica de primera elección. En estos casos la hipercapnia debe considerarse como secundaria a la obesidad per se, pero causas adicionales (como la EPOC, por ejemplo) deben investigarse.
Existe un pequeño subgrupo de pacientes en los que la VNI con soporte de presión no consigue corregir la hipoventilación. Esta situación puede requerir el uso de respiradores volumétricos. Por último, en situaciones excepcionales en los que la VNI resulta ineficaz, puede requerirse la práctica de una traqueotomía.
La adhesión a la terapéutica y la elección personalizada de los parámetros del ventilador, basada en la fisiopatología particular de cada caso, condicionan el éxito de la VNI en estos pacientes.
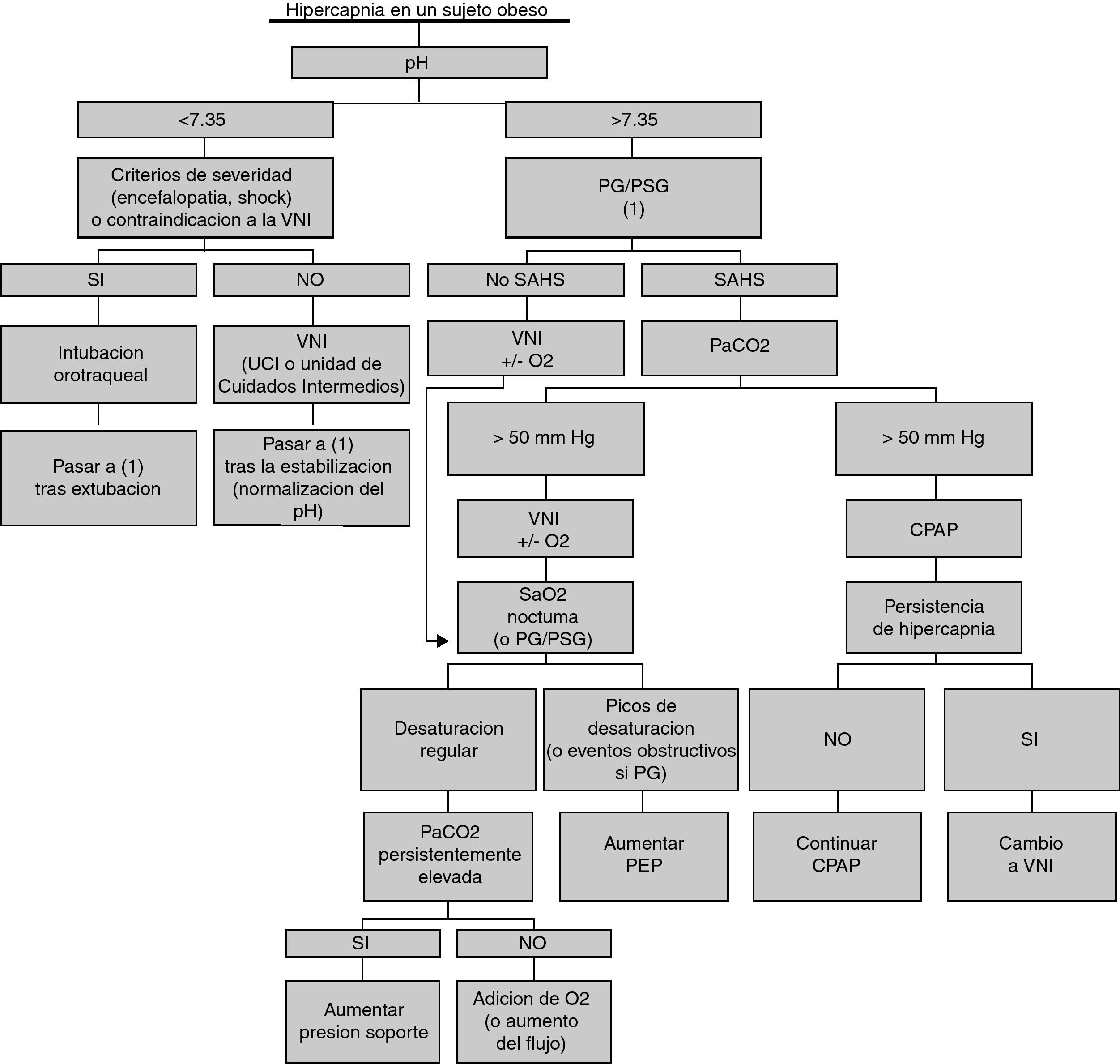
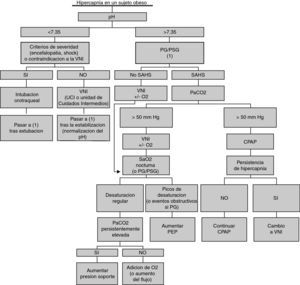
En cuanto a la optimización de la VNI, ha de basarse en el conocimiento de los mecanismos fisiopatológicos y exige una adecuada monitorización, que incluya como mínimo el registro de la SaO2 nocturna bajo ventilación acoplado al control de la PtcCO2 nocturna101 y gasometría arterial periódica. De manera ideal, debería realizarse una PG o una PSG bajo ventilación102. Esta monitorización va a permitir determinar los niveles de PEP necesarios para corregir las apneas, la presión de soporte adecuada para alcanzar la normocapnia y, de persistir una hipoxemia de mecanismo distinto de la hipoventilación, la necesidad de oxigenoterapia. En la figura 2 se propone un algoritmo para el manejo ventilatorio de estos pacientes.
Algoritmo para el manejo de una hipercapnia en el paciente obeso. CPAP: presión positiva continua en la vía aérea; HVO: hipoventilación vinculada a la obesidad; PSG: polisomnografía; SAHS: síndrome de apnea obstructiva del sueño; TRVS: trastornos respiratorios vinculados al sueño; VNI: ventilación no invasiva.
Modificado de Rabec et al114, con autorización.
Un aspecto fundamental que se debe considerar es el que hace referencia a los mecanismos por los que tanto la VNI como en numerosas ocasiones la CPAP, aplicadas durante la noche consiguen corregir la hipoventilación diurna del paciente obeso. Algunos autores, aunque no todos, señalan que la corrección de las anomalías ventilatorias nocturnas en estos pacientes puede normalizar la sensibilidad de los quimiorreceptores a la CO228,103,104. Por otro lado, la mejoría de los volúmenes pulmonares, de la compliance toraco-pulmonar y de la eficacia de los músculos respiratorios pueden ser mecanismos adyuvantes y es sabido que tanto la CPAP como la VNI pueden reducir el trabajo inspiratorio en estos pacientes103,105.
Además de la mejoria gasométrica, resulta fundamental mejorar la calidad de sueño, ya alterada en estos pacientes. En este aspecto, los datos no son concluyentes puesto que al menos un estudio realizado por Chouri-Pontarolo et al28 puso de manifiesto que si bien la VNI disminuye el número de microdespertares relacionados con eventos respiratorios, aumentaba el número de microdespertares no respiratorios.
Tratamiento del asmaDatos publicados indican que la obesidad se asocia a formas más severas de asma y que la presencia de obesidad puede modificar la respuesta al tratamiento en los pacientes asmáticos106. Ello puede explicarse por una diferente biodisponibilidad tisular de los diferentes medicamentos en estos pacientes. Otra hipótesis es que algunas de las citocinas producidas por los adipocitos producen un estado relativo de corticorresistencia107. Los sujetos obesos requieren un tratamiento más intensivo del asma y consultan con mas frecuencia al servicio de urgencias41. Un estudio reciente mostró que un IMC>31 comparado con uno de 22-25 aumenta en un 94% el uso de broncodilatadores108.
En resumen, aunque la base del tratamiento del asma en estos pacientes no varía, su manejo resulta más difícil y puede requerir mayores dosis de antiinflamatorios para un adecuado control.
Complicaciones respiratorias de la obesidad: el gran desafíoEl diagnóstico y el tratamiento de las complicaciones respiratorias del sujeto obeso representan al día de hoy un nuevo desafío para los sistemas de salud. Una encuesta de ámbito nacional llevada a cabo en España publicada el 2000 puso de manifiesto que el 15% de los pacientes en VNI a largo plazo estaban diagnosticados de SOH109. Por otro lado, diversos estudios epidemiológicos de publicación reciente corroboran que la hipoventilación en el obeso constituye, junto con la EPOC, las dos indicaciones más frecuentes de prescripción de una VNI, tanto en situación aguda como al estado estable96,110–112.
Numerosos factores explican este comportamiento:
- –
El incremento marcado en la prevalencia de la obesidad.
- –
El mayor conocimiento de la obesidad como causante de enfermedad respiratoria.
- –
La fisiopatología de la hipercapnia vinculada a la obesidad, en la que se implican factores susceptibles de ser controlados con VNI.
- –
La eficacia de la VNI en el control de las alteraciones gasométricas del obeso.
Varios estudios han confirmado que tanto la VNI como la CPAP a largo plazo disminuyen el número de admisiones hospitalarias, mejoran los síntomas clínicos, la calidad de vida y la supervivencia en agudo y a 5 años en esta población84,96,97,112,113, de manera que el mantenimiento del soporte ventilatorio a largo plazo en estos pacientes resulta indispensable, en la mayoría de los casos, para mantener la normocapnia y la estabilidad clínica.
Puesto que el progresivo incremento de la obesidad en el mundo occidental hace que pueda considerarse como una auténtica epidemia, se hace necesario, además de continuar la investigación encaminada a esclarecer la patogenia de la insuficiencia respiratoria en el obeso y proveer los recursos sanitarios necesarios para asegurar la atención correcta a estos pacientes, incluida la VNI.