La fibrosis quística (FQ) es una enfermedad producida por un defecto de la proteína reguladora de la conductancia transmembrana CFTR. En la actualidad la morbimortalidad asociada a FQ está relacionada fundamentalmente con la afectación pulmonar consecuencia de este defecto. Con el progreso de la enfermedad se incrementa el aislamiento de bacilos gramnegativos no fermentadores como colonizadores en estos pacientes.
El género Pandoraea surge de una reclasificación de especies integradas en el «complejo Burkholderia cepacia», y comprende 9 especies sensibles solamente a tetraciclinas, imipenem y cotrimoxazol.
Describimos el primer caso clínico, en España, de colonización por Pandoraea sputorum en una paciente diagnosticada de FQ a los 11 años que, tras varias colonizaciones previas por diferentes especies de Pseudomonas, en septiembre de 2005 se aisló en esputo un bacilo gramnegativo identificado por secuenciación y espectrometría de masas (MALDITOF-MS) como P. sputorum, resultando solo sensible a piperacilina-tazobactam, cotrimoxazol e imipenem. Desde 2005 a 2008 se demostró la colonización crónica por este microorganismo, asociándose a un deterioro de la función pulmonar que se recuperó tras tratamiento con piperacilina-tazobactam e imipenem. En 2010 se volvió a aislar este microorganismo y se trató con imipenem, fármaco al que la paciente respondió favorablemente.
En la actualidad se desconoce si este microorganismo es un colonizador crónico, produce una infección transitoria o constituye un problema importante en el paciente con FQ, pero dadas las características especiales de sensibilidad a antimicrobianos, la identificación correcta de este género es fundamental. La espectrometría de masas parece ser una técnica válida y más rápida que los métodos de secuenciación para la identificación de estas especies.
Cystic fibrosis (CF) is a disease produced by a defect in the transmembrane conductance regulator protein, CFTR. Currently, the morbidity and mortality associated with CF are fundamentally related with the lung affectation that is a consequence of this defect. With the progression of the disease, there is an increase in the isolation of non-fermenting gram-negative bacilli colonizing these patients.
The genus Pandoraea arises from a reclassification of species included within the “Burkholderia cepacia complex”. It is made up of 9 species susceptible only to tetracycline, imipenem and cotrimoxazole.
We report the first clinical case in Spain of colonization by Pandoraea sputorum in a patient diagnosed with CF at the age of eleven. After several previous colonizations by different Pseudomonas species in September 2005, a gram-negative bacillus was isolated in sputum, which was identified by sequencing and mass spectrometry (MALDITOF-MS) as P. sputorum, only sensitive to piperacillin-tazobactam, cotrimoxazole and imipenem. From 2005 to 2008, chronic colonization by this microorganism was associated with deterioration in lung function that was recuperated after treatment with piperacillin-tazobactam and imipenem. In 2010, this microorganism was once again isolated and treated with imipenem, to which the patient responded favorably.
Currently, it is not known whether this microorganism is a chronic colonizer, whether it produces a transitory infection or whether it constitutes an important problem in CF patients, but given its special characteristics of sensitivity to anti-microbial drugs, the correct identification of this genus is essential. Mass spectrometry seems to be a valid technique that is faster than sequencing methods for identifying these species.
La fibrosis quística (FQ) es una enfermedad autosómica recesiva producida por un defecto congénito en el brazo largo del cromosoma 7 que codifica para una proteína reguladora de la conductancia transmembrana, la CFTR, que se expresa en el aparato respiratorio, el páncreas, las vías biliares, las glándulas sudoríparas y el sistema genitourinario. Como consecuencia de esta alteración se produce una disfunción de las glándulas exocrinas, insuficiencia pancreática y obstrucciones de las vías aéreas resultantes de alteraciones en el transporte mucociliar y el aumento de la producción y viscosidad del moco. Debido a la mejoría en el manejo de las alteraciones pancreáticas, la mayor parte de la morbimortalidad asociada a FQ está relacionada con la afectación pulmonar; entre el 80-90% de los pacientes fallecen por insuficiencia respiratoria debido a infecciones de repetición y una respuesta inflamatoria exagerada1. La calidad de vida y la supervivencia de estos pacientes aumentan conforme disminuyen el número anual de exacerbaciones y la carga bacteriana en las infecciones respiratorias, lo que hace imprescindible el control de la colonización y la valoración del deterioro de la función respiratoria para el manejo del paciente con FQ2-4. Entre los microorganismos aislados como colonizadores en estos pacientes destaca Pseudomonas aeruginosa y Staphylococcus aureus, y como consecuencia del tratamiento antimicrobiano y del deterioro pulmonar se incrementa el aislamiento de bacilos gramnegativos no fermentadores, Stenotrophomonas maltophilia, Acromobacter spp. y Burkholderia cepacia. Es importante definir y conocer los patrones de sensibilidad de los microorganismos que colonizan las vías aéreas en este tipo de pacientes, en especial los aspectos clínicos relacionados con la colonización por patógenos multirresistentes y las opciones terapéuticas específicas para cada situación; es pues evidente que los estudios microbiológicos son imprescindibles para un correcto control y seguimiento del paciente con FQ3,5-7.
El género Pandoraea, compuesto por bacilos gramnegativos móviles no esporulados y no fermentadores, surge como resultado de un reestudio de las especies comprendidas en el «complejo Burkholderia cepacia», Ralstonia picketii y Ralstonia paucula8,9, y fue descrito por Coenye et al. en el año 2000. Contiene 9 especies, de las que solo 5 tienen nombre: P. apista, P. pulmonicola, P. pnomenusa, P. sputorum y P. norimbergensis. La identificación a nivel de especie de este nuevo género resulta compleja, ya que a menudo presentan patrones fenotípicos similares a otras especies bacterianas, y por ello es necesario el uso de métodos de PCR basados en el 16S rRNA6,10. La terapia antibiótica para el tratamiento de las infecciones causadas por especies del género Pandoraea es compleja debido al número limitado de antibióticos a los cuales son sensibles: tetraciclinas, imipenem y cotrimoxazol11,12.
En un intento por comprender mejor la implicación clínica de este patógeno potencial en los pacientes con FQ, describimos el caso clínico de una paciente diagnosticada de FQ con bronquiectasias con varias exacerbaciones secundarias a infección por Pandoraea sputorum y Pseudomonas aeruginosa.
Caso clínicoMujer diagnosticada de FQ a los 11 años (1992), genotipo delta F508 heterocigótica. En 1994 presenta un primer ingreso en el servicio de pediatría por exacerbación, se aísla Pseudomonas aeruginosa en esputo y se trata con ceftazidima 1g/8h más tobramicina 160mg/12h durante 20 días. Se mantiene con tobramicina inhalada hasta 2002, cuando en los controles microbiológicos se objetiva Pseudomonas putida y se instaura tratamiento con amikacina nebulizada 250mg/12h. En el año 2004, coincidiendo con el traslado de la paciente al servicio de neumología, se retira la amikacina y se pauta tobramicina nebulizada a dosis de 300mg/12h en períodos on-off de 28 días; presenta cuadros de broncoespasmo e hiperactividad demostrada por espirometría, por lo que se procede al cambio a colistemitato de sodio 2MU/12h con buena tolerancia. En marzo de 2004 se objetivó un episodio de agudización con cultivo de esputo positivo para Pseudomonas putida, añadiéndose meropenem al tratamiento habitual a dosis de 500mg/8h durante 20 días.
En septiembre de 2005 se aisló en esputo un bacilo gramnegativo no fermentador que posteriormente se identificó como Pandoraea sputorum. Los esputos se sembraron en los medios de cultivo habituales, y a las 24h crecieron colonias mucosas, oxidasa positivas, que se analizaron con el sistema automático Vitek-2 y con el API 20NE (BioMérieux, Francia), obteniéndose resultados no concluyentes por ambos métodos. La identificación definitiva se llevó a cabo mediante secuenciación del 16S del ARN ribosomal en el centro nacional de referencia ISCIII. Paralelamente en nuestro laboratorio se identificó mediante el sistema MALDITOF-MS (Shimadzu Corporation), que lo clasificó de forma correcta a nivel de especie con un porcentaje de confianza del 90%. El antibiograma se realizó por el método de E-test (AB BioMérieux, Francia), resultando solo sensible a piperacilina-tazobactam (CMI=16μg/ml), cotrimoxazol (CMI=1μg/ml) e imipenem (CMI=1,5μg/ml) y resistente a ceftazidima (CMI>256μg/ml), cefepima (CMI>16μg/ml), aztreonam (CMI>16μg/ml), meropenem (CMI>8μg/ml), tobramicina (CMI>256μg/ml), amikacina (CMI>256μg/ml) y colistina (CMI>4μg/ml). En estudios microbiológicos realizados desde septiembre del 2005 a septiembre del 2008 se demostró la colonización crónica por este microorganismo sin que se instaurase tratamiento antimicrobiano.
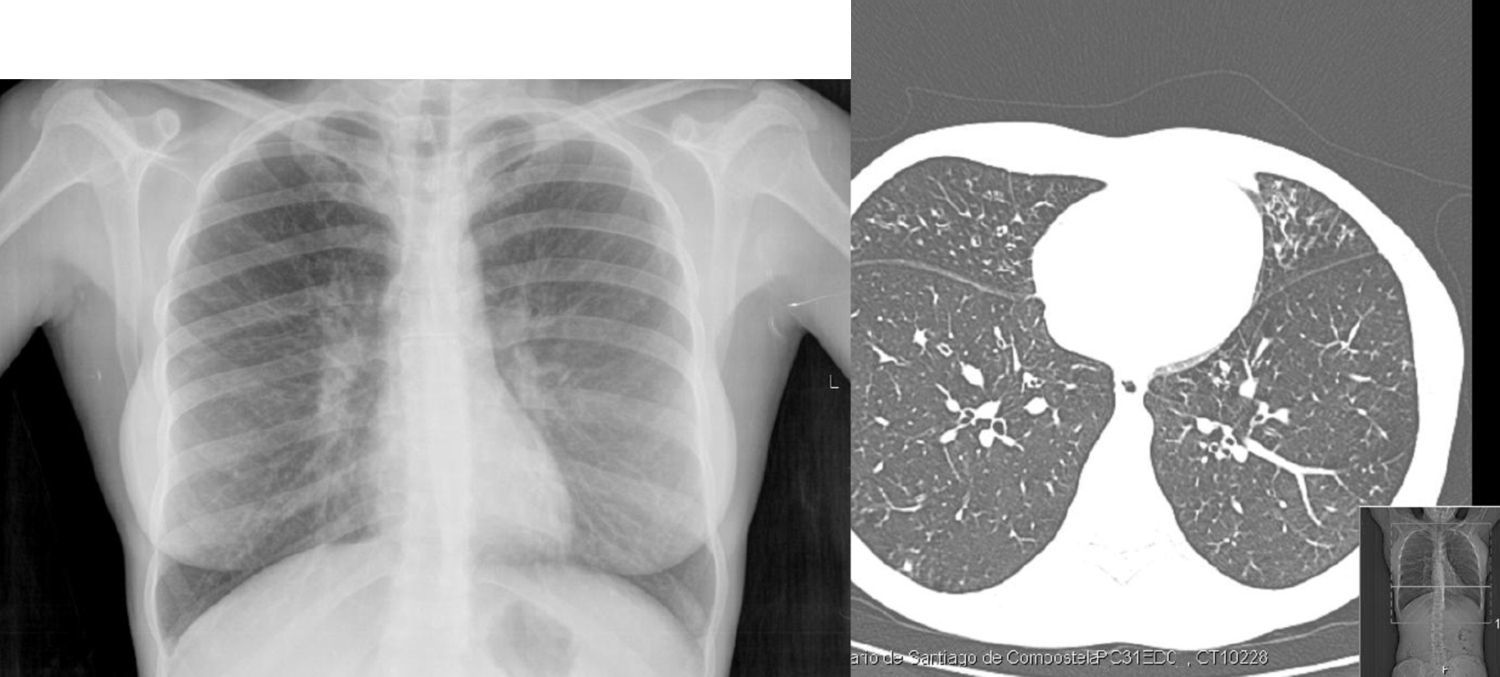
En octubre de 2008 la paciente presentó febrícula, con mayor disnea con saturación de oxígeno por pulsioximetría del 92% a aire ambiente y un deterioro significativo de la función pulmonar (FEV1: 50%). En los estudios de imagen se objetivan bronquiectasias en el lóbulo medio y la língula (fig. 1). Ante la persistencia de P. sputorum en el cultivo de esputos se pautó tratamiento con piperacilina-tazobactam 100mg/8h durante 15 días, encontrándose posteriormente asintomática durante 2 años, con un incremento de la función pulmonar hasta el 65%. En abril de 2010 la paciente presentó expectoración hemoptoica y disnea de medianos esfuerzos, y en muestras respiratorias de nuevo se aisló P. sputorum con el mismo perfil de sensibilidad a antimicrobianos. Se inició tratamiento con imipenem 500mg/8h durante 20 días, y desde el inicio la paciente evolucionó favorablemente y los cultivos microbiológicos de control fueron negativos. En un esputo posterior (mayo del 2010) se aisló Citrobacter freundii sensible a cotrimoxazol, por lo que se instauró este tratamiento a una dosis de100mg/6h, objetivándose mejoría desde el punto de vista funcional y clínico.
En las muestras respiratorias de septiembre del 2010 se aisló de nuevo P. sputorum.
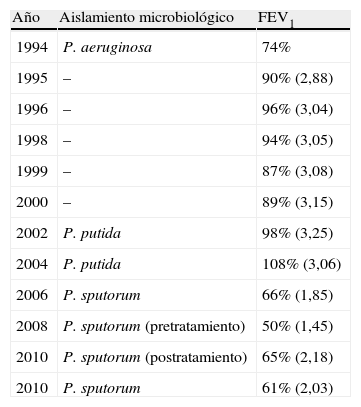
En la tabla 1 se muestra la evolución funcional de la paciente en relación con los microorganismos aislados.
Evolución funcional de la paciente. FEV1: volumen espiratorio forzado en el primer segundo
| Año | Aislamiento microbiológico | FEV1 |
| 1994 | P. aeruginosa | 74% |
| 1995 | – | 90% (2,88) |
| 1996 | – | 96% (3,04) |
| 1998 | – | 94% (3,05) |
| 1999 | – | 87% (3,08) |
| 2000 | – | 89% (3,15) |
| 2002 | P. putida | 98% (3,25) |
| 2004 | P. putida | 108% (3,06) |
| 2006 | P. sputorum | 66% (1,85) |
| 2008 | P. sputorum (pretratamiento) | 50% (1,45) |
| 2010 | P. sputorum (postratamiento) | 65% (2,18) |
| 2010 | P. sputorum | 61% (2,03) |
En la actualidad existen pocos datos sobre los resultados y el curso clínico de los pacientes colonizados por especies del género Pandoraea. Se desconoce si en los pacientes con FQ este microorganismo se comporta como un colonizador crónico como Pseudomonas aeruginosa13, produce una infección transitoria como Klebsiella spp., Enterobacter spp. y Citrobacter sp., o constituye un problema importante como el que se asocia a Burkholderia cepacia, B. anocepacea o B. multivorans14. La evidencia clínica del potencial invasivo de este género ha quedado demostrada en los casos descritos previamente de colonización por Pandoraea sp. en pacientes con FQ14-17, los de bacteriemia por este microorganismo11,18 y en otros 4 casos de pacientes sin FQ en los que el aislamiento de este microorganismo coincidió con un deterioro significativo de la función pulmonar19. No obstante, todavía se tiene muy poco conocimiento relativo a los factores de virulencia y al mecanismo de patogenicidad de este género, así como de su papel en el daño pulmonar en la FQ. Además, se han recuperado cepas de Pandoraea spp. a partir de una gran variedad de muestras clínicas: sangre, esputo, orina, muestras de las vías respiratorias superiores y tejido pulmonar12.
Estudios recientes, realizados en pacientes sin patología previa, han adjudicado una mayor virulencia a la especie P. pulmonicola frente a P. apista y P. pnomenusa, pero es necesario realizar más trabajos, con un número mayor de pacientes, e incluir patologías crónicas para poder sacar conclusiones definitivas. Del mismo modo deberían completarse los estudios con análisis de posible competencia entre especies, ya que en muchos casos se observa una co-colonización por otros patógenos12.
En nuestra paciente la colonización crónica por P. sputorum condujo a una clara disminución de la función pulmonar, probablemente por la producción de IL-6 e IL-8, según se ha demostrado en estudios previos9. Se ha observado también que en los pacientes colonizados por este microorganismo se pueden desarrollar anticuerpos anti-Pandoraea, lo que contribuiría al potencial patógeno de este microorganismo18.
En la revisión bibliográfica realizada solo hemos encontrado un caso previo de colonización por P. sputorum en un paciente trasplantado de pulmón, y el nuestro es el primer caso descrito en España en paciente con FQ. Sin embargo, en la literatura médica hay casos de pacientes con FQ y sometidos a trasplante pulmonar en los que el aislamiento de otras bacterias del género Pandoraea (P. pulmicola y P. apista) se asoció con un grave deterioro de la función pulmonar e incluso con fallo multiorgánico y muerte17,18.
Uno de los aspectos más interesantes del seguimiento microbiológico de los pacientes con fibrosis quística estriba en la demostración de clonalidad de las diferentes cepas a lo largo del tiempo, y con ello pueden evidenciarse patrones de colonización crónica o situaciones esporádicas y su relación con la clínica5. Estudios recientes sugieren, sin evidencia real, una transmisión paciente-paciente12, y en algunos centros se ha indicado el aislamiento de contacto de estos enfermos, pese a no existir consenso ni recomendaciones específicas12,14,20.
Dadas las características especiales de sensibilidad a antimicrobianos de este género, que puede englobarse dentro de los microorganismos considerados multirresistentes, y la diferencia en la evolución clínica de los pacientes con FQ, la identificación correcta de los bacilos gramnegativos no fermentadores es fundamental. En la actualidad, las especies de este nuevo género son a menudo identificadas de forma incorrecta como otras bacterias fenotípicamente similares, y en especial se confunden con especies del complejo Burkholderia cepacia. En el caso de las especies del género Pandoraea, esta identificación implicaba la necesidad de métodos de secuenciación que solo estaban al alcance de laboratorios de referencia. En la actualidad la espectrometría de masas, técnica de reciente introducción en los laboratorios de microbiología, constituye una importante aportación en la identificación de estas especies.
Por otro lado, la colonización por patógenos multirresistentes de difícil identificación por métodos convencionales pone de manifiesto lo ya discutido previamente: la microbiología de la FQ es cada vez más compleja, por lo que será necesario establecer laboratorios de referencia para minimizar, en la medida de lo posible, los errores en la identificación de estos nuevos patógenos emergentes, así como posibles nuevos fenotipos en el futuro7.