La amiloidosis sistémica es causada por el depósito extracelular de proteínas en forma de fibrillas, llamadas amiloide1. Este proceso causa daño funcional de los órganos involucrados, y si no es tratado, conduce a la muerte.
La afectación pulmonar es relativamente frecuente, pero raramente sintomática. Se puede presentar de 3 formas: nodular, traqueobronquial y alveolo septal difusa.
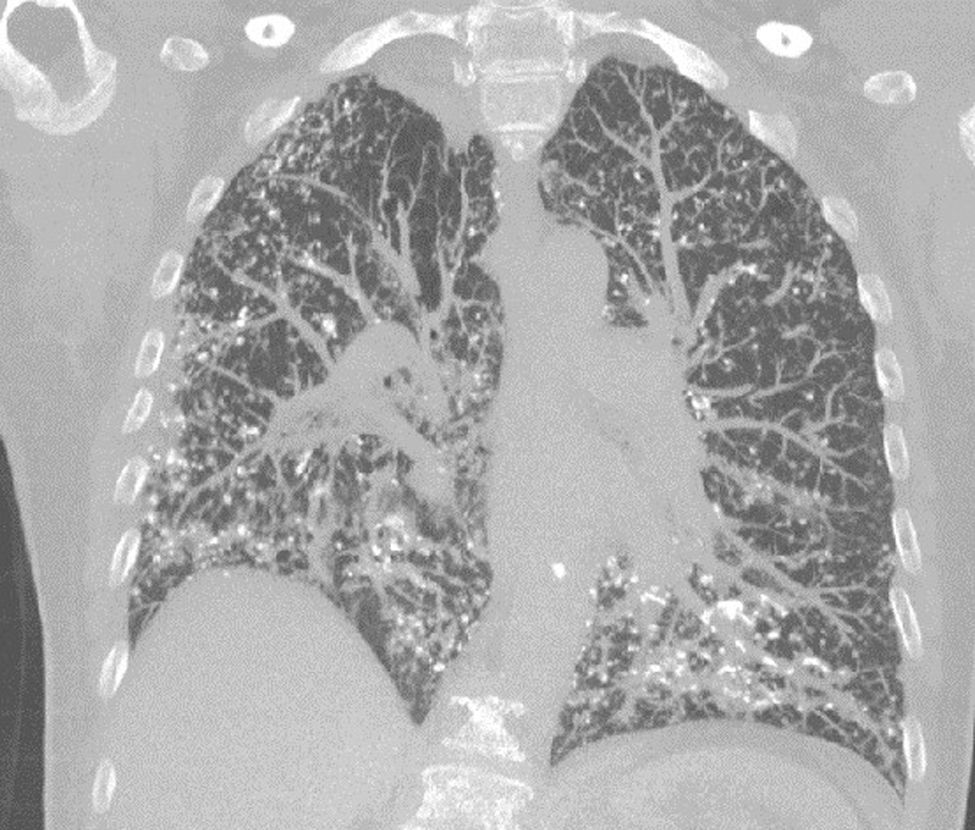
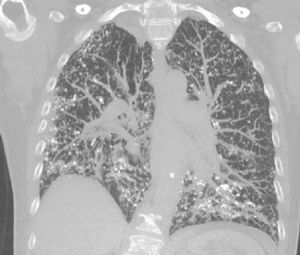
A continuación describimos el caso de una paciente de sexo femenino, de 65 años de edad, con antecedente de EPOC, exfumadora, que refiere presentar disnea progresiva de 6 meses de evolución, sin otro síntoma asociado. Al examen físico presentaba estertores crepitantes secos en ambas bases pulmonares. El hemograma y la bioquímica fueron normales. Se realizó un ecocardiograma que fue normal. La espirometría mostró un defecto obstructivo severo (VEF1 47%) con restricción moderada (CVF 61%). La capacidad de difusión para CO estaba severamente disminuida (17%). El test de la marcha de 6min evidenció una caída significativa de la saturación de oxígeno, debiendo suspenderlo por disnea importante y una saturación de O2 del 73%. Se realizó una tomografía axial computarizada (TAC) de tórax que mostró múltiples imágenes nodulillares, la mayoría densamente calcificadas, engrosamiento de septos interlobulillares de predominio periférico y en segmentos basales (fig. 1). Se realizó una biopsia de pulmón por videotoracoscopia, que informó la presencia de focos nodulares de metaplasia ósea.
Dos semanas posteriores a la biopsia, la paciente comienza con edemas de miembros inferiores, infrapatelares. Se constata en el laboratorio proteinuria de 3,6g en 24h e hipoalbuminemia de 2,8g. Con diagnóstico de síndrome nefrótico se indica realizar biopsia renal la cual es compatible con amiloidosis AL, con cadena ligera lambda como precursora de amiloide. En sangre se constatan cadenas lambda de 723mg/l (5,7-26). Se realiza biopsia de médula ósea que muestra el 40% de células plasmáticas, confirmando el diagnóstico de mieloma múltiple.
Frente a estos hallazgos se revisó nuevamente la biopsia de pulmón, la cual demostró ser positiva para rojo Congo y birrefringencia tanto en las paredes de vasos sanguíneos como en los septos alveolares, confirmando el compromiso pulmonar en forma de amiloidosis pulmonar alveolo septal.
Se inició tratamiento con bortezomib y glucocorticoides. Se repitió un ecocardiograma a los 2 meses del diagnóstico, que mostró un aumento de refringencia a nivel de miocardio y endocardio de ambos ventrículos, compatible con miocardiopatía infiltrativa. Un mes más tarde, la paciente fallece por descompensación cardiaca.
La amiloidosis pulmonar alveolo septal se caracteriza por el depósito de amiloide en septos alveolares y vasos sanguíneos. En general, forma parte del compromiso de la amiloidosis sistémica AL, y con mayor frecuencia se debe al depósito de cadenas ligeras lambda. Distintas series de casos informan que el compromiso pulmonar alveolo septal está presente entre el 78 y el 90% de amiloidosis AL2,3.
La amiloidosis pulmonar alveolo septal tiene una presentación clínica más severa que otros tipos de amiloidosis pulmonar, debido a que los depósitos involucran el intersticio y afectan el intercambio de gases. La forma de presentación es con disnea progresiva, no explicada por otra causa. Esto se refleja en las pruebas de función pulmonar que muestran un patrón restrictivo con una capacidad de difusión reducida de CO e hipoxemia en el esfuerzo4.
En la TAC de alta resolución se pueden encontrar opacidades reticulonodulillares, engrosamiento septal y, con menor frecuencia, opacificación en vidrio esmerilado, bronquiectasias de tracción y panalización5.
Histológicamente, el amiloide puede adoptar un patrón intersticial, nodular, difuso o a modo de placas. También se puede evidenciar en las paredes vasculares. Cuando adopta una disposición intersticial puede pasar desapercibido. Al igual que en este caso, pueden observarse calcificaciones y focos de hueso metaplásico6.
El tratamiento de esta enfermedad es el de la amiloidosis sistémica AL. Reducir la concentración de cadenas ligeras en sangre podría mejorar la disfunción orgánica7, sin embargo, no se han encontrado datos del impacto del tratamiento sobre el compromiso pulmonar.