La Guía Española de la Enfermedad Pulmonar Obstructiva Crónica (GesEPOC) se publicó por primera vez en 2012 y desde entonces ha experimentado una serie de actualizaciones que incorporan las nuevas evidencias sobre el diagnóstico y tratamiento de la EPOC. GesEPOC es una guía de práctica clínica elaborada con la colaboración de las sociedades científicas implicadas en el tratamiento de la EPOC y del Foro Español de Pacientes. Sus recomendaciones se basan en una evaluación de la evidencia mediante la metodología GRADE y en una descripción narrativa de la evidencia en aquellas cuestiones en que la aplicación de GRADE no es posible. En este artículo se resumen las recomendaciones sobre el tratamiento farmacológico de la EPOC estable basadas en la elaboración de nueve preguntas PICO. El proceso de tratamiento de la EPOC comprende cuatro etapas: 1) diagnóstico, 2) determinación del nivel de riesgo, 3) tratamiento inhalado inicial y de continuación e 4) identificación y abordaje de los rasgos tratables. Para la elección del tratamiento inhalado los pacientes de alto riesgo se dividirán en tres fenotipos: no agudizador, agudizador eosinofílico y agudizador no eosinofílico. Los rasgos tratables comprenden unos de tipo general, que deben investigarse en todos los pacientes, como el tabaquismo o la técnica inhalatoria y otros más específicos, que afectan sobre todo a los pacientes graves, como la hipoxemia crónica o la infección bronquial crónica. La base del tratamiento de la EPOC la constituyen los broncodilatadores de larga duración en monoterapia o en combinación según el nivel de riesgo del paciente. Los pacientes agudizadores eosinofílicos deben recibir corticosteroides inhalados y los no eosinofílicos requieren una evaluación más detallada para elegir la mejor opción terapéutica. La nueva GesEPOC también incluye recomendaciones sobre la retirada de corticosteroides inhalados y sobre la indicación de tratamiento con alfa-1 antitripsina. GesEPOC supone una aproximación al tratamiento de la EPOC más individualizada según las características clínicas de los pacientes y su nivel de riesgo o de complejidad.
The Spanish COPD Guidelines (GesEPOC) were first published in 2012, and since then have undergone a series of updates incorporating new evidence on the diagnosis and treatment of COPD. GesEPOC was drawn up in partnership with scientific societies involved in the treatment of COPD and the Spanish Patients’ Forum. Their recommendations are based on an evaluation of the evidence using GRADE methodology, and a narrative description of the evidence in areas in which GRADE cannot be applied. In this article, we summarize the recommendations on the pharmacological treatment of stable COPD based on 9 PICO questions. COPD treatment is a 4-step process: 1) diagnosis, 2) determination of the risk level, 3) initial and subsequent inhaled therapy, and 4) identification and management of treatable traits. For the selection of inhaled therapy, high-risk patients are divided into 3 phenotypes: non-exacerbator, eosinophilic exacerbator, and non-eosinophilic exacerbator. Some treatable traits are general and should be investigated in all patients, such as smoking or inhalation technique, while others affect severe patients in particular, such as chronic hypoxemia and chronic bronchial infection. COPD treatment is based on long-acting bronchodilators with single agents or in combination, depending on the patient's risk level. Eosinophilic exacerbators must receive inhaled corticosteroids, while non-eosinophilic exacerbators require a more detailed evaluation to choose the best therapeutic option. The new GesEPOC also includes recommendations on the withdrawal of inhaled corticosteroids and on indications for alpha-1 antitrypsin treatment. GesEPOC offers a more individualized approach to COPD treatment tailored according to the clinical characteristics of patients and their level of complexity.
La Guía Española de la enfermedad pulmonar obstructiva crónica (GesEPOC) 2021 supone la cuarta actualización de GesEPOC desde la primera versión publicada en 20121. En la elaboración de la guía han participado representantes de las sociedades científicas implicadas en la atención a pacientes con EPOC y del Foro Español de Pacientes.
GesEPOC fue la primera guía clínica en EPOC en proponer un tratamiento guiado por fenotipos clínicos y logró una implementación importante. En la auditoría realizada en consultas externas de Neumología en España (estudio EPOCONSUL) entre mayo de 2014 y mayo de 2015, un 46,3% de las historias clínicas de pacientes con EPOC ya recogían la clasificación por fenotipos de GesEPOC 20122.
La continua actividad investigadora en EPOC y la generación de nuevas evidencias hacen necesario actualizar las recomendaciones de diagnóstico y tratamiento de forma periódica. En este artículo se presenta el apartado de tratamiento farmacológico de la EPOC estable en la nueva GesEPOC 2021. Para su desarrollo se ha seguido la metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE)3. En esta edición de la guía se han elaborado cinco preguntas PICO nuevas y se conservan las recomendaciones de cuatro preguntas de la edición de GesEPOC 20174, por considerar que no ha habido nuevas evidencias significativas en estos aspectos del tratamiento. Los detalles del protocolo que incluyen las preguntas PICO: paciente, intervención, comparación y resultados (Outcomes), la búsqueda bibliográfica y las tablas de evidencia se pueden consultar en el suplemento 1.
El proceso de la atención al paciente con EPOCGesEPOC 2021 propone una evaluación del paciente en cuatro pasos: 1) diagnóstico de la EPOC y medidas generales, 2) estratificación del riesgo, 3) selección del tratamiento inhalado según los síntomas y el fenotipo clínico e 4) identificación y abordaje de los rasgos tratables.
DiagnósticoEl proceso se inicia con la sospecha diagnóstica ante un adulto fumador o exfumador de más de 10 paquetes-año o una exposición crónica a tóxicos inhalados que presenta síntomas respiratorios (disnea o tos crónica con o sin expectoración asociada). La realización de una espirometría en situación clínica de estabilidad permitirá confirmar el diagnóstico al demostrar un cociente entre el volumen espiratorio máximo en el primer segundo (FEV1) y la capacidad vital forzada (FVC) tras la prueba broncodilatadora inferior a 0,7, aunque debemos tener en cuenta que este valor puede infraestimar la obstrucción en sujetos jóvenes y sobrediagnosticar a los de edad más avanzada, ya que este cociente desciende fisiológicamente con el envejecimiento5,6. Por tanto, para establecer un diagnóstico de EPOC es necesario cumplir tres criterios: exposición previa a factores de riesgo, síntomas respiratorios y obstrucción en la espirometría post-broncodilatación.
Tras el diagnóstico existen una serie de medidas generales para tener en cuenta en todo paciente con EPOC que comprenden, entre otras, el abandono del tabaco, la adecuada nutrición, la actividad física regular adaptada a la edad y a las condiciones físicas del paciente, así como evaluación y el tratamiento de las comorbilidades. Todas estas medidas generales no van a ser abordadas en esta publicación. La determinación de la alfa-1 antitripsina (AAT) se debe realizar en todos los pacientes y su abordaje específico se recoge en la sección de rasgos tratables de esta guía.
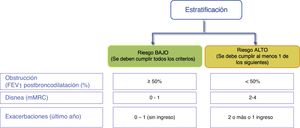
Estratificación del riesgoA continuación se debe evaluar el nivel de riesgo. Como tal se entiende la probabilidad de que el paciente pueda presentar agudizaciones, progresión de la enfermedad, futuras complicaciones, mayor consumo de recursos sanitarios o mayor mortalidad. GesEPOC propone una clasificación en dos niveles de riesgo: bajo y alto. Esta clasificación de riesgo no implica derivación entre niveles asistenciales.
Los factores considerados para la evaluación del riesgo son el grado de obstrucción medido por el FEV1(%) post-broncodilatador, el nivel de disnea medido por la escala modificada de la Medical Research Council (mMRC) y la historia de agudizaciones durante el año previo (fig. 1). Los componentes de esta clasificación de riesgo han demostrado poder predictivo sobre la mortalidad7. La inclusión del FEV1 ha mostrado añadir valor predictivo de forma significativa a la clasificación de riesgo8 y estudios recientes han evidenciado la adecuación de la clasificación de riesgo a la realidad asistencial y su aportación en la selección del tratamiento farmacológico9. A mayor nivel de riesgo, mayor necesidad de intervenciones terapéuticas (tabla 1).
Adecuación del nivel de intervención asistencial a los niveles de riesgo
| Intervenciones terapéuticas | ||
|---|---|---|
| Bajo riesgo | Deshabituación tabáquica | ConsejoTratamiento específico |
| Educación terapéutica | Programa estructurado de educación terapéutica orientado a:• Fomentar el autocuidado• Adhesión terapéuticaTécnica inhalatoria | |
| Actividad física | Ejercicio regular | |
| Vacunación | AntigripalAntineumocócica (conjugada 13 valente)COVID-19Valorar dTpa | |
| Déficit de alfa-1 antitripsina | Tratamiento aumentativo según normativas | |
| Tratamiento farmacológico | Broncodilatadores | |
| Comorbilidad | Tratamiento de las comorbilidades | |
| Alto riesgoAñadir al tratamiento previo: | Tratamiento farmacológico | Guiado por fenotipo clínicoIdentificar rasgos tratables |
| Tratamiento no farmacológico | Rehabilitación pulmonarValorar oxigenoterapia crónica domiciliaraValorar ventilación no invasivaValorar reducción de volumen pulmonar en pacientes con enfisema extenso.Valorar trasplante pulmonar |
COVID-19: enfermedad por coronavirus 2019; dTpa: difteria, tétanos, pertussis acelular.
Los objetivos generales del tratamiento de la EPOC se resumen en: reducir los síntomas de la enfermedad, disminuir la frecuencia y gravedad de las agudizaciones, mejorar la calidad de vida y la supervivencia. Se deben alcanzar tanto los beneficios a corto plazo (control de la enfermedad), como los objetivos a medio y largo plazo (reducción del riesgo).
En cuanto al tratamiento farmacológico inicial, la guía GesEPOC propone un tratamiento basado en la administración de fármacos inhalados y guiado por síntomas en los pacientes de bajo riesgo y por fenotipo clínico en los de alto riesgo10. Los puntos clave del tratamiento farmacológico de la EPOC se exponen en la tabla 2.
Puntos clave del tratamiento farmacológico de la EPOC
| La base del tratamiento de la EPOC estable la constituyen los fármacos inhalados. |
| Los BDLD son los fármacos de primera elección en la mayoría de los pacientes y los tratamientos que se deben añadir a los BDLD en el tratamiento de inicio dependerán del grupo de riesgo y el fenotipo clínico |
| El tratamiento del fenotipo no agudizador se basa en el uso de la doble broncodilatación. |
| El tratamiento del fenotipo agudizador eosinofílico se basa en la utilización de BDLD combinados con CI. |
| El tratamiento del fenotipo agudizador no eosinofílico se basa en los BDLD. Los CI pueden ser útiles en algunos casos, aunque su eficacia es menor. |
| La identificación de rasgos tratables permite un tratamiento específico dirigido a las necesidades de cada paciente. |
| El control de la EPOC es una herramienta útil para el seguimiento y la adecuación terapéutica. |
EPOC: enfermedad pulmonar obstructiva crónica; BDLD: broncodilatadores de larga duración; CI: corticosteroides inhalados.
En el paciente de bajo riesgo no está indicado ningún tipo de tratamiento oral o antiinflamatorio y el tratamiento farmacológico consistirá en la prescripción de broncodilatadores de larga duración (BDLD). En el caso poco frecuente de una obstrucción leve y con escasos síntomas o síntomas intermitentes puede estar indicada la administración de broncodilatadores de corta duración (BDCD) a demanda.
Los BDCD pueden ser de dos tipos: anticolinérgicos (SAMA) como el bromuro de ipratropio y beta-2 agonistas de acción corta (SABA) como salbutamol o terbutalina. En pacientes con síntomas ocasionales, el tratamiento con BDCD reduce los síntomas y mejora la tolerancia al esfuerzo11. Debido a su rápido mecanismo de acción, estos fármacos, añadidos al tratamiento de base, son de elección para el tratamiento a demanda de los síntomas, en cualquier nivel de gravedad de la enfermedad. Cuando el paciente tiene síntomas permanentes o sufre alguna limitación en sus actividades diarias por su problema respiratorio requerirá un tratamiento de base regular con BDLD.
Los BDLD pueden ser beta-2 adrenérgicos (LABA) o anticolinérgicos (LAMA). Los LABA disponibles en España son salmeterol, formoterol, indacaterol, olodaterol y vilanterol y los LAMA son tiotropio, aclidinio, glicopirronio y umeclidinio (tabla 3). Los BDLD deben utilizarse como primer escalón en el tratamiento de todos los pacientes con síntomas persistentes que precisan tratamiento de forma regular, porque permiten un mayor control de los síntomas que el conseguido con BDCD y mejoran la función pulmonar, la capacidad de ejercicio y la calidad de vida12,13. Además, los BDLD han demostrado reducir el número de exacerbaciones, tanto los LABA, como los LAMA14.
Características de los fármacos inhalados para el tratamiento de la EPOC
| Principio activo | Presentación | Dosis recomendada | |
|---|---|---|---|
| Beta-2 adrenérgicos | Salbutamol | ICP: 100 μg/inh | 200 μg/4-6 h |
| Terbutalina | Turbuhaler®: 500 mg/inh | 500 μg/6 h | |
| Salmeterol | ICP: 25 μg/inhAccuhaler®: 50 μg/inh | 50 μg/12 h | |
| Formoterol | ICP: 12 μg/inhTurbuhaler®: 9 μg/inhAerolizer®: 12 μg/inh | 12 μg/12 h | |
| Indacaterol | Breezhaler®: 150 μg/inhBreezhaler®: 300 μg/inh | 150 μg/24 h | |
| Olodaterol | Respimat®: 2,5 μg/inh | 5 μg/24 h | |
| Anticolinérgicos | Bromuro de ipratropio | ICP: 20 μg/inh | 20-40μg/6-8 h |
| Bromuro de tiotropio | Handihaler®: 18 μg/inhRespimat®: 2,5 μg/inh | 18 μg/24 h5 μg 24 h | |
| Aclidinio | Genuair®: 340 μg/inh | 340 μg/12 h | |
| Glicopirronio | Breezhaler®: 50 μg/inh | 50 μg/24 h | |
| Umeclidinio | Ellipta®: 62,5 μg/inh | 62,5 μg/24 h | |
| LABA/LAMA | Indacaterol/glicopirronio | Breezhaler®: 110/50 μg/inh | 110/50 μg/24 h |
| Aclidinio/formoterol | Genuair®: 340/12 μg/inh | 340/12 μg/12 h | |
| Umeclidinio/vilanterol | Ellipta®: 62,5/25 mg/inh | 62,5/25 mg/24 h | |
| Tiotropio/olodaterol | Respimat®: 2,5/2,5 μg/inh | 5/5 μg/24 h | |
| LABA/CI | Beclometasona/formoterol | Nexthaler®: 100/6 μg/inhICP Modulite® 100/6 μg/inh | 200/12 μg/12 h |
| Formoterol/budesonida | Turbuhaler®: 4,5/160 y 9/320 μg/inhSpiromax®: 4,5/160 y 9/320 μg/inhEasyhaler®: 4,5/160 y 9/320 μg/inh | 9/320 μg/12 h | |
| Salmeterol/propionato de fluticasona | Accuhaler®: 50/500 μg/inhForspiro®: 50/500 μg/inh | 50/500 μg/12 h | |
| Furoato de fluticasona/ vilanterol | Ellipta®: 100/25 μg/inh | 100/25 μg/24 h | |
| LABA/LAMA/CI | Beclometasona/formoterol/glicopirronio | ICP: 100/6/12.5 μg/inh | 200/12/25 μg/12 h |
| Furoato de fluticasona/ vilanterol/umeclidinio | Ellipta®: 100/25/62,5 μg/inh | 100/25/62,5 μg/24 h |
LABA/LAMA: Beta-2 adrenérgico de larga duración/ antimuscarínico de larga duración; LABA/CI: Beta-2 adrenérgico de larga duración/ corticosteroide inhalado; ICP: inhalador en cartucho presurizado; inh: inhalación.
Existen diferencias entre los diversos BDLD, los hay con una duración de acción de 12 horas (aclidinio, salmeterol y formoterol) y de 24 horas (tiotropio, umeclidinio, glicopirronio, indacaterol, olodaterol y vilanterol). Con relación a la prevención de agudizaciones, tiotropio ha demostrado ser más eficaz que salmeterol o indacaterol15,16, por este motivo ante la elección de un BDLD en monoterapia se recomienda un LAMA de primera elección sobre un LABA (tabla 4)
Recomendaciones sobre el tratamiento farmacológico de la EPOC en fase estable
| Pregunta PICO | Recomendación | Especificaciones | Fuerza de la recomendación | Nivel de evidencia |
|---|---|---|---|---|
| 1. ¿Qué tratamiento es de elección en monoterapia, un LABA o un LAMA?* | En pacientes con EPOC que precisan un broncodilatador de larga duración en monoterapia se sugiere el tratamiento con un LAMA. | La evidencia analizada se basa en una mayor prevención de agudizaciones en estudios realizados con el LAMA tiotropio. En pacientes sin agudizaciones no hay diferencias en la eficacia clínica entre LAMA y LABA. | Débil | Moderada |
| 2. Para el tratamiento inicial en un paciente de bajo riesgo no agudizador ¿Es la doble broncodilatación superior a la monoterapia? | En pacientes de bajo riesgo que permanecen sintomáticos con un broncodilatador de larga duración se recomienda la terapia con doble broncodilatación.En pacientes de alto riesgo sintomáticos (mMRC ≥ 2) se recomienda la terapia con doble broncodilatación en comparación con el tratamiento con un solo broncodilatador. | En pacientes con afectación espirométrica grave o muy grave, la terapia con doble broncodilatación de inicio es superior a la monoterapia por su mayor efecto sobre la función pulmonar y los síntomas. | Fuerte | Moderada |
| 3. Para el tratamiento inicial en un paciente agudizador no eosinofílico ¿Qué tratamiento es de elección LABA/LAMA o LABA/CI? | Se sugiere el tratamiento inicial con LABA/LAMA en un paciente agudizador no eosinofílico. | La comparación entre la eficacia de ambas alternativas en la prevención de agudizaciones no es concluyente, aunque la relación beneficio/riesgo parece favorecer al tratamiento LABA/LAMA en el perfil de pacientes que requieren tratamiento inicial.El tratamiento con LABA/CI es una alternativa en pacientes con agudizaciones muy frecuentes y con eosinofilia en sangre cercana a las 300 células/mm3. | Débil | Baja |
| 4. En pacientes con agudizaciones a pesar de un tratamiento con LABA/LAMA ¿Es eficaz la triple terapia LABA/LAMA/CI? | En pacientes con agudizaciones a pesar de un tratamiento con LABA/LAMA se sugiere la terapia triple con LABA/LAMA/CI. | La terapia triple con LABA/LAMA/CI ofrece una mayor reducción en el riesgo de agudizaciones y una mayor mejoría en los síntomas que la doble broncodilatación (LABA/LAMA).No se puede descartar que la reducción en las agudizaciones con la triple terapia frente a LABA/LAMA en pacientes agudizadores no eosinofílicos sea clínicamente irrelevante. | Débil | Moderada |
| 5. ¿Es eficaz el tratamiento aumentativo con AAT para frenar la evolución del enfisema en pacientes con DAAT? | En pacientes con enfisema por DAAT se sugiere el tratamiento aumentativo con el objetivo de reducir la pérdida de densidad pulmonar medida por TC. | El tratamiento aumentativo, sin embargo, no ha demostrado eficacia en síntomas o reducción de agudizaciones. | Débil | Moderada |
| 6. ¿Cuándo utilizar mucolíticos en la prevención de agudizaciones?* | En pacientes con EPOC fenotipo agudizador a pesar de un tratamiento adecuado se sugiere añadir un mucolítico a dosis altas. | Se debe discutir con el paciente los costes asociados al tratamiento con agentes mucolíticos | Débil | Moderada |
| 7. ¿Cuándo utilizar roflumilast en la prevención de agudizaciones?* | Se sugiere el uso de roflumilast como fármaco de segunda línea para prevenir exacerbaciones en pacientes fenotipo agudizador con bronquitis crónica y limitación grave al flujo aéreo. | Su perfil de seguridad puede hacer que la tolerancia al fármaco sea escasa. Se debe prestar atención a la posible aparición de efectos adversos. | Débil | Moderada |
| 8. ¿Cuándo utilizar macrólidos a largo plazo en la prevención de agudizaciones?* | En pacientes con EPOC con fenotipo agudizador, con al menos tres agudizaciones el año previo a pesar del tratamiento adecuado, se sugiere el tratamiento con macrólidos a largo plazo. | Se debe restringir a pacientes graves con frecuentes agudizaciones. Realizar un control estricto ante los posibles efectos adversos como la prolongación del intervalo QT, pérdida de la capacidad auditiva o la generación de resistencias. | Débil | Moderada |
| 9. ¿Se pueden retirar los corticosteroides inhalados en pacientes con EPOC? | a) Considerar la retirada de CI en pacientes con agudizaciones infrecuentes (0-1 moderada el año previo) y < 300 eosinófilos/mm3b) Se recomienda no retirar los CI en pacientes agudizadores eosinofílicos | Tras la retirada se debe continuar con un tratamiento con broncodilatadores de larga duración. | a) Débilb) Fuerte | ModeradaModerada |
En general, los BDLD son bien tolerados y presentan escasos efectos adversos. No obstante, se deben tener en cuenta los siguientes efectos: LABA: temblor fino de las extremidades, calambres musculares, taquicardia, hipertensión arterial, vasodilatación periférica, cefalea, hiperglucemia, hipopotasemia, tos, broncoespasmo, irritación orofaríngea y dispepsia. El tratamiento con LAMA se puede asociar a sequedad de boca, retención urinaria, incremento de la presión ocular e irritación faríngea. Se debe tener en cuenta que los ensayos clínicos excluyen a pacientes con cardiopatía significativa, por lo que se debe estar alerta con el uso de los broncodilatadores en estos pacientes12,13.
En pacientes sintomáticos o con una limitación al ejercicio evidente a pesar de la monoterapia broncodilatadora, se debe comprobar el cumplimiento con el tratamiento y la adecuada técnica inhalatoria. También existe la posibilidad de cambiar de BDLD, por ejemplo, de un LAMA a un LABA17. El siguiente escalón terapéutico es la doble terapia broncodilatadora, la asociación de LABA y LAMA ofrece un beneficio funcional añadido con reducción de la necesidad de medicación de rescate, mejoría de los síntomas y de la calidad de vida frente a la monoterapia12,13,18,19.
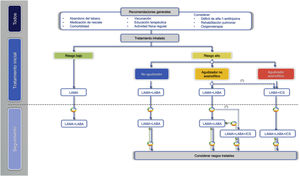
En el siguiente escalón de tratamiento en los pacientes de bajo riesgo se pueden asociar dos BDLD para optimizar el efecto broncodilatador (fig. 2, tabla 3).
Tratamiento inhalado del paciente de alto riesgoEn los pacientes de alto riesgo, la GesEPOC 2021 reconoce tres fenotipos en el esquema de tratamiento farmacológico: 1) no agudizador, 2) agudizador eosinofílico y 3) agudizador no eosinofílico.
Esta distribución de fenotipos es distinta a la de GesEPOC 20174 y viene motivada por por nuevas evidencias disponibles. En primer lugar, el llamado fenotipo mixto EPOC-asma (ACO) venía definido por GesEPOC y la Guía Española del Asma (GEMA) como un paciente con EPOC y diagnóstico concomitante de asma o con eosinofilia periférica o una prueba broncodilatadora muy positiva20,21. En los últimos años se ha confirmado el papel predictor de la eosinofilia periférica en la respuesta clínica a los corticosteroides inhalados (CI) en la EPOC22,23. Sin embargo, se ha comprobado que la prueba broncodilatadora muy positiva raramente se presenta aislada y tiene un escaso valor diagnóstico24,25. Por este motivo GesEPOC propone separar las dos formas clínicas principales del ACO26 y reservar la denominación de ACO para la coexistencia de un diagnóstico de asma, como comorbilidad, en un paciente con EPOC, lo que implicará que se deban tratar ambas enfermedades. Por el contrario, la presencia de eosinofilia periférica (> 300 células/μL) en un paciente con historial de agudizaciones de repetición (dos o más en el último año o una con ingreso hospitalario), definirá al paciente EPOC agudizador eosinofílico.
Con relación a los fenotipos de enfisema y bronquitis crónica, ambos están ya definidos1. Sin embargo, respecto al tratamiento inhalado de la EPOC no existe ningún aspecto diferencial entre ambos. Por este motivo incluiremos tanto el enfisema como la tos y expectoración crónica en la lista de rasgos tratables, ya que serán útiles en pacientes graves para indicar otro tipo de tratamientos farmacológicos no inhalados o no farmacológicos específicos. De este modo los fenotipos de GesEPOC 2021 se definen como:
Fenotipo no agudizadorEl fenotipo no agudizador se caracteriza por presentar como máximo una agudización el año previo sin requerir atención hospitalaria.
El tratamiento inicial en un paciente con EPOC de alto riesgo no agudizador es la doble broncodilatación (tabla 4). Esta recomendación se basa en la demostración de una mayor eficacia broncodilatadora frente a la monoterapia, que se acompaña de una mejoría significativa de la disnea, de la calidad de vida y una reducción en la utilización de la medicación de rescate18,27, incluso demostrado en pacientes sin medicación concomitante con CI28. Las combinaciones existentes de BDLD (LABA/LAMA) se presentan en la tabla 3.
Fenotipo agudizador eosinofílicoSe define como fenotipo agudizador a todo paciente con EPOC que presente en el año previo dos o más agudizaciones ambulatorias, o una o más agudizaciones graves, que precisen atención hospitalaria29. Estas exacerbaciones deben estar separadas al menos cuatro semanas desde la resolución de la exacerbación previa o seis semanas desde el inicio de los síntomas, para diferenciar el nuevo evento de una recaída o de un fracaso terapéutico29. Debido a la diferente respuesta a los tratamientos farmacológicos es importante diferenciar los que tienen un fenotipo eosinofílico o no eosinofílico. Aquellos pacientes con > 300 eosinófilos/mm3 en fase estable se clasificarán como agudizadores eosinofílicos. La concentración de eosinófilos en sangre puede variar30,31, por lo que será preferible disponer de diversas determinaciones del mismo periodo en el que se evalúa la frecuencia de las agudizaciones para poder hacer una decisión terapéutica más fiable. Estudios amplios realizados en España demuestran que aproximadamente entre un 15-25% de los pacientes con EPOC tiene > 300 eosinófilos/mm3 en fase estable31,32.
Los pacientes agudizadores que presentan una concentración elevada de eosinófilos (> 300 células/mm3) en sangre experimentan una mayor respuesta clínica a los CI y justifican el uso de los CI asociados a un LABA como primera opción para reducir el riesgo de agudizaciones22,23,33 (tabla 3). La respuesta a los CI presenta una gradación de acuerdo con la concentración de eosinófilos en sangre, por lo que pueden ser útiles también a concentraciones < 300 células/mm3, pero su eficacia será cada vez menor a medida que disminuya la eosinofilia periférica22,34.
El siguiente escalón terapéutico en los pacientes agudizadores eosinofílicos es la triple terapia CI/LABA/LAMA (tabla 3 y fig. 2). Estudios recientes de triple terapia fija han demostrado una mayor eficacia en la mejoría de la función pulmonar, los síntomas respiratorios y una mayor reducción del riesgo de agudizaciones que la combinación LABA/CI35–37. También la triple terapia ha demostrado una mayor reducción del riesgo de agudizaciones que la combinación LABA/LAMA, en especial en pacientes que tenían una mayor concentración de eosinófilos en sangre35,36,38. Estos estudios incluyeron pacientes sintomáticos y con agudizaciones frecuentes y graves a pesar de un tratamiento regular para su EPOC, por lo que la triple terapia se considera un tratamiento de continuación y no un tratamiento inicial para la EPOC39.
Fenotipo agudizador no eosinofílicoSe trata de un paciente que cumple los criterios del fenotipo agudizador, pero presenta al mismo tiempo < 300 eosinófilos/mm3 en sangre periférica. En estos pacientes la eficacia de los CI es menor, aunque esto no los excluye del tratamiento, en particular si la cifra de eosinófilos es > 100 células/mm334.
En estos pacientes la asociación LABA/LAMA ha demostrado una mejoría modesta en prevención de agudizaciones frente a LAMA40,41, pero ofrece el beneficio añadido de la mejoría de los síntomas y de la calidad de vida frente a la monoterapia12,13,18,19. La revisión sistemática y metaanálisis de los resultados de las combinaciones LABA/LAMA frente a LABA/CI en la prevención de agudizaciones muestran grandes diferencias en efectividad, debidas fundamentalmente a los distintos criterios de inclusión de los ensayos clínicos. Además, en ninguno de estos estudios se comparaba LABA/LAMA con LABA/CI como tratamiento de inicio35,36,42 (Suplemento 1). En general, la combinación LABA/CI ofrece mejores resultados cuando las cifras de eosinófilos son más elevadas (más cercanas a 300 eosinófilos/mm3), cuando la frecuencia de agudizaciones es mayor y las agudizaciones previas respondieron bien a corticosteroides sistémicos36,43, mientras que LABA/LAMA ofrece mejores resultados que LABA/CI cuando las cifras de eosinófilos son menores, las agudizaciones son menos frecuentes o requieren tratamiento con antibióticos, además tiene un mayor efecto broncodilatador y menor riesgo de neumonía42,43. Debido a que GesEPOC 2021 considera el diagnóstico concomitante de asma como una comorbilidad que se debe tratar, aquellos con más de 300 eosinófilos/mm3 se clasifican en el fenotipo eosinofílico y que además la mayoría de los pacientes agudizadores tienen una frecuencia baja de agudizaciones, se recomienda el tratamiento con LABA/LAMA de primera elección en la mayoría de los pacientes agudizadores no eosinofílicos (tabla 4). La combinación LABA/CI se puede indicar cuando la frecuencia de agudizaciones es superior, las agudizaciones responden a corticosteroides sistémicos, no hay antecedentes de neumonía y la cifra de eosinófilos es más cercana a 300 eosinófilos/mm3.
El paciente agudizador no eosinofílico que sufre agudizaciones frecuentes o graves a pesar de un tratamiento con LABA/LAMA requiere una atención especializada y se debe investigar la presencia de rasgos tratables44,45, tal como se indicará en el apartado correspondiente. Con relación al tratamiento inhalado, los CI en forma de triple terapia pueden ser de utilidad si presentan cifras de eosinófilos entre 100 y 300 células/mm335,36,43. En este caso la indicación de CI debe considerar de nuevo los factores que se asocian con una mayor efectividad y seguridad de los CI, como son: 1) agudizaciones más frecuentes o graves, 2) agudizaciones previas que responden a corticosteroides orales, 3) no fumadores activos y 4) sin antecedentes de neumonía46. En cambio, la eficacia de los CI en pacientes con cifras de eosinófilos < 100 células/mm3 es muy limitada y desaconseja su uso para evitar efectos adversos35,36,43,47 (tabla 4). Cuando el inicio de tratamiento fue con LABA/CI, la escalada será a triple terapia.
Identificación y abordaje de los rasgos tratables. Tratamiento no inhaladoLa denominación de rasgo tratable se utiliza para referirse a una característica (clínica, fisiológica o biológica) que se puede identificar mediante pruebas diagnósticas o biomarcadores y que tiene un tratamiento específico44,45. Es importante tener en cuenta que en un paciente determinado es probable que existan varios rasgos tratables y que todos ellos deben ser considerados. En su definición es esencial el objetivo de mejorar los resultados clínicos para pacientes individuales y minimizar los efectos secundarios innecesarios para aquellos menos propensos a tener una respuesta a un tratamiento en concreto.
Atendiendo a su relevancia y aplicabilidad, GesEPOC identifica los rasgos tratables más importantes y frecuentes que se deben investigar en pacientes de alto riesgo, con la excepción del déficit de AAT que es un rasgo que se debe investigar en todos los pacientes con EPOC48 (tabla 5).
Algunos de los rasgos tratables más relevantes de la EPOC, de especial relevancia en pacientes de alto riesgo
| Rasgos tratables | Indicadores | Relevancia e implicaciones terapéuticas |
|---|---|---|
| Deficiencia de alfa 1 antitripsina* | Niveles de alfa-1 antitripsina en sangre periférica | Se relaciona con un mayor riesgo de EPOC y con una progresión acelerada de la enfermedad. El tratamiento aumentativo previene la evolución del enfisema48. |
| Disnea | Escalas de disnea. Tomografía axial computarizada | La teofilina puede mejorar la disnea49.La rehabilitación pulmonar es eficaz en controlar la disnea96. En pacientes seleccionados, las técnicas de reducción de volumen pulmonar pueden mejorar la disnea grave59. |
| Bronquitis crónica | Tos y esputo durante 3 meses consecutivos durante 2 años. | La presencia de bronquitis crónica es un factor que predispone a las agudizaciones en la EPOC.En el fenotipo agudizador con bronquitis crónica, roflumilast es eficaz en la prevención de agudizaciones70-72.También los mucolíticos /antioxidantes son eficaces en la reducción de agudizaciones67-70. |
| Enfisema grave e hiperinsuflación pulmonar | Tomografía axial computarizada, medición de volúmenes pulmonares y difusión del CO | Las técnicas de reducción de volumen pulmonar en pacientes seleccionados han demostrado mejorar la tolerancia al ejercicio, el estado de salud y la función pulmonar59. |
| Infección bronquial crónica | Presencia de microorganismos potencialmente patógenos en los cultivos de muestras respiratorias | Se asocia con agudizaciones de etología infecciosa, con mayor frecuencia y gravedad, y una mayor mortalidad y declive funcional. El tratamiento con antibióticos a largo plazo añadido a la medicación habitual puede reducir las agudizaciones y mejorar la calidad de vida70,78,79. También los mucolíticos /antioxidantes son eficaces en la reducción de agudizaciones67-70. |
| Bronquiectasias | Tomografía axial computarizada | Peor pronóstico y mayor frecuencia y gravedad de las agudizaciones. Seguir tratamiento según la guía de bronquiectasias75. |
| Hipertensión pulmonar precapilar | Ecocardiograma, péptido natriurético, cateterismo | Es un factor de mal pronóstico y su tratamiento mejora los síntomas y previene las complicaciones asociadas. |
| Insuficiencia respiratoria crónica | PaO2 < 60 mmHg y/oPaCO2 > 45 mmHg | La insuficiencia respiratoria crónica se asocia a una menor supervivencia. La oxigenoterapia continua a domicilio ha demostrado aumentar la supervivencia y reducir las agudizaciones y hospitalizaciones63.En pacientes con hipercapnia mantenida y episodios recurrentes de acidosis respiratoria, la ventilación no invasiva ha demostrado ser de utilidad64. |
| Caquexia | Índice de masa corporal (IMC ≤ 20 kg/m2) | La desnutrición se relaciona con mayor riesgo de hospitalización, mayor duración de la estancia y mayor riesgo de reingreso. Suplementos nutricionales, dieta y actividad física son las recomendaciones de tratamiento65,97. |
Los detalles sobre los tratamientos no farmacológicos de los rasgos tratables han sido objeto de otros documentos nacionales o internacionales, por lo que sólo nos referiremos a ellos de forma resumida.
DisneaLa disnea debemos considerarla como un síntoma, pero por razones de organización del texto incluimos el tratamiento de la disnea grave en este apartado. Los pacientes que persistan con disnea importante a pesar de la doble broncodilatación requieren una evaluación que incluya la posibilidad de identificar rasgos tratables y descartar la presencia de comorbilidades que pueden incrementar la disnea como la insuficiencia cardiaca. En particular se debe evaluar la necesidad de un programa de rehabilitación pulmonar y la necesidad de realizar una tomografía computarizada (TC) de tórax para evaluar la indicación de técnicas de reducción de volumen pulmonar.
Desde un punto de vista farmacológico se puede ensayar la adición de teofilinas, que son fármacos broncodilatadores débiles, con un efecto positivo sobre la fuerza del diafragma, un aumento del rendimiento de los músculos respiratorios, una reducción del atrapamiento aéreo y una mejoría del aclaramiento mucociliar49,50. Aunque la dosis habitual es de 200-300 mg/12 horas por vía oral en comprimidos de liberación sostenida, se han obtenido buenos resultados con dosis de 200 o 300 mg/día en preparados de liberación retardada de 24 horas50. Dosis más bajas (100 mg/12 h) han demostrado efectos beneficiosos sobre FEV1 pre-broncodilatador51, aunque no han mostrado un efecto sobre la prevención de exacerbaciones52,53.
La toxicidad de la teofilina es dosis-dependiente. Cuando se administra de forma prolongada se deben verificar sus concentraciones plasmáticas y se debe tener en cuenta el riesgo de interacciones con otros fármacos como el alopurinol, ciprofloxacino, eritromicina, benzodiacepinas o cimetidina, entre otros. En cualquier caso, su limitada eficacia clínica y su estrecho margen terapéutico las relega a ocupar un lugar de tercera línea, principalmente en pacientes de alto riesgo si persisten disneicos tras la doble terapia broncodilatadora49.
Déficit de alfa-1 antitripsinaEl déficit de alfa-1 antitripsina (DAAT) es una causa congénita de enfisema en la edad adulta48. El DAAT grave afecta a 1/4.500 personas de raza caucásica y es responsable de aproximadamente uno de cada 700 casos de EPOC en el sur de Europa54. Para su correcta identificación, todo paciente con EPOC debe tener al menos una medición de sus concentraciones de AAT sérica o una determinación de su genotipo mediante técnicas no invasivas como el análisis de ADN obtenido por raspado de células de la mucosa bucal55. Tras la identificación de un paciente con DAAT se debe realizar un estudio familiar para detectar posibles casos no diagnosticados48. Los casos detectados deben ser notificados al Registro Español de pacientes con Déficit de alfa-1 antitripsina, integrado en el registro European Alpha-1 Antitrypsin Deficiency Research Collaboration (EARCO)56 y se deben derivar a un centro de referencia para un diagnóstico completo y evaluación del posible tratamiento sustitutivo y estudio familiar57.
El tratamiento sustitutivo con AAT purificada está indicado en los pacientes con enfisema pulmonar asociado a un DAAT grave por su efecto en enlentecer la pérdida de densidad pulmonar58 (tabla 4). Es importante el diagnóstico precoz para evitar exposiciones de riesgo, en especial el tabaquismo e iniciar un tratamiento específico cuanto antes para preservar el tejido pulmonar48.
Enfisema grave e hiperinsuflaciónLa presencia de un enfisema grave con hiperinsuflación condiciona una disnea grave e intolerancia al ejercicio. Su evaluación requiere un análisis detallado con TC de tórax, volúmenes pulmonares, prueba de difusión del CO y prueba de la marcha de seis minutos. Según la gravedad y distribución del enfisema el paciente puede ser candidato a técnicas de reducción de volumen pulmonar endoscópicas o quirúrgicas59.
Hipertensión pulmonarSe suele manifestar también con disnea grave o desproporcionada al grado de obstrucción bronquial e intolerancia al ejercicio con desaturación grave y precoz durante la prueba de marcha de seis minutos. Requiere una evaluación con gasometría arterial, prueba de la marcha, ecocardiografía, péptido natriurético y cateterismo cardiaco. El tratamiento suele incorporar la oxigenoterapia además del tratamiento de la enfermedad de base60. Se ha descrito un fenotipo vascular en la EPOC caracterizado por hipoxemia con normocapnia o hipocapnia, muy baja capacidad de difusión y una disnea a mínimos esfuerzos con un patrón de limitación al ejercicio cardiovascular en presencia de una limitación al flujo aéreo leve o moderada61,62.
Insuficiencia respiratoriaEn pacientes con EPOC e hipoxemia grave (PaO2 ≤ 55 mmHg) en reposo, la oxigenoterapia continua ha demostrado un beneficio en la supervivencia y la calidad de vida. La oxigenoterapia continua (al menos 15 horas al día, incluyendo las horas de sueño) está indicada cuando la PaO2 en reposo ≤ 55 mmHg, y también con una PaO2 en reposo entre 56-59 mmHg con evidencia de daño orgánico por hipoxia (Incluyendo insuficiencia cardiaca derecha, hipertensión pulmonar o policitemia). El flujo de oxígeno debe ser el suficiente para mantener una PaO2 > 60 mmHg o una SpO2 > 90%63.
Hipercapnia crónicaSe recomienda la ventilación mecánica domiciliaria de alta intensidad a largo plazo en los pacientes con EPOC estable hipercápnicos por sus beneficios en supervivencia o en aquellos que se mantienen hipercápnicos a las dos a cuatro semanas tras un episodio de insuficiencia respiratoria hipercápnica que requiere soporte ventilatorio hospitalario por sus beneficios en prolongar el tiempo hasta el reingreso hospitalario o muerte64,65. El síndrome overlap y el síndrome de hipoventilación-obesidad se deben diferenciar de la insuficiencia respiratoria crónica atribuible únicamente a la EPOC avanzada.
Bronquitis crónicaLa bronquitis crónica se define clásicamente como la producción de expectoración durante al menos tres meses seguidos en dos años consecutivos, aunque a efectos prácticos se puede considerar como la producción habitual de expectoración en fase estable de la EPOC. Es un factor de riesgo de agudizaciones frecuentes y tiene un impacto importante en la calidad de vida de los pacientes66.
Los pacientes que a pesar de un tratamiento inhalado óptimo presentan agudizaciones y bronquitis crónica, se pueden beneficiar de un tratamiento con mucolíticos/antioxidantes. La carbocisteína67 y la N-acetilcisteína (NAC) a dosis altas, consideradas antioxidantes (600 mg/12 h) han demostrado una reducción significativa de las agudizaciones, especialmente en pacientes de alto riesgo (aquellos con FEV1 < 50% o con dos o más agudizaciones en el año previo, o ambos)68–70 (tabla 4).
Una alternativa específica para pacientes agudizadores con bronquitis crónica es el roflumilast, el cual es un fármaco antiinflamatorio oral, inhibidor de la fosfodiesterasa 4, que ha demostrado prevenir las agudizaciones en pacientes con EPOC grave que presentan tos y expectoración crónica y además sufren agudizaciones frecuentes71. Este efecto se mantiene cuando se añade roflumilast al tratamiento de mantenimiento con un BDLD, sea LABA o LAMA. El efecto de roflumilast en la prevención de agudizaciones se ha observado incluso al añadirse a la terapia triple y en especial en pacientes más graves que requieren ingreso hospitalario72 (tabla 4). La dosis habitual es de 500 μg por vía oral una vez al día.
Los efectos adversos con roflumilast suelen aparecer al inicio del tratamiento, son rápidamente detectados por el paciente y pueden desaparecer en las cuatro primeras semanas, pero en ocasiones condicionan el abandono del fármaco. Los más frecuentes son la pérdida de peso, efectos gastrointestinales, náuseas, dolor de cabeza y pérdida de apetito. El perfil de seguridad de roflumilast no se modifica en función del tratamiento concomitante que el paciente pueda estar tomando para la EPOC. Se debe evitar la utilización de roflumilast con teofilinas. GesEPOC sugiere el tratamiento con roflumilast en pacientes con EPOC y obstrucción grave, bronquitis crónica y agudizaciones a pesar de un tratamiento inhalado adecuado70.
BronquiectasiasEl fenotipo agudizador puede presentar bronquiectasias en hasta un 70% de los casos73, que pueden contribuir a mantener un círculo vicioso amplificando la inflamación subyacente e induciendo la presencia de agudizaciones frecuentes e incluso se asocian a una mayor mortalidad74. En pacientes con EPOC y bronquiectasias se debe tratar el componente infeccioso y la hipersecreción mucosa de acuerdo con las normativas de tratamiento de las bronquiectasias75.
Infección bronquial crónicaLa IBC se define como el aislamiento de un mismo microorganismo potencialmente patógeno en al menos tres cultivos de esputo en un año, separados al menos un mes entre ellos76. La presencia de IBC se asocia a mayor frecuencia y gravedad de las agudizaciones y peor pronóstico77. El tratamiento estará indicado en el caso que se asocie a agudizaciones frecuentes. No existe evidencia de la efectividad del tratamiento de la IBC en el caso poco frecuente de pacientes no agudizadores.
En pacientes agudizadores está indicado el tratamiento a largo plazo con macrólidos si presentan al menos tres agudizaciones en el año previo a pesar de un tratamiento inhalado adecuado78. Los macrólidos administrados de forma prolongada han demostrado reducir de forma significativa el número de agudizaciones78,79. La efectividad de los macrólidos en la EPOC se ha observado en pacientes con y sin bronquiectasias asociadas68. La dosis recomendada sería azitromicina 500 mg/día, tres días por semana. Este tratamiento debe reservarse a centros de referencia con seguimiento clínico, auditivo, electrocardiograma, de bioquímica hepática y microbiológico para descartar infección por micobacterias. Existe escasa evidencia de la eficacia de este tratamiento más allá del año de seguimiento, por lo que se recomienda evaluar el posible riesgo-beneficio de forma anual80. Al igual que otras normativas internacionales, GesEPOC sugiere el tratamiento a largo plazo con macrólidos en pacientes con EPOC moderada a muy grave y agudizaciones a pesar de un tratamiento inhalado adecuado70 (tabla 4).
Existe muy escasa evidencia sobre la eficacia y seguridad del tratamiento con antibióticos inhalados, pero es una alternativa a considerar en pacientes graves, con agudizaciones frecuentes e IBC con base en la experiencia existente en el tratamiento de la IBC en las bronquiectasias76,81.
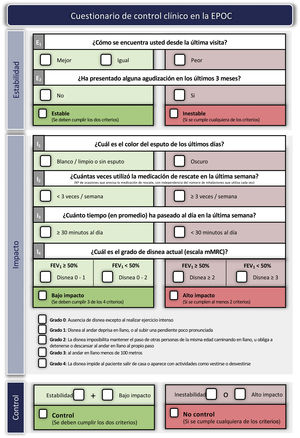
Adecuación del tratamiento durante el seguimientoEstablecer el grado de controlLa adecuación del tratamiento debe realizarse en cada visita médica, en la que se deberán evaluar posibles cambios en el nivel de riesgo, fenotipo o la aparición de nuevos rasgos tratables. GesEPOC propone utilizar el control de la EPOC mediante la aplicación de una escala diseñada y validada para facilitar las decisiones terapéuticas, que se basa en una serie de variables de fácil obtención en cada visita82. La combinación de estas variables indica que el paciente tiene un buen control cuando presenta estabilidad (sin exacerbaciones en los tres meses previos) y un nivel de bajo impacto, definido éste por un bajo nivel de disnea, sin expectoración o expectoración mucosa, uso infrecuente de medicación de rescate y un nivel adecuado de actividad física83. Los criterios detallados para evaluar el control de la EPOC se presentan en la figura 3. El paciente clasificado como no controlado tiene un mayor riesgo de agudización tanto a corto plazo en los próximos seis meses, como a largo plazo y mayor riesgo de deterioro en su calidad de vida relacionada con la salud84,85, por lo que es preciso un análisis detallado de las posibles causas de esta falta de control y puede ser necesario un incremento en la intensidad del tratamiento.
Reducción de tratamientoEn el apartado anterior del tratamiento farmacológico se han descrito los pasos sucesivos de incremento en la intensidad del tratamiento según el aumento de los síntomas o la frecuencia de agudizaciones, por el contrario, en ocasiones se puede también considerar una desescalada en el tratamiento en pacientes controlados. Con relación al tratamiento broncodilatador, es conocido que ejerce su efecto solamente durante su administración, por lo que es muy probable que la retirada de un broncodilatador o su sustitución por otro de menor potencia broncodilatadora o menor duración de acción produzca un empeoramiento funcional o sintomático86,87. Por el contrario, GesEPOC sugiere la retirada de CI en pacientes que no tengan agudizaciones frecuentes (no más de una moderada en el año previo) y < 300 eosinófilos/mm3. Sin embargo, en los pacientes con agudizaciones frecuentes no existe suficiente evidencia para establecer una recomendación de retirada de CI. Los estudios de retirada de CI han demostrado un aumento significativo del riesgo de agudizaciones al retirar los CI en pacientes con > 300 eosinófilos/mm3, por lo que se establece una recomendación fuerte de no retirar los CI en pacientes agudizadores eosinofílicos88 (tabla 4). El objetivo de la retirada de los CI es evitar la posible aparición de efectos adversos89 en pacientes en los que no está probada su eficacia.
COVID-19 y EPOCDurante los primeros meses de 2020 ha aparecido una pandemia causada por el coronavirus SARS-CoV-2 que es el causante de la enfermedad COVID-19 (coronavirus disease 2019)90, con más de 81 millones de casos confirmados en todo el mundo y más de 1,9 millones en España a finales de diciembre de 2020.
La COVID-19 es una enfermedad altamente contagiosa y de expresión clínica muy variable. Puede cursar asintomática o como un leve síndrome gripal en algunas personas o causar una neumonía bilateral grave con necesidad de ventilación mecánica y una elevada mortalidad en casos graves90. Además, las secuelas son muy variadas y pueden prolongarse durante meses, con manifestaciones de cualquier órgano o sistema, como anosmia, fatiga, afectaciones cardiacas, alteraciones de la concentración y el sueño o fibrosis pulmonar, entre otras.
Las series de casos iniciales sugerían que los pacientes con EPOC estaban poco representados entre los pacientes con COVID-19 grave, y llevaron a pensar que había algún factor protector en ellos, tal vez derivado de su propia enfermedad o de su tratamiento91. Sin embargo, series más recientes han demostrado una mayor frecuencia de casos de EPOC entre los afectados de COVID-19, aunque no parece que exista una mayor susceptibilidad que en la población general de la misma edad, pero sí que la EPOC puede asociarse a un peor pronóstico92.
La pandemia por SARS-CoV-2 ha condicionado una serie de cambios que afectan profundamente el manejo habitual de los pacientes con EPOC93. Un resumen de los aspectos más importantes para tener en cuenta se presenta en la tabla 694. De acuerdo con el tratamiento de la EPOC, no existe evidencia de que ninguno sea un factor de riesgo o protector frente a la infección por SARS-CoV-2, por lo que tanto los tratamientos inhalados como orales deben mantenerse igual que antes del periodo de pandemia. Los pacientes con EPOC deben cumplir con las vacunaciones recomendadas y con las medidas de protección de uso de mascarilla, higiene de manos y distancia social95.
Aspectos para tener en cuenta en el diagnóstico y tratamiento de la EPOC en época de pandemia por SARS-CoV-2
| Prevención del riesgo | Vacunación antigripal anual, uso de mascarilla, higiene de manos y distancia social |
| Espirometría | Interrogar por síntomas y toma de temperatura previa. A ser posible disponer de una PCR negativa previa. Restringir a casos necesarios para el diagnóstico o que puedan comportar un cambio en el tratamiento98. |
| COVID-19 o agudización de EPOC | La COVID-19 suele cursar con fiebre, cefalea, anosmia, disgeusia, astenia y síntomas gastrointestinales. |
| Tratamiento de la EPOC | Mantener el mismo tratamiento para la EPOC. |
| Tratamiento de la COVID-19 | Mismas pautas de tratamiento que en pacientes no EPOC. |
| Rehabilitación pulmonar | Promover programas de tele-rehabilitación, estimular la actividad física. |
| Seguimiento del paciente EPOC | Preferir la consulta telefónica cuando sea posible, o las visitas online o por videollamada. |
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesMarc Miravitlles ha recibido honorarios como ponente de AstraZeneca, Boehringer Ingelheim, Chiesi, Cipla, AstraZeneca, Menarini, Rovi, Bial, Sandoz, Zambon, CSL Behring, Grifols y Novartis; honorarios de consultoría de AstraZeneca, Boehringer Ingelheim, Chiesi, Ferrer, GlaxoSmithKline, Bial, Gebro Pharma, Kamada, CSL Behring, Laboratorios Esteve, Ferrer, Mereo Biopharma, Verona Pharma, TEVA, Spin Therapeutics, pH Pharma, Novartis, Sanofi y Grifols, y ayudas para la investigación de GlaxoSmithKline and Grifols. Myriam Calle ha recibido honorarios por impartir conferencias de Novartis, Chiesi, AstraZeneca, Boehringer Ingelheim, AstraZeneca y GlaxoSmithKline. Jesús Molina ha recibido honorarios en los últimos tres años por asesoría científica y/o por impartir conferencias de Astra-Zeneca, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Menarini, Novartis y Pfizer. Pere Almagro ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Laboratorios Esteve, Menarini, y Novartis. José-Tomás Gómez ha recibido honorarios por asesoría científica y/o impartir conferencias de Astra-Zeneca, BIAL, Chiesi, Laboratorios Esteve, Grifols, GlaxoSmithKline, Mylan, Reig-Jofré, ROVI, TEVA y Zambon. Juan Antonio Trigueros ha recibido honorarios por actividades formativas y participación en estudios clínicos de Astra Zéneca, Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline, Mundipharma, Menarini, Pfizer y Teva. Borja G. Cosío ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Laboratorios Esteve, Faes Farma, Teva, Menarini, Sanofi y Novartis. Juan Antonio Riesco ha recibido honorarios por asesoría científica y/o por impartir conferencias de Astra-Zeneca, Bial, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Menarini, Mundipharma, Novartis, Pfizer, Rovi y Teva. Ciro Casanova ha recibido en los últimos tres años haber recibido honorarios por impartir conferencias y/o asesoría científica y/o ayudas para proyectos de investigación de Astra-Zeneca, Bial, Boehringer-Ingelheim, Chiesi, GlaxoSmithKline, Menarini y Novartis. Pere Simonet ha recibido honorarios por actividades de formación continuada de Boehringer Ingelheim, Menarini, Mundipharma, GlaxoSmithKline, Chiesi y AstraZeneca. David Rigau no tiene conflictos de interés. Jose Luis Lopez-Campos ha recibido honorarios en los últimos 3 años por proporcionar conferencias, asesoramiento científico, participación en estudios clínicos o redacción de publicaciones para (orden alfabético): AstraZeneca, Boehringer Ingelheim, Chiesi, CSL Behring, Esteve, Ferrer, Gebro, GlaxoSmithKline, Grifols, Menarini, Novartis, Rovi y Teva. Joan B. Soriano ha recibido financiación para realizar investigación médica y becas desde 2016 a 2021 de Chiesi, GSK, Linde, y Novartis vía el IIS del Hospital Universitario de La Princesa; ha participado en actividades formativas, conferencias, comités asesores y/o consultoría durante el periodo 2015-2019 patrocinadas por: AirLiquide, Almirall, AstraZeneca, Boehringer-Ingelheim, CHEST, Chiesi, ERS, IHME, GEBRO, Grifols, GSK, Laminar, Linde, Lipopharma, Menarini, Mundipharma, Novartis, Pfizer, RiRL, Rovi, SEPAR, Takeda, y Zambon; no ha recibido (ni directa ni indirectamente) fondos de la industria del tabaco o sus afiliados. Julio Ancochea ha recibido honorarios por asesoría científica y/o por impartir conferencias de Actelion, Air Liquide, Almirall, AstraZeneca, Boehringer Ingelheim, Carburos Médica, Chiesi, Faes Farma, Ferrer, GlaxoSmithKline, InterMune, Linde Healthcare, Menarini, MSD, Mundipharma, Novartis, Pfizer, Roche, Rovi, Sandoz, Takeda y Teva. Juan José Soler-Cataluña ha recibido honorarios por asesoría científica y/o por impartir conferencias de AstraZeneca, Bial, Boehringer Ingelheim, Chiesi, Grupo Ferrer, GlaxoSmithKline, Laboratorios Esteve, Teva, Menarini, Mundipharma, Novartis, Rovi y Zambon.
Coordinador: Marc Miravitlles, Sociedad Española de Neumología y Cirugía Torácica (SEPAR).Comité Ejecutivo: Pere Almagro, Sociedad Española de Medicina Interna (SEMI); Julio Ancochea, Myriam Calle, Ciro Casanova, Eusebi Chiner, Borja G. Cosío, Elena Gimeno-Santos, Carme Hernández, José Luis López-Campos, Juan Antonio Riesco, Nuria Seijas, Joan B. Soriano, Juan José Soler-Cataluña (SEPAR); Jesús Molina, Sociedad Española de Medicina Familiar y Comunitaria (semFYC); Dolors Navarro; Asociación de Pacientes y Familiares de EPOC y Apneas del Sueño (APEAS), Federación Nacional de Asociaciones de Pacientes Respiratorios (FENAER), Foro Español de Pacientes (FEP); Leopoldo Palacios Gómez; Federación de Asociaciones de Enfermería Comunitaria y Atención Primaria (FAECAP); Pascual Piñera Salmerón
Sociedad Española de Medicina de Urgencias y Emergencias (SEMES); Eulogio Pleguezuelos, Sociedad Española de Rehabilitación y Medicina Física (SERMEF), Sociedad de Rehabilitación Cardiorrespiratoria (SORECAR); Sebastià Santaeugenia
Sociedad Española de Geriatría y Gerontología (SEGG); Pere Simonet Grupo de Respiratorio en Atención Primaria (GRAP); Adolfo Simón Sociedad Española de Medicina de Urgencias y Emergencias (SEMES); José Tomás Gómez, Sociedad Española de Médicos de Atención Primaria (SEMERGEN); Juan Antonio Trigueros, Sociedad Española de Médicos Generales y de Familia (SEMG). Metodología:
David Rigau; Centro Cochrane Iberoamericano, Barcelona, España