Los pacientes con distrofia muscular de Duchenne (DMD) presentan una gran incidencia de estreñimiento, siendo el uso crónico de laxantes el pilar fundamental de su tratamiento. Se ha postulado que la causa fundamental del estreñimiento en estos pacientes sea el deterioro funcional de la musculatura lisa del tracto gastrointestinal que puede causar dilatación gástrica, enlentecimiento del vaciamiento gástrico e ileal o, incluso, una pseudooclusión intestinal. Las anomalías patológicas y funcionales del músculo liso parecen derivarse de la deficiencia de distrofina, la proteína codificada por el locus asociado a la DMD1. Por otro lado, la dilatación gástrica o intestinal puede verse agravada concretamente en aquellos pacientes con insuficiencia respiratoria hipercápnica, por la ingestión de aire en contexto del uso de ventilación no invasiva (VNI)2. Es bien conocido que el tratamiento con laxantes puede conllevar la aparición de acidosis metabólica3,4, una alteración electrolítica que podría acarrear consecuencias a nivel respiratorio en pacientes con hipoventilación crónica.
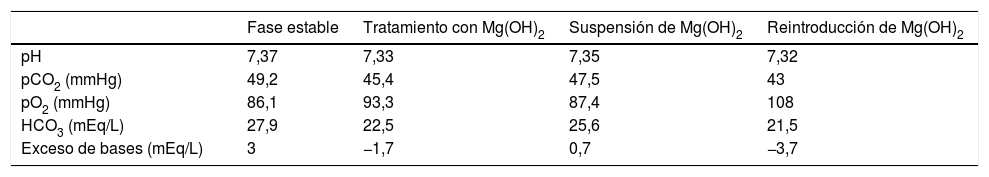
Presentamos el caso de un varón de 37años con DMD con insuficiencia respiratoria crónica hipercápnica y requerimiento de VNI durante 12horas al día. El estudio de función pulmonar en fase estable muestra: FEV1/FVC 94%, FVC 26%, FEV1 30%, PIM 12%, PEM 8%, pico flujo de la tos 149L/min, pH 7,37, pO2 86,1mmHg, pCO2 49,2mmHg, HCO3 27,9mEq/L. En controles rutinarios en Consultas Externas se objetiva la presencia de una anemia ferropénica por lo que se decide añadir hierro oral a su tratamiento habitual (betahistina, dihidrocloruro y paracetamol). El paciente presenta un empeoramiento del estreñimiento crónico decidiéndose iniciar hidróxido de magnesio (Mg(OH)2) como laxante. En los sucesivos controles se detecta un empeoramiento del equilibrio ácido-base con aparición de acidosis metabólica (ver tabla 1) y aumento del requerimiento de soporte ventilatorio, llegando a ser de hasta 18-20horas diarias. En la historia clínica dirigida el paciente no presenta ningún foco de infección. En la evolución gasométrica, además, se observa una disminución de la pCO2 y del bicarbonato (HCO3), situándose nuevamente en niveles similares a los de su estado basal. Se comprueba una correcta función renal y la presencia de un anión GAP normal (sodio 139mmol/L, cloro102 mmol/L). Ante la sospecha de acidosis metabólica secundaria al uso de hidróxido de magnesio, se decide sustituir su administración por bisacodilo y lactitol. Un control gasométrico posterior muestra la corrección de la acidosis, presentando resultados similares a su situación basal. Dos años más tarde, el paciente reinicia tratamiento con hidróxido de magnesio por estreñimiento pertinaz produciéndose un nuevo episodio de acidosis metabólica (ver tabla 1).
Evolución gasométrica
| Fase estable | Tratamiento con Mg(OH)2 | Suspensión de Mg(OH)2 | Reintroducción de Mg(OH)2 | |
|---|---|---|---|---|
| pH | 7,37 | 7,33 | 7,35 | 7,32 |
| pCO2 (mmHg) | 49,2 | 45,4 | 47,5 | 43 |
| pO2 (mmHg) | 86,1 | 93,3 | 87,4 | 108 |
| HCO3 (mEq/L) | 27,9 | 22,5 | 25,6 | 21,5 |
| Exceso de bases (mEq/L) | 3 | −1,7 | 0,7 | −3,7 |
HCO3: bicarbonato; Mg(OH)2: hidróxido de magnesio; pCO2: presión parcial de dióxido de carbono; pO2: presión parcial de oxígeno.
La cronificación o empeoramiento de la acidosis metabólica pueden tener diversas consecuencias, entre otras, la alteración de la contractilidad cardíaca con disminución del gasto cardíaco, aumento en la incidencia de arritmias, vasodilatación arterial y venosa, aumento de las resistencias vasculares pulmonares, de las demandas metabólicas, resistencia a la insulina, anaerobiosis por reducción de la síntesis de adenosina-trifosfato (ATP), hiperpotasemia y alteraciones del nivel de consciencia5,6.
En concreto, el hidróxido de magnesio es un laxante de tipo osmótico que puede inducir alteraciones en el equilibrio ácido-base por la pérdida de bicarbonato, produciendo mayor grado de acidosis cuanto mayor sea esta3,7,8. La respuesta inicial a la pérdida de bicarbonato es la disminución de la pCO2 mediante el estímulo de la ventilación, produciendo una hiperventilación a fin de normalizar el pH. Como promedio, la pérdida de 1mEq/L de HCO3 se compensa con la caída de 1,2mmHg de la pCO29, pero esta respuesta es agotable tanto si se cronifica como si el paciente no es capaz de responder a la demanda respiratoria, pudiendo provocar fatiga muscular, alteración de la mecánica ventilatoria y aumento de las necesidades de VNI. En base a este mecanismo, se ha propuesto el uso de fármacos acidificadores como parte del tratamiento de la hipercapnia residual en pacientes bajo ventilación mecánica domiciliaria10. Sin embargo, en pacientes con enfermedades neuromusculares el mecanismo de hiperventilación compensatorio podría producir, como en este caso, un aumento del trabajo respiratorio.
Es importante, por tanto, prestar atención al uso de laxantes osmóticos en pacientes con patología neuromuscular e insuficiencia respiratoria crónica bajo tratamiento con ventilación mecánica domiciliaria puesto que sus consecuencias podrían ser especialmente graves.