La enolasa específica de neurona (EEN) es el marcador tumoral más sensible para el carcinoma de pulmón microcítico en el momento del diagnóstico. El objetivo del presente estudio fue revisar la utilidad de sus valores séricos como factor pronóstico en pacientes con este cáncer y determinar la correlación entre los valores y el estadio de la enfermedad y la respuesta a la quimioterapia.
MétodosEn este estudio prospectivo, se evaluaron pacientes con carcinoma de pulmón microcítico para su respuesta a la quimioterapia, supervivencia sin progresión de la enfermedad y supervivencia global. El criterio de valoración se designó como la muerte del paciente debida a la enfermedad. Los análisis de EEN se efectuaron antes y después de completar la quimioterapia.
ResultadosSe incluyeron en el estudio 65 pacientes. Los niveles de EEN fueron significativamente más altos en los pacientes que fallecieron de la enfermedad. En pacientes que respondieron al tratamiento los valores pretratamiento fueron significativamente más bajos. Los valores postratamiento no se correlacionaron significativamente con la respuesta a la quimioterapia, supervivencia libre de progresión, supervivencia global y pronóstico de los pacientes. El cambio de los valores de EEN entre el intervalo pre y postratamiento no se correlacionó significativamente con la respuesta al tratamiento, supervivencia libre de progresión y supervivencia global.
ConclusionesLes posible que los valores de EEN no guarden relación con el estadio de la enfermedad. No obstante, en pacientes con carcinoma de pulmón microcítico, en la predicción de una respuesta apropiada a la quimioterapia pueden usarse unos valores bajos previos al tratamiento. Los valores séricos postratamiento y la tasa del cambio entre los valores pre y postratamiento no se relacionaron con la respuesta a la quimioterapia, supervivencia libre de progresión y supervivencia global.
Neuron-specific enolase (NSE) is the most sensitive tumor marker for small-cell lung carcinoma (SCLC) at the time of diagnosis. The main purpose of this study was to review the usefulness of serum NSE level as a prognostic factor in patients with SCLC and to determine the correlation between the NSE level and the stage of disease and response to chemotherapy.
MethodsIn this prospective study, patients with SCLC were evaluated for response to chemotherapy, survival without disease progression, and overall survival. The end point was designated at patient death due to SCLC. NSE assays were performed before and after completion of chemotherapy.
ResultsSixty-five patients were included in study. NSE levels were significantly higher in patients who died of SCLC. The pre-treatment NSE levels in patients who responded to treatment were significantly lower. The post-treatment NSE levels were not significantly correlated with response to chemotherapy, progression-free survival, overall survival, and prognosis of patients. Change in the NSE level between the pre- and post-treatment periods was not significantly correlated with response to treatment, progression-free survival, and overall survival.
ConclusionsNSE levels might not be related with the stage of the disease. However, a low pre-treatment NSE level might be used in predicting good response to chemotherapy in patients with SCLC. The post-treatment serum NSE levels and the rate of change between pre- and post-treatment serum levels of NSE were not related with response to chemotherapy, progression-free survival, and overall survival.
El cáncer de pulmón microcítico, que representa el 15–25% de carcinomas pulmonares, es una entidad diferente del cáncer de pulmón no microcítico porque demuestra un crecimiento rápido, metástasis precoces y una respuesta satisfactoria a la quimioterapia1.
Aunque se han obtenido progresos con la quimioterapia de combinación, los pacientes con este cáncer siguen presentando un mal pronóstico, en particular aquéllos con enfermedad diseminada. Desde la década de los 80, los investigadores han prestado atención a los factores que podrían ser útiles en la predicción de la respuesta al tratamiento y la supervivencia2. Como factores pronósticos de este cáncer, son prominentes el sexo, extensión de la enfermedad, estado general, pérdida de peso, valores de hemoglobina, recuento de leucocitos y de plaquetas y concentración de lactato deshidrogenasa y de enolasa específica de neurona (EEN)3. La EEN es una enzima glucolítica que está presente casi exclusivamente en las neuronas y células neuroendocrinas4. Es el marcador tumoral más sensible de este cáncer en el momento del diagnóstico5–7.
El objetivo del presente estudio fue revisar la utilidad de los valores séricos de ENN antes y después del tratamiento como factor pronóstico en pacientes con cáncer de pulmón microcítico y determinar las correlaciones entre el marcador y el estadio de la enfermedad y la respuesta a la quimioterapia. Además, también se investigó la asociación de la supervivencia con la diferencia entre los valores séricos pre y postratamiento de EEN, lo que no se ha descrito previamente.
MétodosPacientesEn este estudio prospectivo se incluyó a los pacientes con cáncer de pulmón microcítico confirmado histopatológicamente, en los que se había establecido el diagnóstico entre julio 2007–diciembre 2008 en el Department of Thoracic Diseases del Izmir Dr. Suat Seren Thoracic Diseases and Surgery Training and Research Hospital. El protocolo de estudio fue aprobado por el comité ético local de la institución. Todos los participantes leyeron, aprobaron y firmaron un formulario de consentimiento informado.
Se excluyó del estudio a los pacientes sin definición del estadio o que no habían recibido quimioterapia. En todos los pacientes que participaron en el estudio el diagnóstico de extensión se efectuó por medio de TC con realce de contraste, ecografía abdominal, gammagrafía ósea con TC99, y tomografía craneal con realce de contraste o resonancia magnética cerebral. También se efectuaron pruebas de laboratorio sistemáticas que incluyeron un panel bioquímico y hemograma. En el momento del diagnóstico se registraron la fecha del diagnóstico, sexo, edad, puntuación del estado general (0–4) del Eastern Cooperative Oncology Group (ECOG)8, antecedentes de tabaquismo (paquete-años) estadio clínico (enfermedad diseminada, regional)9 y lugares de las metástasis.
Modalidades de tratamientoTodos los pacientes recibieron 4–6 ciclos de quimioterapia con derivados del platino a intervalos cada 21 días. Se administró etopósido (100mg/m2 en los días 1, 2, y 3), combinado con cisplatino (75mg/m2 en el día 1) o carboplatino AUC6 (carboplatino [mg]=6,0×[tasa de filtración glomerular+25] en el día 1). Los pacientes se valoraron mediante una exploración física, formulando preguntas sobre los síntomas, al igual que exámenes de laboratorio sistemáticos (panel hematológico y bioquímico) antes de cada ciclo de quimioterapia.
Para la radioterapia se usó un acelerador lineal médico (6MeV LINAC [Saturne 43®, General Electric, Francia]). Se aplicó un total de 46–50Gy de radioterapia radical al mediastino en pacientes que habían obtenido una respuesta completa a la quimioterapia. En caso de respuesta parcial, se administró un total de 46Gy al mediastino y al tumor una dosis de 2Gy/d y se aplicó radioterapia radical adicional con una dosis de 10Gy (dosis de refuerzo) al tumor. Aunque en 38 pacientes la radioterapia radical se inició secuencialmente, en 6 pacientes se inició simultáneamente con el segundo ciclo de quimioterapia. Tras la quimioterapia y la radioterapia radical, se efectuó irradiación craneal profiláctica con una dosis de 10×250cGy a pacientes que habían obtenido una respuesta completa.
Respuesta al tratamiento y seguimientoLos pacientes se evaluaron mediante una TC torácica por lo que respecta a la respuesta al tratamiento tras la 2, 4 y 6 tanda de quimioterapia. Desde un punto de vista radiológico, se consideró que la desaparición completa de la lesión era una «respuesta completa», una reducción del tamaño en el 50% o más se consideró una «respuesta parcial», una reducción de menos del 50% o un crecimiento de menos del 25% en el tamaño de la lesión se consideró «enfermedad estable» y el crecimiento en más del 25% del tamaño de la lesión se consideró «enfermedad progresiva»10.
En el seguimiento, todos los pacientes se evaluaron con una radiografía de tórax, pruebas de laboratorio sistemáticas, y TC torácica, si era necesaria, cada 3 meses. Los pacientes con una enfermedad localizada y que obtuvieron una respuesta completa a la quimioterapia recibieron irradiación craneal. Se registraron otras opciones de tratamiento (radioterapia paliativa y quimioterapia de segunda línea), supervivencia sin progresión de la enfermedad, y supervivencia global. El criterio de valoración se designó como la muerte del paciente debida a cáncer de pulmón microcítico.
Análisis de la enolasa específica de neuronaEn el momento del diagnóstico y después de la 4 y 6 tanda de quimioterapia, se obtuvieron muestras de sangre venosa de todos los pacientes, que se trasladaron directamente al departamento de microbiología. Todas las muestras de sangre se centrifugaron y se separaron los sueros. Las muestras de suero se separaron en alícuotas y se almacenaron a −20°C hasta su análisis. Se usó el equipo comercial de EEN micro ELISA (DRG International Inc., Mountainside, NJ, EE.UU.) en un analizador automatizado micro ELISA (ETI-Max 3000; Dia Sorin S.p.A., Saluggia, Italia), de acuerdo con las instrucciones del fabricante. Se utilizaron 5 calibradores diferentes de 5–200μg/l (calibrador I: 5μg/l, calibrador II: 25μg/l, calibrador III: 50μg/l, calibrador IV: 100μg/l, calibrador V: 200μg/l). Se obtuvieron los valores de absorbancia de los pacientes por lo que respecta a μg/l usando el método de la curva de calibración.
El control de calidad y los criterios de validación se evaluaron de acuerdo con las recomendaciones del fabricante (DRG International [2007] Instruction Manual: Neuron Specific Enolase ELISA; USA [www.drg-international.com]).
Análisis estadísticoLos análisis estadísticos se efectuaron utilizando el programa SPSS 15.0 para Windows (SPSS Inc., Chicago, IL, EE.UU). En el presente estudio, las variables categóricas se presentaron como tablas de frecuencia, y las variables numéricas se presentaron como estadística descriptiva (media, desviación estándar, mediana, mínimo y máximo). Para la comparación de los valores pre y postratamiento de EEN se usó la prueba de Wilcoxon. Para la comparación de los valores de EEN entre las variables categóricas con los 2 grupos, se usó la prueba de la U de Mann-Witney y para la comparación de las variables categóricas con más de 2 grupos se usó la prueba de Kruskal-Wallis. Para la evaluación de la relación entre los datos numéricos y los valores de EEN se consideró el coeficiente de correlación de Spearman. Se aceptó como estadísticamente significativo un valor de p<0,05. En el modelo del análisis multivariante se usó un análisis de regresión de Cox con un modelado mediante el procedimiento backward (razón de verosimilitud [LR]).
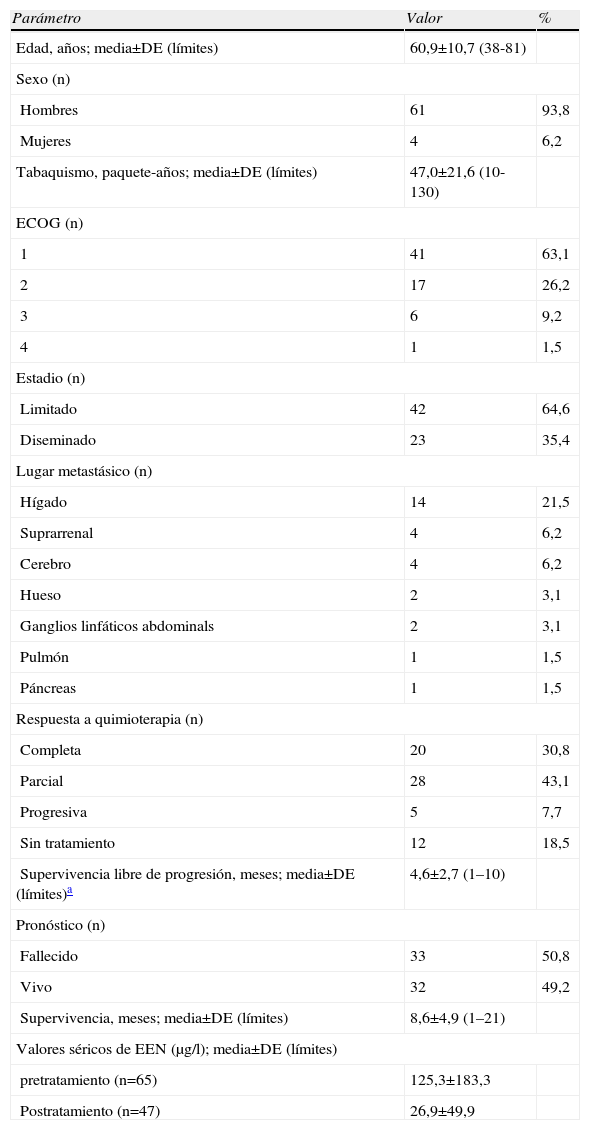
ResultadosSe incluyeron en el estudio 65 pacientes. Sus características generales se presentan en la tabla 1. La combinación de etopósido y cisplatino se administró a 51 pacientes (78,5%) y 14 pacientes (21,5%) recibieron una combinación de carboplatino y etopósido. Se administró un total de 4–6 ciclos de quimioterapia a 56 pacientes. Antes de completarla 7 pacientes fallecieron de la enfermedad. En 2 la quimioterapia se interrumpió debido a la toxicidad relacionada con el tratamiento. Recibieron quimioterapia de segunda línea 12 pacientes, uno recibió quimioterapia de tercera línea y un paciente se sometió a electrocauterización endobronquial. El seguimiento mediano fue de 12 meses tras el diagnóstico inicial. Recibieron irradiación craneal profiláctica 14 pacientes.
Características demográficas y clínicas de pacientes con cáncer de pulmón microcítico
| Parámetro | Valor | % |
| Edad, años; media±DE (límites) | 60,9±10,7 (38-81) | |
| Sexo (n) | ||
| Hombres | 61 | 93,8 |
| Mujeres | 4 | 6,2 |
| Tabaquismo, paquete-años; media±DE (límites) | 47,0±21,6 (10-130) | |
| ECOG (n) | ||
| 1 | 41 | 63,1 |
| 2 | 17 | 26,2 |
| 3 | 6 | 9,2 |
| 4 | 1 | 1,5 |
| Estadio (n) | ||
| Limitado | 42 | 64,6 |
| Diseminado | 23 | 35,4 |
| Lugar metastásico (n) | ||
| Hígado | 14 | 21,5 |
| Suprarrenal | 4 | 6,2 |
| Cerebro | 4 | 6,2 |
| Hueso | 2 | 3,1 |
| Ganglios linfáticos abdominals | 2 | 3,1 |
| Pulmón | 1 | 1,5 |
| Páncreas | 1 | 1,5 |
| Respuesta a quimioterapia (n) | ||
| Completa | 20 | 30,8 |
| Parcial | 28 | 43,1 |
| Progresiva | 5 | 7,7 |
| Sin tratamiento | 12 | 18,5 |
| Supervivencia libre de progresión, meses; media±DE (límites)a | 4,6±2,7 (1–10) | |
| Pronóstico (n) | ||
| Fallecido | 33 | 50,8 |
| Vivo | 32 | 49,2 |
| Supervivencia, meses; media±DE (límites) | 8,6±4,9 (1–21) | |
| Valores séricos de EEN (μg/l); media±DE (límites) | ||
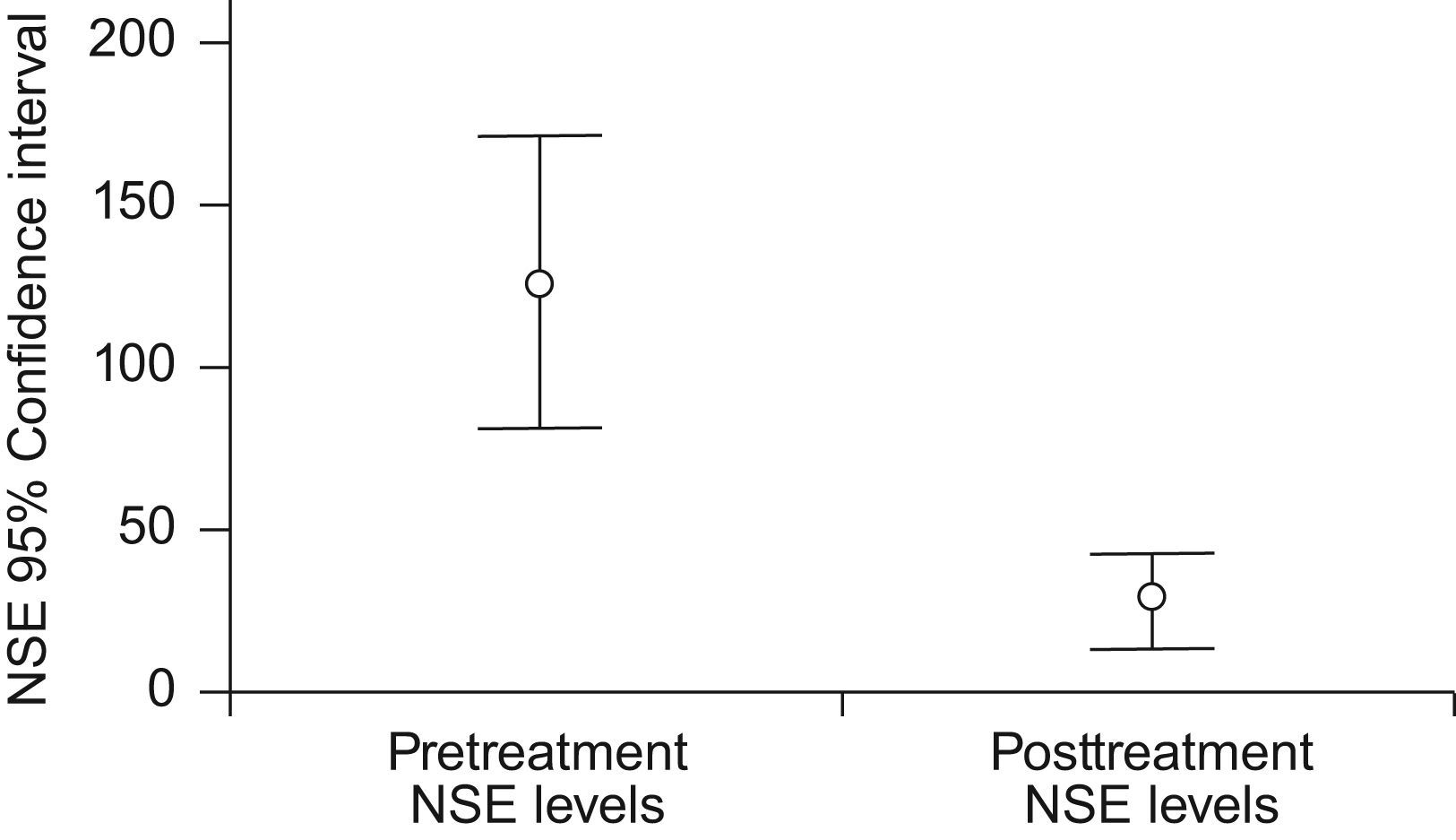
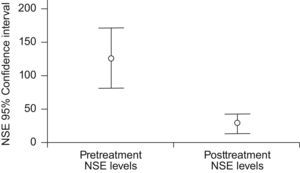
| pretratamiento (n=65) | 125,3±183,3 | |
| Postratamiento (n=47) | 26,9±49,9 | |
DE: desviación estándar; ECOG: Eastern Cooperative Oncology Group; EEN: enolasa específica de neurona.
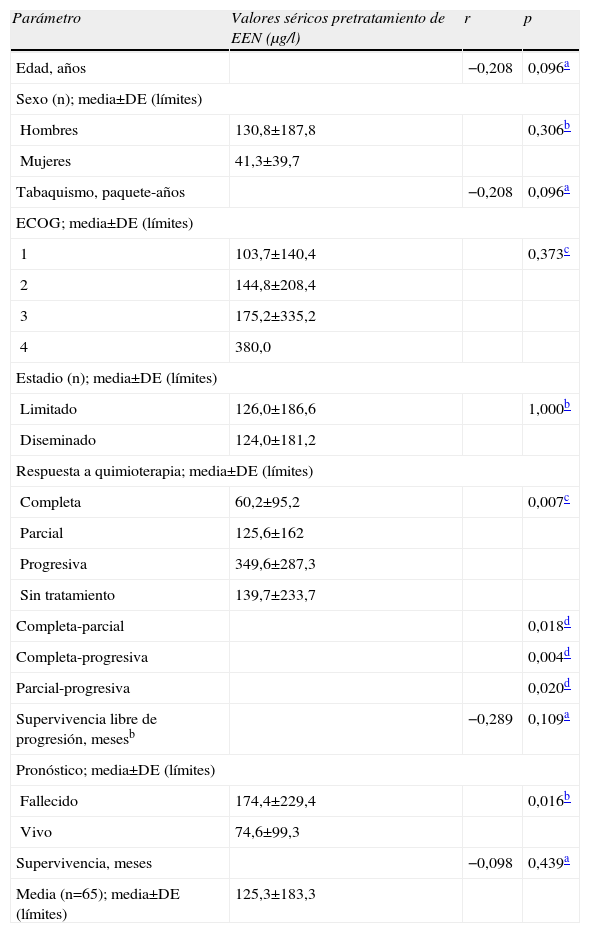
Los valores séricos pretratamiento de EEN se determinaron en todos los pacientes mientras que los valores postratamiento se determinaron en 47 casos (fig. 1). Los valores pretratamiento no se correlacionaron con la edad, sexo, antecedentes de tabaquismo (paquete-años), estado general, supervivencia libre de progresión y supervivencia global. Los valores de EEN fueron significativamente más altos en pacientes que fallecieron de la enfermedad. Los valores pretratamiento fueron significativamente más bajos en pacientes que respondieron al tratamiento (tabla 2).
Valores séricos pretratamiento de enolasa específica de neurona (EEN) de acuerdo con las características de la enfermedad y de los pacientes, y respuesta a la quimioterapia
| Parámetro | Valores séricos pretratamiento de EEN (μg/l) | r | p |
| Edad, años | −0,208 | 0,096a | |
| Sexo (n); media±DE (límites) | |||
| Hombres | 130,8±187,8 | 0,306b | |
| Mujeres | 41,3±39,7 | ||
| Tabaquismo, paquete-años | −0,208 | 0,096a | |
| ECOG; media±DE (límites) | |||
| 1 | 103,7±140,4 | 0,373c | |
| 2 | 144,8±208,4 | ||
| 3 | 175,2±335,2 | ||
| 4 | 380,0 | ||
| Estadio (n); media±DE (límites) | |||
| Limitado | 126,0±186,6 | 1,000b | |
| Diseminado | 124,0±181,2 | ||
| Respuesta a quimioterapia; media±DE (límites) | |||
| Completa | 60,2±95,2 | 0,007c | |
| Parcial | 125,6±162 | ||
| Progresiva | 349,6±287,3 | ||
| Sin tratamiento | 139,7±233,7 | ||
| Completa-parcial | 0,018d | ||
| Completa-progresiva | 0,004d | ||
| Parcial-progresiva | 0,020d | ||
| Supervivencia libre de progresión, mesesb | −0,289 | 0,109a | |
| Pronóstico; media±DE (límites) | |||
| Fallecido | 174,4±229,4 | 0,016b | |
| Vivo | 74,6±99,3 | ||
| Supervivencia, meses | −0,098 | 0,439a | |
| Media (n=65); media±DE (límites) | 125,3±183,3 | ||
DE: desviación estándar; ECOG: Eastern Cooperative Oncology Group; EEN: enolasa específica de neurona.
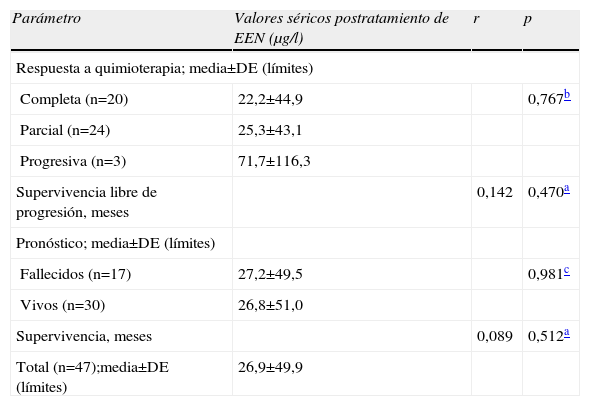
No se identificó una relación significativa entre los valores postratamiento y la respuesta a la quimioterapia, supervivencia libre de progresión, supervivencia global y pronóstico de los pacientes (tabla 3). El cambio entre los valores pre y postratamiento no se relacionó significativamente con la respuesta al tratamiento, supervivencia libre de progresión y supervivencia global (tabla 4).
Valores séricos postratamiento de enolasa específica de neurona (EEN) de acuerdo con la respuesta a la quimioterapia y pronóstico
| Parámetro | Valores séricos postratamiento de EEN (μg/l) | r | p |
| Respuesta a quimioterapia; media±DE (límites) | |||
| Completa (n=20) | 22,2±44,9 | 0,767b | |
| Parcial (n=24) | 25,3±43,1 | ||
| Progresiva (n=3) | 71,7±116,3 | ||
| Supervivencia libre de progresión, meses | 0,142 | 0,470a | |
| Pronóstico; media±DE (límites) | |||
| Fallecidos (n=17) | 27,2±49,5 | 0,981c | |
| Vivos (n=30) | 26,8±51,0 | ||
| Supervivencia, meses | 0,089 | 0,512a | |
| Total (n=47);media±DE (límites) | 26,9±49,9 | ||
DE: desviación estándar; EEN: enolasa específica de neurona.
Cambio de los valores séricos entre el intervalo pre y postratamiento de enolasa específica de neurona (EEN) de acuerdo con la respuesta a la quimioterapia
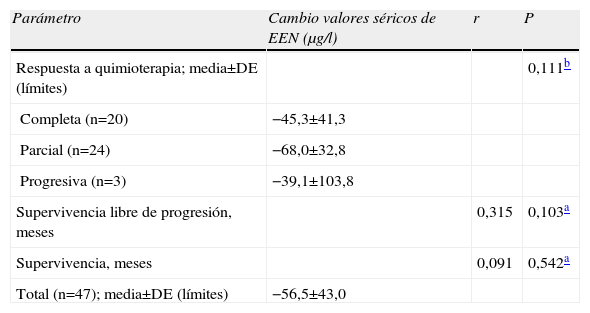
| Parámetro | Cambio valores séricos de EEN (μg/l) | r | P |
| Respuesta a quimioterapia; media±DE (límites) | 0,111b | ||
| Completa (n=20) | −45,3±41,3 | ||
| Parcial (n=24) | −68,0±32,8 | ||
| Progresiva (n=3) | −39,1±103,8 | ||
| Supervivencia libre de progresión, meses | 0,315 | 0,103a | |
| Supervivencia, meses | 0,091 | 0,542a | |
| Total (n=47); media±DE (límites) | −56,5±43,0 |
DE: desviación estándar; EEN: enolasa específica de neurona.
Se efectuó un análisis de regresión de Cox con un modelado mediante el procedimiento backward (razón de verosimilitud [LR]). El modelo usado incluyó los factores que afectaron a la supervivencia como la edad, sexo, estadio de la enfermedad, puntuación ECOG, valores séricos pretratamiento de EEN y cambio de los valores entre el intervalo pretratamiento y postratamiento. El factor más importante que afectó a la supervivencia fue el valor sérico pretratamiento del marcador (p=0,013; cociente de riesgo [CR]=1,002; intervalo de confianza [IC] del 95% ,1,001–1,004).
DiscusiónEn la práctica clínica, un marcador tumoral ideal es apropiado para el examen de cribado y el diagnóstico precoz y puede valorar el pronóstico y supervisar los efectos del tratamiento y el seguimiento. La EEN es uno de los marcadores tumorales de uso más difundido en pacientes con cáncer de pulmón microcítico. Sus valores séricos son altos en casi el 75% de pacientes con este tumor en el momento del diagnóstico inicial11,12. A pesar de la elevada frecuencia de un aumento de sus valores en pacientes con la enfermedad, los datos no son concluyentes por lo que respecta a su valor predictivo para la extensión de la enfermedad13,14, correlación con la respuesta clínica15,16, distinción de una respuesta completa de una parcial14,17, predicción de recidivas15,16 y correlación con la supervivencia13,16.
En general, se ha identificado que unos valores bajos de este marcador se asocian con una respuesta completa y una supervivencia prolongada en pacientes que se someten a quimioterapia5. En el presente estudio, los valores séricos pretratamiento de los pacientes con una respuesta satisfactoria a la quimioterapia fueron significativamente más bajos. En aquellos con una respuesta completa comparado con aquellos con una respuesta parcial, al igual que en aquellos con una respuesta parcial en comparación con aquellos con progresión de la enfermedad, se identificaron valores séricos significativamente más bajos. Los valores séricos postratamiento no se asociaron con la respuesta a la quimioterapia.
También se ha investigado la relación entre los valores séricos de este marcador y la presencia o no de enfermedad metastásica. Quoix y et al13 describieron que los valores de EEN fueron significativamente más altos en pacientes con enfermedad diseminada que en aquellos con enfermedad limitada. Además, sugirieron que el valor predictivo de los valores de este marcador era mayor cuando se evaluaba junto con la concentración de lactato deshidrogenasa. Van de Pol y et al11 describieron que los valores del marcador no fueron significativamente diferentes de acuerdo con la presencia de enfermedad metastásica o del lugar de las metástasis extratorácicas. Los resultados del presente estudio demostraron que los valores séricos de EEN no fueron significativamente diferentes entre pacientes con enfermedad diseminada y limitada.
Se ha documentado que la EEN es un factor pronóstico independiente para la supervivencia del cáncer de pulmón microcítico3. Bonner et al18 describieron que los valores pretratamiento y los valores mínimos inducidos por el tratamiento fueron variables pronósticas independientes del tiempo hasta la progresión y la supervivencia en pacientes con este cáncer. Los valores del marcador previos al tratamiento se correlacionaron inversamente con el tiempo hasta la progresión y la supervivencia en pacientes con la enfermedad. Los valores postratamiento no se relacionaron con la respuesta a la quimioterapia, supervivencia libre de progresión, supervivencia global, y pronóstico de los pacientes. Además, el cambio entre los valores pre y postratamiento no se relacionó con la respuesta a la quimioterapia, supervivencia libre de progresión, y supervivencia global.
Los valores séricos de EEN no son un marcador tumoral útil para predecir las recidivas19. Wójcik et al20 describieron una relación significativa entre la supervivencia libre de enfermedad y los valores iniciales en pacientes con cáncer de pulmón microcítico. Se ha descrito que el seguimiento de los valores en pacientes con la enfermedad es una variable pronóstica satisfactoria de actividad tumoral; no obstante, los valores no predicen los lugares de las lesiones metastásicas11. En el presente estudio, los valores séricos determinados en los periodos tanto pre como postratamiento no se relacionaron con la supervivencia libre de progresión.
Se ha destacado que diversos marcadores se asocian con el pronóstico de cáncer de pulmón microcítico. Uno de ellos, el oncogén ERBB2, se asocia con la presencia de enfermedad diseminada21. En pacientes con cáncer de pulmón microcítico los valores séricos de EEN suelen ser altos. Este aumento ha propiciado la realización de muchos estudios sobre extensión de la enfermedad, respuesta a la quimioterapia, recidiva, supervivencia libre de progresión y supervivencia global11,12. En comparación con otros estudios, en el presente estudio, se determinaron de los valores séricos pre y postratamiento para la predicción del pronóstico de pacientes con la enfermedad. Sin embargo, el presente estudio adolece de algunas limitaciones. En primer lugar, se efectuó con carácter abierto. Esto podría entrañar un sesgo durante el análisis de los datos. En segundo lugar, incluyó una muestra de pacientes a pequeña escala con diferentes estadios de la enfermedad. Los valores séricos pretratamiento no se relacionaron con la edas, sexo, antecedentes de tabaquismo, extensión de la enfermedad, estado general, supervivencia libre de progresión y supervivencia global. No obstante, unos valores bajos pretratamiento se relacionaron significativamente con una respuesta satisfactoria a la quimioterapia. De forma parecida, los valores postratamiento y la tasa del cambio entre los valores pre y postratamiento no se relacionaron significativamente con la respuesta a la quimioterapia, supervivencia libre de progresión y supervivencia global.
ConclusionesLos pacientes con cáncer de pulmón microcítico constituyen un problema complejo por las dificultades de obtener una respuesta satisfactoria al tratamiento. Se requiere una investigación adicional que ayude a seleccionar mejor a los pacientes que requieren quimioterapia y opciones de tratamiento adicionales. En este estudio prospectivo, abierto, se compararon los valores pre y postratamiento de EEN en pacientes con la enfermedad que recibieron quimioterapia. Se concluye que los valores séricos de este marcador no se relacionan con el estadio de la enfermedad; no obstante, unos valores séricos bajos previos al tratamiento podrían ser útiles en la predicción de una respuesta satisfactoria a la quimioterapia.
Contribuciones de los autoresAEE efectuó los estudios de genética molecular, participó en la alineación de la secuencia y redactó el manuscrito. AG efectuó los inmunoanálisis. FT participó en la alineación de la secuencia. AEE y OB participaron en el diseño del estudio y efectuaron el análisis estadístico. ZZU y SZG concibieron el estudio y participaron en su diseño y coordinación, y contribuyeron a la redacción del manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.