Introducción
El estudio de las enfermedades del mediastino es a menudo difícil, y con frecuencia las técnicas de imagen como la tomografía axial computarizada (TAC) y la resonancia magnética no pueden establecer el diagnóstico diferencial entre lesiones malignas y benignas sobre la base de los criterios morfológicos de las lesiones1,2. Por otra parte, el diagnóstico de certeza anatomopatológico es imprescindible tanto en la estadificación ganglionar mediastínica previa al tratamiento de los pacientes con carcinoma de pulmón de células no pequeñas (CPCNP) como en la evaluación de pacientes con adenopatías o masas de origen incierto. Por ello, en numerosas ocasiones se requiere la obtención de material citológico o histológico, que obliga a recurrir a técnicas quirúrgicas invasivas, con una morbilidad no despreciable.
La ultrasonografía endoscópica (USE) es una técnica que combina la endoscopia digestiva y la ecografía para conseguir imágenes ecográficas desde el interior del tubo digestivo. Cuando el transductor se encuentra en el interior del esófago, pueden visualizarse las estructuras del mediastino medio y posterior situadas en un radio de 6 cm alrededor del esófago. La punción aspirativa con aguja fina guiada por USE en tiempo real (USE-PAAF) ha demostrado recientemente ser una técnica muy segura y muy eficaz en el diagnóstico de extensión mediastínico del CPCNP y del carcinoma de esófago3-6. Además, en los últimos años se han publicado algunas series sobre su utilidad en el diagnóstico de masas mediastínicas7-9.
El objetivo del presente estudio ha sido evaluar la utilidad de la USE-PAAF para la obtención del diagnóstico citológico de las lesiones mediastínicas en un centro de tercer nivel de nuestro país.
Pacientes y métodos
Entre enero de 2001 y septiembre de 2003 se exploró de forma consecutiva con USE y USE-PAAF a 59 pacientes remitidos para estudio de una lesión mediastínica diagnosticada por TAC o para la estadificación de una neoplasia de esófago o pulmón diagnosticada y confirmada citohistológicamente por las técnicas habituales (endoscopia con biopsias y broncoscopia con biopsia bronquial y/o broncoaspirado, respectivamente). Las exploraciones se realizaron bajo sedación consciente con propofol y remifentanilo, controlada por un anestesiólogo, después de obtener el consentimiento informado de cada paciente y comprobar la normalidad del tiempo de protrombina y del recuento de plaquetas.
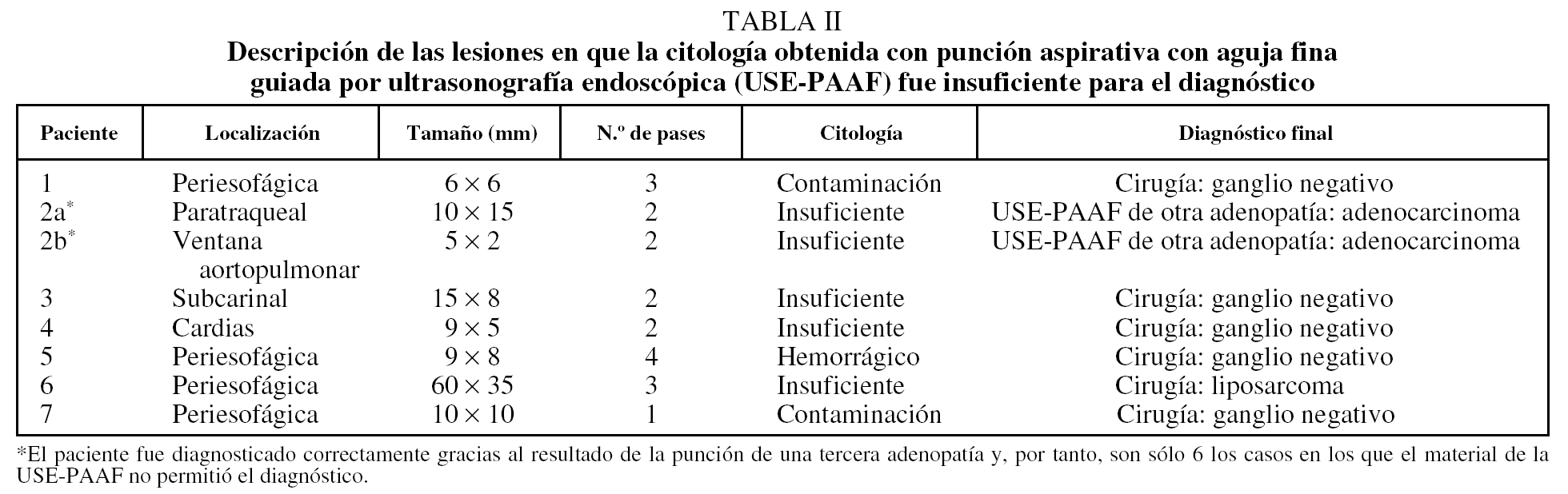
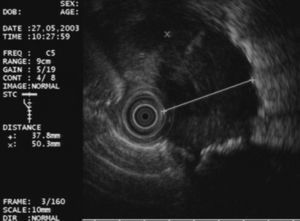
En primer lugar se efectuó una ecoendoscopia diagnóstica usando un ecoendoscopio radial con frecuencias de 5 y 20 MHz (GF UM20 y GF UM160, Olympus America Inc., Melville, NY, EE UU). En todos los casos se realizó una exploración sistemática del mediastino posterior y medio, y de los territorios ganglionares accesibles a la USE (regiones 4R, 4L, 5, 7, 8 y 9) con el fin de identificar y caracterizar morfológicamente las lesiones y establecer la relación entre éstas y las estructuras vecinas (figs. 1 y 2).
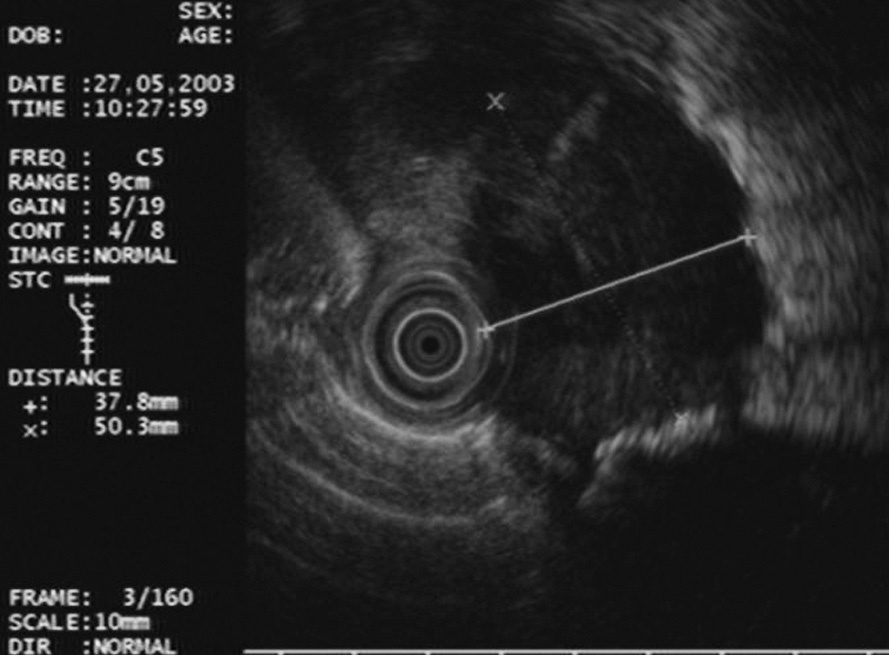
Fig. 1. Masa paraesofágica izquierda de características malignas: heterogénea y mal delimitada. Se trataba de un liposarcoma.
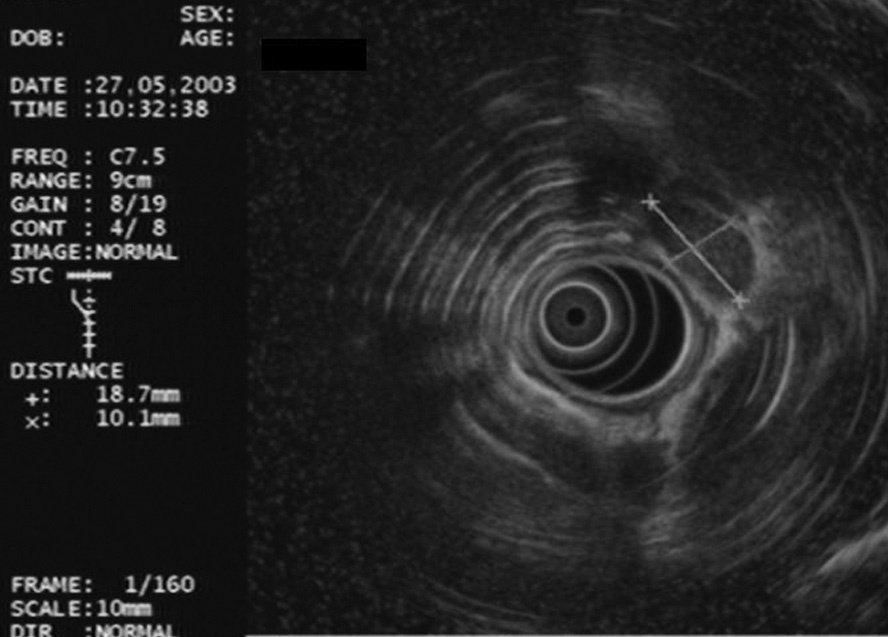
Fig. 2. Adenopatía en la región 4L con características ecográficas de malignidad: redonda, hipoecogénica, bien delimitada y diámetro corto de 1 cm.
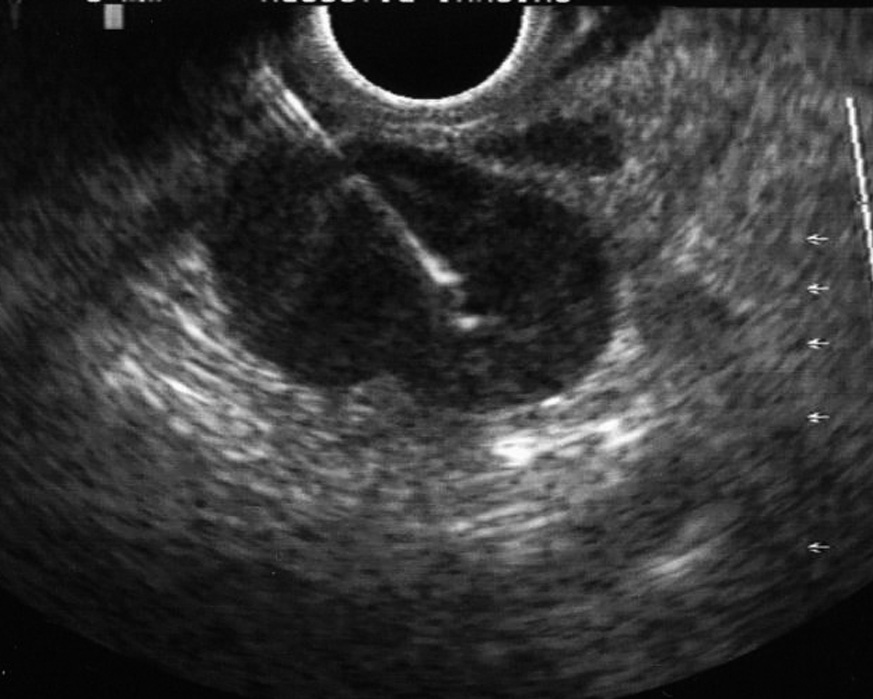
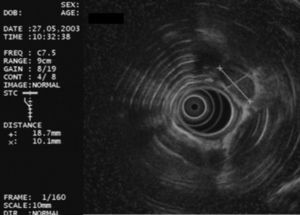
La USE-PAAF se realizó con un ecoendoscopio sectorial (GF UC30P, Olympus America Inc., Melville, NY, EE UU) y una aguja de Wilson Cook de 22 G y 8 cm de longitud (Wilson-Cook Medical Inc., Winston-Salem, NC, EE UU), según la técnica habitual: después de localizar la lesión a estudio con el ecoendoscopio sectorial, se introdujo la aguja a través del canal operativo del ecoendoscopio haciéndola avanzar hasta el interior de la lesión bajo control ultrasonográfico en tiempo real (fig. 3). El uso sistemático de Doppler color permitió descartar la existencia de vasos sanguíneos en el trayecto de la aguja. Tras retirar el estilete central de la aguja (que evita que la muestra obtenida en la punción se contamine con células de la pared del tubo digestivo), se aplicó una presión negativa entre 3 y 5 ml mediante una jeringa de 10 ml acoplada a la empuñadura de la aguja, mientras el ecoendoscopista realizaba movimientos repetidos de avance y retirada de la aguja dentro de la lesión.
Fig. 3. Punción aspirativa con aguja fina guiada por ultrasonografía endoscópica de una adenopatía mediastínica. Puede verse la aguja en el interior de la adenopatía.
Cuando se identificó más de una adenopatía en el mismo territorio ganglionar, se escogió la que tenía mayores probabilidades de ser maligna (mayor tamaño, redonda, bien delimitada e hipoecogénica). En el caso de hallar varias adenopatías en distintos territorios ganglionares, se escogió la que, por su localización, tendría un mayor impacto clínico en caso de ser positiva de malignidad.
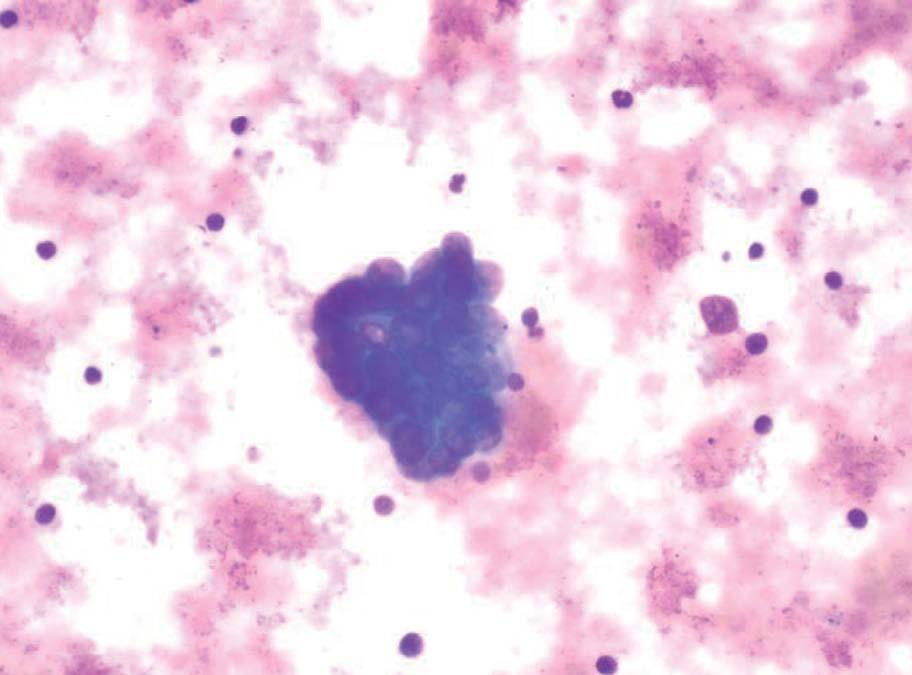
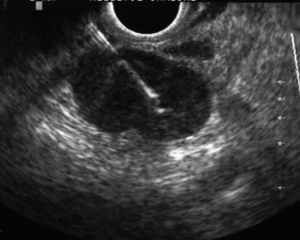
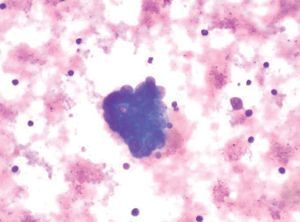
Durante la realización de la USE-PAAF, un citólogo se hallaba presente en la sala de exploración para valorar de forma inmediata la muestra obtenida. Parte de ésta se extendió sobre una laminilla y se tiñó con una tinción rápida (Diff-Quick®, Diagnostic Grifols S.A., España), mientras que el resto del material se conservó en alcohol para su posterior tinción con Papanicolau y en solución salina para procesarla en forma de bloque celular (fig. 4). Se consideró que una lesión era neoplásica cuando se identificaron células malignas, mientras que la ausencia de células malignas junto con la presencia de linfocitos normales se consideró diagnóstica de adenopatía benigna. Para el diagnóstico de tuberculosis se estimó necesaria la identificación de granulomas caseificantes y/o cultivo de Löwenstein positivo. Para el análisis estadístico se consideró positivo cualquier resultado diferente de adenopatía benigna.
Fig. 4. Metástasis de adenocarcinoma.
Se utilizó como referencia la cirugía en los casos operados, y el resultado de la citología obtenida con la USE-PAAF, cuando ésta fue positiva para células malignas, en los casos en que el tratamiento quirúrgico no estaba indicado, tal como se ha hecho de forma clásica en la literatura médica, dado lo insólito de los falsos positivos con esta técnica5,9,10. Cuando la USE-PAAF fue benigna y no se indicó tratamiento quirúrgico, se consideró como referencia el seguimiento clínico durante un año como mínimo y la respuesta al tratamiento tuberculostático en el caso de diagnosticarse tuberculosis.
En los casos en que la lesión fue quística se administró profilaxis antibiótica con ciprofloxacino.
Análisis estadístico
La sensibilidad, la especificidad, la precisión diagnóstica y los valores predictivos positivo y negativo se calcularon según las fórmulas habituales. La comparación de proporciones se hizo con el test de la χ², y para la comparación de medias en series independientes se utilizó la prueba de la t de Student.
Resultados
En total se realizó USE-PAAF a 59 pacientes (50 varones y 9 mujeres), con una edad media ± desviación estándar de 63 ± 10 años (intervalo: 36-82) y un total de 89 lesiones (86 sólidas y 3 quísticas). Las indicaciones fueron las siguientes: estadificación de un carcinoma de pulmón o de esófago ya diagnosticados (24 y 7 casos, respectivamente), el diagnóstico de una lesión mediastínica de etiología desconocida en pacientes con enfermedad maligna (n = 17; sospecha de neoplasia de pulmón pero sin confirmación histológica por otras técnicas; antecedente reciente de una neoplasia ya tratada, o presencia de una neoplasia de localización extramediastínica en el momento del estudio) y el diagnóstico de una lesión mediastínica de etiología desconocida en pacientes sin sospecha de presentar enfermedad maligna (n = 11).
En cuanto a los pacientes remitidos para estadificación de un cáncer de pulmón (n = 24), la lesión primaria se localizó en el pulmón izquierdo en 13 casos (8 en el lóbulo superior y 5 en el inferior) y en el pulmón derecho en 11 (5 en el lóbulo superior, 4 en el inferior y 2 en el medio). En 13 casos la TAC no detectó adenopatías de tamaño significativo. En los 11 casos restantes, la TAC describió la existencia de 18 adenopatías de tamaño patológico que se localizaban en la región subcarinal (n = 7), ventana aortopulmonar (n = 5), periesofágica (n = 4) y paratraqueal (n = 2). Todos los pacientes tenían estudio broncoscópico previo y se había realizado punción transbronquial a ciegas en 2 de 7 adenopatías subcarinales sin haberse demostrado malignidad.
La localización más frecuente de las lesiones fue periesofágica (n = 48), subcarinal (n = 25) y ventana aortopulmonar (n = 13); en 3 casos fue paratraqueal. La media de su tamaño, medido por USE, fue de 2,4 ± 2 × 1,6 ± 1,4 cm (intervalos: 0,6-8 para el diámetro mayor y 0,4-7,1 para el diámetro menor).
El material obtenido por la USE-PAAF fue adecuado y permitió el diagnóstico en 53 de los 59 pacientes (90%) y 81 de las 89 lesiones (91%), correspondientes a 78 lesiones sólidas (adenopatías y masas tumorales) y los 3 quistes; se realizó una media de 2 pases en cada lesión (intervalo: 1-6). En la tabla I se enumeran todos los diagnósticos citológicos que se obtuvieron con la USE-PAAF.
Disponemos de la cirugía como referencia en 23 pacientes (39%) y 36 lesiones (40%), mientras que el resultado de la citología o el seguimiento clínico constituyen la referencia en 26 (44%) y 2 (3%) pacientes y 37 (42%) y 2 (2%) lesiones, respectivamente. Sin embargo, en 8 pacientes, con un total de 14 lesiones, no fue posible el seguimiento, de modo que no hubo referencia (3 pacientes con enfermedad de base benigna y 5 con enfermedad maligna).
El tamaño de las lesiones malignas fue significativamente mayor que el de las benignas (diámetro corto: 2,7 ± 1,4 y 1 ± 0,9 cm, respectivamente; p < 0,001). Todas las lesiones sólidas con un diámetro corto superior a 2,1 cm fueron malignas (n = 15); por el contrario, todas las lesiones con un diámetro corto menor de 0,8 cm fueron benignas (n = 28). Identificamos 5 lesiones en 5 pacientes con un diámetro corto de 1 cm o menor (por tanto, la TAC las hubiera considerado inespecíficas o de baja probabilidad de tener metástasis) que tenían metástasis de un CPCNP.
No hubo ningún caso en que, con un material considerado adecuado para el diagnóstico, la citología no permitiera el diagnóstico. Los casos en que la citología fue insuficiente para establecer el diagnóstico se consideraron falsos negativos 6 pacientes (10%) y 8 lesiones (9%) (tabla II). Sin embargo, en ninguno de los casos la ausencia de diagnóstico citológico condicionó una actitud diferente en cuanto al tratamiento recibido. Así, en un paciente se consiguió el diagnóstico al puncionar otra adenopatía (metástasis de un CPCNP) y, por tanto, recibió tratamiento neoadyuvante. Los otros 5 pacientes con CPCNP y material insuficiente por USE-PAAF fueron operados y las adenopatías mediastínicas fueron negativas en todos los casos. Por último, un paciente con una masa mediastínica de gran tamaño fue operado y el diagnóstico histológico demostró que se trataba de un liposarcoma.
En 30 pacientes (un total de 33 lesiones) se consiguió un diagnóstico de enfermedad, y se consideraron verdaderos positivos, mientras que en 15 pacientes (con 27 lesiones en total) las adenopatías fueron benignas (tabla I). No hubo ningún falso positivo de malignidad. Así, la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión para el diagnóstico de enfermedad de la USE-PAAF en las lesiones fueron del 81, el 100, el 100, el 75 y el 88%, respectivamente (el 88, el 100, el 100, el 80 y el 92% al analizarlos por paciente).
Un paciente presentó fiebre autolimitada y otro una crisis hipertensiva que requirió tratamiento; éstas fueron las 2 únicas complicaciones después del procedimiento.
Discusión
Los carcinomas de esófago y de pulmón tienen una incidencia elevada y, debido a que en el momento del diagnóstico se encuentran en más de la mitad de los casos en fases avanzadas, su pronóstico es muy malo. Los tratamientos actuales se basan en la estadificación según el TNM en el momento del diagnóstico, y ello es especialmente relevante en el carcinoma escamoso de esófago y en el CPCNP, que son tumores en los que la cirugía ofrece la mayor probabilidad de curación. En estos casos, la detección de adenopatías mediastínicas metastásicas comportará un cambio en la estrategia terapéutica, que puede pasar de la cirugía directa al tratamiento neoadyuvante seguido o no de cirugía y, en algunos casos, al tratamiento paliativo11. Las adenopatías mediastínicas son también frecuentes en afecciones benignas como la tuberculosis, histoplamosis, sarcoidosis, antracosis y silicosis12,13, y otras enfermedades malignas extratorácicas14,15.
La utilidad de la USE-PAAF ha quedado ampliamente demostrada en el estudio de las enfermedades intraabdominales16-18. También se han publicado algunos estudios que demuestran su eficacia en el estudio de las enfermedades mediastínicas posteriores e inferiores7-9, donde se han descrito unos resultados similares a los obtenidos en el abdomen. En un estudio reciente se demuestra que la USE-PAAF es superior a la aplicación de los criterios ecográficos de malignidad en la identificación de adenopatías mediastínicas malignas y se concluye que es necesario proceder siempre a la confirmación histológica19. En este sentido, la USE-PAAF no sólo es menos invasiva y se asocia a menor morbilidad que otras técnicas como la mediastinoscopia, sino que además es menos costosa, ya que, mientras que la mediastinoscopia requiere anestesia general y hospitalización en la mayoría de los casos, la USE-PAAF se realiza bajo sedación consciente y en régimen ambulatorio20.
En nuestro estudio, hasta 37 adenopatías tenían un diámetro corto inferior a 1 cm y 5 de ellas fueron malignas (5,6%). Este dato es muy importante, ya que el diagnóstico por TAC de adenopatías metastásicas en el CPCNP se basa en el criterio del tamaño (diámetro corto ≥1 cm o≥ 1,2 cm si la localización es subcarinal) con una precisión diagnóstica del 41-49%4,21. Por el contrario, varios estudios sobre la utilidad de la USE-PAAF en la estadificación del CPCNP han descrito una precisión diagnóstica de hasta el 97%5,22. Se han descrito resultados similares con la PAAF guiada por ecografía transbronquial, cuya precisión diagnóstica oscila entre el 89 y el 97%23,24. Sin embargo, esta precisión es algo menor en los casos en que previamente la TAC no describe ninguna adenopatía valorable (70%)25, con una sensibilidad y especificidad del 50 y el 100%, respectivamente26. Hay pocos estudios que hayan comparado estas 2 técnicas, pero con los resultados preliminares de que disponemos se intuye que ambos procedimientos son complementarios, ya que, mientras la PAAF guiada por ecografía transbronquial accede mejor a las lesiones paratraqueales anteriores, subcarinales y traqueobronquiales, la USE-PAAF lo hace a las adenopatías paraesofágicas y de la ventana aortopulmonar. En un estudio reciente que compara la eficacia global de las 2 técnicas en las regiones ganglionares accesibles a ambas se obtiene una precisión global del 95%27.
El material obtenido con la USE-PAAF fue adecuado y permitió el diagnóstico en 53 de 59 pacientes (90%) y 81 de 89 lesiones (91%), resultados similares a los publicados en la literatura médica9,28 y con una media de pases similar a la descrita cuando se realiza punción de adenopatías abdominales16,17, pero mejor que la comunicada por algunos autores en algunas series de punciones de adenopatías mediastínicas10. Una de las explicaciones para estos buenos resultados es la presencia del citólogo en la sala de exploración29.
En nuestra serie no hubo falsos positivos, todos los falsos negativos fueron casos en que la citología había sido insuficiente para hacer un diagnóstico y en ninguno de ellos cambió la estrategia terapéutica. Además, la tasa de falsos negativos fue muy inferior al 20% descrito en otras series10.
En lo referente a las lesiones quísticas, existe consenso en cuanto a que, en general, no deben puncionarse por el riesgo de complicaciones. Sin embargo, en algunos casos el aspecto morfológico atípico, la presencia de una enfermedad de base que pueda estar relacionada u otras circunstancias especiales pueden hacer no sólo justificable sino imprescindible la punción. De los 3 pacientes de nuestra serie con lesiones quísticas, uno presentaba un quiste broncogénico repleto de material denso que le confería el aspecto de tumoración sólida; el segundo presentaba un gran seudoquiste de páncreas con importante extensión mediastínica, que ocasionaba disfagia y obligó a plantear tratamiento quirúrgico, por lo que se consideraron indicadas todas las maniobras diagnósticas previas a una decisión terapéutica tan agresiva. Finalmente, el tercer paciente estaba diagnosticado de leucemia linfoblástica crónica y la lesión quística mediastínica resultó ser una adenopatía patológica con componente quístico. Si la punción se considera necesaria, las complicaciones infecciosas pueden evitarse realizando profilaxis antibiótica (habitualmente con ciprofloxacino)30.
En conclusión, la USE-PAAF es una técnica eficaz y segura en el estudio de las afecciones mediastínicas y permite el diagnóstico citológico de adenopatías no valorables por la TAC por su pequeño tamaño. La probabilidad de malignidad es mayor cuanto mayor es el tamaño de la lesión a estudio.
Estudio financiado en parte con una beca del Instituto de Salud Carlos III (03/10066).
Correspondencia:
Dra. A. Ginés.
Unidad de Endoscopia. Institut de Malalties Digestives. Hospital Clínic.
Villarroel, 170. 08036 Barcelona. España.
Correo electrónico: magines@clinic.ub.es
Recibido: 22-2-2006; aceptado para su publicación: 19-9-2006.