Introducción
Las micobacterias (taxonómicamente referidas como género Mycobacterium) incluyen un grupo de poco más de 100 especies de microorganismos débilmente grampositivos. Aunque la mayoría de estas especies son saprofitas, algunas son patógenas para el ser humano y otros animales. Todas las especies del género presentan una pared celular compleja, extraordinariamente rica en lípidos, que les confiere la propiedad de acidorresistencia. Mientras que las especies no patógenas son de crecimiento rápido, las patógenas se caracterizan por su lento crecimiento, con tiempos de generación que varían de 12 a 24 h.
Las especies que causan enfermedad natural en humanos o animales pertenecen a los denominados: a) complejo Mycobacterium tuberculosis (M. tuberculosis, M. bovis, M. canetti, M. africanum y M. microti), y b) complejo Mycobacterium avium-intracellulare (M. avium subsp. avium, M. avium subsp. paratuberculosis, M. avium subsp. silvaticum y M. intracellulare). Entre dichas especies, sin duda M. tuberculosis es el principal patógeno estricto que causa la tuberculosis en humanos, seguido de M. bovis, mientras que M. avium subsp. avium y M. intracellulare son causa de enfermedad pulmonar en personas inmunodeprimidas; se estima que hasta el 70% de los pacientes con infección por el virus de la inmunodeficiencia-sida (CD4+ ≤50/μl) presentan infección por alguno de estos oportunistas1.
La tuberculosis pulmonar es la forma más común de tuberculosis, así como la forma más importante en términos epidemiológicos. Se trata de una enfermedad pulmonar infectocontagiosa de naturaleza crónica, que afecta a seres humanos de todas las edades. Se estima que una tercera parte de la población mundial se encuentra infectada con el bacilo de Koch y, según cifras oficiales de la Organización Mundial de Salud, hay aproximadamente 8 millones de nuevos casos de tuberculosis cada año y 2 millones de muertes por dicha enfermedad2. A pesar de la amplia disponibilidad de la vacuna antituberculosa (BCG), la incidencia ha ido en aumento. Además, se ha cuestionado la eficacia de dicha vacuna3,4, aunque está claro que las personas vacunadas tienen menor riesgo de desarrollar las formas extrapulmonares de la enfermedad, especialmente en el caso de la tuberculosis meníngea en los niños5,6.
En México las cifras oficiales de la Secretaría de Salud indican que la tuberculosis ocupa el lugar 17 como causa de muerte en la población general en edad productiva, pero, al igual que en el resto del mundo, M. tuberculosis es el microorganismo que ocasiona el mayor número de defunciones por sí solo. Hasta la semana 28 del año 2006 se notificaron 7.257 casos nuevos de tuberculosis pulmonar y 76 casos nuevos de meningitis tuberculosa en México7; la Organización Mundial de la Salud informa de una prevalencia de 53 casos por cada 100.000 habitantes en las Américas en general2.
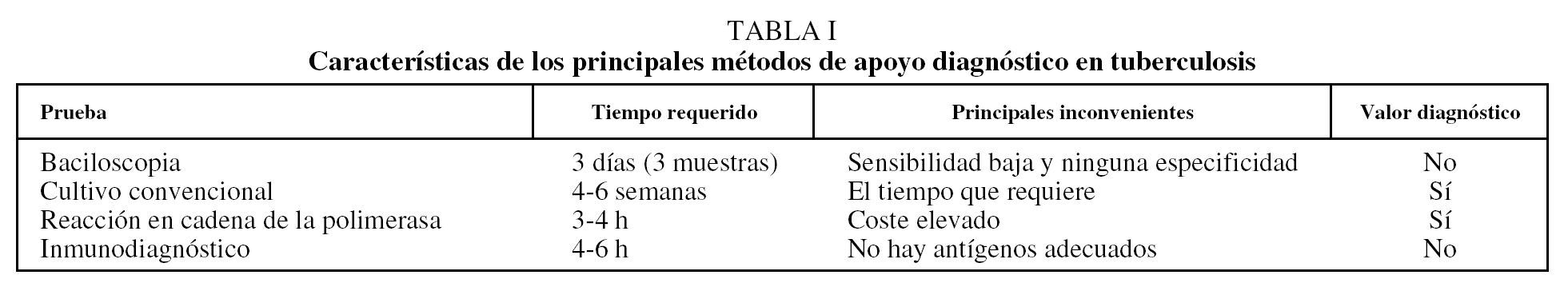
Tradicionalmente el diagnóstico de sospecha de la tuberculosis pulmonar se establece en individuos con tos crónica y evidencia radiológica de lesiones pulmonares, que con mayor frecuencia se presentan en la zona apical del pulmón derecho. Una vez agotados los criterios clínicos, el diagnóstico por pruebas de laboratorio continúa con la baciloscopia en esputo para demostrar la presencia de bacilos ácido-alcohol resistentes8, y para el diagnóstico definitivo se cultiva e identifica la especie infectante a partir de las secreciones bronquiales del paciente9. Sin embargo, a pesar de la variedad de estrategias disponibles en la actualidad, su valor diagnóstico es muy variable (tabla I). Aun sin considerar el tiempo necesario para llevar a cabo las pruebas de sensibilidad a los antimicrobianos, el diagnóstico microbiológico de la tuberculosis requiere de 6 a 8 semanas, un tiempo considerablemente largo para retrasar la instauración del tratamiento con antifímicos (o antituberculosos). Por otro lado, la prescripción de los fármacos sin esperar a los resultados de sensibilidad in vitro, así como la falta de cumplimiento del tratamiento por parte de los pacientes, ha favorecido el surgimiento de resistencia a múltiples fármacos en cepas de M. tuberculosis. También es importante puntualizar que otros factores ajenos al diagnóstico de la infección, como el acceso a los servicios de salud, la atención médica oportuna, entre otros, también influyen negativamente en el control de la pandemia10.
Además de la rigurosa aplicación del tratamiento acortado y estrictamente supervisado, es imperativo el desarrollo y aplicación de nuevas estrategias que permitan el diagnóstico oportuno de la enfermedad, particularmente de métodos de bajo coste que permitan abordar la problemática de la tuberculosis desde una perspectiva poblacional. A continuación se presentan las estrategias en desarrollo que resultan más prometedoras para el diagnóstico y seguimiento epidemiológico de la tuberculosis: a) los métodos inmunológicos para la detección de anticuerpos circulantes en el paciente (diagnóstico serológico), y b) los métodos moleculares para la identificación y genotipificación de aislamientos clínicos de M. tuberculosis.
Métodos inmunológicos
Los métodos inmunológicos en estudio más comunes para el diagnóstico de la tuberculosis se basan en la detección de anticuerpos séricos formados contra antígenos de Mycobacterium, los cuales pueden ser proteínas, lípidos o hidratos de carbono, o bien en la identificación de antígenos específicos del bacilo en secreciones del paciente mediante el uso de anticuerpos monoclonales generados ex vivo.
Pruebas basadas en la detección de anticuerpos
Los análisis basados en la detección de anticuerpos contra M. tuberculosis constituyen una alternativa muy importante a los métodos tradicionales para el diagnóstico de la tuberculosis activa, ya que detectan la respuesta inmunológica que se organiza ante la infección, y que no existe o se encuentra disminuida en los individuos infectados asintomáticos (con tuberculosis latente). Además, la clase de inmunoglobulina que se detecte (IgG o IgM) podría indicar si el proceso infeccioso se encuentra o no en curso. Otras ventajas de los métodos serológicos es que son sencillos de realizar, de bajo coste, no invasivos, etc. Sin embargo, una de las principales limitaciones del diagnóstico serológico es la carencia de antígenos altamente específicos y sensibles, como se describe a continuación.
En el enzimoinmunoanálisis (ELISA), o en una simplificación de éste (Dot-ELISA), se adsorben antígenos de M. tuberculosis en una fase sólida para llevar a cabo la captura de anticuerpos específicos contra la micobacteria a partir del suero de los pacientes. La captura del anticuerpo se pone de manifiesto mediante el empleo de un segundo anticuerpo conjugado con una enzima (frecuentemente peroxidasa), que al reaccionar con su sustrato (H2O2) permite revelar la reacción antígeno-anticuerpo. Desafortunadamente, para la realización de esta prueba no es posible emplear un extracto total de las proteínas del bacilo, ya que en las poblaciones que son vacunadas sistemáticamente (como en México) se encuentra reactividad cruzada contra antígenos de la cepa vacunal (M. bovis-BCG) e incluso contra antígenos de las micobacterias saprofitas que son abundantes en el medio ambiente.
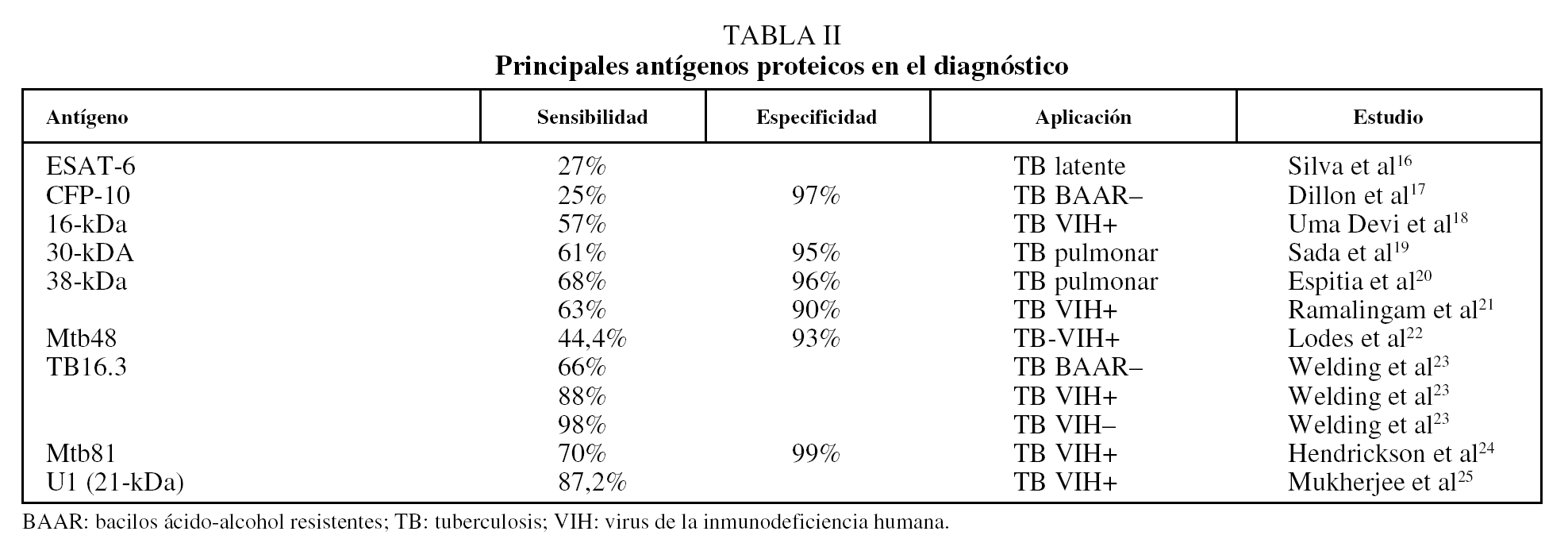
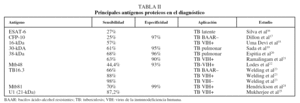
Anticuerpos antiproteínas. Una alternativa ha consistido en emplear antígenos purificados de M. tuberculosis para limitar la reactividad cruzada. Sin embargo, para la mayoría de los antígenos inmunodominantes, la respuesta humoral, aunque es muy intensa, resulta bastante heterogénea entre los pacientes tuberculosos14, de modo que no hay un antígeno que sea reconocido sistemáticamente por todos ellos. Empleando uno de los antígenos más prometedores para el serodiagnóstico, la proteína de 38 kDa, se alcanza una sensibilidad de alrededor del 80% en pacientes con baciloscopias positivas, pero sólo de aproximadamente un 15% en el caso de pacientes con baciloscopias negativas15. Desde luego, uno de los grandes retos es disponer de una estrategia que permita diagnosticar rápidamente los casos de tuberculosis pulmonar con bacilos ácido-alcohol resistentes negativos, así como los casos de tuberculosis extrapulmonar, en los que la baciloscopia carece de utilidad. En la tabla II se recogen los principales antígenos proteicos utilizados para el diagnóstico16-25.
Para ampliar la sensibilidad y especificidad que se alcanzan con los antígenos puros se ha propuesto utilizar una mezcla de varios antígenos inmunodominantes a fin de cubrir toda la gama de respuestas que se dan entre los individuos de una población. En este sentido, mediante un panel de 9 antígenos (ESAT-6, 14-kDa, MPT63, 19-kDa, MPT64, MPT51, MTC28, 30-kDa, 38-kDa y KatG) se consiguió una sensibilidad del 90%14. Una de las ventajas de emplear antígenos proteicos para el inmunodiagnóstico es que éstos pueden producirse mediante la tecnología del ADN recombinante, lo que permite su expresión y purificación a gran escala, con el consiguiente abaratamiento de los costes de la prueba. Entre los antígenos recombinantes más innovadores que se han probado para el inmunodiagnóstico de la tuberculosis destaca una poliproteína recombinante multiepítope (TbF6), expresada en Escherichia coli como proteína de fusión, que incluye regiones antigénicas de las proteínas Mtb8, 38-kDa, Mtb11 y Mtb48, y con la que se alcanzó una sensibilidad del 94%25,26.
Sin embargo, no solamente los antígenos proteicos son candidatos a ser considerados para el inmunodiagnóstico. La pared celular de M. tuberculosis es extraordinariamente rica en lípidos, glucolípidos y azúcares complejos para los que se ha demostrado que se organiza una respuesta inmunitaria humoral durante la infección27-28.
Anticuerpos antilípidos. Entre los lípidos y glucolípidos de la pared celular de M. tuberculosis destaca el grupo de los lípidos de trealosa diaciltrealosa (DAT), triaciltrealosa (TAT), monomicolato de trealosa (MMT), dimicolato de trealosa (DMT) y los sulfolípidos (SL-1), para los que se ha demostrado, tanto en individuos tuberculosos como en modelos murinos de infección, que se producen anticuerpos específicos de las clases IgM, IgA e IgG29-32. Esto permite el diseño de métodos diagnósticos en los que se utilizan antígenos lipídicos purificados adsorbidos en una matriz sólida para la búsqueda de anticuerpos específicos en el suero de los pacientes. Algunos de estos antígenos ya han demostrado su utilidad, como es el caso de la TAT, con la que se han alcanzando valores de sensibilidad y especificidad superiores a los obtenidos con antígenos proteicos (tabla III)31-38. Una ventaja adicional que representa la utilización de antígenos lipídicos es que la respuesta humoral no es tan heterogénea como con los antígenos proteicos.
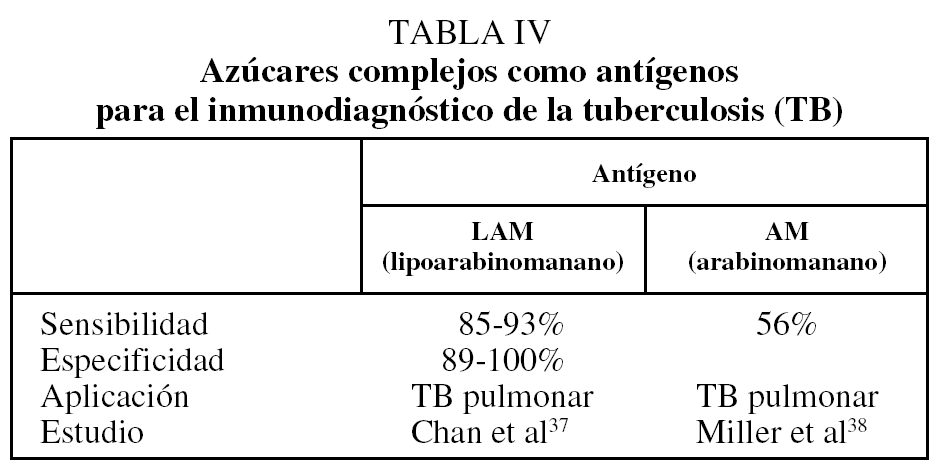
Anticuerpos antiazúcares. El lipoarabinomanano (LAM) y sus precursores biosintéticos, los fosfatidilinositolmanósidos (PIM), también se encuentran abundantemente en la pared celular de M. tuberculosis, y asimismo se ha demostrado que durante la infección activa se producen anticuerpos de las clases IgM e IgG contra estos glucoconjugados34-35. Es de particular importancia destacar que, aunque el LAM se encuentra ampliamente distribuido en las diferentes especies del género Mycobacterium, la estructura fina de la molécula en su parte más externa es diferente en las especies patógenas y saprofitas36. Las especies patógenas de crecimiento lento (M. tuberculosis, M. bovis, M. avium, M. leprae, etc.) presentan glucosilación terminal con residuos de manosa (manLAM), mientras que en las especies saprofitas de crecimiento rápido (M. fortuitum, M. smegmatis, etc.) la fina estructura de la parte más externa está formada por residuos de arabinosa (araLAM) o no existe. Esto abre la posibilidad de que la respuesta humoral dirigida contra el LAM de las micobacterias patógenas pueda diferenciarse de la que se genera por el contacto con las especies saprofitas (no virulentas). Con el empleo del LAM se han alcanzado valores de sensibilidad del 85 al 93%37. Otro de los azúcares que se han probado como antígenos para el inmunodiagnóstico es el arabinomanano, con el que se ha tenido muy poco éxito porque es estructuralmente muy similar entre las micobacterias, aunque se ha demostrado que se desencadena una respuesta humoral durante la infección (tabla IV)37,38. Desafortunadamente, el uso de lípidos y azúcares complejos como antígenos para el serodiagnóstico tiene el inconveniente de requerir el cultivo de M. tuberculosis y la purificación de dichos antígenos, algunos de los cuales se encuentran en muy escasa cantidad en la pared del bacilo.
Pruebas basadas en la detección de antígenos
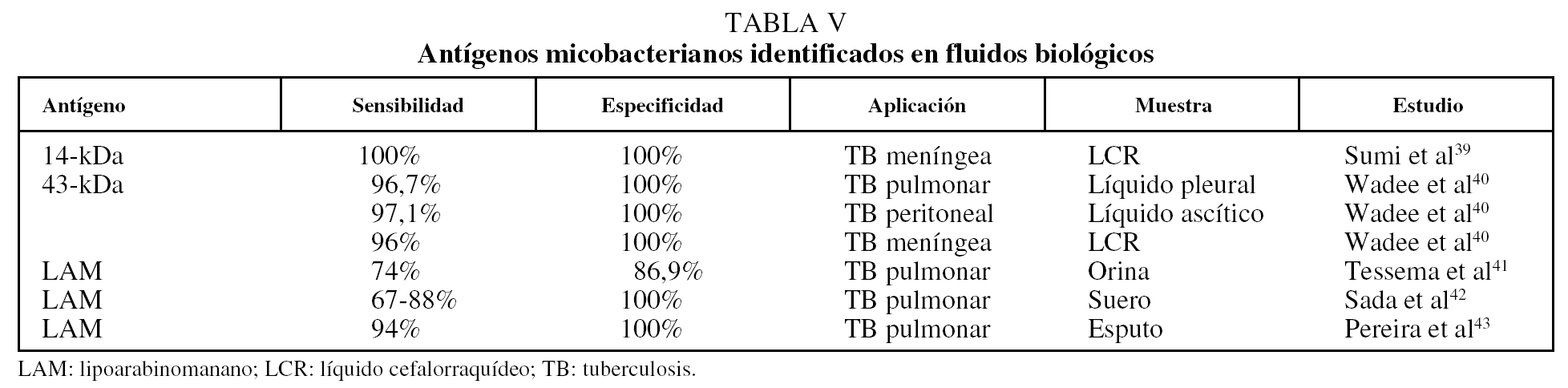
Una estrategia más dentro de los métodos inmunológicos para el diagnóstico de la tuberculosis es la detección de antígenos específicos del patógeno en el suero y otras secreciones, particularmente en la orina, mediante el uso de anticuerpos monoclonales muy específicos. El antígeno más utilizado en los inmunoanálisis es de nuevo el LAM, seguido de algunas proteínas de secreción de la micobacteria. Como puede apreciarse en la tabla V39-43, los métodos inmunológicos de captura de antígeno ofrecen los valores de sensibilidad y especificidad más altos para el diagnóstico de la tuberculosis. Una ventaja muy importante de los métodos basados en la detección de antígeno es que pueden emplearse para el diagnóstico de la tuberculosis extrapulmonar.
Mimótopos peptídicos de antígenos no proteicos
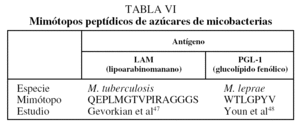
Aunque los glucolípidos y azúcares complejos de la pared celular de M. tuberculosis constituyen excelentes alternativas como antígenos para el serodiagnóstico, presentan la limitación de que no pueden producirse de manera recombinante porque son productos genéticos secundarios; además, para muchos de ellos aún no se han caracterizado las rutas metabólicas que les dan origen. Sin embargo, desde hace mucho tiempo se ha demostrado que pequeños péptidos de 7 a 15 residuos aminoacídicos pueden mimetizar la estructura tridimensional de algunos epítopes de hidratos de carbono complejos44-45. Lo anterior permite que tales péptidos, conocidos como mimótopos porque mimetizan epítopes, puedan reemplazar el uso de las moléculas complejas de lípidos y azúcares, imposibles de sintetizar químicamente o de manera recombinante. Actualmente se comercializan diversos sistemas que, a partir de una biblioteca combinatoria de péptidos expresados en fagos filamentosos (phage display), permiten el aislamiento de secuencias que puedan mimetizar conformacionalmente los determinantes antigénicos de moléculas complejas. Entre los mimótopos que se han generado para estructuras complejas de la pared celular de micobacterias destacan los producidos para determinantes antigénicos en el LAM y el glucolípido fenólico (PGL-1) de M. tuberculosis y M. leprae, respectivamente46,47, citados en la tabla VI. La utilidad de dichos mimó ;topos para el serodiagnóstico está aún por explorar en cada uno de los casos.
Otras pruebas
Particularmente en los países donde la vacunación se aplica de manera sistemática, o donde la alta tasa de infección con micobacterias saprofitas ambientales complica el serodiagnóstico por el alto grado de reacción cruzada que se observa, ha comenzado a evaluarse la respuesta inmunitaria celular in vitro al derivado proteico purificado (PPD). En estos métodos las células mononucleares del paciente con diagnóstico clínico de tuberculosis se estimulan con PPD, o con antígenos específicos (particularmente ESAT-6 y CFP-10), y se evalúa la proliferación celular, así como la producción de interferón gamma48-51. En esto se fundamenta el sistema QuantiFERON-TB Test (Cellestis Ltd., Carnegie, Victoria, Australia), recientemente aprobado por la Food and Drug Administration estadounidense para el diagnóstico de la tuberculosis. Una variante a la cuantificación de la producción de interferón gamma in vitro es la cuantificación directa de las células que lo producen mediante el análisis inmunoenzimático ELISPOT. Desafortunadamente la necesidad de cultivar in vitro las células de cada paciente encarece los costes del diagnóstico y limita su utilidad a escala poblacional.
Métodos moleculares
Aunque los métodos inmunológicos, particularmente los serológicos, son bastante sencillos de realizar a escala poblacional, no dan información alguna acerca de la especie o cepa que causa la infección, por lo que para propósitos de vigilancia epidemiológica la genotipificación de los aislamientos clínicos mediante técnicas de biología molecular ha constituido siempre la herramienta de elección, y en fechas recientes dichas estrategias moleculares han comenzado a aplicarse para identificar micobacterias directamente en los fluidos biológicos de los pacientes con fines de diagnóstico. Sin embargo, en el caso de la identificación de M. tuberculosis no se cuenta con un gen único que permita hacer un diagnostico fiable, y siempre es necesario llevar a cabo la amplificación de al menos 3 genes o regiones genómicas para poder tener un diagnóstico certero.
Métodos que permiten la identificación de especies
Tradicionalmente la identificación de la especie a que corresponde un aislamiento clínico se realiza mediante una batería de pruebas bioquímicas y fisiológicas seriadas, por lo que se tarda mucho tiempo en llegar a la identificación precisa del agente aislado a partir de las secreciones del paciente. En los últimos años las tecnologías de hibridización de ácidos nucleicos, la reacción en cadena de la polimerasa (PCR) y la disponibilidad de los genomas completos de muchos de los microorganismos de interés médico han revolucionado la forma de encarar el diagnóstico microbiológico y la epidemiología de las enfermedades infecciosas.
Las regiones de diferenciación. Los métodos modernos de biología molecular, en particular los basados en la PCR, ofrecen la posibilidad de identificar de manera precisa a una gran diversidad de microorganismos, entre ellos las micobacterias, mediante el uso de iniciadores para PCR dirigidos contra secuencias genómicas específicas de género y especie. La secuenciación del genoma de M. tuberculosis52 y los primeros hallazgos de la genómica comparativa53-55 han permitido identificar grandes pérdidas de material genético (deleciones) que caracterizan a las diferentes especies de micobacterias. Algunas de estas regiones de diferenciación están restringidas a las especies del complejo M. tuberculosis y permiten diferenciarlas de las micobacterias no patógenas (micobacterias no tuberculosas).
En el método descrito por Huard et al56 en 2003 se emplean 6 pares de iniciadores para PCR dirigidos contra los loci Rv0577, Rv3349c, Rv1510, Rv1970, Rv3877/8 y Rv3120, que generan amplicones de 400-1.200 pares de bases (tabla VII) que permiten la identificación de M. tuberculosis, M. africanum subtipo I, M. africanum subtipo II, M. bovis, M. bovis-BCG, M. caprae, M. microti y M. canetti. Además, la carencia de productos de amplificación para estas regiones genómicas permite catalogar a un aislamiento clínico como micobacteria no tuberculosa.
PCR-RFLP (polimorfismo en el tamaño de fragmentos de restricción) de hsp65
Para la diferenciación de las micobacterias que no pertenecen al complejo M. tuberculosis se ha hecho uso de la variabilidad del gen hsp65, que codifica para una proteína de choque térmico que se halla presente en todas las micobacterias57. En el método descrito originalmente por Telenti et al58 en 1993, se amplifica por PCR una región de 439 pares de bases, que posteriormente es digerida con las enzimas de restricción BstEII y HaeIII, cuyos patrones de restricción para la secuencia amplificada de hsp65 pueden identificarse visualmente, o bien puede emplearse un programa computacional para automatizar el análisis. El uso de otras enzimas de restricción como Sau961, CfoI59, o AvaII, HphI, HpaII60 ha permitido la diferenciación de hasta 62 especies de micobacterias no tuberculosas del género Mycobacterium.
Métodos para la genotipificación de aislamientos clínicos de M. tuberculosis
Para la genotipificación de aislamientos clínicos se cuenta principalmente con métodos basados en la hibridación con sondas de ADN derivadas de elementos repetitivos que caracterizan al complejo M. tuberculosis. Las 2 técnicas más empleadas son la hibridación tipo Southern blot (RFLP-IS6110) y los espoligotipos, aunque recientemente el uso del número variable de repeticiones en tándem (VNTR) ha demostrado ser también de gran utilidad.
RFLP-IS6110. La genotipificación por RFLP se basa en que las diferentes cepas o aislamientos clínicos presentan variaciones discretas en su material genético que pueden ponerse en evidencia al digerir el ADN con enzimas de restricción de corte frecuente, lo que genera patrones de digestión que permiten diferenciarlas61. Las enzimas de restricción más frecuentemente empleadas (BstEII y BclI) generan múltiples bandas que dificultan el análisis, por lo que se ha generalizado el uso de sondas radiomarcadas derivadas de elementos repetitivos secuencias de inserción, que varían en cuanto al número de copias y su distribución en los genomas de las micobacterias. Esta técnica requiere partir de cepas aisladas por cultivo, extraer el ADN de las micobacterias, digerirlo con una enzima de restricción que corte el elemento de inserción (generalmente PvuII para cortar IS6110), resolver el ADN digerido en agarosa o poliacrilamida, transferirlo a membranas de nitrocelulosa e hibridizar con una sonda para IS6110 marcada radiactivamente, aunque en la actualidad puede emplearse el marcado no radiactivo, con biotina o digoxigenina. Debido a que M. tuberculosis contiene de 8 a 20 copias de IS6110 (depende de la cepa), con este método se detectan de 16-40 bandas, que permiten hacer la diferenciación y clasificación de los aislamientos clínicos62.
Otra de las secuencias de inserción que se utilizan para la diferenciación de cepas de micobacterias es la IS1081 (1.324 pares de bases), que se encuentra en las cepas del complejo M. tuberculosis, pero, debido a que tiene un bajo número de copias, tiene un uso limitado en estudios epidemiológicos; también presenta el inconveniente de no poder diferenciar a M. bovis-BCG de otros miembros del complejo M. tuberculosis63.
Espologotipos (spoligotyping). En este método se aprovecha el alto grado de polimorfismo del locus DR de M. tuberculosis64. Dicho locus contiene repeticiones directas de 36 pares de bases, separadas por secuencias no repetitivas de 34-41 pares de bases, y las cepas varían tanto en el número de repeticiones directas como en la presencia o ausencia de algunos de los espaciadores. En el método de espoligotipos las secuencias conservadas de las repeticiones directas se emplean como diana para la amplificación por PCR, y se aprovecha la alta variabilidad en las regiones espaciadoras para obtener diferentes patrones de hibridiación de dicho producto amplificado contra oligonucleótidos espaciadores sintéticos que se fijan covalentemente a una membrana de nitrocelulosa. En el método descrito por Kamerbeek et al65 en 1997 se emplea un conjunto de 43 espaciadores que, además de permitir la tipificación de cepas de M. tuberculosis, las diferencia de las de M. bovis y M. bovis-BCG.
En 2002 Van der Zanden et al66 introdujeron 51 nuevos espaciadores que aumentan de forma considerable la capacidad de dicha estrategia para la genotipificación.
Número variable de repeticiones en tándem (VNTR). Al igual que los minisatélites descritos en genomas eucarióticos, en M. tuberculosis se han encontrado 41 regiones de 40-100 pares de bases de secuencias repetitivas dispuestas en tándem, llamadas MIRU (de Mycobacterial interspersed repetitive units unidades repetitivas intergénicas dispersas de micobacterias). De éstas, 12 loci son lo suficientemente polimórficos en cuanto a su número de copias en los aislamientos clínicos de M. tuberculosis y ya han comenzado a aplicarse con éxito en estudios epidemiológicos67. Además, el uso de MIRU-VNTR para la genotipificación de aislamientos clínicos tiene la ventaja de poder automatizarse.
Conclusiones
Sin lugar a duda las estrategias moleculares constituyen una herramienta insuperable en el campo de la microbiología de la tuberculosis, ya que en cuestión de horas es posible determinar con precisión la especie a que pertenece un determinado aislamiento clínico. Más aún, mediante el análisis de los espoligotipos o de VNTR es posible llevar a cabo el seguimiento epidemiológico adecuado. Desafortunadamente, aunque las técnicas moleculares son lo bastante sensibles para detectar ADN a partir de sólo 2 micobacterias, su aplicación en el diagnóstico de la tuberculosis no ha tenido el éxito que se esperaba, principalmente debido a la presencia de inhibidores de la PCR en las muestras clínicas. Sin embargo, el uso de la PCR, una vez que se ha aislado el agente etiológico mediante el cultivo de las muestras clínicas en los medios convencionales, reduce a sólo unas horas la identificación de la especie. Otro de los motivos por los que el cultivo difícilmente será superado es que no tiene rival para el estudio de la sensibilidad a los fármacos, aun cuando se han descrito diversos métodos moleculares para el análisis de genes micobacterianos asociados a la resistencia a fármacos68.
Por otro lado, las características que hacen que los métodos serológicos sean tan atractivos (sencillez, bajo coste, etc.), una vez superado el problema de la disponibilidad de antígenos específicos, permitirían sustituir la baciloscopia como método de apoyo al diagnóstico y diseñar estudios de prevalencia de la tuberculosis a escala poblacional.
El valor predictivo de los diversos métodos no es una cuestión totalmente definida, sobre todo para los métodos que aún se encuentran en estudio. La baciloscopia, por ejemplo, tiene una sensibilidad muy baja (10%), por lo que un valor negativo no descarta la presencia del bacilo; sin embargo, un resultado positivo constituye una evidencia fidedigna de la presencia de M. tuberculosis en un paciente que presenta las características clínicas de la enfermedad. Por su parte, el cultivo tradicional tiene un valor predictivo más alto (95%) y, juntamente con las pruebas bioquímicas, constituye la técnica de referencia en la identificación del bacilo de Koch; sin embargo, como es bien conocido, el tiempo que se requiere para llegar a un diagnóstico preciso es extraordinariamente largo69. Por su parte, los innovadores métodos inmunológicos para la detección de anticuerpos presentan en general valores muy bajos de sensibilidad y especificque la captura de antígenos micobacterianos, particularmente la detección de glucolípidos, parece muy prometedora, hoy día no se lleva a cabo de forma sistemática, sobre todo por la falta de disponibilidad y/o comercialización de anticuerpos monoclonales específicos. Por último, entre los métodos moleculares en estudio, la PCR constituye la mejor opción para la identificación directa de M. tuberculosis, aunque sólo detecta la presencia de su material genético, sin posibilidad de informar acerca de la viabilidad del bacilo. Por lo anterior, aún no es posible disponer de una estrategia diagnóstica rápida que presente todas las ventajas requeridas para que su implementación a gran escala permita hacer frente al avance de la epidemia, por lo que sigue siendo necesario el criterio clínico junto a las pruebas de laboratorio y resulta preciso continuar en la búsqueda de nuevas estrategias.
Agradecimientos
Los autores desean expresar su gratitud a Erika Segura Salinas y Paulina Lezama Núñez, del Instituto de Investigaciones Biomédicas-UNAM, por sus oportunas sugerencias y aportaciones al presente trabajo.
El Dr. Palma-Nicolás cuenta con una beca del Consejo Nacional de Ciencia y Tecnología (CONACYT) para realizar sus estudios de doctorado en México (2002-2006). La UAM Reynosa Aztlán de la Universidad Autónoma de Tamaulipas brindó apoyo económico para la preparación del presente manuscrito.
Correspondencia:
Dr. V. Bocanegra-García.
Calle 16 y Lago de Chapala. Fracc. Aztlán.
88740 Reynosa. Tamaulipas. México.
Correo electrónico: vbocanegra@uat.edu.mx
Recibido: 1-2-2006; aceptado para su publicación: 14-11-2006.