La ecografía como guía en la punción percutánea de lesiones torácicas periféricas (LTP) ofrece ventajas frente a otras técnicas de imagen. La mayoría de los estudios con esta técnica han sido comunicados por radiólogos intervencionistas. El objetivo de este estudio ha sido analizar la rentabilidad diagnóstica de la punción percutánea guiada por ecografía en una unidad de técnicas de neumología.
MetodologíaEstudio retrospectivo de 58 pacientes con LTP puncionadas con visualización ecográfica en tiempo real, entre el 1 de marzo de 2011 y el 1 de septiembre de 2014. Los resultados fueron divididos en 3 categorías diagnósticas: maligna, benigna y no diagnóstica (ND); esta última incluye los resultados de benignidad no específica (SD) y los de muestra insuficiente para diagnóstico (MID).
ResultadosSe obtuvo: resultado maligno en 34 (58,6%) de los procedimientos, resultado benigno en 13 (22,4%) y ND en 11 (19%) (SD en 5 [8,6%] y MID en 6 [10,3%]). En 5 de los casos ND el resultado final fue de malignidad y en 4 de ellos se tratada de una MID. La sensibilidad diagnóstica obtenida fue del 75,6%, el valor predictivo negativo del 54,2%, y la especificidad y el valor predictivo positivo del 100%, con una rentabilidad diagnóstica del 81%. Cuando se excluyeron los casos con MID los valores fueron del 87,2%, 72,3%, 100% y 100%, respectivamente, con una rentabilidad diagnóstica del 90,4%. No hubo complicaciones graves con la técnica.
ConclusionesLa punción percutánea bajo guía ecográfica en LTP realizada por neumólogos intervencionistas es una técnica segura y con una alta rentabilidad diagnóstica.
The use of ultrasound in peripheral thoracic lesions offers advantages over other radiological guiding methods. This diagnostic procedure has been applied in most studies published by radiologists. Our aim was to determine the diagnostic efficacy of percutaneous ultrasound-guided punctures and biopsies of peripheral thoracic lesions performed by pulmonologists.
MethodologyA retrospective analysis of 58 patients who underwent real-time ultrasound-guided transthoracic punctures and biopsy of peripheral thoracic lesions between March 2011 and September 2014 in the pulmonology department of our hospital. Cases were classified into the following diagnostic categories: malignant, benign and non-diagnostic (non-specific benign without evidence of malignancy and insufficient specimen).
ResultsA conclusive diagnosis was obtained in 47 procedures (81%), of which 13 (22.4%) were specific benign lesions and 34 (58.6%) cancers. In the remaining 11 (19%) patients, a non-diagnostic result was obtained [non-specific benign in 5 cases (8.6%) and insufficient specimen in 6 (10.3%)]. Sensitivity was 75.6%, negative predictive value was 54.2%, specificity and positive predictive value were 100%, and diagnostic accuracy was 81%. Excluding procedures with insufficient specimens, the results were 87.2%, 72.3%, 100%, 100% and 90.4% respectively. There were no serious complications.
ConclusionsPercutaneous ultrasound-guided puncture and biopsy in the diagnosis of peripheral thoracic lesions performed by pulmonologists is a safe procedure with high diagnostic accuracy. We achieved similar results to those previously obtained by radiologists.
La ecografía torácica (ET) es una herramienta eficaz y segura en la evaluación de lesiones localizadas en la pared torácica, la cavidad pleural, el mediastino y la periferia del pulmón1,2. La punción percutánea de estas lesiones mediante guía ecográfica para la obtención de muestras cito-histológicas permite visualizar la punción en tiempo real3. Hay otras múltiples ventajas de la obtención de muestras histológicas guiadas por ET frente a otras técnicas de imagen, entre las que están la ausencia de exposición radiológica, la accesibilidad y la posibilidad de realizar el procedimiento a pie de cama, el bajo coste y el acortamiento en el tiempo de la realización del procedimiento4,5. Estas características son de especial utilidad en las personas más susceptibles a radiaciones, como los niños y las embarazadas, o en pacientes de difícil movilización, como los ingresados en unidades de cuidados intensivos6.
Se estima que el 40% de los cánceres pulmonares aparecen como masas pulmonares periféricas, por lo que son potencialmente accesibles a la ET7. A pesar de todas estas ventajas, en nuestro entorno todavía es escaso el uso de la ET en el estudio de las lesiones malignas del tórax, siendo la punción guiada por tomografía computarizada (TC) la técnica de elección en la mayoría de centros4.
En nuestra unidad disponemos de ecografía desde el año 2010, de empleo habitual en la detección de derrame pleural y guía en la realización de la toracocentesis. A partir del año 2011 comenzamos a obtener muestras percutáneas guiadas por ecografía de lesiones pleuro-pulmonares y mediastínicas, con visualización de la punción en tiempo real.
La mayoría de estudios con esta técnica han sido comunicados por parte de radiólogos intervencionistas y la experiencia comunicada por neumólogos es limitada2,8–10.
En la revisión bibliográfica no hemos encontrado series publicadas de hospitales españoles.
El objetivo del presente estudio es valorar la rentabilidad y la seguridad de la punción y/o biopsia guiada por ET en el diagnóstico de lesiones torácicas periféricas en una unidad de técnicas de neumología (UTN).
Material y métodosSelección de pacientes y recogida de datosSe trata de un estudio retrospectivo de todos los pacientes a los que se les realizó la punción percutánea guiada por ET, con visualización en tiempo real, para el diagnóstico de lesiones torácicas periféricas entre el 1 de marzo de 2011 hasta el 1 de septiembre de 2014. La información del procedimiento se obtuvo a partir de los datos recogidos del programa informático ENDOBASE OLYMPUS® (Tokio, Japón) y los datos demográficos, clínicos, histopatológicos, las complicaciones y la evolución de la historia clínica digital.
A todos los pacientes, excepto a uno, se les había realizado TC torácica previa al procedimiento, que fue usada como prueba de imagen de referencia para delimitar la localización y el tamaño de la lesión torácica. En el paciente en que no se disponía de TC previa el cálculo del tamaño de la lesión se realizó por ET. De acuerdo al diámetro mayor de la lesión estas fueron clasificadas como nódulo (≤3cm) o masa (>3cm).
En todos los pacientes hubo un seguimiento de la evolución clínica y radiológica durante un periodo mínimo de 6 meses y máximo de 48 meses. Se consideraron complicaciones graves del procedimiento: neumotórax, sangrado clínicamente relevante, necesidad transfusional, requerimiento de un tubo de drenaje torácico o el ingreso no programado.
Realización de la pruebaComo requisito previo a la técnica se debía tener una cifra de plaquetas superior a 100.000/μl y un tiempo de protrombina activada dentro de los límites de referencia.
El examen ecográfico y la PAAF/biopsia fueron realizados en el mismo acto por personal de la unidad de técnicas respiratorias del servicio de neumología, empleando el equipo de ecografía General Electric LOGIQ P6 (Solingen, Alemania).
Las lesiones intratorácicas se evaluaron inicialmente con un transductor convexo de 4MHz. En caso de invasión de la pared torácica el examen se completó con un transductor lineal de 7MHz (fig. 1). Los pacientes fueron colocados en posición de decúbito supino, prono o decúbito lateral para lograr la aproximación ecográfica a la lesión del modo más cercano y seguro posible.
Para la realización de las punciones se empleó una aguja fina Chiba® 22G (Gallini, Italia) en 50 de los procedimientos y para las biopsias se utilizaron agujas de diámetros de 16 y 18G, Acecut® (TSK, Japón), Trucut® (Biopsybell, Italia) o Surecut® (TSK, Japón) en 14, 8 y 5 procedimientos respectivamente.
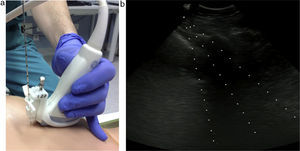
Ambas técnicas (PAAF y biopsia) se realizaron con visualización ecográfica en tiempo real acoplando a la sonda del ecógrafo un tutor o mandril (fig. 2) para ayudarnos a dirigir la toma de la muestra.
Las muestras se obtuvieron sin presencia del patólogo. Todas las punciones/biopsias se realizaron bajo anestesia local de la piel y tejido subyacente con instilación de mepivacaína al 2%.
Clasificación de los resultadosLos resultados de la citología y/o biopsia fueron divididos en 3 categorías diagnósticas: 1) maligna; 2) benigna; y 3) no diagnóstica (ND). Las 2 primeras categorías (maligna y benigna) se consideran resultados concluyentes. Por el contrario, la categoría ND incluye los casos con diagnóstico no concluyente: resultado benigno no específico sin evidencia de malignidad (SD) (celularidad inespecífica/inflamatoria o necrosis) y resultados cuya muestra resulta insuficiente para diagnóstico (MID).
Los casos fueron clasificados como malignos cuando se obtuvo un diagnóstico de neoplasia maligna, y benignos cuando se obtuvo un diagnóstico patológico específico de benignidad basado en los resultados histológicos y tenían un curso clínico compatible con el diagnóstico.
Aquellos pacientes en los que la muestra obtenida no fue diagnóstica (ND) precisaron de procedimientos diagnósticos alternativos: nuevas muestras cito-histológicas o el curso clínico-radiológico.
Las nuevas muestras se obtuvieron por radiólogos intervencionistas (PAAF guiada por TC o por ET), por neumólogos mediante un procedimiento diferente (toracocentesis o broncoscopia con biopsia transbronquial) o por cirujanos torácicos mediante resección quirúrgica.
Análisis estadísticoSi el resultado de la punción demostró la presencia de células neoplásicas, se consideró el resultado como verdadero positivo (VP) y no se realizó ninguna prueba confirmatoria adicional.
Un resultado histológico benigno, ya fuera por citología y/o biopsia, fue considerado un verdadero negativo (VN) para malignidad cuando se obtuvo confirmación histológica y/o la lesión en su control radiológico por TC y/o tomografía de emisión de positrones (PET) decreció, se mantuvo estable o desapareció a pesar de no recibir un tratamiento antitumoral específico, con un tiempo de seguimiento mínimo de 6 meses y máximo de 48 meses.
Un resultado histológico benigno fue considerado un falso negativo cuando en nuevas muestras de la lesión se obtuvo finalmente un diagnóstico de malignidad, o el curso clínico-radiológico indicó que la lesión era maligna (el tamaño de la lesión controlado por TC y/o PET aumentó o se identificaron metástasis).
Los casos ND no son incluidos en esta valoración al no tratarse de muestras adecuadas para realizar un diagnóstico de precisión, benigno o maligno.
Las variables cuantitativas se expresaron como media (±desviación estándar), mientras que las variables cualitativas o dicotómicas se expresaron como porcentajes y frecuencias absolutas para las variables.
Valoramos el rendimiento diagnóstico del test con una tabla de contingencia de 2×2 en la que se expresaron los resultados positivos o negativos para malignidad de la punción dirigida por ecografía (filas) y la presencia o ausencia de un diagnóstico cierto (columnas). Con ello se obtuvo la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP), el valor predictivo negativo (VPN) y la rentabilidad diagnóstica del test. El cálculo de la S y el VPN de la prueba se realizó considerando todas las muestras, incluyendo las MID y posteriormente seleccionando solo las muestras adecuadas para análisis citológico (exclusión del análisis de las MID)11.
Para la comparación entre diagnóstico (procedimientos con resultado concluyente y procedimientos con resultado no concluyente) y distintas variables categóricas se utilizó la prueba de χ2. Las variables categóricas comparadas con el diagnóstico fueron: tamaño (nódulo y masa) y el tipo de punción realizada (PAAF, biopsia). Para la comparación entre diagnóstico de subtipo histológico en el carcinoma de pulmón no microcítico (CNM) y el tipo de punción se utilizó la prueba de χ2.
Para todos los cálculos se consideró como significativa una p<0,05.
Los análisis se realizaron con el programa Statistical Package for Social Sciences versión 20.0 (SPSS, Chicago, IL, EE. UU.).
ResultadosEl tamaño de la lesión era menor o igual a 3cm (nódulo) en 15 de los casos (26%) y mayor de 3cm en 43 casos (74%).
La localización de las lesiones fue pulmonar en 51 casos (88%), mediastínica en 3 casos (5%), pleuroparietal en 2 casos (3,5%) y supraclavicular en 2 casos (3,5%) (tabla 1).
Datos antropométricos de los pacientes, localización de la lesión, tamaño de la lesión, aguja empleada y tipo de punción
| Características | Pacientes |
|---|---|
| Edad, años (x±DS) | 60,86±14,14 |
| Sexo (masculino/femenino) | 45/13 |
| Localización (n, %) | |
| Lóbulo superior derecho | 18 (31,0) |
| Lóbulo medio | 2 (3,4) |
| Lóbulo inferior derecho | 10 (17,2) |
| Lóbulo superior izquierdo | 16 (27,6) |
| Lóbulo inferior izquierdo | 5 (8,6) |
| Mediastino anterior | 3 (5,2) |
| Supraclavicular | 2 (3,4) |
| Pleuroparietal | 2 (3,4) |
| Tamaño lesión (n, %) | |
| Nódulo (≤3cm) | 15 (25,9) |
| Masa (>3cm) | 43 (74,1) |
| Tipo aguja empleada | |
| Chiba® | 50 |
| Surecut® | 5 |
| Acecut® | 14 |
| Trucut® | 8 |
| No disponible | 3 |
| Tipo punción realizada (n, %) | |
| Solo PAAF | 28 (48,3) |
| Solo biopsia | 5 (8,6) |
| PAAF+biopsia | 22 (37,9) |
| No disponible | 3 (5,2) |
PAAF: punción-aspiración con aguja fina.
En la tabla 2 se muestra cómo de los 58 procedimientos realizados se obtuvo un resultado concluyente (para enfermedad benigna o maligna) en 47 casos (81%), siendo el diagnóstico obtenido con más frecuencia el de CNM (38%). De los 11 casos no diagnósticos (ND) (19%) (tabla 3) el diagnóstico final se alcanzó por PAAF guiada por TC realizada por radiólogos intervencionistas (un caso), PAAF guiada por ET realizada por radiólogos intervencionistas (2 casos), toracotomía quirúrgica (un caso), broncoscopia con biopsia transbronquial (un caso), toracocentesis (un caso) o por la evolución clínica y radiológica (5 casos). Cinco de los procedimientos inicialmente no diagnósticos de malignidad (benignos y no diagnósticos) fueron definidos como malignos al final del estudio.
Distribución por diagnósticos de la población estudiada
| Diagnóstico final | Número | % |
|---|---|---|
| Maligno | 34 | 58,6 |
| No microcítico | 22 | 37,9 |
| Adenocarcinoma | 15/22 | |
| Carcinoma escamoso | 5/22 | |
| No microcítico* | 2/22 | |
| Microcítico | 4 | 6,9 |
| Metástasis | 2 | 3,4 |
| Otros cánceres | 6 | 10,3 |
| Benigno | 13 | 22,4 |
| Tuberculosis | 5 | 8,6 |
| Absceso | 4 | 6,9 |
| Paquipleuritis/fibrotórax | 2 | 3,4 |
| Tumor fibroso pleural | 1 | 1,7 |
| Linfadenitis granulomatosa | 1 | 1,7 |
| Sin diagnóstico | 5 | 8,6 |
| Muestra insuficiente | 6 | 10,3 |
| Total | 58 | 100,00 |
Subanálisis de los pacientes con resultado citohistológico sin diagnóstico o muestra insuficiente para diagnóstico
| Paciente | Diagnóstico | Tamaño por TC (cm) | Localización | Tipo muestra | Método diagnóstico final | Diagnóstico final |
|---|---|---|---|---|---|---|
| #4 | Muestra insuficiente | 4 | LSI | PAAF | Evolutivo clínico y radiológico | Absceso pulmonar |
| #5 | Muestra insuficiente | 8 | LID | PAAF | Evolutivo clínico y radiológico | Neoplasia maligna (paciente prefirió no realizar más técnicas diagnósticas) |
| #10 | Muestra insuficiente | 2,5 | SC | Biopsia | BTB por broncoscopia | Carcinoma microcítico de pulmón |
| #12 | Muestra insuficiente | 7 | LSI | PAAF | PAAF guiada por ET realizada por radiólogo intervencionista | Carcinoma escamoso de pulmón |
| #37 | Celularidad inflamatoria (SD) | 1,9 | LID | PAAF+biopsia | - PAAF guiada por TC negativa - Nódulo benigno: evolución radiológica | Nódulo benigno |
| #39 | Celularidad inflamatoria (SD) | 8,4 | PP | PAAF+biopsia | Toracocentesis positiva Evolutivo clínico y radiológico | Mediastinitis purulenta |
| #41 | Necrosis (SD) | 9,6 | LSD | PAAF+biopsia | PAAF guiada por ET realizada por radiólogo intervencionista (precisó 2 procedimientos días distintos para obtener positividad) | Sarcoma pulmonar |
| #45 | Necrosis (SD) | 5,9 | MA | Biopsia | Toracotomía | Hidatidosis pulmonar |
| #49 | Muestra insuficiente | 3 | LSD | PAAF | Control PET/TC | Lesión cicatricial |
| #53 | Muestra insuficiente | 5 | MA | PAAF | PAAF guiada por TC | Linfoma B |
| #57 | Celularidad inflamatoria (SD) | 6,3 | LSD | PAAF+biopsia | LBA positivo para Klebsiella Evolutivo clínico y radiológico | Neumonía por Klebsiella |
BTB: biopsia transbronquial; FN: falso negativo; LBA: lavado broncoalveolar; LID: lóbulo inferior derecho; LSD: lóbulo superior derecho; LSI: lóbulo superior izquierdo; MA: mediastino anterior; PAAF: punción-aspiración con aguja fina; PET/TC: tomografía por emisión de positrones/tomografía computarizada; PP: pleuroparietal; SC: supraclavicular; SD: sin diagnóstico; VN: verdadero negativo.
La tabla 4 muestra el rendimiento diagnóstico de la punción percutánea guiada por ecografía en el mejor supuesto clínico (excluyendo las muestras insuficientes) y el peor supuesto clínico (incluyendo tanto las muestras insuficientes como las de celularidad inflamatoria).
Rendimiento diagnóstico de la punción percutánea guiada por ecografía incluyendo o excluyendo las muestras insuficientes para el diagnóstico
| Variable | Incluyendo muestras insuficientes | Excluyendo muestras insuficientes |
|---|---|---|
| Número (n) | 58 | 52 |
| No diagnóstico | 11 | 5 |
| Sensibilidad | 75,6% | 87,2% |
| Especificidad | 100% | 100% |
| VPN | 54,2% | 72,3% |
| Rentabilidad diagnóstica | 81% | 90,4% |
El tamaño de la lesión (nódulo/masa) no influyó en la obtención de un diagnóstico concluyente (p=0,91).
No se encontraron diferencias estadísticamente significativas entre el tipo de punción realizada (PAAF, biopsia o PAAF+biopsia) y el rendimiento diagnóstico (p=0,96). Tampoco hubo diferencias estadísticamente significativas en el rendimiento diagnóstico de la prueba entre el grupo con biopsia (solo biopsia o con PAAF) y el grupo en los que solo se realizó PAAF (p=0,75). Además, en los 22 pacientes diagnosticados de CNM, excluyendo para el análisis 2 pacientes en los que no se conoce el tipo de aguja empleada en el procedimiento, no se obtuvieron diferencias estadísticamente significativas entre la realización de PAAF y biopsia (con o sin PAAF) en la determinación del subtipo histológico.
No se produjeron complicaciones graves en relación con ninguno de los procedimientos. Uno de los pacientes falleció a los pocos días del procedimiento y su muerte fue atribuida a progresión de la enfermedad maligna.
DiscusiónEl presente estudio evidencia que la punción percutánea guiada por ecografía realizada por neumólogos intervencionistas es útil en el diagnóstico de lesiones torácicas periféricas en contacto con la pleura, de tal manera que se consigue un diagnóstico específico (para benignidad o malignidad) hasta en el 81% de los casos. Tiene una alta rentabilidad diagnóstica para malignidad cuando se obtiene muestra suficiente para diagnóstico.
Además, nuestros resultados muestran que es una técnica útil para establecer diagnósticos de benignidad, como pueden ser los de etiología infecciosa, especialmente tuberculosis y abscesos. En los 5 casos en los que no se logró el diagnóstico de malignidad, el resultado cito-histológico inicial de la punción/biopsia guiada por ET fue no-diagnóstico (muestra insuficiente o indeterminada) que, en cualquier caso, obligó a estudios posteriores. Esto tiene importancia clínica, ya que no ha habido ningún paciente con diagnóstico inicial específico de benignidad, que no obligaría a un nuevo procedimiento diagnóstico alternativo, que haya sido un falso negativo. Esta situación conllevaría un error diagnóstico potencialmente mayor.
No obstante, consideramos que la obtención de un diagnóstico de benignidad no debe evitar que realicemos un estricto seguimiento clínico y radiológico de estas lesiones. Esto es particularmente importante en los abscesos, ya que estos también se pueden dar en lesiones neoplásicas.
Además obtenemos muy buenos resultados en términos de seguridad. Algunas de las justificaciones de este buen resultado pueden ser: 1) la realización de la técnica por neumólogos previamente entrenados en técnicas intervencionistas; y 2) la guía ecográfica es, en sí misma, una técnica más segura porque nos permite puncionar una lesión en contacto con la pleura y visualizar la punción en tiempo real2,12,13. Por el contrario, en las punciones guiadas por TC observamos complicaciones con más frecuencia14, entre otras razones, porque se suele atravesar/lacerar el pulmón sano. «En la ET ves lo que haces, en la TC ves lo que hiciste15».
Nuestro estudio presenta varias limitaciones, alguna de ellas relacionadas con su carácter retrospectivo. En los primeros procedimientos realizados no se recogían algunos datos como el tipo de aguja empleada, el número de punciones realizadas o el diámetro de la lesión medido por ecografía.
Los diagnósticos obtenidos mediante la punción percutánea guiada por ecografía no fueron confirmados posteriormente mediante el gold standard (la biopsia quirúrgica) ni frente a otros procedimientos diagnósticos (como la punción guiada por TC), para evitar al paciente procedimientos invasivos de riesgo. Por ello, a pesar de sus limitaciones intrínsecas, para establecer el diagnóstico final requerimos un seguimiento evolutivo clínico y radiológico del paciente que fuera congruente.
Otra limitación de nuestro estudio es la ausencia de patólogo que realice una interpretación citológica rápida en el momento del procedimiento, ya que su presencia podría disminuir los resultados de muestra insuficiente obtenidos por PAAF16–18. Por ello, recomendamos disponer de un patólogo que esté presente en el momento de realizar la técnica, para aumentar la rentabilidad diagnóstica.
Muchos estudios han demostrado que la ecografía es igual de efectiva que la TC como guía durante la realización de biopsias percutáneas de lesiones pulmonares periféricas, y la rentabilidad diagnóstica mediante confirmación histológica varía según los estudios entre el 84-95%1,4,12,19–21.
La mayor parte de la bibliografía sobre punción percutánea guiada por ecografía está publicada por radiólogos intervencionistas2,8,9; sin embargo, el presente artículo es uno de los primeros que describe los resultados de esta técnica realizada por neumólogos intervencionistas.
Entre las principales limitaciones de la ET se encuentran la imposibilidad para visualizar la pleura completamente, por la interposición de las costillas, y que solo permite evaluar aquellas lesiones que tengan un contacto suficiente con la pared torácica4,19, por lo que, para ser puncionadas, las lesiones deberán contar con una buena ventana ecográfica6,12.
A diferencia de lo que ocurre con la TC, el tamaño de la lesión no parece influir en el rendimiento diagnóstico de la biopsia guiada por ecografía20–24.
Esto se explica por el hecho de que normalmente cuando se usa la TC como guía en la punción/biopsia de lesiones de pequeño tamaño, la punción no se lleva a cabo en tiempo real, a no ser que se disponga de TC con fluoroscopia, y tanto las costillas como los movimientos respiratorios dificultan la orientación precisa de la punción en las lesiones pequeñas. Por el contrario, el uso de la ecografía como guía proporciona imágenes dinámicas en tiempo real durante la punción percutánea y permite al operador ser más exacto a la hora de alcanzar la lesión, ya que visualiza la punta de la aguja15. Además, la flexibilidad y el corto tiempo de examen permiten que la repetición de la punción sea más fácil1. Como en estos estudios, en el análisis de nuestros casos no encontramos diferencias estadísticamente significativas en el rendimiento diagnóstico de la punción guiada por ET según el tamaño de la lesión.
Comparada con la PAAF, la obtención de muestras con aguja de biopsia proporciona comparativamente mayor tamaño muestral, lo que facilita el diagnóstico, permitiendo además la determinación de los subtipos en caso de tumores malignos y la realización de análisis molecular19,20. A pesar de esto, nosotros no hemos encontrado diferencias estadísticamente significativas en la rentabilidad diagnóstica mediante PAAF o biopsia, ni en la determinación del subtipo histológico, si bien ello podría ser en parte debido al pequeño tamaño muestral. En nuestro trabajo utilizamos diferentes agujas de biopsia porque en estudios anteriores4,25 no se han evidenciado diferencias en el rendimiento diagnóstico en función del tipo de aguja utilizado.
Cada vez se trabaja más en la búsqueda de descriptores ecográficos que sirvan como factores predictivos que diferencien las lesiones pulmonares periféricas malignas de las benignas. Parece que algunos de los criterios que mejor contribuyen a esa diferenciación son el contorno de la superficie pulmonar, los límites con el pulmón ventilado, la destrucción de la arquitectura normal, el desplazamiento vascular, la neovascularización y la invasión de estructuras adyacentes6,13. Jeon et al.16 demostraron que el único factor que afecta al rendimiento diagnóstico en las biopsias transtorácicas guiadas por ecografía, de forma estadísticamente significativa, era la longitud del arco de la lesión en contacto con la pleura, de tal forma que en los casos de valores de longitud del arco de la lesión en contacto con la pleura ≤30mm la rentabilidad diagnóstica bajaba del 98 al 85,4%.
El empleo de la ET en el ámbito de la neumología está en progresión ascendente en los últimos años, favorecido por el desarrollo de programas educativos como la iniciativa Harmonization of Education in Respiratory Medicine for European Specialists (HERMES), que en su última actualización de 2006 recomienda el aprendizaje de la técnica como parte integrante de la formación en neumología26,27.
A pesar de todas sus ventajas, todavía es escaso el uso de la ET en el estudio de las lesiones malignas del tórax, siendo la punción guiada por TC la técnica de elección en la mayoría de centros4.
En los últimos años los avances científicos y tecnológicos están permitiendo aumentar el campo de aplicación de la ET; tal es el caso del doppler color, que permite aumentar el espectro diagnóstico y mejorar la seguridad de la ET al evitar la punción de grandes vasos2, o el empleo de contraste en la ET que permite una mejor identificación del tejido a puncionar en las lesiones pulmonares periféricas mejorando la eficacia diagnóstica28.
Estudios que incluyan algunas variables, como pueden ser el número de punciones por procedimiento, la presencia/ausencia de patólogo, el acceso de la lesión o la curva de aprendizaje en series de mayor tamaño nos permitirán conocer mejor los distintos factores que influyen en la rentabilidad diagnóstica.
En cualquier caso, estudios como el presente refrendan la importancia creciente de la ultrasonografía, siendo previsible que siga desarrollándose aumentando su espectro de actividad entre los neumólogos intervencionistas.
En concreto, los exitosos resultados de la punción percutánea guiada por ET, tanto en rentabilidad diagnóstica como en seguridad, apoyan su elección como primera opción para el diagnóstico de lesiones torácicas en contacto con la pleura2, siempre y cuando no existan contraindicaciones y sea realizado por médicos entrenados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.