El «pulsioxímetro» es uno de los utensilios médicos más utilizados en la práctica médica, que sirve para la medición no invasiva del oxígeno transportado por la hemoglobina en el interior de los vasos sanguíneos. Este dispositivo emite luz con 2 longitudes de onda de 660nm (roja) y 940nm (infrarroja) que son características respectivamente de la oxihemoglobina y la hemoglobina reducida; mediante la comparación de la luz que se absorbe durante la onda pulsátil con respecto a la absorción basal se calcula el porcentaje de oxihemoglobinas1. La correlación entre la saturación de oxígeno y la presión parcial de oxígeno en sangre arterial viene determinada por la curva de disociación de la oxihemoglobina.
En la vida diaria la presencia de saturación de oxígeno muy por debajo de los límites esperados2 obliga a descartar numerosas etiologías, algunas de las cuales son bastantes infrecuentes. Presentamos un caso de hemoglobinopatía con alteración en la afinidad por el oxígeno detectada por pulsioximetría.
Se trata de un paciente varón de 53 años, de profesión agricultor, exfumador de 10 años, con inicio a los 13 años; índice paquete-año: 15; alergia a penicilinas e intolerancia al tramadol; comunicación interventricular congénita, sin repercusión en su salud, en la actualidad. Antecedentes patológicos familiares, madre con cardiopatía crónica, padre fallecido de linfoma no Hodgkin. Tiene una hermana sana.
Acude a consulta derivado desde atención primaria por presentar, desde 6 meses antes de la consulta un cuadro de disnea a los grandes esfuerzos, sin otra semiología respiratoria.
En la exploración física no se detectaron hallazgos relevantes, sin cianosis, ni taquipnea, ni otros signos de insuficiencia respiratoria crónica, pero con una saturación basal de oxígeno del 76-77%, llamativamente baja y bien tolerada, comprobada con distintos dispositivos. Se realiza una gasometría donde se comprueba una presión parcial de oxígeno en sangre arterial por debajo de los valores de la normalidad, confirmando una hipoxemia: saturación de oxígeno del 76%, con una presión parcial de oxígeno en sangre arterial de 41mmHg. La radiografía de tórax no muestra alteraciones. También se practicó espirometrías con valores normales, en todos los casos (FVC: 5580-117%, FEV1: 4470-123%, FEV1/FVC: 80%, MEEF: 25-75%: 3340-100%).
Para descartar los motivos más frecuentes de hipoxemia se realiza una tomografía axial computarizada de tórax en la que se apreció únicamente una vena cava superior izquierda persistente y el tronco braquiocefálico hipoplásico, descartándose, entre otros problemas, enfermedad tromboembólica a nivel radiológico. También se realiza test de difusión, que es normal.
Por sus antecedentes cardiológicos se solicita reevaluación específica, para descartar cualquier tipo de shunt anteriovenoso: se realizaron ecocardiografías transtorácica, transesofógica y test de burbujas, donde se descartan los datos de comunicación interventricular activa, además se realiza cateterismo cardiaco, con fracción de eyección ventricular conservada, descartando alteraciones de los calibres arteriales coronarios y de la circulación pulmonar y sistémica.
En las pruebas analíticas realizadas (hemograma; bioquímica; perfil renal; hepático; tiroideo… entre otros) no se constataron alteraciones.
Finalmente y tras contactar con hematología, se realiza una electroforesis de hemoglobinas: el paciente presenta una hemoglobina de movilidad anómala en el estudio electroforético que alcanza un 35%. Se calcula la P50 de la misma, que en nuestro paciente fue de 34,5, coherente con una hemoglobinopatía con alteración en la afinidad por el oxígeno. Ante esta sospecha, se solicita identificación de la hemoglobina anómala al Hospital San Carlos de Madrid, que tras secuenciación de ADN determina que nos encontramos ante un paciente portador de una hemoglobinopatía Rothschild.
El estudio de ADN identifica la mutación TGG>CGG en el codón 37 en el 2.o exón del gen β en el alelo que determina el cambio de aminoácido triptófano por arginina en la posición 3 de la hélice C de la cadena β codificada por el alelo mutado.
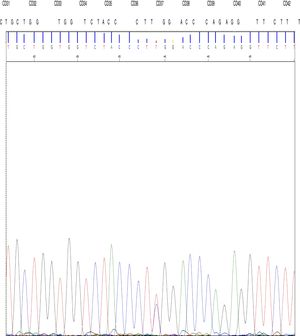
También se realizó una cromatografía líquida de alto rendimiento, donde se evidenció una hemoglobina anómala en la fracción correspondiente a la hemoglobina D; tras nuevas muestras de gasometría (p50 valor de 34,5) arterial y venosa se concluyó, que se trataba de una hemoglobinopatía Rothschild [β37 (C3) Asp>Tyr; HBB: c.112T>C] (fig. 1).
La hemoglobina consta de un tetrámero de cadenas polipeptídicas de globinas, un par de cadenas similares a α de 141 aminoácidos de longitud y un par de cadenas similares a β de 146 aminoácidos3. El adulto tiene como principal hemoglobina la HbA con estructura α2β2, cada fracción hemo puede unir una única molécula de oxígeno por lo que cada molécula puede transportar hasta 4 moléculas de oxígeno, las propiedades principales que se alteran en la hemoglobinopatías son la solubilidad y la unión reversible de oxígeno, que depende sobre todo de los aminoácidos hidrófilos, de los aminoácido hidrófobos que revisten la bolsa de hemo, de una histidina en la hélice F y de los aminoácidos que forman las superficie de contacto α1β1 y de α1β2, es en estas regiones es donde se localiza la alteración que modifica la afinidad del oxígeno3.
La hemoglobina de Rothschild es una mutación de la cadena β de la hemoglobina donde se sustituye el residuo de triptófano en posición β37(C3) por arginina. El triptófano en B37 (C3) es un punto de contacto en las interfaces α1β2 y α2β1 y la sustitución del triptófano por la arginina conlleva una desestabilización de las interfaces afectadas durante la oxigenación y la desoxigenación, esperando una desviación del oxígeno normal, pero dicha desviación solo se produce a nivel molecular y no tiene aparente manifestación clínica en los pacientes, que generalmente se mantienen asintomáticos4,5. Cabe destacar que la presión parcial a la cual la hemoglobina esta medio saturada es p50, la HbA tiene una p50 de 25±2mmHg, mientras que la hemoglobina de Rothschild [β 37(C3) RTP-->Erg] tiene una p50 mayor por su baja afinidad al oxígeno4–6.
La alteración de la saturación de oxígeno en nuestro paciente, determinada mediante pulsioxímetro, fue el dato inicial tras el cual se realiza este estudio. Tras identificar como causa de este problema la hemoglobinopatía y explicarle al paciente la baja implicación clínica de este hallazgo, el paciente minimizó sus problemas y síntomas, que habían sido sobredimensionados por la conciencia de las alteraciones detectadas y el miedo provocado ante la sospecha de patología médica. Por todo ello debemos considerar que, ante un paciente con saturaciones de oxígeno bajas sin causa evidente y baja concordancia clínica, uno de los motivos a tener en cuenta es este tipo de hemoglobinopatías, que, aunque infrecuentes, pueden aparecer en nuestro quehacer diario.
Además, para completar el estudio familiar, e identificar otros afectos, se usó la pulsioximetría, que permitió identificar como portadores a su hermana y a 2 sobrinos.
Podemos considerar que ante un paciente con saturaciones de oxígeno bajas sin causa aparente de patología que justifique la hipoxia4,5,7, debemos pensar que se trate de una alteración de la afinidad del oxígeno7–9 por la hemoglobina, sabiendo que muchas de ellas cursan sin síntomas5 y que con una medición de la saturación mediante un pulsioxímetro podremos detectar patologías infrecuentes10,11 como es el caso que nos ha ocupado.