La gripe es una enfermedad contagiosa altamente prevalente y con significativa morbimortalidad. El tratamiento disponible con fármacos antivirales, de ser administrado de forma precoz, puede reducir el riesgo de complicaciones severas; sin embargo, muchos tipos de virus desarrollan resistencia a estos fármacos, reduciendo notablemente su efectividad. Ha habido un gran interés en el desarrollo de nuevas opciones terapéuticas para combatir la enfermedad. Una gran variedad de fármacos han demostrado tener actividad antiinfluenza, pero aún no están disponibles para su uso en la clínica. Muchos de ellos tienen como objetivo componentes del virus, mientras que otros son dirigidos a elementos de la célula huésped que participan en el ciclo viral. Modular los componentes del huésped es una estrategia que minimiza el desarrollo de cepas resistentes, dado que estos no están sujetos a la variabilidad genética que tiene el virus. Por otro lado, la principal desventaja es que existe un mayor riesgo de efectos secundarios asociados al tratamiento. El objetivo de la presente revisión es describir los principales agentes farmacológicos disponibles en la actualidad, así como los nuevos fármacos en estudio con potencial beneficio en el tratamiento de la gripe.
Influenza is a very common contagious disease that carries significant morbidity and mortality. Treatment with antiviral drugs is available, which if administered early, can reduce the risk of severe complications. However, many virus types develop resistance to those drugs, leading to a notable loss of efficacy. There has been great interest in the development of new drugs to combat this disease. A wide range of drugs has shown anti-influenza activity, but they are not yet available for use in the clinic. Many of these target viral components, which others are aimed at elements in the host cell which participate in the viral cycle. Modulating host components is a strategy which minimizes the development of resistance, since host components are not subject to the genetic variability of the virus. The main disadvantage is the risk of treatment-related side effects. The aim of this review is to describe the main pharmacological agents currently available and new drugs in the pipeline with potential benefit in the treatment of influenza.
La gripe es una enfermedad infecciosa generada por distintos tipos de virus influenza, caracterizada por un cuadro respiratorio agudo, altamente contagioso. Si bien suele presentarse como formas leves con resolución en 3 a 7 días, también puede predisponer a contraer infecciones secundarias o presentarse en formas severas como neumonía o síndrome de distrés respiratorio agudo, siendo en ocasiones fatal, sobre todo en pacientes de edad avanzada1–4. La gripe estacional afecta al 5-10% de la población mundial cada año, resulta en ∼3 a 5 millones de casos severos y entre 250.000 y 500.000 muertes. Se puede presentar en forma de brotes pandémicos, con alta mortalidad y gran impacto sobre la salud pública5.
La vacunación es fundamental en la prevención de la enfermedad y sus complicaciones, principalmente para grupos de riesgo como niños, ancianos, portadores de enfermedades respiratorias crónicas y embarazadas. El tratamiento disponible con fármacos antivirales, de ser administrado de forma precoz, puede reducir el riesgo de complicaciones severas; sin embargo, muchos tipos de virus desarrollan resistencia a fármacos, reduciendo su efectividad, por lo que ha habido un gran interés en los últimos años en el desarrollo de nuevas opciones terapéuticas para combatir la enfermedad. La presente revisión describe los principales agentes farmacológicos disponibles en la actualidad y analiza nuevos medicamentos en estudio con potencial beneficio en el tratamiento de la gripe5–7 (tabla 1).
Fármacos antigripales
| Fármacos actualmente utilizados | |
| Inhibidores del canal iónico M2 | Inhibidores de la neuraminidasa |
| Amantadina | Oseltamivir |
| Rimantadina | Zanamivir |
| Peramivir | |
| Laninamivir | |
| Otros grupos farmacológicos | |
| Fármacos activos ante componentes del virus | Fármacos activos ante componentes del huésped |
| Inhibidores de la unión y de la fusión | Inhibidores de la unión |
| MBX2329 | DAS181 (Fludase®) |
| Arbidol | Aprotinina |
| Anticuerpos: CH65, D1-8, HB36.6 | |
| Inhibidores de endocitosis y fusión | |
| Inhibidores de la polimerasa viral | Glicirrizina |
| Favipiravir (T-705) | LJ001 |
| VX-787 | Bafilomicina A1 |
| Concanamicina A | |
| Inhibidores de la nucleoproteína | Salifenilalamida |
| Nucleozina | |
| Naproxeno | Inhibidores de la transcripción y transporte del ARN viral |
| Geldanamicina | |
| Inhibidores de la proteína NS1 | 17-AAG |
| NSC125044 | Ribavirina |
| JJ3297 | Viramidina |
| Baicalina | |
| Inhibidores de la exportación del complejo ribonucleoproteico viral y de procesos postranscripcionales | |
| Verdinexor | |
| Nitazoxanida | |
| Inhibidores de vías de defensa intracelulares | |
| U0126 | |
| PD-0325901 | |
| AZD-6244 | |
| AZD-8330 | |
| RDEA-119 | |
| Ácido acetil salicílico | |
| Otros agentes con actividad antiinfluenza | |
| Ouabaína | |
Los virus de la gripe pertenecen a la familia Orthomyxoviridae y son clasificados como A, B o C. Los virus influenza A circulan en diversas especies como humanos, equinos, porcinos y aves, mientras que los de tipo B afectan solo a humanos. El cuadro gripal causado por los tipos A y B es indistinguible; por el contrario, la C causa síntomas respiratorios leves8–10.
La estructura del virus influenza A consta de una envoltura lipídica que proviene de la célula huésped y lleva ancladas las glucoproteínas hemaglutinina (HA) y neuraminidasa (NA), antígenos de superficie usados para clasificar a los virus (por ejemplo, H1N1, H3N2, H5N1). En la membrana se encuentran también las proteínas de matriz M2 y M1, mientras que en el centro de la partícula viral se halla el complejo ribonucleoproteico (segmentos de ARN viral y las proteínas polimerasa básica 1, polimerasa básica 2 [PB2] y polimerasa ácida [PA]), la nucleoproteína (NP), la proteína de exportación nuclear y la proteína no estructural 2. El genoma es de ARN de cadena simple y segmentado en 8 partes, que dan origen a entre 8 y 12 proteínas del virus11–16.
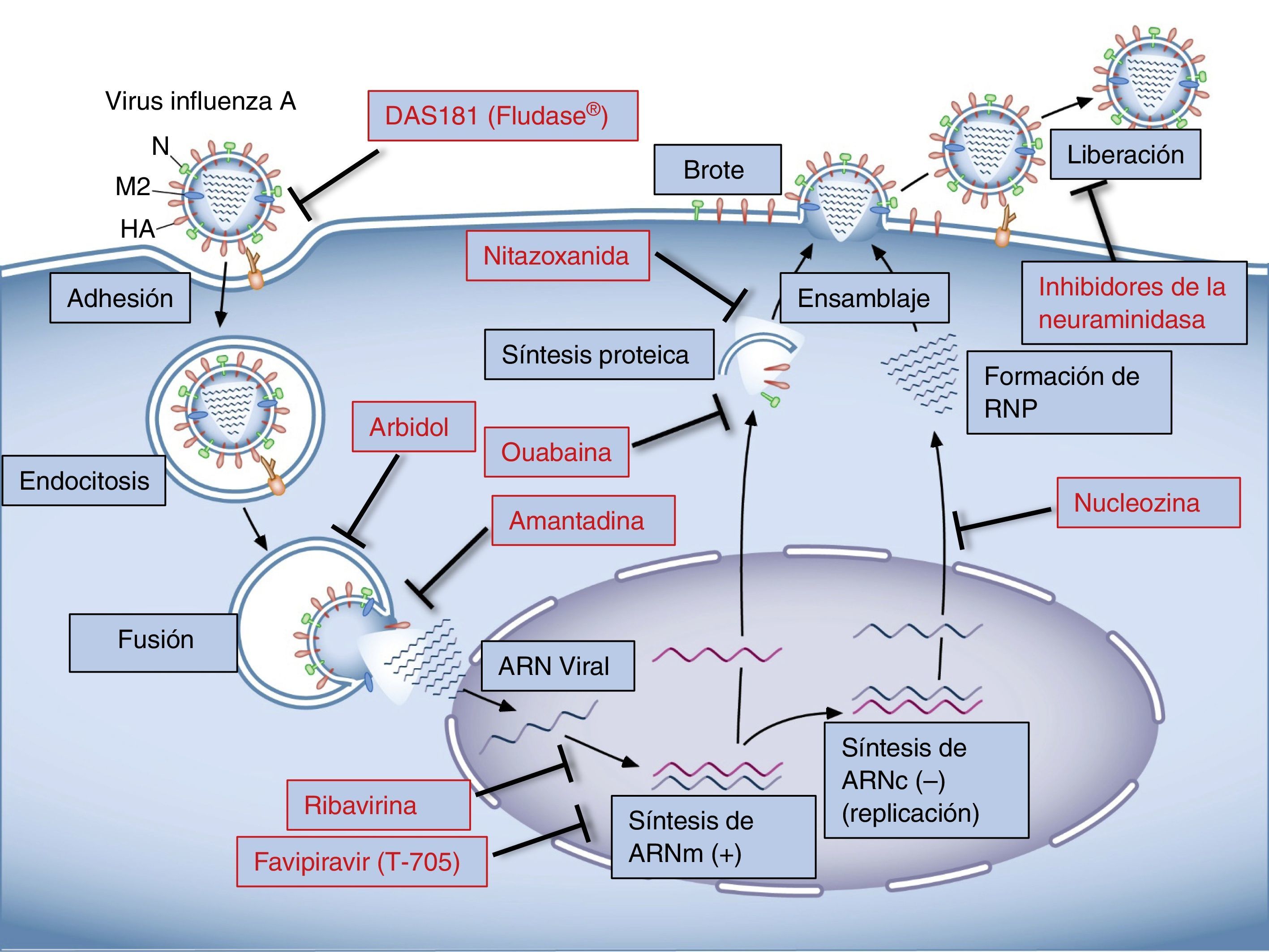
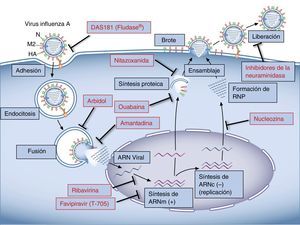
El ciclo viralEl anclaje a la célula huésped se da a través de la unión de la HA del virus con el ácido siálico de las glucoproteínas o glucolípidos de la membrana celular17. Las especies de influenza que afectan a humanos reconocen preferentemente el ácido siálico unido a galactosa por una unión α2,6 (SA α2,6Gal), que abunda en las células epiteliales del tracto respiratorio18,19. Una vez el virus se une al receptor de membrana, ingresa a la célula huésped por endocitosis y se libera en el citoplasma celular fusionando su membrana con la del endosoma. La HA viral es clave en este paso, ya que al ser escindida por proteasas del huésped20,21 expone una región conocida como «péptido de fusión» que interactúa con la membrana del endosoma y determina la fusión de las membranas liberando el contenido del virión al citoplasma celular22–24. Un paso importante para este proceso es la acidificación del endosoma que ocurre a través de un canal iónico formado por la proteína viral M2. Por este canal ingresan protones y favorecen la separación de la proteína de matriz M1 y el complejo ribonucleoproteico del virus, que es así liberado al citoplasma para su posterior importación nuclear25–27. Una vez en el núcleo, el ARN viral es transcrito a ARN mensajero (ARNm), que es poliadenilado, hecho fundamental para la expresión de las proteínas virales28. La traducción de las proteínas virales es llevada a cabo por la maquinaria de la célula huésped, y una vez sintetizadas las proteínas PA, PB y NP son importadas al núcleo para facilitar la transcripción y replicación del ARN viral. Los complejos de ribonucleoproteína son luego exportados del núcleo, para lo cual son fundamentales la proteína no estructural 2, la proteína de exportación nuclear y la M1. Las proteínas virales HA, NA y M2 son glucosiladas en el retículo endoplásmico y transportadas a través de la red Golgi hasta la membrana celular29. Las ribonucleoproteínas y los 8 segmentos virales una vez transportados a la membrana celular son empaquetados para generar los nuevos brotes virales. Varias proteínas estructurales del virus, como HA, NA y M2, contribuyen al proceso de brote por su interacción con la membrana lipídica celular29. El proceso finaliza cuando las membranas se fusionan en la base del brote y el virus se escinde mediante la acción de la NA, que cataliza la remoción del ácido siálico de las glucoproteínas de superficie30.
TerapéuticaFármacos actualmente utilizadosDe los 5 fármacos antiinfluenza actualmente disponibles, solo 3 son recomendados por la Food and Drug Administration de los Estados Unidos para esta temporada: oseltamivir (Tamiflu®) vía oral, zanamivir (Relenza®) vía inhalatoria y peramivir (Rapivab®) vía intravenosa, todos inhibidores de la NA31. Los inhibidores del canal iónico M2, amantadina y rimantidina, no están recomendados dado que los virus circulantes poseen una gran tasa de resistencia a estas y que no poseen efecto en los virus influenza tipo B ni C32.
Inhibidores del canal iónico M2Los derivados del adamantano, como amantadina y rimantadina, son fármacos con conocido efecto antiinfluenza A y han sido la primera opción para el tratamiento de la gripe durante muchos años. Su acción consiste en la unión a un bolsillo específico de la proteína viral M2, estabilizando su conformación cerrada e impidiendo que después de la fusión, el virus pueda liberar el complejo ribonucleoproteico al citoplasma para seguir adelante con el ciclo viral33. También se ha demostrado que la amantadina puede afectar el pH de las vesículas que transportan las glucoproteínas virales, interfiriendo así con el proceso de ensamblaje34.
A causa de la resistencia viral a estos fármacos se han desarrollado nuevos compuestos estructuralmente relacionados, como los azoloadamantanos35,36. Sin embargo, no hay fármacos de este grupo con actividad probada contra todos los virus circulantes resistentes a amantadina.
Inhibidores de la neuraminidasaPoseen actividad contra influenza A y B; oseltamivir y zanamivir son los más antiguos, y los de las nuevas generaciones son peramivir y laninamivir. Estos fármacos impiden la escisión del ácido siálico inhibiendo la liberación del virión, evitando que las nuevas partículas virales se diseminen a otras células37. La resistencia global a los inhibidores de la NA es menos del 2% de los virus circulantes en 2013-2014; sin embargo, se han identificado virus en comunidades localizadas (Japón, China, Australia) que poseen alta resistencia a estos fármacos38. Es prometedor el desarrollo de nuevas moléculas inhibidoras de la NA, con actividad frente a cepas resistentes a los fármacos actualmente disponibles39–42.
En la práctica clínica los inhibidores de la NA son los únicos antigripales actualmente recomendados; entre ellos, oseltamivir es el más utilizado, dada su buena biodisponibilidad para uso oral. Sin embargo, existe un intenso debate sobre la interpretación de los estudios clínicos que avalan su eficacia. Un metaanálisis realizado por el grupo Cochrane en 2014 evidenció un modesto beneficio del tratamiento con oseltamivir en casos de gripe leve, con una reducción de la duración de los síntomas de 7 a 6,3 días en adultos y una reducción de los síntomas en niños sanos; sin embargo, no mostro beneficio en niños asmáticos. La tasa de hospitalización de los pacientes con oseltamivir fue similar a la de los no tratados43. De un metaanálisis publicado en Lancet en 2015 surge que para los casos leves de infección por influenza confirmada, el tratamiento con oseltamivir disminuye el tiempo de síntomas, las infecciones respiratorias bajas y las admisiones hospitalarias. En ambos estudios se reportan las náuseas y los vómitos como principales efectos secundarios44. En cuanto a las presentaciones severas de la gripe, si bien no existen trabajos clínicos aleatorizados, estudios observacionales indican un beneficio del uso de oseltamivir con una reducción significativa de la tasa de mortalidad para casos graves45–47. Las guías de práctica clínica recomiendan el inicio precoz de antivirales para el tratamiento de casos graves de influenza confirmada que requieren hospitalización o en pacientes con riesgo de complicaciones severas, como menores de 2 o mayores de 65 años, portadores de enfermedad pulmonar crónica, inmunosuprimidos, obesos mórbidos, mujeres embarazadas o puérperas de menos de 2 semanas. La quimioprofilaxis posexposición se puede considerar en personas con alto riesgo de complicaciones o no inmunizados, y siempre iniciarla en las primeras 48h posexposición. El fármaco de primera línea es oseltamivir, mientras que el uso de zanamivir inhalatorio, nebulizado o intravenoso está indicado en caso de cepas resistentes a oseltamivir o mala absorción intestinal. La dosis indicada de oseltamivir es de 75mg 2 veces por día para tratamiento y una vez por día para quimioprofilaxis, y para zanamivir inhalatorio, de 10mg 2 veces por día para tratamiento y una vez por día para quimioprofilaxis; este último no está recomendado en casos de asma o EPOC. La duración del tratamiento debe ser de 5 días, pudiendo prolongarse en casos graves, mientras que para la profilaxis se recomienda 10 días tanto para oseltamivir como para zanamivir32,48,49.
Otros grupos farmacológicosExiste una considerable cantidad de fármacos que han sido ensayados por su potencial antiviral, pero aún no están disponibles para su uso en la clínica. Describiremos los grupos más importantes.
Fármacos activos ante componentes del virusInhibidores de la unión y la fusión viralLigandos sintéticos de la HA viral: este grupo comprende una variedad de moléculas capaces de ser reconocidas por la HA viral, interfiriendo así en la interacción virus-célula. Ejemplos de ello son MBX2329 (un amino éster de fenil alquilo) y MBX2546 (una sulfonamida), que inhiben la entrada del virus influenza A mediante su unión al tallo de la HA, interfiriendo con la fusión viral50. También se han estudiado péptidos sintéticos análogos al ácido siálico que son reconocidas por la HA viral e inhiben su acción51, y antagonistas del péptido de fusión que interrumpen el cambio conformacional de HA necesario para la correcta fusión del virus a la célula52.
Arbidol: fármaco sintético actualmente aprobado para el tratamiento de la gripe en Rusia y China, pero no en EE. UU. dada la insuficiente evidencia clínica49. Se trata de una molécula hidrofóbica que penetra la membrana lipídica de virus encapsulados e interacciona con los fosfolípidos de membrana y proteínas transmembrana ricas en residuos aromáticos de la envoltura viral, interfiriendo con los procesos de entrada y fusión a la célula huésped53,54. Un estudio clínico multicéntrico aleatorizado (ARBITR) mostró en pacientes con influenza tratados con arbidol, un acortamiento de la enfermedad con reducción de la severidad y de la emisión de virus55.
Se han identificado cepas de influenza resistentes a arbidol por mutaciones en la subunidad HA2, permitiendo que el virus prosiga con el proceso de fusión a la membrana del endosoma56. La síntesis de compuestos estructuralmente relacionados abre una puerta a nuevos antivirales, tal es el caso de indoles sintéticos que en estudios in vitro presentan mayor potencia antiviral que arbidol sobre ciertos subtipos de influenza A57.
Anticuerpos anti-HA: se han desarrollado anticuerpos monoclonales contra sitios altamente conservados de HA, capaces de neutralizar cepas de virus influenza. Como ejemplo, el anticuerpo CH65, descrito a partir de la muestra de un paciente con vacuna antiinfluenza en 2007, ha demostrado ser eficaz in vitro contra un amplio espectro de cepas de influenza H1N1, gracias a su unión en el bolsillo de unión de la subunidad HA158. El anticuerpo D1-8 ha mostrado eficacia para neutralizar diferentes cepas de virus influenza H3N2 in vitro e in vivo, logrando en ratones una mayor supervivencia comparado con el tratamiento con oseltamivir59. También los anticuerpos dirigidos contra el tallo de la proteína HA pueden ser eficaces contra el virus influenza. El HB36.6 ha mostrado eficacia contra diferentes cepas de H1N1 y H5N1 in vitro, mientras que en ratones demostró reducir la replicación viral y mejorar la supervivencia60.
Inhibidores de la polimerasa viralLa polimerasa viral es una proteína altamente conservada entre las distintas cepas de influenza, siendo un objetivo terapéutico de interés.
Favipiravir (T-705): es una molécula capaz de convertirse dentro de la célula en un análogo nucleósido, el ribonucleótido T-705-4-ribofuranosil-5’-monofosfato, que inhibe la actividad de la ARN polimerasa viral sin afectar la síntesis celular de ARN ni ADN61. Se ha demostrado su eficacia frente a distintas cepas de influenza62–64.
Inhibidores de PB2: para la traducción del ARNm viral se requiere un iniciador 5’cap, que el virus «roba» del pre-ARNm del huésped. En este proceso es esencial la unión de la subunidad PB2 a la caperuza 5’ del pre-ARNm del huésped y la subsecuente escisión del extremo 5’ por la proteína PA con actividad endonucleasa65,66. Los fármacos en estudio que interfieren con este proceso tienen un gran potencial como antivirales67. Tal es el caso de VX-787, que ha demostrado actividad in vivo contra diversas clases de influenza A, siendo eficaz tanto en profilaxis como en tratamiento68,69.
Inhibidores de la nucleoproteínaLa nucleoproteína se une al ARN viral y forma parte del complejo ribonucleoproteico. Es fundamental para la síntesis del ARN viral y también participa en la exportación nuclear de las ribonucleoproteínas virales y en el tráfico citoplasmático70.
Nucleozina: es el fármaco más estudiado de este grupo. Se ha demostrado que posee actividad antiviral en diferentes tiempos del ciclo del virus: en fases tempranas inhibe la transcripción de ARN viral y la síntesis proteica, y en fases tardías bloquea el tráfico citoplasmático de las nuevas ribonucleoproteínas71. Recientemente se han desarrollado análogos a la nucleozina con potencia antiviral ante diferentes especies de influenza A72.
Naproxeno: es un inhibidor de la ciclooxigenasa 2 cuya actividad antiinfluenza ha sido identificada recientemente. Se ha evidenciado que forma complejos con la NP e inhibe competitivamente la unión de NP al ARN. Tiene potencia in vitro e in vivo contra virus influenza A73. También se han sintetizado derivados de naproxeno con potencial efecto antiviral, que están en estudio74.
Inhibidores de la proteína NS1NS1 es una proteína multifuncional que se une al ARNm y regula pasos posteriores a la transcripción: se une al ARN de cadena doble bloqueando la inhibición de la transcripción por parte de la cinasa PKR75,76 e inhibe la exportación nuclear de ARNm poliadenilado del huésped77–79. Además, NS1 protege al virus de la defensa celular antiviral inhibiendo la respuesta mediada por interferón80–82. Se han desarrollado distintos fármacos que inhiben la actividad de NS183. Por ejemplo, NSC125044 y sus derivados84, entre ellos el compuesto JJ3297, afectan la replicación del virus in vitro restableciendo el efecto antiviral del interferón85. La baicalina ha demostrando actividad antiinfluenza in vitro e in vivo, ejerciendo su efecto mediante la alteración del dominio de unión de la proteína NS186.
Fármacos activos ante componentes del huéspedEl conocimiento de las funciones celulares necesarias para el ciclo viral ha permitido identificar objetivos terapéuticos para el diseño de fármacos antivirales. Modular la respuesta del huésped es una estrategia que minimiza el desarrollo de cepas resistentes, dado que estos no están sujetos a la variabilidad genética que tiene el virus. Por otro lado, el riesgo de efectos secundarios asociados al tratamiento es una desventaja. Investigaciones sobre la interacción entre proteínas virales y del huésped describieron una extensa red con más de 130 interacciones entre 10 proteínas virales y 87 proteínas humanas87. Análisis más recientes identificaron 91 factores del huésped cuya inhibición previene la replicación viral in vitro88. Del análisis informático de base de datos de fármacos surgen cientos de moléculas que interactúan con factores del huésped esenciales para la replicación viral; la mayoría de estas son fármacos actualmente utilizados con otros fines terapéuticos89.
Anclaje y fusión viralDAS181 (Fludase®): es una proteína desarrollada fusionando el dominio catalítico de NA con una secuencia de anclaje a la superficie de las células del epitelio respiratorio, cuya función es escindir los residuos de ácido siálico de la superficie celular, evitando así la entrada del virus a la célula. Ha demostrado actividad antiinfluenza A y B en experimentos con animales; sin embargo, estudios clínicos no han mostrado eficacia en la mejoría de los síntomas de la gripe90,91.
Aprotinina: es un polipéptido que inhibe las proteasas del huésped que escinden la HA viral. Interfiere así con el proceso de unión y fusión del virus a la célula, teniendo actividad antiinfluenza in vitro e in vivo92,93. Últimamente se han desarrollado otros compuestos sintéticos, inhibidores de las serín proteasas del epitelio respiratorio con eficacia in vitro antiinfluenza94.
Endocitosis y fusiónGlicirrizina: es un compuesto que ha mostrado actividad antiinfluenza A al alterar la estabilidad de la membrana lipídica de la célula huésped, impidiendo el proceso de endocitosis de virus encapsulados95–97.
LJ001: es una molécula de similar mecanismo de acción que glicirrizina y afecta el proceso de fusión del virus con la célula. Posee efecto antiviral de amplio espectro contra virus encapsulados, incluyendo influenza A98.
Bafilomicina A1 y concanamicina A: antibióticos macrólidos que inhiben la acción de la H+ ATPasa vacuolar que bombea protones desde el citoplasma celular al interior del endosoma99,100. Más recientemente se ha estudiado la salifenilhalamida, otro inhibidor de la H+ ATPasa vacuolar, mostrando eficacia antiviral101.
Brote y salida del virusLa enzima farnesil difosfato sintasa, que participa en la síntesis de compuestos lipídicos de la membrana plasmática, es inhibida por la proteína viperina, cuya expresión es inducida por interferón. Se ha demostrado que dicha inhibición altera la composición de la membrana plasmática celular, interfiriendo con el ensamblaje y brote de las partículas virales. La enzima farnesil difosfato sintasa ha sido propuesta como potencial objetivo para el desarrollo de fármacos con actividad antivirus influenza102.
Transcripción y transporte del ARN viralLa proteína chaperona Hsp90 participa en la importación nuclear del ARN viral y en el ensamblaje de la polimerasa del virus, y se ha demostrado que se une a la proteína PB2, transportándose al núcleo junto con ella y modulando la interacción entre proteína polimerasa básica 1 y PA103. Inhibidores de Hsp90 como geldanamicina y su derivado sintético 17-AAG han demostrado actividad contra virus influenza en cultivos celulares104.
Ribavirina y su precursor viramidina: son antivirales de amplio espectro. Ribavirina (Virazole®), usada en el tratamiento del virus de la hepatitis C, es un análogo del nucleótido guanosina y su principal mecanismo de acción es la inhibición competitiva de la enzima inosina 52 monofosfatasa deshidrogenasa de la célula huésped, afectando la biosíntesis de GTP y, por lo tanto, la síntesis del ARN viral y la producción de proteínas virales105. A pesar de haber obtenido resultados positivos en animales106, los estudios clínicos no han demostrado eficacia que avale su uso107,108.
Exportación del complejo ribonucleoproteico viral y procesos postranscripcionalesVerdinexor (KPT-335): es una molécula que inhibe la proteína exportina 1 necesaria para la salida del complejo ribonucleoproteico del virus del núcleo al citoplasma. Se ha demostrado que posee actividad antiviral frente a diferentes cepas de influenza109.
Nitazoxanida: es un fármaco antiparasitario con actividad ante diferentes cepas de virus influenza A, ya que inhibe la maduración de la HA viral110. Un estudio clínico aleatorizado demostró una reducción de los síntomas en pacientes con infección por influenza no complicada111.
Vías de defensa intracelularesLa vía Raf/MEK/ERK pertenece a la familia de las mitogen activated protein kinases –MAPK– y es activada por los virus influenza. Su bloqueo inhibe la exportación nuclear de ribonucleoproteínas por su interacción con la proteína viral de exportación nuclear112,113. Experimentos in vivo muestran que la administración del compuesto U0126, un inhibidor de MEK, reduce la carga viral en tejido pulmonar y mejora la supervivencia de ratones infectados con influenza114. La asociación de inhibidores de MEK con oseltamivir aumenta la eficacia antiviral in vitro de este último115.
La vía del factor de transcripción NF-κB regula la expresión de citocinas antivirales cuya activación ha sido asociada con un incremento en la replicación de virus influenza116,117. El ácido acetil salicílico que inhibe la IKK2, cinasa activadora de IκB, tiene efecto antiviral, alterando la exportación nuclear de ribonucleoproteínas virales118. La modulación de esta vía es promisoria para el desarrollo de nuevas terapias.
Otros agentes con potencial actividad antiinfluenzaGran variedad de fármacos utilizados para otras enfermedades han sido identificados como inhibidores de la replicación del virus influenza mediante ensayos in vitro. Por ejemplo, se ha demostrado que los inhibidores de la Na,K-ATPasa poseen actividad antiviral frente a distintos tipos de virus ADN y ARN. Los glucósidos cardiotónicos, inhibidores específicos de la Na,K-ATPasa, tienen una potente actividad in vitro ante citomegalovirus y otros herpes virus; particularmente la ouabaína ha demostrado inhibir la síntesis de proteínas virales119,120. El virus del ebola también puede ser inhibido in vitro por la ouabaína121; en los coronavirus el principal mecanismo inhibitorio de la ouabaína está dado por la activación de la vía de señalización intracelular de la cinasa Src y la inhibición del proceso de fusión122. Los reovirus también son susceptibles a la acción de la ouabaína por alteración de la fusión viral123. La digoxina, otro inhibidor de la Na,K-ATPasa, es activo in vitro frente al vaccinia virus124. Recientemente se ha encontrado que diferentes miembros de la familia de glucósidos cardiotónicos inhiben la replicación del virus de influenza A in vitro125,126.
En resumen, el tratamiento antigripal continúa siendo un desafío. Los fármacos actualmente utilizados son dirigidos a componentes virales y, por tanto, su eficacia puede verse afectada por los cambios genéticos propios del virus influenza. En los últimos años se han estudiado y desarrollado gran cantidad de fármacos dirigidos a modular la respuesta celular del huésped. Dado que tienen efecto ante distintas cepas del virus y minimizan la emergencia de especies resistentes, son promisorios como nuevos agentes para la terapia antiviral (fig. 1).
FinanciaciónEste artículo fue financiado en parte por subsidios de los National Institutes of Health, HL-48129 y HL-71643.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.