Algunos estudios han analizado la precisión de los instrumentos autoajustables de presión positiva continua (auto-CPAP) para determinar el índice de apnea-hipopnea (IAH) residual1–7, pero no se ha confirmado la de los equipos de servoventilación adaptativa (SVA), a pesar de que estos datos orientan el tratamiento y pueden influir notablemente en el tratamiento óptimo de los episodios respiratorios con el ajuste de presión prescrito.
Evaluamos la precisión de los dispositivos de SVA para detectar episodios respiratorios en 7 pacientes con apneas centrales/respiración de Cheyne-Stokes (AC/RCS) y en 9 con síndrome de apneas complejas del sueño (SACS), diagnosticados mediante poligrafía respiratoria (PR) o PSG convencional. Las AC se definieron como la constatación de un IAH>15 con predominio de apneas centrales (>50%), según los criterios de la AASM de 20078. El SACS se definió como la presentación de AC (IAC>15h) durante el aumento gradual de CPAP9 en pacientes que al inicio del estudio presentaban apnea obstructiva del sueño que persistió durante el seguimiento con CPAP.
Se ofreció tratamiento con SVA a todos los pacientes. La marca del dispositivo dependió de la compañía contratada por el Servei Català de la Salut, que proporcionó tratamiento gratuito a los pacientes. El AutoSet CS®, que no permite ajustes automáticos de presión espiratoria (EPAP) se configuró con: EPAP de 6cm de H2O, presión de soporte (PS) mínima de 3cm de H2O y presión máxima (Pmax) de 25cm de H2O. Los parámetros de configuración del BiPAP autoSV Advanced® fueron los siguientes: EPAP mínima de 4cm de H2O, EPAP máxima de 10cm de H2O, PS mínima de 0cm de H2O y PS máxima de 25cm de H2O.
Al cabo de 3 meses, los pacientes se sometieron a una PSG con el dispositivo de SVA, y el IAH obtenido a partir del análisis del software del dispositivo (IAH-SVA) se comparó con el obtenido de forma manual a partir de la PSG (IAH-PSG) durante el tiempo total de sueño (IAH-PSG-TTS) y el tiempo de grabación (IAH-PSG-TG). Para el análisis se registraron las fugas obtenidas de la tarjeta inteligente de la SVA.
La concordancia entre el IAH-PSG y el IAH-SVA se examinó con un gráfico de Bland y Altman10. La existencia de una asociación entre la fuga de la mascarilla y la diferencia entre el IAH-PSG y el IAH-SVA se evaluó mediante la correlación de Friedman.
Los valores se expresaron con la mediana (percentiles: 25-75) o la media±DE.
Quince pacientes eran varones (93,7%), y no se observaron diferencias significativas entre los sujetos con AC o SACS en los parámetros basales de edad (67 [63-79] años vs. 73 [63-78]) años, índice de masa corporal (28 [25-32] kg/m2), puntuación de Epworth (4 [3-6] vs. 6 [4-13]) o IAH (50 [48-81] vs. 46 [41,5-60,5]).
Dos de los 16 pacientes declinaron el tratamiento con SVA. Los pacientes con SACS que previamente habían recibido tratamiento con CPAP durante 284 días (34-902) fueron tratados con los dispositivos BiPAP autoSV Advanced® (n = 2) o AutoSet CS® (n = 6), y los pacientes que presentaban AC/RCS con los dispositivos BiPAP autoSV Advanced® (n=2) o AutoSet CS® (n=4).
La PSG efectuada a los 3 meses con el dispositivo mostró la resolución de las AC. En 2 casos no fue posible descargar los datos del dispositivo de SVA (uno con BiPAP autoSV Advanced® y uno con AutoSet CS®).
En los 12 pacientes, el IAH-SVA (3,3 [1,3,4]) fue significativamente más bajo que el IAH-TTS o IAH-TG (10,6 [4,8-20,2]; p=0,005 y 7,5 [3,8-15,7]; p=0,008, respectivamente). El IH derivado del dispositivo de SVA también fue significativamente más bajo que el IH-PSG-TTS (2,8 [1-3,9] vs. 9,5 [3-20]); p=0,005) y el IH-PSG-TG (7,4 [2,5-15,5]; p=0,010).
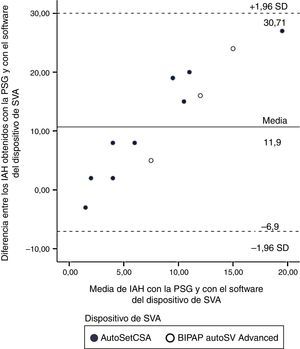
En la figura 1 se muestra el gráfico de Bland y Altman de la diferencia entre el IAH-PSG y el IAH-SVA frente a la media de ambas mediciones, con una diferencia media de 11,9±9,6 (intervalo de confianza 95%: –6,90, 30,71), que fue mayor para valores de IAH residual más altos.
Gráfico de Bland y Altman10 de la diferencia entre el IAH obtenido durante la PSG y el obtenido mediante el software del dispositivo de SVA, respecto a la media de IAH de la PSG y del software del dispositivo de SVA.
IAH: índice de apnea-hipopnea; PSG: polisomnografía; SVA: servoventilación adaptativa
El IAH-PSG fue inferior a 10 episodios/h en 6 de los 14 pacientes (42,8%) e inferior a 15 en 8 de los 14 pacientes (57,1%), mientras que según el IAH-SVA el IAH fue inferior a 10 en todos los pacientes.
No se observó ninguna correlación significativa entre las fugas de la mascarilla y la diferencia media entre el IAH-PSG y el IAH-SVA de la tarjeta inteligente (r=–0,423; p=0,256) en los pacientes que utilizaron el dispositivo AutoSet CS®. En los pacientes que utilizaron el BiPAP autoSV Advanced® no se observaron fugas importantes.
La precisión del software interno para estimar el IAH residual con dispositivos auto-CPAP1–7 se ha analizado en algunos estudios, pero, por lo que sabemos, no se ha publicado ninguna información relativa a los dispositivos de SVA. Aunque, de acuerdo a los datos del software, los dispositivos de SVA trataron de forma adecuada los episodios respiratorios de todos los pacientes, de acuerdo a las codificaciones de la PSG el tratamiento fue subóptimo en un número sustancial de pacientes. Así, el software del dispositivo de SVA infraestimó el IAH, a expensas de la infraestimación de las hipopneas. Como posibles explicaciones de las variaciones en las codificaciones manuales de la PSG observadas en diferentes estudios que han analizado dispositivos auto-CPAP se ha apuntado la variabilidad entre observadores, especialmente para identificar las hipopneas, y los diferentes criterios utilizados para codificarlas1,7. En nuestro estudio, el mismo médico codificó manualmente los episodios respiratorios con el tratamiento con SVA. Una explicación más plausible de este hecho son las diferencias en los criterios de codificación de las hipopneas entre las detecciones manuales y automáticas de los episodios residuales. El criterio de codificación manual de la hipopnea fue una reducción del flujo aéreo del 50% seguida de una desaturación de al menos el 3% y/o despertar8, mientras que la detección de episodios respiratorios con el software del dispositivo de SVA no tiene en cuenta la saturación de oxígeno ni el despertar del sueño. Otra explicación podrían ser las diferencias entre el tiempo de sueño en la PSG y el tiempo de grabación. Pese a ello, el IAH-SVA calculado en función de la eficiencia del sueño o del tiempo de grabación fue significativamente más bajo que el IAH-PSG. Finalmente, la infraestimación de los episodios residuales del software del dispositivo de SVA también podría indicar la presencia de fugas excesivas, aunque durante la PSG con el dispositivo de SVA no observamos ninguna correlación significativa entre las fugas de las mascarillas y la diferencia entre el IAH-PSG y el IAH-SVA de la tarjeta inteligente.
Aunque examinamos 2 poblaciones de pacientes con AC y 2 dispositivos de SVA, no hubo diferencias en las características basales de ambos grupos y en todos los sujetos con AC y con SACS se identificó el efecto de la SVA sobre las AC con ambos dispositivos. No obstante, el reducido número de pacientes que utilizó cada dispositivo no nos permitió efectuar un análisis comparativo de la precisión de los software de los dispositivos.
En resumen, el IAH derivado del software del dispositivo infraestimó significativamente el IAH codificado de forma manual durante la PSG, con un sesgo medio de 11, a expensas de las hipopneas, y en mayor grado con IAH residuales más altos. Todavía no se conoce la importancia clínica del IAH residual en estos pacientes, muchos de los cuales padecen insuficiencia cardíaca. Es necesario llevar a cabo más estudios para confirmar estos resultados y conocer si son o no aplicables a alguna marca de dispositivos de SVA.
AutoríasMaría Guadalupe Silveira: análisis de datos y redacción del manuscrito.
Gabriel Sampol: diseño del estudio y revisión del manuscrito.
Roser Cambrodi y Àlex Ferre: recogida de datos.
Patrícia Lloberes: diseño del estudio, redacción del manuscrito y supervisión.
Los autores desean dar las gracias a Yvette Jusseaume por la traducción al inglés del manuscrito, y a Rosa Llòria por su asistencia editorial.