La enfermedad del pulmón de granjero (EPG) es una forma de neumonitis por hipersensibilidad (NH) producida por la inhalación de microorganismos procedentes del heno o grano almacenado en condiciones de alta humedad en el ámbito laboral agrícola. Se trata de una enfermedad probablemente infradiagnosticada, sobre todo en el Norte de España, donde las condiciones climáticas son propicias para el desarrollo de la misma.
Según estudios previos los antígenos más frecuentes suelen ser hongos y actinomicetos termofílicos. La epidemiología de la enfermedad no es del todo bien conocida, y se basa en estudios realizados por grupos centroeuropeos y asiáticos.
La presentación clínica puede ser variada, diferenciándose las formas agudas (tras exposición a elevadas concentraciones del antígeno) y las crónicas (exposición a menores concentraciones del antígeno, pero más prolongada en el tiempo). En estos casos es esencial, en aquellos pacientes con clínica respiratoria durante la exposición laboral agrícola, demostrar una radiología y función pulmonar compatible, así como una sensibilización al antígeno, una linfocitosis en el lavado broncoalveolar en su caso y/o una anatomía patológica concordante.
El tratamiento principal es la evitación antigénica, por lo que la educación de los pacientes en las medidas preventivas es fundamental. Por el momento, no existen estudios controlados que permitan evaluar el papel de tratamientos inmunosupresores en esta enfermedad. El tratamiento con corticosteroides solo ha demostrado acelerar la resolución de las formas agudas, pero no hay estudios que demuestren su efectividad a largo plazo, con el fin de evitar la progresión de la enfermedad ni disminuir su mortalidad.
Farmer's lung disease (FLD) is a form of hypersensitivity pneumonitis (HP) caused by inhaling microorganisms from hay or grain stored in conditions of high humidity in the agricultural workplace. It is probably underdiagnosed, especially in northern Spain, where climatic conditions favor the development of this disease.
According to previous studies, the most common antigens are usually thermophilic actinomycetes and fungi. The epidemiology of the disease is not well known, and is based on studies conducted by Central European and Asian groups.
The clinical presentation may vary, differentiating the chronic (exposure to lower concentrations of the antigen over a longer period time) and the acute forms (after exposure to high concentrations of the antigen). In patients with respiratory symptoms and agricultural occupational exposure, radiological, lung function and/or anatomical pathology findings must be compatible with FLD, bronchoalveolar lavage must show lymphocytosis, and tests must find sensitivity to the antigen.
The main treatment is avoidance of the antigen, so it is essential to educate patients on preventive measures. To date, no controlled studies have assessed the role of immunosuppressive therapy in this disease. Corticosteroid treatment has only been shown to accelerate resolution of the acute forms, but there is no evidence that it is effective in preventing disease progression in the long-term or reducing mortality.
La enfermedad del pulmón de granjero (EPG), descrita por primera vez en el año 1932 por Campbell, constituye una de las formas más prevalentes de neumonitis por hipersensibilidad (NH)1. Se produce por la inhalación de microorganismos presentes en el heno, polvo de grano o paja almacenados en condiciones de alta humedad. En algunos países supone una importante causa de morbilidad entre los trabajadores agrarios2,3. En nuestro país, las publicaciones son escasas4–6, lo que contrasta con las amplias series publicadas en regiones con condiciones climáticas similares a las regiones del Norte de nuestro país.
EpidemiologíaDeterminar con exactitud la prevalencia de la EPG es difícil, ya que se trata de una entidad influenciada por factores como el clima o la zona geográfica analizada, las costumbres locales y las diferencias en la naturaleza e intensidad de la exposición antigénica7. Se ha estimado que entre el 0,5% al 3% de granjeros podrán desarrollar un cuadro de EPG, lo cual se asocia a una mayor mortalidad. Estudios más recientes realizados en granjeros asiáticos han descrito una prevalencia menor al 6%7,8, pero disponemos de pocos estudios epidemiológicos realizados en nuestro entorno9.
EtiologíaLos antígenos responsables de la mayoría de los casos de NH, incluida la EPG, son bacterias. Los actinomicetos termófilos son los agentes más frecuentemente descritos. Las especies de actinomicetos termófilos incluyen Saccharopolyspora rectivirgula (previamente conocida como Micropolyspora faeni, descrito como principal antígeno de la EPG), Thermoactinomyces vulgaris, Thermoactinomyces viridis y Thermoactinomyces sacchari, entre otros. Estos organismos se reproducen en zonas de elevada humedad y temperaturas de 40-60°C. Se aíslan con frecuencia en graneros contaminados (por heno enmohecido y otras hierbas de forraje), vaquerías y plantas de compostaje. Estos son algunos de los agentes etiológicos más descritos en estudios realizados en Europa y Norteamérica10,11, pero el granjero también se expone a otros hongos y fragmentos de hongos que también pueden inducir EPG como son Alternaria, Aspergillus fumigatus y Botrytis11,12. Por lo tanto, la EPG es frecuente en las regiones ganaderas, sobre todo en las estaciones lluviosas y frías, en las cuales las condiciones climáticas suponen un aumento en las concentraciones de microorganismos existentes en el heno almacenado (fig. 1)12.
PatogeniaLa patogenia de cualquier NH, incluyendo la EPG, implica una exposición repetida a partículas antigénicas en un paciente susceptible, previamente sensibilizado. El tamaño, la solubilidad, la naturaleza, la resistencia a la degradación enzimática y la capacidad de inducir una respuesta inflamatoria son algunas de las características que van a presentar los antígenos capaces de inducir una respuesta inmunológica. Estos antígenos están implicados en la formación de inmunocomplejos antígeno-anticuerpo, sobre todo del tipo IgG, los cuales van a intervenir en la activación del complemento. La respuesta de anticuerpos no es suficiente para causar la enfermedad, y se requiere también una respuesta citotóxica de linfocitos CD8+. Otro mecanismo implicado es el mediado por los linfocitos, sobre todo del tipo Th1, que es responsable de la alveolitis linfocitaria y de la formación de granulomas1,13. Algunos estudios han demostrado que los linfocitos también están involucrados en la patogenia de esta enfermedad, y la demostración de su estimulación sirve como prueba diagnóstica de la EPG14. Incluso se ha descrito que reacciones de hipersensibilidad inmediata, no debidas a IgE, sino probablemente por IgG4, podrían desempeñar un papel en la génesis de la respuesta inmunológica13,15.
Se dispone de poca información sobre las características singulares del huésped que determinan la susceptibilidad a desarrollar la enfermedad. Es una enfermedad más frecuente en varones de edad media, aunque esto probablemente refleje diferencias en los niveles de exposición. La EPG es más habitual en no fumadores, lo que podría explicarse por el hecho de que el tabaco reduce la respuesta de la IgG a los antígenos inhalados, influye en la producción de citocinas y altera la función de los macrófagos16,17.
Los factores de riesgo ambientales conocidos son la concentración antigénica, la duración de la exposición, el ritmo (frecuencia/intermitencia) de la misma, el uso o no de una protección respiratoria y las características de las prácticas laborales11.
Formas clínicasClásicamente se ha clasificado la NH en 3 grupos (forma aguda, subaguda y crónica), dependiendo principalmente de los hallazgos clínicos y radiológicos en el momento del diagnóstico18:
AgudaSe produce tras exposiciones a altas concentraciones del antígeno en un corto período de tiempo. Los síntomas aparecen a las 4-8h de la exposición, y tienden a desaparecer en un breve período de tiempo. Destacan síntomas inespecíficos como malestar general, febrícula o fiebre y tos seca. En los casos más graves aparece disnea rápidamente progresiva. En la exploración física destaca la presencia de crepitantes finos a la auscultación respiratoria.
SubagudaOcurre tras inhalaciones continuas pero no masivas del antígeno. Los síntomas aparecen de forma más insidiosa. Se caracteriza por malestar general, febrícula, astenia y anorexia, con disnea de aparición progresiva y tos no productiva.
CrónicaAparece tras la exposición a menores concentraciones antigénicas, pero más prolongadas en el tiempo. También está descrita como la evolución de una forma aguda o subaguda no tratada. Presenta habitualmente una clínica de disnea de esfuerzo progresiva y tos seca. En la exploración física son características la presencia de acropaquias y la auscultación de crepitantes secos. En pacientes con episodios agudos recurrentes está descrito el desarrollo de una enfermedad pulmonar obstructiva con enfisema centrolobulillar en lugar de fibrosis19.
Esta clasificación en 3 grupos se ha puesto en cuestión en varias ocasiones, optándose por clasificar la EPG en un estudio únicamente en formas agudas y crónicas. Lacasse et al. analizaron 168 pacientes con NH, agrupándolos en 2 grupos según la presentación clínico-radiológica. El primer grupo, de 41 pacientes, presentaba más síntomas recurrentes como sibilantes, fiebre y no presentaba alteraciones en la radiografía simple de tórax. En cambio, en el segundo grupo, compuesto de 127 pacientes, se objetivaban acropaquias, hipoxemia, una alteración restrictiva funcional respiratoria y radiología de fibrosis establecida. El único dato en común era la presencia de vidrio deslustrado en la tomografía de alta resolución (TCAR) torácica20.
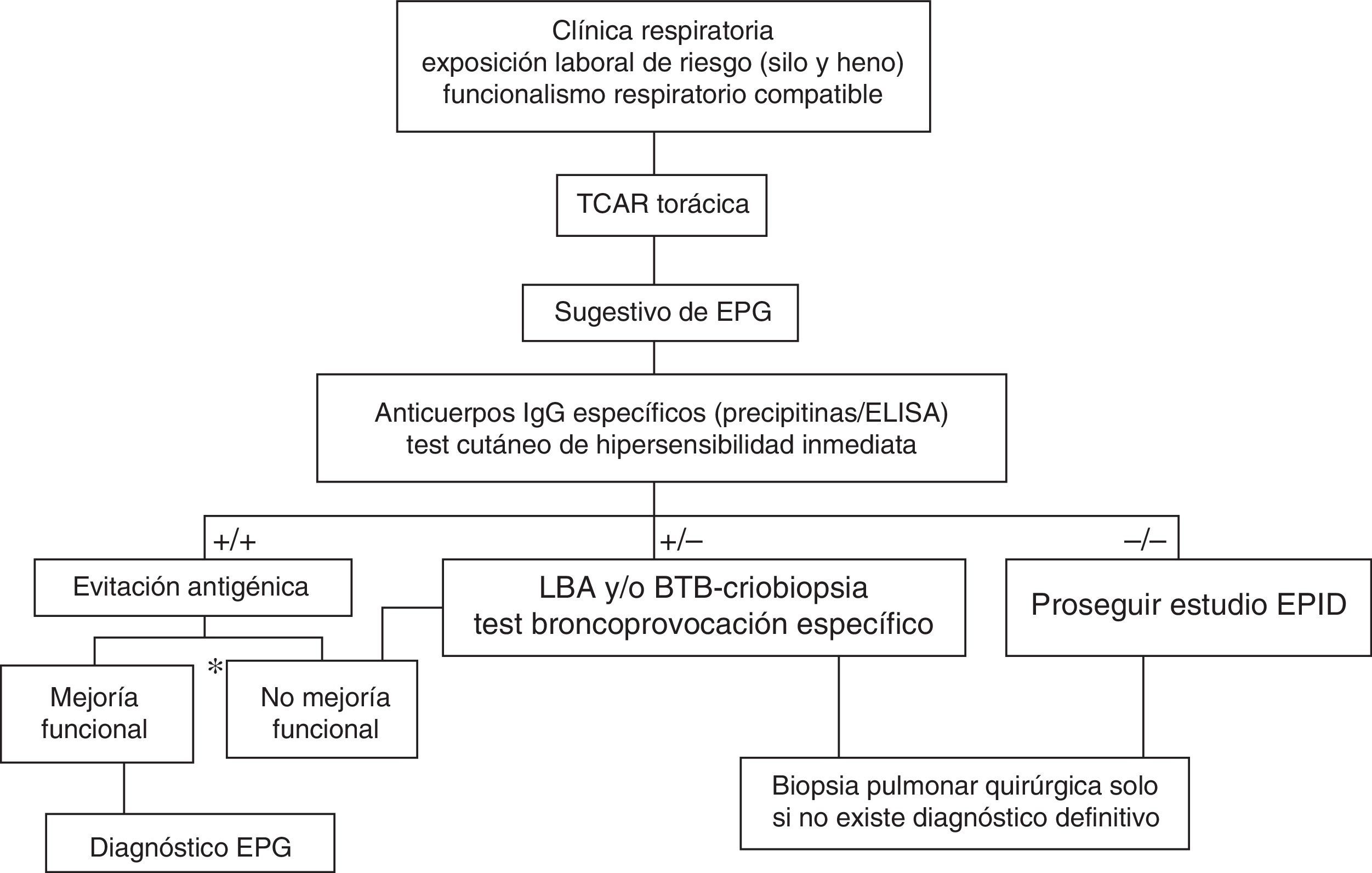
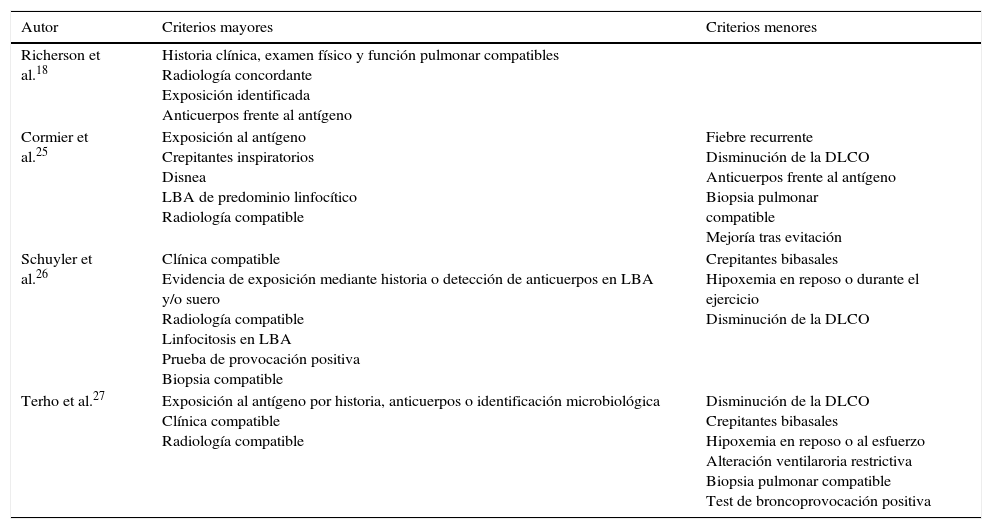
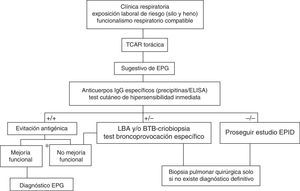
DiagnósticoClásicamente se han propuesto varios criterios diagnósticos para la NH sin estar ninguno de ellos validado. Los principales se resumen en la tabla 1. Al igual que en otras enfermedades pulmonares intersticiales difusas (EPID), partiremos de la sospecha clínica, realizando una historia detallada de las exposiciones laborales y ambientales, con una clínica sugestiva y datos funcionales respiratorios, radiológicos, citológicos en el lavado broncoalveolar (LBA) y anatomopatológicos concordantes21,22 (fig. 2). A partir de aquí realizaremos las siguientes pruebas complementarias:
Principales criterios propuestos para el diagnóstico de neumonitis por hipersensibilidad
| Autor | Criterios mayores | Criterios menores |
|---|---|---|
| Richerson et al.18 | Historia clínica, examen físico y función pulmonar compatibles Radiología concordante Exposición identificada Anticuerpos frente al antígeno | |
| Cormier et al.25 | Exposición al antígeno Crepitantes inspiratorios Disnea LBA de predominio linfocítico Radiología compatible | Fiebre recurrente Disminución de la DLCO Anticuerpos frente al antígeno Biopsia pulmonar compatible Mejoría tras evitación |
| Schuyler et al.26 | Clínica compatible Evidencia de exposición mediante historia o detección de anticuerpos en LBA y/o suero Radiología compatible Linfocitosis en LBA Prueba de provocación positiva Biopsia compatible | Crepitantes bibasales Hipoxemia en reposo o durante el ejercicio Disminución de la DLCO |
| Terho et al.27 | Exposición al antígeno por historia, anticuerpos o identificación microbiológica Clínica compatible Radiología compatible | Disminución de la DLCO Crepitantes bibasales Hipoxemia en reposo o al esfuerzo Alteración ventilaroria restrictiva Biopsia pulmonar compatible Test de broncoprovocación positiva |
Algoritmo diagnóstico propuesto para la enfermedad del pulmón de granjero (EPG).
LBA: lavado broncoalveolar; BTB: biopsia transbronquial.
*Mejoría funcional respiratoria >20% de la FVC, FEV1 y/o de la Dlco.
Fuente: modificado del algoritmo propuesto para el diagnóstico de NH por Morell et al.28.
Es útil solicitar anticuerpos específicos mediante la determinación de anticuerpos específicos de tipo IgG o precipitinas (anticuerpos Ig G precipitantes) en el suero del paciente frente a los diferentes anticuerpos sospechados, con el fin de demostrar que el individuo ha estado expuesto y está sensibilizado al agente causal. Una determinación negativa de precipitinas plasmáticas no nos excluye el diagnóstico, sobre todo en las formas crónicas de la enfermedad, ya que existe correlación entre los títulos de anticuerpos y los niveles de exposición, pudiendo negativizar si no existe contacto durante un periodo de tiempo con el antígeno causal. También existen limitaciones en su determinación: la primera limitación está relacionada con la falta de estandarización de los métodos de análisis, la segunda, en que el panel de precipitinas variará entre diferentes regiones, por lo que será necesario determinar cuáles son los antígenos más frecuentes en cada una de ellas23,24. En este sentido, también es muy recomendable realizar un cultivo para hongos y actinomicetos del heno o del vegetal correspondiente al que está expuesto el paciente.
Debido a que en diversas situaciones puede ser difícil detectar anticuerpos específicos, se han propuesto otros métodos para evaluar la sensibilización. Morell et al.13 estudiaron la rentabilidad diagnóstica del test de inhibición de migración de leucocitos (LMIT) en 20 pacientes con pulmón del granjero y en 24 granjeros asintomáticos. En el primer grupo el test fue positivo en el 95% (19/20), mientras que fue positivo solamente en 44% (11/25) del grupo control; diferencia que resultó estadísticamente significativa (p<0,005). El LMIT también se estudió en 8 pacientes con EPG sin contacto con el antígeno durante el año previo, y resultó positivo en el 87% (7/8). Los autores concluyeron, por tanto, que el test era incluso más efectivo en el diagnóstico de la EPG comparado con los test para anticuerpos específicos, incluso en pacientes que no habían tenido contacto con el antígeno durante el año previo.
El resto de parámetros analíticos son inespecíficos. En las formas agudas podemos observar leucocitosis, así como elevación de los subgrupos de inmunolobulinas (IgG, IgM e IgA) y de la proteína C reactiva.
Pruebas cutáneasLa realización de pruebas cutáneas de sensibilidad retardada al antígeno se consideran muy inespecíficas, sin embargo algunos estudios han demostrado su efectividad diagnóstica, en especial en su lectura inmediata (10-15min), tanto en la EPG con sensibilidad del 83% y especificidad del 72%29 como también en el pulmón del cuidador de aves, con sensibilidad del 90% y especificidad del 85%30.
Pruebas de provocaciónEl test de provocación bronquial específico, con el antígeno en cuestión, posee una elevada sensibilidad y especificidad del 85% y 86% cuando se evalúan pacientes expuestos a antígenos de aves y hongos. Estos test tratan de reproducir la clínica y repercusión funcional pulmonar que tendría lugar en el ambiente laboral. Es una prueba que debe realizarse en el ámbito hospitalario, bajo supervisión médica, pero no todos los centros disponen de la posibilidad de realizarla31.
RadiologíaLa radiografía de tórax en las fases agudas puede ser normal o presentar infiltrados pulmonares difusos. En las fases crónicas podemos observar un patrón reticular bilateral.
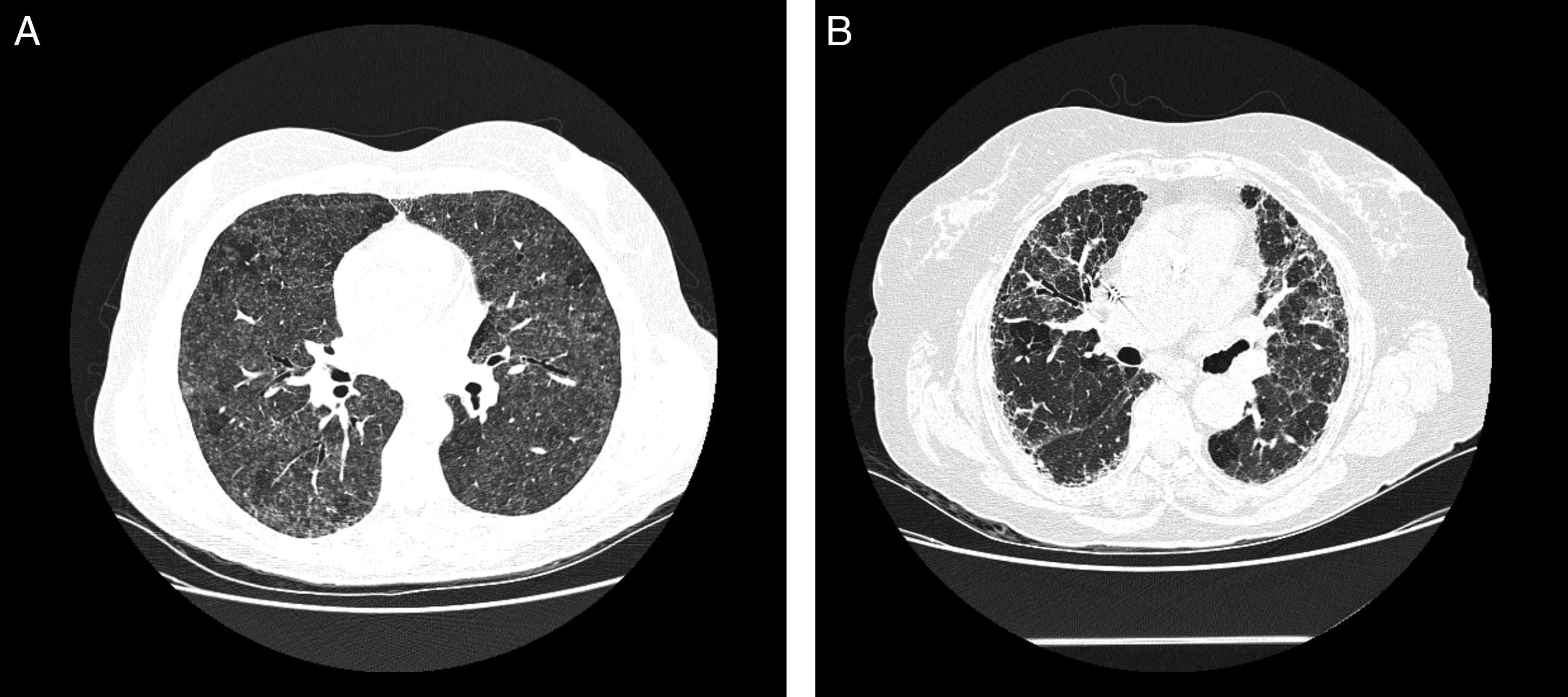
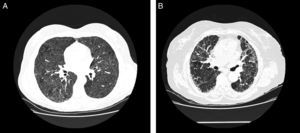
En la TCAR torácica, en las fases agudas, es característica la presencia de infiltrados difusos en vidrio deslustrado y las imágenes hiperlucentes (estas como consecuencia de bronquiolitis concomitante), que en conjunto proporcionan una imagen de perfusión en mosaico32. Es también típica la existencia de nódulos centrolobulillares en algunas de las fases de la enfermedad, pero son más frecuentes en las fases agudas32 (fig. 3A). En las formas crónicas destaca la presencia de imágenes en forma de panal. En un 20% de los casos de EPG se puede objetivar la presencia de enfisema en pacientes no fumadores33,34.
Radiología de la enfermedad del pulmón de granjero.
A. TCAR torácica de paciente con EPG aguda. Se aprecian infiltrados en vidrio deslustrado y nódulos centroacinares. B. TCAR torácica de paciente con EPG crónica. Destaca un patrón reticular en campos medios con presencia, en menor grado, de vidrio deslustrado.
La distribución de la afectación es típica en campos medios y superiores, aunque la presencia en campos inferiores no es excluyente, lo que hace en ocasiones que sea de afectación predominantemente en panal y quela imagen de la TC sea indistinguible de un patrón radiológico de neumonía intersticial usual (NIU)35 (fig. 3B).
Funcionalismo respiratorioLos pacientes presentan un patrón ventilatorio restrictivo con alteración del intercambio de gases (disminución de la DLco y desaturación al esfuerzo) al igual que sucede en otras EPID. En las formas crónicas de la EPG puede existir un patrón ventilatorio obstructivo que acompaña al enfisema36-38.
Prueba de inhalación específicaCon el fin de confirmar el diagnóstico, en los casos de duda, como ya hemos referido antes, debe practicarse una prueba de inhalación específica (PIE) frente a los antígenos sospechosos, que según la zona serán diferentes hongos y/o actinomicetos. Actualmente la PIE, después de los estudios realizados en otras neumonitis por hipersensibilidad, en especial el pulmón del cuidador de aves39-41, y tras la reciente publicación de Muñoz et al.31, tanto en el pulmón del cuidador de aves como en otros tipos de neumonitis por hipersensibilidad esta prueba puede ya considerarse como validada. Así pues, antes de efectuar una biopsia pulmonar quirúrgica debe realizarse una PIE con los antígenos adecuados en aquellos centros donde esté disponible.
BroncoscopiaEn el estudio de la EPG, así como en el de otras EPID, el lavado broncoalveolar (LBA) nos puede orientar en el diagnóstico diferencial. La citología del LBA suele mostrar en la EPG un incremento en el número de los linfocitos CD8 (predominio linfocitario>20% y, usualmente, pero no siempre, una inversión del cociente linfocitario CD4/CD8)42.
Biopsia transbronquial, criobiopsia y biopsia pulmonar quirúrgicaLa biopsia transbronquial (BTB) puede ser útil en los estadios iniciales de la enfermedad43. La BTB pulmonar por criosonda (o criobiopsia) es una técnica endoscópica menos invasiva que la biopsia pulmonar quirúrgica, que podría desempeñar un papel relevante en el diagnóstico de la EPG. Estudios recientemente publicados demuestran una rentabilidad diagnóstica en las EPID superior al 70%, con un número de complicaciones relativamente bajo44-46.
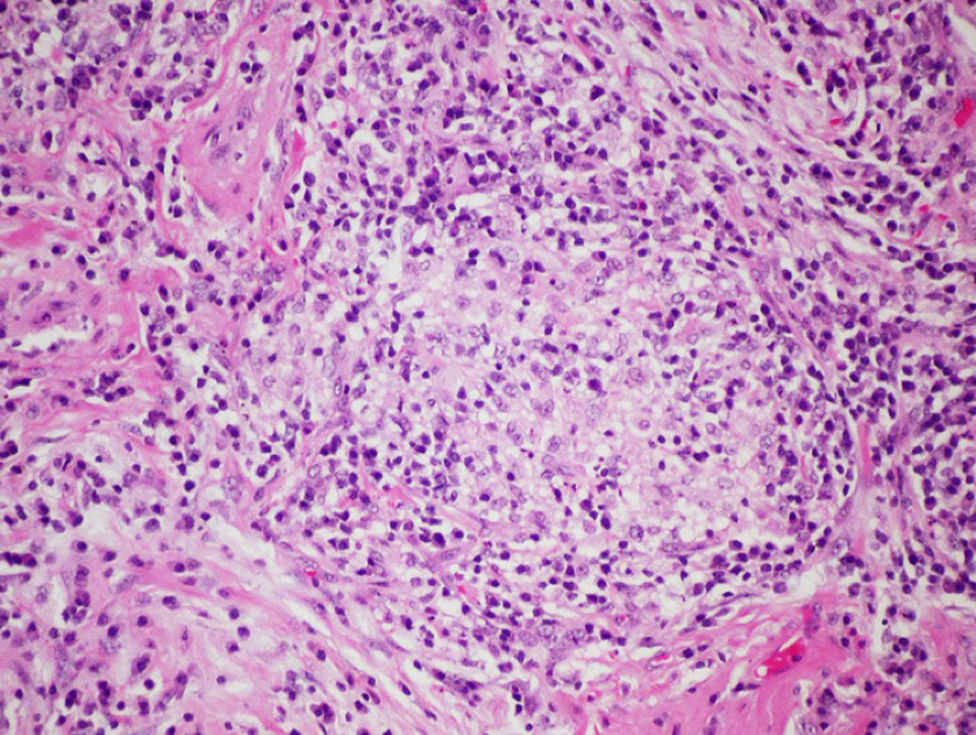
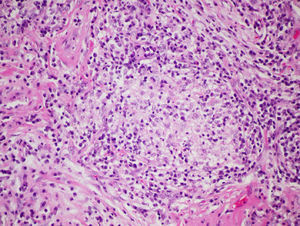
La biopsia pulmonar quirúrgica no se suele requerir para establecer un diagnóstico de EPG, aunque a menudo tiene un papel crucial en la diferenciación de una forma crónica con respecto a otras entidades intersticiales, especialmente en aquellos casos en los que no se logra una identificación antigénica28,47. En general, es raro que sea necesaria en las fases agudas, ya que la relación causal suele ser fácil de establecer. La mayor serie publicada hasta la fecha es la de Hariri et al., en la que se describen 5 casos de NH aguda, aunque los hallazgos sugieren que pueden corresponder a casos de exacerbación aguda de una NH previa, más que a un cuadro de NH aguda como tal, ya que se observó la presencia de fibrina intraalveolar con algunos eosinófilos y neutrófilos intersticiales que coexistían con cambios subagudos, como la bronquiolitis linfocitaria y granulomas laxos no necrotizantes48. Por este motivo, los hallazgos histológicos en esta fase aguda de enfermedad no son del todo conocidos. Se han descrito infiltrados alveolares, con presencia de neutrófilos, eosinófilos y vasculitis necrosante de pequeño vaso48. En las formas subagudas y crónicas no existe una relación tan evidente entre el inicio de los síntomas y la exposición causal, y pueden desarrollarse cambios de tipo fibrosante en algunos casos compatibles con un patrón de neumonía intersticial usual (NIU) o neumonía intersticial no específica (NINE)49. Generalmente, los hallazgos histológicos típicos, pero no patognomónicos, constituyen una tríada clásica descrita por Coleman y Colby50, aunque existen otros artículos más recientes que la describen con mayor detalle: 1) Neumonía intersticial de predominio linfocitario; 2) bronquiolitis crónica en forma de infiltrado peribronquiolar de predominio linfocitario con o sin fibrosis; y 3) granulomas laxos no necrotizantes de predominio intersticial51 (fig. 4). Sin embargo, se debe tener en cuenta que hasta en un 30% de los casos los hallazgos granulomatosos pueden estar ausentes. Incluso algunas publicaciones revelan la existencia de la tríada completa únicamente en el 50% de casos48, describiéndose también la presencia de metaplasia peribronquiolar49.
Diagnóstico diferencialEl diagnóstico diferencial lo realizaremos esencialmente con otras EPID. Las formas crónicas pueden ser similares a la fibrosis pulmonar idiopática (FPI) y a la NINE en fase fibrótica, con presentación clínica progresiva y paucisintomática. Incluso tras la realización de la biopsia pulmonar quirúrgica, los diagnósticos diferenciales que se le plantean a un patólogo ante una biopsia de esta naturaleza comprenden incluso otras entidades tan diversas como la sarcoidosis, las EPID secundarias a fármacos, la neumonía intersticial linfocítica y las EPID secundarias a enfermedades del tejido conectivo. En formas crónicas avanzadas puede ser muy difícil de diferenciar el patrón histológico de NIU en FPI, o de patrón de NINE, aunque la extensión de la fibrosis hacia el centro del lobulillo en las biopsias con patrón NIU debe evidenciar la posibilidad de una NH crónica50-52. Se ha observado en series de autopsias que la fibrosis predomina sobre la presencia de granulomas en las formas crónicas17.
Las formas agudas, debido a la clínica inespecífica que presentan, pueden orientarse inicialmente como un proceso pseudogripal en aquellos cuadros con una radiografía de tórax simple normal, o como una neumonía bacteriana en aquellos casos en los que aparezcan infiltrados pulmonares.
Por lo tanto, aunque los datos descritos como más frecuentes nos orienten al diagnóstico, la variedad de presentación clínica, radiológica e histológica obliga a una estricta correlación entre todas ellas para establecer un diagnóstico de certeza.
TratamientoEl tratamiento de la EPG se basa fundamentalmente en la correcta evitación a la exposición del antígeno, conducta que trataremos con más detalle en el apartado de prevención, que es la única medida que ha demostrado disminuir la progresión de la enfermedad.
El tratamiento con glucocorticoides acelera la recuperación de las formas agudas, pero no ha demostrado que influya en la evolución de la enfermedad a largo plazo, y algunos autores dudan de su papel en las formas crónicas13,53. Tradicionalmente está recomendado en aquellos pacientes que presentan una alteración funcional respiratoria. Las dosis son similares a las utilizadas en otras EPID como la sarcoidosis (30mg/día durante un mes, continuando con 20mg/día, seguido de un descenso progresivo hasta dosis de mantenimiento de 7,5-15mg/día). No existe evidencia científica para recomendar el uso o no de glucocorticoides por vía inhalada.
Los tratamientos inmunosupresores se han ensayado en las formas refractarias de otras formas de NH, como el pulmón del cuidador de aves, pero no en la EPG. En estos pacientes los pocos casos publicados muestran una mejor evolución funcional con rituximab54,55.
El trasplante pulmonar está indicado en las formas progresivas, que a pesar de los tratamientos previamente comentados presentan ya insuficiencia respiratoria. Un estudio reciente muestra una mayor supervivencia a los 5 años de los pacientes trasplantados por NH respecto a aquellos trasplantados por FPI56.
PrevenciónExisten 3 posibilidades para reducir la inhalación repetida de las partículas orgánicas en los pacientes que padecen EPG, y así evitar la progresión hacia un proceso fibrosante, y por tanto, irreversible: a) la retirada definitiva del paciente del ámbito agrícola, lo cual en la mayoría de ocasiones no es una opción factible, debido sobre todo a motivos económicos; b) desarrollo de nuevas técnicas para el secado del heno, ventilación y mecanización del proceso de alimentación de la ganadería; y c) utilizar equipos de protección respiratoria capaces de evitar la entrada de los antígenos en el árbol respiratorio.
Una de las principales medidas preventivas consiste en mejorar los métodos de almacenamiento del heno. En este aspecto, el secado o calentamiento del forraje durante su almacenamiento ha demostrado ser útil en la disminución de la concentración de antígeno57. También se ha demostrado que la disposición del forraje en fardos cuadrados de baja densidad dificulta el crecimiento de microorganismos. Sin embargo, esta metodología está desapareciendo debido al alto coste y elevado personal necesario, y está siendo sustituida por la disposición en fardos redondos (fig. 1). Estos fardos son más fáciles de almacenar y de manipular, sin embargo, presentan una alta concentración de humedad debido a la mayor compactación del heno58. También es importante el vaciado del silo de forma más lenta, consiguiendo disminuir el polvo en suspensión (por lo tanto la concentración de antígeno), así como el tiempo de exposición. Además, se debe tener especial cuidado en preservar una adecuada ventilación del espacio de almacenamiento creando flujos continuos, con el objetivo de conseguir una menor concentración de CO2 y de bioaerosoles59. Sin embargo, también se trata de una instalación costosa, lo que dificulta su aceptación generalizada.
En algunas regiones se realizan determinadas prácticas tradicionales destinadas a la prevención de la proliferación de microorganismos, como es la salazón del heno, pero son ineficaces58-60. Existen también en el mercado aditivos que se pueden aplicar al forraje para mejorar las condiciones de almacenamiento, pero suelen ser ácidos muy corrosivos para la maquinaria agrícola, por lo que los agricultores y ganaderos son bastante reacios a usarlos.
El uso de equipos de protección respiratoria es la medida de prevención que no requiere el cese de la actividad agrícola (fig. 5). En 1971 las observaciones clínicas de Gourley y Braidwood61 mostraban la eficacia de las máscaras de protección en pacientes diagnosticados de EPG en su forma aguda. Los filtros usados retenían partículas de 0,8μ con una efectividad del 98%. Kusaka et al.62 estudiaron una cohorte de 21 pacientes diagnosticados de EPG a los que les proporcionaron sistemas de protección respiratoria que mantuvieron durante un periodo de 2 años en la práctica de sus actividades agrícolas habituales, especialmente durante la manipulación del heno. En este periodo se observó una reducción significativa de los síntomas de exposición aguda al compararlos con los que habían presentado en los 4 años previos, y solo un paciente presentó síntomas agudos graves que requiriesen hospitalización y/o tratamiento con corticoides. Sin embargo, la eficacia de los sistemas de protección respiratoria en la prevención de la enfermedad crónica no ha sido aún ratificada en otros estudios.
Algunos tipos de sistemas de protección respiratoria pueden resultar incómodos, lo que se traduce en un pobre cumplimiento. En el estudio previamente comentado, de los 21 pacientes a los que se les entregaron sistemas de protección respiratoria, 17 (80%) los toleraron durante un periodo prolongado de 2 años; los 4 pacientes que abandonaron su uso lo hicieron por incomodidad y por ausencia de síntomas cuando trabajaban sin los sistemas de protección62. Probablemente, la tolerancia de los sistemas de protección respiratoria está relacionada con la protección contra los síntomas agudos que se desencadenan con la exposición, y el hecho de que pueden representar la única alternativa al cambio de ocupación. Cuando se aconseja al paciente sobre el uso de estos sistemas es importante: 1) elegir el más confortable y efectivo contra el antígeno que se quiere evitar; y 2) aconsejar sobre su cuidado y mantenimiento.
PronósticoLa evolución de la EPG es muy variada y depende esencialmente del tiempo, así como la concentración de exposición del antígeno. Aun así, en algunos pacientes, a pesar de realizar correctamente la evitación, la enfermedad sigue progresando debido a causas y mecanismos aún no conocidos.
La fase aguda de la EPG generalmente es reversible, sin embargo una exposición de manera continua o tras varios episodios subagudos de hipersensibilidad al antígeno puede ocasionar la evolución a formas fibróticas, que comportan alteraciones irreversibles al nivel de la estructura y función pulmonar36,63. Hasta un 20% de las formas agudas evolucionan a la cronicidad. Un estudio finlandés estimó la supervivencia media a 17 años desde el momento de aparición de los síntomas entre un 9-17%64. Los factores asociados a una mayor mortalidad en NH son la presencia de un patrón fibrótico en la TC torácica65 y de hipertensión arterial pulmonar significativa66.
ConclusionesEn resumen, la EPG se trata de una enfermedad posiblemente infradiagnosticada en el Norte de España, aunque no disponemos de estudios epiemiológicos precisos. Tampoco existen estudios que demuestren la efectividad a largo plazo del tratamiento con corticosteroides ni con otros inmnunosupresores, así como tampoco disponemos de un panel de antígenos para su diagnóstico según la región. Es necesario aumentar la sospecha diagnóstica de esta enfermedad, teniendo en cuenta que la forma de presentación incluso puede ser atípica para el concepto clásico de EPID (aquellos casos con presencia de alteración ventilatoria obstructiva y enfisema en la TCAR torácica). A aquellos pacientes diagnosticados se les debe recomendar observar una estrategia detallada para prevenir la exposición al antígeno, incluyendo, sobre todo, cómo usar de forma correcta los equipos de protección respiratoria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al resto de componentes del Grupo Gallego Multidisciplinar de Enfermedades Pulmonares Intersticiales Difusas (GAMEPID): José Blanco, Ana González, Coral González, Noemí Mengual, Isabel Otero, Cristina Ramos, Carlota Rodríguez y Juan Suárez.
Al Dr. Antón Penas por ceder las imágenes de la figura 1.
A la empresa 3M por la cortesía del material aportado para las imágenes de la figura 5.