Evaluar la utilidad de diferentes características ecográficas para diferenciar los ganglios linfáticos (GL) benignos y malignos mediante ecografía endobronquial (EBUS) y validar una puntuación para una aplicación clínica en tiempo real.
MétodosSe analizaron 208GL mediastínicos procedentes de 141pacientes. Dos observadores evaluaron de manera independiente 6criterios ecográficos diferentes (eje menor ≥10mm, forma, margen, ecogenicidad y estructura hiliar central [EHC] y presencia de densidad hiperecogénica). Se generó una puntuación simplificada en la que a la presencia de márgenes bien definidos, la forma redondeada y el eje menor ≥10mm se les asignaba una puntuación de 1 y a la ecogenicidad heterogénea y la ausencia de EHC se les asignaba una puntuación de 1,5. La puntuación se evaluó prospectivamente para la aplicación clínica en tiempo real en 65GL durante la EBUS llevada a cabo por 2operadores experimentados en 39pacientes. Estos criterios se correlacionaron con los resultados histopatológicos, y se calcularon la sensibilidad, la especificidad y los valores predictivos positivo (VPP) y negativo (VPN).
ResultadosLa heterogeneidad y la ausencia de EHC fueron los parámetros que mostraron la máxima sensibilidad y VPN (≥90%) en la predicción de la malignidad de los GL, con una coincidencia interobservadores aceptable (92 y 87%, respectivamente). En la aplicación en tiempo real, la sensibilidad y la especificidad de la puntuación >5 fueron del 78 y del 86%, respectivamente; tan solo la ausencia de EHC, la forma redondeada y el tamaño de los GL mostraron una asociación significativa con la malignidad de estos.
ConclusionesLa combinación de diferentes criterios ecográficos puede ser útil en la predicción de la malignidad de los GL mediastínicos y válida para una aplicación clínica en tiempo real.
To evaluate the utility of different ultrasonographic (US) features in differentiating benign and malignant lymph node (LN) by endobronchial ultrasound (EBUS) and validate a score for real-time clinical application.
Methods208 mediastinal LN acquired from 141patients were analyzed. Six different US criteria were evaluated (short axis ≥10mm, shape, margin, echogenicity, and central hilar structure [CHS], and presence of hyperechoic density) by two observers independently. A simplified score was generated where the presence of margin distinction, round shape and short axis ≥10mm were scored as 1 and heterogeneous echogenicity and absence of CHS were scored as 1.5. The score was evaluated prospectively for real-time clinical application in 65 LN during EBUS procedure in 39patients undertaken by two experienced operators. These criteria were correlated with the histopathological results and the sensitivity, specificity, positive and negative predictive values (PPV and NPV) were calculated.
ResultsBoth heterogenicity and absence of CHS had the highest sensitivity and NPV (≥90%) for predicting LN malignancy with acceptable inter-observer agreement (92% and 87% respectively). On real-time application, the sensitivity and specificity of the score >5 were 78% and 86% respectively; only the absence of CHS, round shape and size of LN were significantly associated with malignant LN.
ConclusionsCombination of different US criteria can be useful for prediction of mediastinal LN malignancy and valid for real-time clinical application.
La obtención de muestras de ganglios linfáticos (GL) es esencial para llevar a cabo una estadificación exacta del cáncer de pulmón. La ecografía endobronquial (EBUS) es una técnica que combina la visualización endoscópica con las imágenes de ecografía de alta frecuencia1. La EBUS permite visualizar tanto los GL mediastínicos como los hiliares2,3 y, por tanto, hace posible guiar su punción para la obtención de muestras para citología e histología2,4,5.
En la última década, múltiples estudios han evaluado las observaciones ecográficas que pueden asociarse a la infiltración maligna de los GL en los cánceres de cabeza y cuello, mama, cérvix uterino y esófago2,6-9. Fujiwara et al.10 describieron en un reciente estudio retrospectivo del cáncer de pulmón que 4características ecográficas tenían valor predictivo respecto a la infiltración maligna de GL mediastínicos (forma redondeada, margen bien definido, ecogenicidad heterogénea y presencia de signos de necrosis por coagulación). Schmid-Bindert et al.11 propusieron una puntuación que combinaba criterios ecográficos para predecir la malignidad de los GL mediastínicos; dichos criterios eran la forma redondeada, los márgenes bien definidos, la ecogenicidad, la ausencia de toda estructura hiliar central (EHC), el eje menor con un diámetro ≥1cm y el índice de potencia de Doppler color de grado2 o 3. Los autores llegaron a la conclusión de que si están presentes menos de 3 de los criterios descritos, el GL tiene una probabilidad muy baja de ser maligno11. Sin embargo, estos criterios son retrospectivos y podrían tener un componente subjetivo, puesto que no se ha realizado ninguna validación prospectiva y algunos de los criterios empleados son difíciles de determinar en tiempo real por operadores experimentados.
En un intento de validar la utilidad clínica de los criterios antes descritos, planteamos la hipótesis de que algunas características ecográficas de los GL pudieran tener una buena capacidad predictiva de la infiltración maligna de GL, y por tanto ser utilizadas como guía para la aspiración de los GL, mejorando con ello la estadificación del carcinoma broncógeno. En consecuencia, los objetivos del presente estudio fueron, en primer lugar, evaluar retrospectivamente qué características ecográficas de la EBUS eran más exactas para diferenciar la afectación benigna de la maligna en los GL tanto mediastínicos como hiliares tras correlacionar dichas características con los resultados histopatológicos. En segundo lugar, analizar prospectivamente la puntuación anteriormente propuesta de una combinación de criterios ecográficos para la aplicación clínica en tiempo real.
MétodosDiseño y pacientes del estudioEl estudio se dividió en 2partes. La primera parte fue un estudio descriptivo para el que se seleccionaron 176 pacientes con GL mediastínicos/hiliares a los que se practicó una EBUS en el Hospital Universitario Son Espases entre 2009 y 2012 para la estadificación del cáncer de pulmón o para el estudio de una sospecha de infiltración maligna de GL. De estos pacientes, 141 fueron incluidos en el estudio y 2observadores que no conocían el diagnóstico final analizaron de manera independiente las imágenes de 208GL. La segunda parte fue un estudio prospectivo para el que se seleccionó a 39pacientes consecutivos en los que 2observadores evaluaron una predicción de la probabilidad de afectación maligna del GL en tiempo real basándose en los criterios anteriormente validados. Se incluyó a pacientes consecutivos en los que se había programado una EBUS para el estudio de GL mediastínicos/hiliares identificados en la tomografía computarizada (TC) de tórax o GL hipermetabólicos identificados en una tomografía de emisión de positrones con fluorodesoxiglucosa (PET-FDG).
La indicación de una estadificación invasiva del mediastino mediante EBUS, ecografía endoscópica (EUS) o una combinación de ambas técnicas la establece un comité local multidisciplinario de cáncer de pulmón siguiendo criterios estandarizados12: a)agrandamiento de GL mediastínicos discretos con captación de PET; b)actividad de PET en un GL mediastínico y ganglios de aspecto normal en la TC, y c)sospecha de afectación de N2,3 con un mediastino radiográficamente normal (según la TC y la PET) y un tumor central o N1. Se excluyó a los pacientes con alguna contraindicación para la broncoscopia según las recomendaciones de la American Thoracic Society13 o con un riesgo anestésico elevado (estado físico de la American Society of Anesthesiologists >3)14. La historia clínica completa, así como la TC de tórax y la PET-FDG, fueron analizadas por un comité multidisciplinario de cáncer de pulmón, que estableció la indicación de la EBUS con aspiración por punción transbronquial guiada (TBNA) o aspiración por punción transtraqueal (TTA) según lo recomendado por las guías internacionales15. Posteriormente, los pacientes fueron evaluados por el equipo de anestesiología antes de la intervención. Se obtuvo un consentimiento informado firmado de cada paciente.
Intervención de EBUS+TTA/TBNALa EBUS se llevó a cabo con el empleo de un endoscopio EB-1970UK (Pentax, 10,0-5,0MHz, Tokio, Japón) y el sistema de Ecografía Digital Hitachi EUB-7000HV. La EBUS se realizó por vía oral bajo sedación profunda con el empleo de propofol, midazolam y fentanilo y con ventilación espontánea bajo control del anestesiólogo en todos los pacientes incluidos en el estudio. La intervención se realizó según lo descrito por Yasufuku et al.2. Los GL agrandados (más de 5mm) se identificaron en las mediciones realizadas en las imágenes ecográficas capturadas digitalmente. Se conservaron imágenes fijas para un análisis posterior. Los vasos sanguíneos se confirmaron con el modo Doppler. Para la TBNA y/o la TTA se utilizó una aguja de calibre22. La aguja se introdujo desde el canal de trabajo de la EBUS a través de la pared bronquial y se realizó una punción de GL bajo control ecográfico para obtener una muestra de tejido. Se realizó un frotis del material aspirado en portaobjetos de vidrio, se secó al aire y se tiñó de inmediato con hematoxilina y eosina estándar para una evaluación rápida in situ (rapid on-site evaluation [ROSE]) por parte de un citopatólogo. Tres muestras consecutivas con un tejido del GL reactivo se consideraron negativas para enfermedad maligna. Además, los materiales aspirados se recogieron en formol líquido, en donde el bloque celular se sometió a una evaluación histológica final por parte del anatomopatólogo. El diagnóstico anatomopatológico final fue la referencia estándar para considerar positiva para malignidad la infiltración del GL. Los pacientes con resultados anatomopatológicos negativos en la EBUS, en los que los GL malignos fueron confirmados tras la cirugía (mediastinoscopia o resección pulmonar con linfadenectomía sistemática), fueron considerados también positivos en el análisis ecográfico de los GL.
Análisis de las imágenes ecográficasTodas las imágenes ecográficas fueron evaluadas para determinar las características ecográficas anteriormente descritas11 con objeto de validar una puntuación predictiva de la malignidad. Se evaluaron las siguientes características ecográficas asociadas a la malignidad11:
- 1.
Forma redondeada definida como una relación entre los 2diámetros perpendiculares <1,5.
- 2.
Margen definido y bien delimitado, que se distingue por una línea blanca marcada que limita el GL.
- 3.
Aspecto de ecogenicidad heterogénea como variable dicotómica, opuesta a homogénea.
- 4.
Ausencia de EHC visible como estructura central lineal con ecogenicidad alta con o sin un vaso sanguíneo.
- 5.
Eje menor con un diámetro ≥10mm.
- 6.
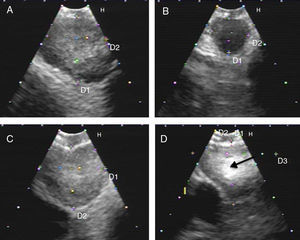
Presencia de una densidad hiperecogénica en el interior del GL (figs. 1 y 2).
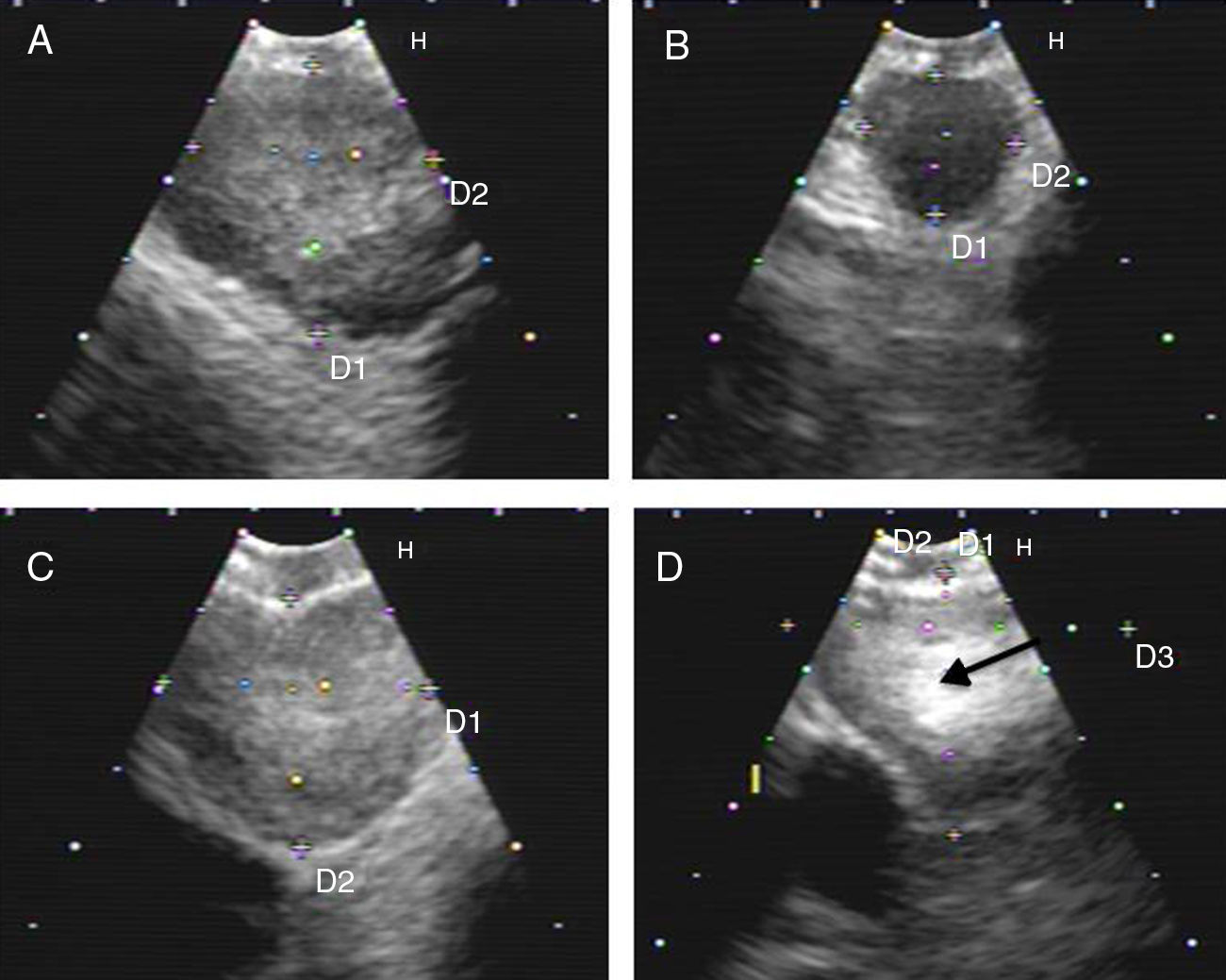
Figura 1.Series de imágenes ecográficas de EBUS de ganglio linfático mediastínico que muestran diferentes criterios. A)Ecogenicidad heterogénea con margen bien delimitado en ganglio linfático reactivo. B)Ecogenicidad homogénea con margen mal definido en linfadenitis reactiva. C)Ecogenicidad heterogénea con margen bien delimitado en adenocarcinoma. D)Densidad hiperecogénica en el interior de ganglio linfático (flecha) en carcinoma microcítico. Las imágenes de ganglios linfáticos (A-D) mostraron ausencia de estructura hiliar central.
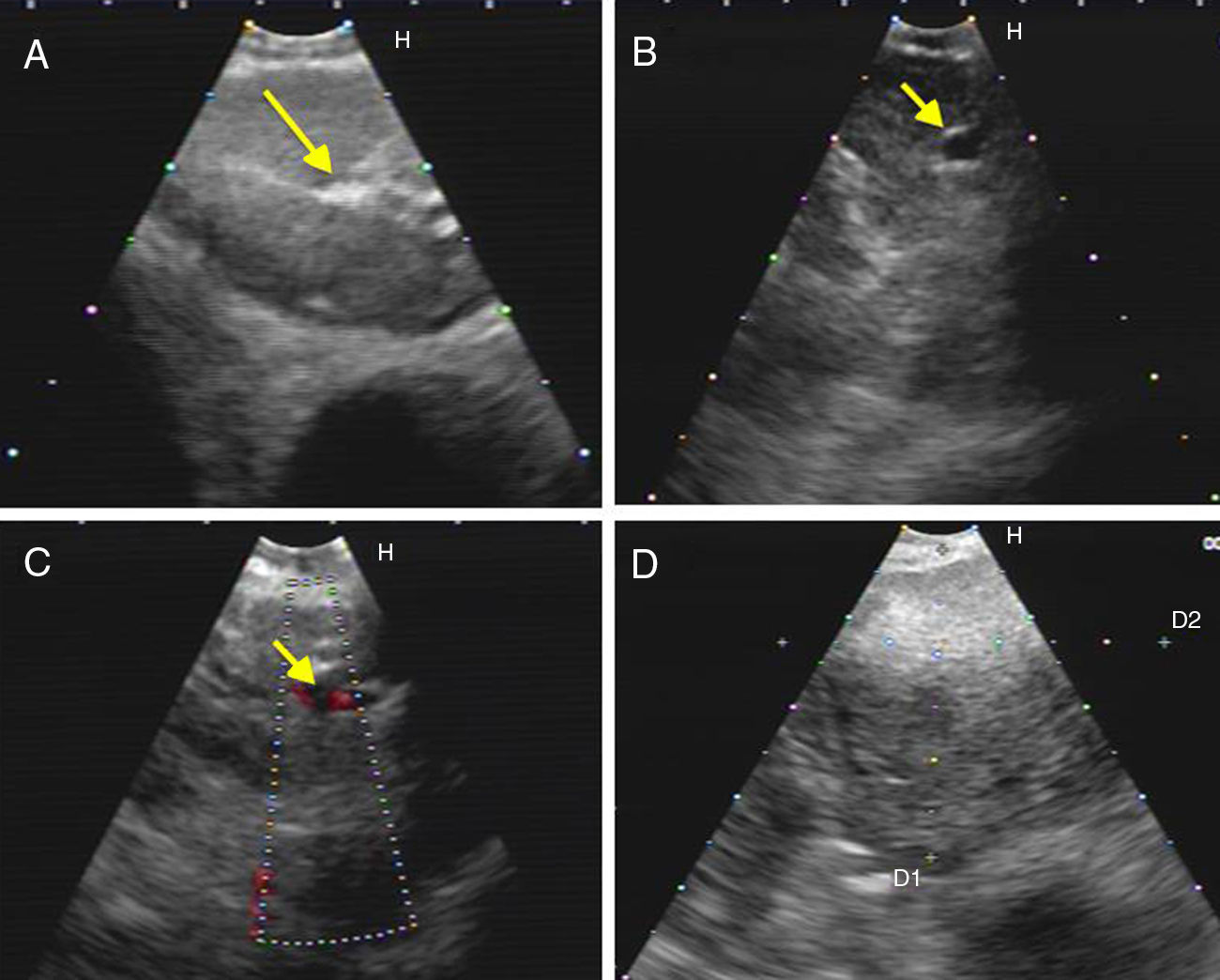
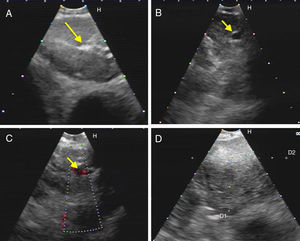
Figura 2.Series de imágenes ecográficas de EBUS de ganglio linfático mediastínico que muestran diferentes criterios (continuación). A)Presencia de estructura hiliar central (flecha) en linfadenitis reactiva. B,C)Presencia de estructura hiliar central con vaso sanguíneo (flecha) en otro ganglio linfático reactivo; demostración en modo Doppler en C. D)Margen mal definido con ecogenicidad heterogénea en metástasis extratorácica con ausencia de estructura hiliar central.
Se calculó la coincidencia interobservadores (CIO) para cada criterio ecográfico. Estos criterios se correlacionaron con los resultados histopatológicos finales, y se calcularon la sensibilidad, la especificidad y los valores predictivos positivo (VPP) y negativo (VPN) mediante la curva de características operativas del receptor (ROC) y el área bajo la curva (AUC).
Generación de la puntuaciónSegún la reproducibilidad de los criterios anteriormente mencionados, se generó una puntuación simplificada con 5elementos y se calculó para la predicción de la malignidad de los GL. Cada uno de ellos se puntuó de la siguiente forma: ecogenicidad heterogénea (puntuada como 1,5) frente a homogénea (puntuada como 0); ausencia de EHC (puntuada como 1,5) frente a su presencia (puntuada como 0); forma redondeada (puntuada como 1 frente a 0); eje menor del diámetro del GL≥10mm (puntuado como 1) y <10mm (puntuado como 0); margen bien delimitado del GL (puntuado como 1) y margen mal diferenciado (puntuado como 0). Se generó una puntuación total mediante la suma de cada criterio aislado y se representó gráficamente en relación con el diagnóstico anatomopatológico con el empleo de curvas ROC.
Validación de la puntuaciónLa puntuación previamente modificada se aplicó de forma prospectiva a las imágenes ecográficas del GL sospechoso durante la intervención de EBUS por parte de los 2broncoscopistas que realizaban la exploración. El análisis ecográfico lo llevó a cabo un anatomopatólogo antes de la ROSE. Se calculó la puntuación y se correlacionó con los resultados histopatológicos. Se realizó una ecografía Doppler para evaluar el flujo sanguíneo en el interior del GL. La utilidad de la puntuación propuesta se evaluó para la aplicación clínica en tiempo real con objeto de predecir los GL malignos.
Análisis estadísticoLos datos se presentan en forma de media±desviación estándar (DE) o número (porcentaje), según sea apropiado. Las comparaciones entre las características ecográficas malignas y no malignas se realizaron con la prueba de Mann-Whitney. Las pruebas estadísticas se llevaron a cabo con valores de p bilaterales y se consideró significativo un valor de p<0,05. Se utilizaron curvas ROC para calcular la sensibilidad y la especificidad, seguido del cálculo del VPP y VPN de la puntuación y de cada criterio en relación con el diagnóstico anatomopatológico final. Se presentan los valores del AUC o el índice C, así como los intervalos de confianza (IC) del 95%. La CIO se calculó utilizando el método de intervalo a intervalo, que se calcula sumando el número total de coincidencias en los intervalos (tanto en cuanto a presencia como en cuanto a ausencia) y dividiendo por la suma del número de coincidencias y discrepancias en los intervalos16; una CIO del 80% se consideró una coincidencia positiva. Se utilizó el programa estadístico MedCalc® (versión 9.2.1.0, Acacialaan 22, B-8400 Ostende, Bélgica).
ResultadosCaracterísticas ecográficasLas características de los pacientes y los principales resultados se resumen en la tabla 1. Después de establecer la correlación con los datos anatomopatológicos, se analizaron las imágenes obtenidas en 141pacientes, que incluían 208GL en diferentes estaciones ganglionares. El GL subcarinal (estación7) fue el puncionado con mayor frecuencia (45,7%), seguido de los de las estaciones4D y 4I (24 y 9,6%, respectivamente) (tabla 1).
Datos basales de los pacientes y diagnóstico anatomopatológico de los ganglios linfáticos de los que se obtuvieron muestras
| Población (n=141) | |
| Edad (años) [media±DE] | 63,1±10 |
| Varones: n (%)/Mujeres: n (%) | 117 (83)/24 (17) |
| GL afectados (n=208) | |
| 7, n (%) | 95 (45,7) |
| 4D, n (%) | 50 (24) |
| 4I, n (%) | 20 (9,6) |
| 2D, n (%) | 8 (3,8) |
| 6, n (%) | 1 (0,4) |
| Estaciones 10-12, n (%) | 34 (16,3) |
| Diagnóstico anatomopatológico: casos malignos | |
| Cáncer de pulmón primario | |
| Adenocarcinoma, n (%) | 32 (22,7) |
| Carcinoma espinocelular, n (%) | 18 (12,8) |
| Cáncer de pulmón microcítico, n (%) | 9 (6,4) |
| Cáncer de pulmón no microcítico indiferenciado, n (%) | 9 (6,4) |
| Carcinoma microcítico, n (%) | 2 (1,4) |
| Otros | |
| Metástasis extratorácicas, n (%) | 8 (5,7) |
| Linfoma, n (%) | 3 (2,1) |
D: derecho; DE: desviación estándar; GL: ganglio linfático; I: izquierdo.
La prevalencia del diagnóstico definitivo de enfermedad maligna en los GL analizados fue del 50,5%, frente al 49,5% de linfadenitis reactiva. El diagnóstico anatomopatológico final de las muestras evaluadas se presenta en la tabla 1, en la que se observa que el adenocarcinoma fue el diagnóstico más frecuente en la cohorte estudiada (22,7%), seguido del carcinoma espinocelular (12,8%).
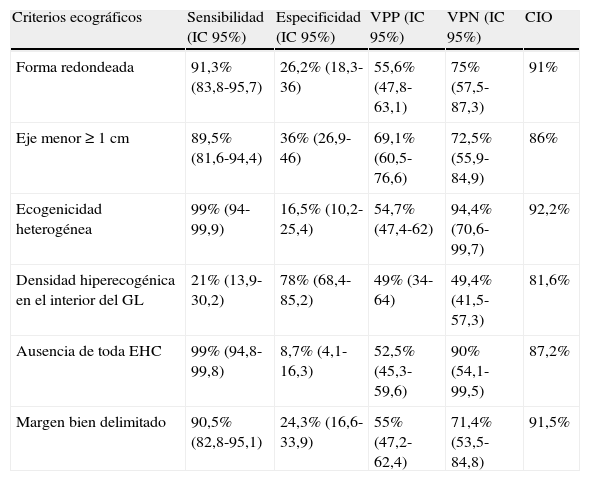
El análisis de las características ecográficas de los GL, con su sensibilidad, su especificidad, su VPP y su VPN para la enfermedad maligna, se indica en la tabla 2. La evaluación de los diferentes criterios ecográficos puso de manifiesto que tanto la ecogenicidad heterogénea como la ausencia de EHC con o sin vaso sanguíneo central eran los factores con mayor sensibilidad en la predicción de la enfermedad maligna (99% en ambos casos), mientras que la presencia de una densidad hiperecogénica en el interior del GL era el factor que tenía una especificidad más alta en la predicción de los GL malignos (78%). Además, la ecogenicidad heterogénea mostró un VPN del 94,4%, seguido del de la ausencia de EHC (90%). Ninguno de los criterios ecográficos propuestos tuvo un VPP clínicamente aceptable. Se registró una CIO positiva para los criterios propuestos, siendo la coincidencia máxima la de la ecogenicidad heterogénea (92,2%) (tabla 2).
Sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo para la malignidad del ganglio linfático con los diferentes criterios ecográficos
| Criterios ecográficos | Sensibilidad (IC95%) | Especificidad (IC95%) | VPP (IC95%) | VPN (IC95%) | CIO |
| Forma redondeada | 91,3% (83,8-95,7) | 26,2% (18,3-36) | 55,6% (47,8-63,1) | 75% (57,5-87,3) | 91% |
| Eje menor ≥1cm | 89,5% (81,6-94,4) | 36% (26,9-46) | 69,1% (60,5-76,6) | 72,5% (55,9-84,9) | 86% |
| Ecogenicidad heterogénea | 99% (94-99,9) | 16,5% (10,2-25,4) | 54,7% (47,4-62) | 94,4% (70,6-99,7) | 92,2% |
| Densidad hiperecogénica en el interior del GL | 21% (13,9-30,2) | 78% (68,4-85,2) | 49% (34-64) | 49,4% (41,5-57,3) | 81,6% |
| Ausencia de toda EHC | 99% (94,8-99,8) | 8,7% (4,1-16,3) | 52,5% (45,3-59,6) | 90% (54,1-99,5) | 87,2% |
| Margen bien delimitado | 90,5% (82,8-95,1) | 24,3% (16,6-33,9) | 55% (47,2-62,4) | 71,4% (53,5-84,8) | 91,5% |
CIO: coincidencia interobservadores; EHC: estructura hiliar central; GL: ganglio linfático; IC: intervalo de confianza; ND: no determinado; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
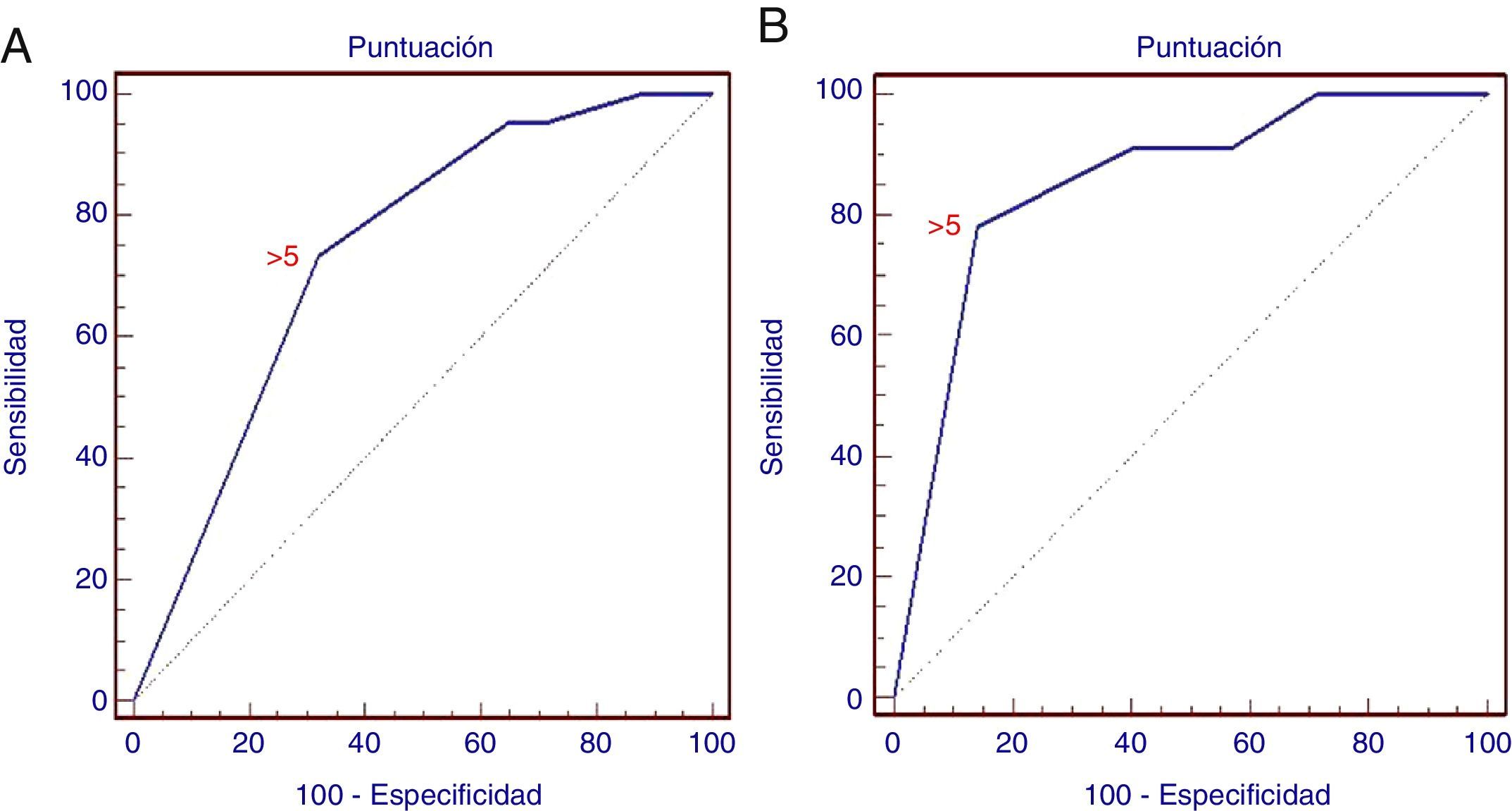
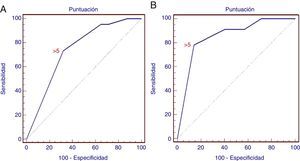
Hubo una diferencia estadísticamente significativa entre la infiltración de GL maligna y la no maligna para cada criterio (p<0,01), excepto la presencia de una densidad hiperecogénica en el interior del GL (p>0,05). En consecuencia, la puntuación se generó utilizando únicamente 5criterios, según lo descrito antes en la metodología. Con el análisis de ROC, la puntuación combinada >5 tuvo una sensibilidad del 73,3% y una especificidad del 68% (AUC=0,738; IC95%: 0,673-0,796; p=0,0001) en la predicción de una infiltración maligna del GL (fig. 3). El VPP y el VPN para la puntuación generada fueron del 70 y del 71,4%, respectivamente.
Curva ROC de la puntuación para la predicción de una infiltración maligna de un ganglio linfático. A)La curva ROC para el estudio retrospectivo muestra las diferentes sensibilidad y especificidad de los criterios positivos combinados (AUC=0,738; IC95%: 0,673-0,796; p=0,0001). B)La curva ROC para el estudio prospectivo (AUC=0,852; IC95%: 0,743-0,928; p=0,0001).
En 39pacientes se realizó una evaluación en tiempo real del GL durante la EBUS y se examinaron 65GL durante la intervención. La prevalencia de la enfermedad maligna en los GL examinados fue del 35,4%, y el diagnóstico anatomopatológico más frecuente fue el de adenocarcinoma (15,4%). El GL subcarinal fue la estación puncionada con mayor frecuencia (46,2%), seguida de la estación4D (24,6%) y luego la estación10 derecha o izquierda (18,5%). Las estaciones4I, 2D y 2I constituyeron el 7,7, el 1,5 y el 1,5%, respectivamente. Al aplicar los criterios ecográficos previos validados en tiempo real, observamos que la ausencia de EHC, la forma redondeada y el eje menor ≥10mm mostraban diferencias estadísticamente significativas entre los GL no malignos y los malignos (p=0,0012; p=0,012 y p=0,023, respectivamente). Ni la ecogenicidad heterogénea ni el margen bien delimitado mostraron una diferencia significativa entre los GL benignos y los malignos (p>0,05) según lo indicado por el análisis retrospectivo de las imágenes ecográficas.
Con la combinación de criterios positivos durante la intervención, observamos que la puntuación >5 tenía una sensibilidad del 78% y una especificidad del 86% en la detección de los GL malignos (AUC=0,852; IC95%: 0,743-0,928; p=0,0001), con una especificidad superior a la del análisis de las imágenes. El VPP y el VPN fueron del 75 y del 88%, respectivamente.
DiscusiónLa EBUS-TBNA se ha introducido de manera convincente en la práctica clínica como instrumento eficaz para la estadificación del cáncer de pulmón con una exactitud comparable a la de la cirugía17-20. Sin embargo, la aspiración sistemática de todos los GL con el empleo de EBUS-TBNA es una intervención que requiere mucho tiempo y tiene unos costes elevados6. Ello plantea la necesidad de una búsqueda de criterios ecográficos que sirvan de guía para la obtención de muestras de diferentes estaciones de GL. En este estudio hemos puesto de manifiesto que no hay un único criterio que sea lo suficientemente específico, pero que una combinación de diferentes criterios ecográficos puede ser útil para predecir la malignidad de los GL mediastínicos6-8,10,11, y que ello puede ser válido para una aplicación clínica en tiempo real.
Diferentes estudios han analizado retrospectivamente con anterioridad los diferentes criterios ecográficos para la predicción de la infiltración maligna de GL en los casos de cáncer de pulmón, con el empleo de EBUS o EUS6,10,11. Fujiwara et al.10 definieron 4criterios diferentes para la predicción de los GL malignos, con una exactitud diagnóstica del 63,8 al 86,0% para los GL malignos. Gill et al.6 estudiaron de manera similar los GL mediastínicos en casos de cáncer de pulmón primario con el empleo de EUS; estos autores observaron que tan solo la forma redondeada, el eje menor >8,3mm y los márgenes bien diferenciados se asociaban a la infiltración maligna de GL. Más recientemente, Schmid-Bindert et al.11 estudiaron las adenopatías mediastínicas con independencia de la enfermedad subyacente y describieron una puntuación basada en la suma de 6criterios positivos para sospechar la presencia de un GL maligno; describieron una alta probabilidad de enfermedad maligna con una puntuación ≥3. Además, observaron que la ecogenicidad heterogénea y la ausencia de EHC eran las características que tenían un mejor VPN. Nuestros resultados concuerdan con estos datos.
En nuestro estudio se eligieron 5criterios de malignidad de los GL por su simplicidad cuando era necesario aplicarlos en tiempo real. Aunque ninguno de ellos por separado mostró una especificidad suficiente por sí mismo para diferenciar la malignidad, lo cual concuerda con lo indicado por resultados previos, una puntuación de >5 se asoció a unos resultados aceptables de sensibilidad y especificidad en el análisis retrospectivo. Según lo descrito anteriormente11, la ecogenicidad heterogénea y la ausencia de EHC fueron los factores con mayor sensibilidad (99%) en la predicción de los GL malignos y con un mejor VPN (94,4 y 90%, respectivamente). Es interesante señalar que la aplicación en tiempo real de estos criterios durante la intervención de EBUS mejoró tanto la sensibilidad como la especificidad de una puntuación >5 hasta alcanzar el 78,3 y el 86%, respectivamente, en la predicción de la malignidad de los GL. Además, la ausencia de EHC, la forma y el diámetro del eje menor ≥10mm del GL fueron significativamente diferentes en la infiltración no maligna y maligna. Sin embargo, la ecogenicidad heterogénea y el margen bien delimitado no mostraron una correlación significativa durante la evaluación en tiempo real según lo observado anteriormente en el análisis de las imágenes.
En nuestro análisis retrospectivo de las imágenes de ecografía observamos que la presencia de una densidad hiperecogénica en el interior del GL era el signo más específico de un GL maligno, con una baja sensibilidad, que podía atribuirse a su baja incidencia10. En consecuencia, la puntuación generada no incluyó este criterio. El VPP inaceptable de los criterios actuales revisados podría deberse, por un lado, a la prevalencia relativamente baja de la infiltración maligna de los GL en nuestra cohorte. Por otro lado, observamos que la presencia de una puntuación >5 era la que tenía la mejor sensibilidad y especificidad, lo cual podría explicarse por muchas causas: en primer lugar, que no hay un único criterio ecográfico aceptable para predecir por sí solo la malignidad de un GL21; en segundo lugar, que no se han descrito adenopatías malignas, incluida la adenopatía reactiva, asociadas a un diámetro del GL≥10mm y con pérdida de EHC ecográfica22,23, lo cual hace que estas 2características sean inespecíficas para la infiltración maligna de GL. Esto planteaba el problema de que es difícil basarse únicamente en 3criterios positivos para predecir la infiltración maligna de GL según lo descrito anteriormente11. La presencia del signo de necrosis por coagulación central10 no se había observado en nuestro análisis retrospectivo, y el grado de flujo sanguíneo en el interior del GL24 no era aplicable de manera viable para un uso clínico simplificado y mostró una coincidencia moderada en los distintos observadores11, por lo que no la incorporamos a los criterios evaluados.
Este estudio tiene ciertas limitaciones; en primer lugar, la medición del eje del GL es subjetiva25 y depende de la manipulación del transductor de EBUS para obtener los diámetros máximos del GL. En segundo lugar, no pudimos obtener biopsias de todos los GL detectados durante la EBUS debido a la proximidad de vasos sanguíneos o a la dificultad de introducir la aguja a través de la pared de las vías aéreas, lo cual podría deberse a una fibrosis o infiltración maligna de la propia pared. En tercer lugar, en este estudio no se utilizó EUS. Se recomienda la combinación de aspiración con aguja fina guiada por EUSEUS-FNA y EBUS-TBNA para la evaluación completa de los GL mediastínicos con una sensibilidad y VPN superiores a los de cada técnica por separado26. Sin embargo, un reciente ensayo controlado y aleatorizado centrado en la exactitud diagnóstica ha demostrado que la adición de la EUS-FNA a la EBUS-TBNA no mejoró la exactitud ni la sensibilidad27.
En conclusión, los criterios seleccionados (forma redondeada, margen bien delimitado, ecogenicidad heterogénea, ausencia de EHC, eje menor ≥10mm) son fiables para una aplicación clínica en tiempo real. La puntuación >5 mostró una buena predicción de los GL malignos, y ello podría ser útil para la toma de decisiones de muestreo de GL durante la intervención. Además, no hay un único criterio que permita descartar, por sí solo, la infiltración maligna de los GL mediastínicos/hiliares; sin embargo, la ausencia de EHC, la forma redondeada y el diámetro creciente del GL van a favor de la malignidad del GL.
Conflicto de interesesHanaa Shafiek ha recibido subvenciones de la Universidad de Alejandría y del Ministerio de Enseñanza Superior de Egipto, como miembro de ParOwn (The Partnership y Ownership Initiative). Por lo demás, los autores no tienen otros conflictos de intereses.
Los autores desean expresar su agradecimiento a todos los componentes del equipo de la Unidad de Broncoscopia por su aportación en la logística del estudio.