La disfunción muscular es una de las manifestaciones sistémicas más estudiadas en la EPOC. Las alteraciones metabólicas musculares son difíciles de estudiar in vivo, debido a la falta de técnicas no invasivas. El objetivo fue evaluar sincrónicamente la actividad metabólica de diferentes grupos musculares en pacientes con EPOC.
MétodosSe incluyeron 39 pacientes y 21 controles (función pulmonar normal), candidatos a realización de tomografía axial computarizada y por emisión de positrones para estadificación de lesión pulmonar localizada. Tras infusión de 18-fluor-deoxi-glucosa, se captaron imágenes de 2 músculos respiratorios (porciones costal y crural del diafragma, y recto abdominal) y 2 músculos periféricos (cuádriceps y bíceps braquial), utilizando como índice de metabolismo glucídico el standard uptake value.
ResultadosEste índice fue superior en ambas porciones del diafragma comparado con el resto de los músculos en todos los sujetos. Además, el diafragma crural y el recto del abdomen mostraban mayor actividad en los pacientes con EPOC que en los controles (1,8±0,7 vs. 1,4±0,8; y 0,78±0,2 vs. 0,58±0,1; respectivamente; p<0,05). El cuádriceps mostraba una tendencia similar. En los pacientes con EPOC los niveles de captación de ambos músculos respiratorios y del cuádriceps se correlacionaron directamente con el atrapamiento aéreo (r=0,388; 0,427 y 0,361, respectivamente; p<0,05).
ConclusionesExiste mayor nivel de captación-utilización de glucosa en el diafragma humano respecto de otros músculos en respiración tranquila. Se confirma cuantitativamente que los pacientes con EPOC tienen incrementado el metabolismo glucídico de sus músculos respiratorios (con tendencia similar para el cuádriceps), en relación directa con las cargas mecánicas que afrontan.
Muscle dysfunction is one of the most extensively studied manifestations of COPD. Metabolic changes in muscle are difficult to study in vivo, due to the lack of non-invasive techniques. Our aim was to evaluate metabolic activity simultaneously in various muscle groups in COPD patients.
MethodsThirty-nine COPD patients and 21 controls with normal lung function, due to undergo computed axial and positron emission tomography for staging of localized lung lesions were included. After administration of 18-fluordeoxyglucose, images of 2 respiratory muscles (costal and crural diaphragm, and rectus abdominus) and 2 peripheral muscles (brachial biceps and quadriceps) were obtained, using the standard uptake value as the glucose metabolism index.
ResultsStandard uptake value was higher in both portions of the diaphragm than in the other muscles of all subjects. Moreover, the crural diaphragm and rectus abdominus showed greater activity in COPD patients than in the controls (1.8±0.7 vs 1.4±0.8; and 0.78±0.2 vs 0.58±0.1; respectively, P<.05). A similar trend was observed with the quadriceps. In COPD patients, uptake in the two respiratory muscles and the quadriceps correlated directly with air trapping (r=0.388, 0.427 and 0.361, respectively, P<.05).
ConclusionsThere is greater glucose uptake and metabolism in the human diaphragm compared to other muscles when the subject is at rest. Increased glucose metabolism in the respiratory muscles (with a similar trend in their quadriceps) of COPD patients is confirmed quantitatively, and is directly related to the mechanical loads confronted.
La enfermedad pulmonar obstructiva crónica (EPOC) es un proceso de elevada prevalencia, que se caracteriza no solo por la afectación pulmonar, sino por la presencia de numerosas manifestaciones sistémicas y/o comorbilidades extrapulmonares1. Entre estas destacan las alteraciones nutricionales y la disfunción muscular esquelética2,3, que se hallan a su vez relacionadas entre sí y condicionan per se un peor pronóstico de la enfermedad4,5. La disfunción de los músculos respiratorios conlleva dificultades en la ventilación, sobre todo cuando aumentan los requerimientos sobre esta. Por su parte, la disfunción de los músculos de las extremidades condiciona dificultades en la capacidad de ejercicio y numerosas actividades de la vida diaria6. Aunque algunos de los factores causales son comunes a los diversos grupos musculares del organismo, existen otros que son más específicos3. Es el caso de los cambios en la mecánica ventilatoria que afectarían sobre todo a los músculos respiratorios, y el decondicionamiento derivado de la menor actividad física que tendría su principal efecto en los músculos de las extremidades inferiores3. También los mecanismos celulares y moleculares que contribuyen a la disfunción y los hallazgos estructurales y metabólicos que se asocian a ella pueden ser generalizados o más particulares de un grupo muscular concreto7. Entre otras consecuencias de los citados factores y mecanismos se hallan cambios en la bioenergética muscular, que se hace menos eficiente, al menos en los músculos de las extremidades inferiores8. Sin embargo, los estudios metabólicos presentan una serie de problemas importantes. Por un lado, si se realizan in vivo exigen una instrumentalización agresiva del paciente (p. ej. cateterización de los vasos de entrada y salida al músculo)8, y no siempre son técnicamente posibles. Por otro lado, si se realizan in vitro exigen la toma de muestras biópsicas y su inmediato procesamiento9. Por todo ello, son escasos los trabajos que evalúen los cambios metabólicos que ocurren en músculos de difícil acceso como son los respiratorios, y casi todos ellos se realizan empleando procedimientos cruentos como la biopsia10–12. Sin embargo, un mayor conocimiento del uso de sustratos energéticos en los músculos de los pacientes con EPOC puede ser útil para el manejo de su disfunción muscular y de las alteraciones del estado nutricional-composición corporal que frecuentemente se asocian a la enfermedad.
Las técnicas de imagen han avanzado extraordinariamente en los últimos años. Entre ellas, la tomografía por emisión de positrones (PET) permite orientar sobre el origen de diversas lesiones a partir de la tasa de captación y utilización de metabolitos clave. En 2005 se utilizó ya esta técnica para valorar la actividad de los músculos torácicos y abdominales de pacientes con EPOC, observándose una mayor actividad cualitativa que en sujetos sanos13. Pocos años después, Osman et al. (2011) confirmaron estos hallazgos combinando la PET con la tomografía axial computarizada (TAC) en los músculos inspiratorios14. Nuestra hipótesis fue que esta técnica mixta puede ser útil en la valoración in vivo y con escasa invasividad de la actividad metabólica simultánea de los músculos respiratorios y periféricos, cuyos hallazgos estructurales y metabólicos en las biopsias de los pacientes con EPOC son en gran parte divergentes3,7. La actual disponibilidad de técnicas de cuantificación en la captación del radiotrazador permitiría además una mayor precisión en las observaciones. Por tanto, el objetivo de este estudio fue evaluar de forma general pero cuantitativa la actividad metabólica sincrónica de diversos grupos musculares en pacientes con EPOC, comparándola con la de sujetos con función pulmonar normal.
MétodosPoblaciónInicialmente fueron candidatos todos los enfermos atendidos consecutivamente por lesión pulmonar considerada inicialmente como localizada en la Unidad Funcional de Cáncer de Pulmón de nuestra institución (n=104). En todos ellos estaba prevista la realización de TAC y de PET para la estadificación definitiva de la enfermedad. El período de estudio fue de 10 meses. Como criterios de exclusión se tomaron los antecedentes de patología neoplásica previa y de otras enfermedades respiratorias o inflamatorias. También se excluyeron los pacientes afectos de otras patologías que pudiesen ocasionar falsos positivos en la PET, y aquellos cuyo estudio funcional respiratorio no definiera con claridad un patrón de estricta normalidad o una alteración ventilatoria obstructiva. También se excluyeron los pacientes cuya PET mostrara una imagen de extensión de la enfermedad. Finalmente quedaron incluidos 60 sujetos, de los que 39 tenían historia y pruebas funcionales respiratorias compatibles con el diagnóstico de EPOC1 y el resto no presentaban antecedentes respiratorios y su espirometría forzada y transferencia del CO estaban dentro de la normalidad.
Diseño y aspectos éticosSe trata de un estudio retrospectivo y transversal, cuyo diseño siguió las normas locales, nacionales e internacionales de investigación en seres humanos (incluyendo el Código de Buenas Prácticas Científicas de nuestra institución y la Declaración de Helsinki), así como la normativa legal sobre la confidencialidad de los datos (Ley Orgánica 15/1999 de 13 de diciembre de Protección de Datos de Carácter Personal [LOPD]). El estudio fue aprobado por el Comité de Ética de la institución y, tras ser informados sobre sus objetivos y posibles consecuencias, todos los sujetos confirmaron por escrito su autorización para el uso de su información clínica.
TécnicasClínica, antropometría y función respiratoriaEn primer lugar se recogieron los datos de filiación, semiología y aspectos clínicos diversos, así como valores antropométricos (peso, talla y cálculo del índice de masa corporal) de cada paciente. A continuación se procedió a la exploración funcional respiratoria, incluyendo una espirometría forzada con prueba broncodilatadora (Datospir 92, SIBEL, Barcelona, España), la determinación de volúmenes pulmonares estáticos y resistencia de las vías aéreas por pletismografía corporal (Masterlab, Jaeger, Würzburg, Alemania), de la capacidad de transferencia del monóxido de carbono con el medidor de gases incorporado al citado equipo (técnica de «respiración única»), y gasometría arterial (medidor de gases Rapidlab 860, Bayer, Chiron Diagnostics, GmbH, Tuttlingen, Alemania). En todos los casos se siguieron las recomendaciones de SEPAR y, salvo en el caso de la gasometría, se utilizaron los valores de referencia publicados para población local15–17.
Tomografía por emisión de positrones combinada con tomografía axial computarizadaTras un ayuno de 4h, se determinó la glucemia capilar basal (medidor Accu-Chek Aviva, Roche Diagnostics GmbH, Mannheim, Alemania). Si la glucemia era superior a 140mg/dl se administraba una dosis de insulina rápida según protocolo estandarizado, realizándose posteriormente controles seriados cada 15min hasta obtener valores inferiores a 140mg/dl. Obtenidos estos valores, a todos los enfermos se les administró el radiotrazador 18-flúor-desoxi-glucosa (18F-FDG) a dosis de 0,1mCi/kg. Tras un mínimo de 45min se procedió a la adquisición de imágenes de cuerpo entero con PET/TAC, cuantificándose la actividad metabólica glucídica en los diversos grupos musculares mediante el standard uptake value18,19. Este sistema permite obtener una variable que corresponde al cociente entre la concentración de señal radiactiva en un lugar determinado y la concentración de dicha actividad que se produciría en el caso hipotético de una distribución aleatoria por todo el organismo, expresado en unidades arbitrarias. Los músculos estudiados fueron el diafragma, como representante de los músculos predominantemente inspiratorios; el recto anterior del abdomen (región umbilical y cresta ilíaca), como músculo accesorio de la espiración; el cuádriceps (porción del recto anterior, junto al trocánter mayor) y el bíceps braquial (tercio medio del brazo). En los 2 músculos de las extremidades se tomó el valor obtenido en el hemicuerpo no dominante. A su vez, en el caso del diafragma se obtuvieron imágenes y cuantificación diferenciadas para sus porciones costal (zona de aposición) y crural (a la altura del 12.o cuerpo vertebral dorsal).
Análisis estadísticoLas variables cuantitativas con distribución normal se presentan como valor de la media±desviación estándar, mientras que las que no presentaban dicha distribución se muestran como mediana±límites intercuartílicos. Las comparaciones de variables de distribución no normal entre diferentes músculos para un mismo sujeto se realizaron mediante la prueba de Wilcoxon, mientras que las comparaciones entre grupos lo fueron con la prueba no paramétrica de la U de Mann-Whitney. Finalmente, las relaciones entre variables cuantitativas se analizaron mediante el coeficiente de correlación de Spearman. En todos los casos la significación estadística se definió por una p inferior a 0,05. Se utilizó el programa estadístico SPSS versión 14.0 (IBM, New York, NY, EE. UU.) en todos los análisis.
ResultadosCaracterísticas clínicasLa filiación y características clínicas, incluyendo las antropométricas y funcionales, aparecen en la tabla 1. Fundamentalmente se trataba de sujetos en la sexta-séptima décadas de la vida y con buen estado nutricional. En el grupo control, 6 sujetos habían sido fumadores en el pasado, con una media de consumo de 15 paquetes/año. En cuanto a las características funcionales, y tal como es implícito al diseño, diferentes variables se hallaban modificadas en los pacientes con EPOC.
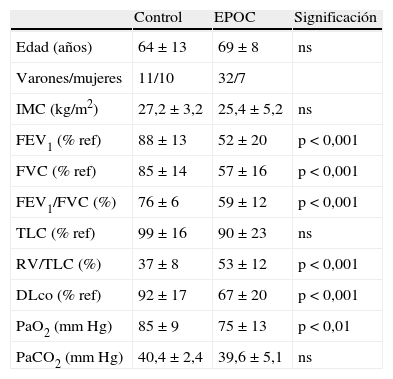
Características de filiación, antropométricas y funcionales respiratorias de los pacientes con EPOC y de los sujetos con función pulmonar normal (controles)
| Control | EPOC | Significación | |
| Edad (años) | 64±13 | 69±8 | ns |
| Varones/mujeres | 11/10 | 32/7 | |
| IMC (kg/m2) | 27,2±3,2 | 25,4±5,2 | ns |
| FEV1 (% ref) | 88±13 | 52±20 | p<0,001 |
| FVC (% ref) | 85±14 | 57±16 | p<0,001 |
| FEV1/FVC (%) | 76±6 | 59±12 | p<0,001 |
| TLC (% ref) | 99±16 | 90±23 | ns |
| RV/TLC (%) | 37±8 | 53±12 | p<0,001 |
| DLco (% ref) | 92±17 | 67±20 | p<0,001 |
| PaO2 (mm Hg) | 85±9 | 75±13 | p<0,01 |
| PaCO2 (mm Hg) | 40,4±2,4 | 39,6±5,1 | ns |
DLco: factor de transferencia del monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; ns: no significativo; PaCO2: presión parcial de anhídrido carbónico en sangre arterial; PaO2: presión parcial de oxígeno en sangre arterial; RV: volumen residual; TLC: capacidad pulmonar total.
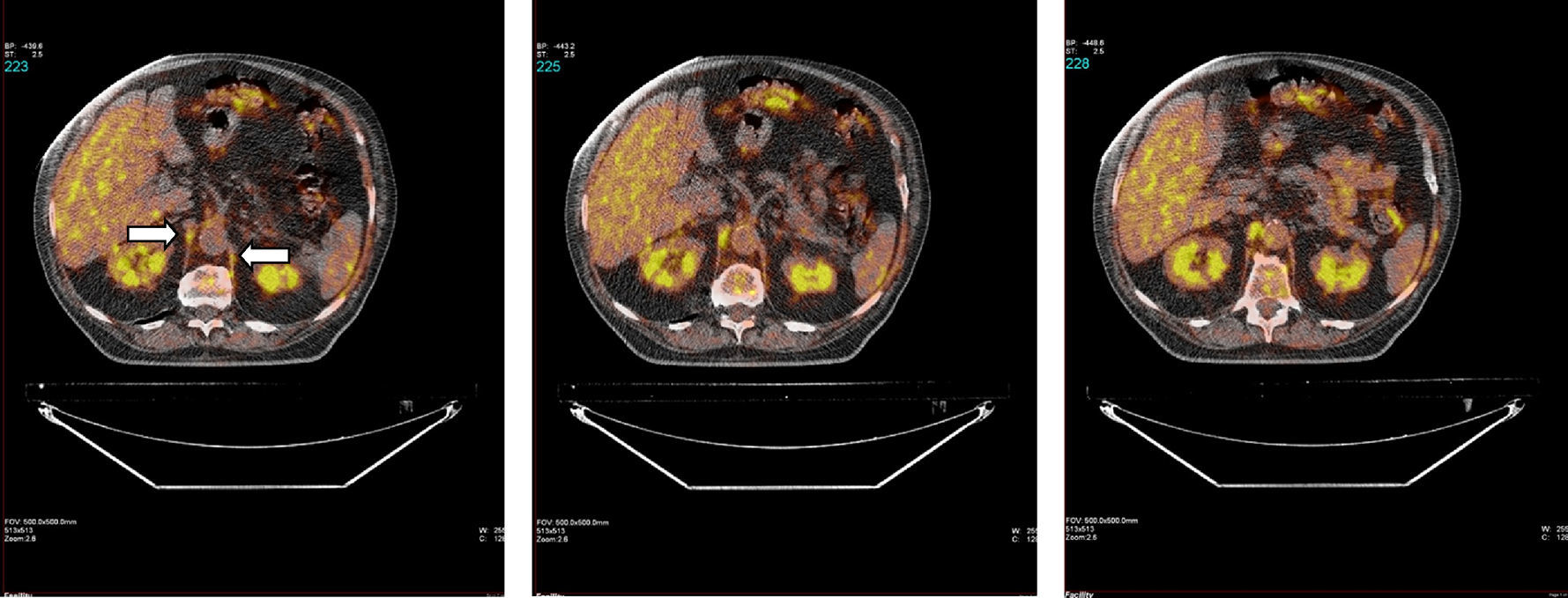
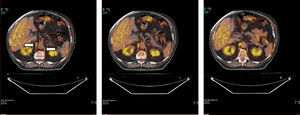
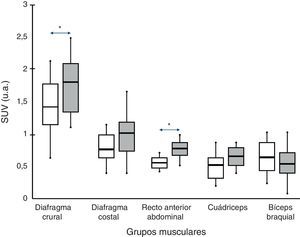
En la figura 1 se muestra un ejemplo característico de la captación del radiotrazador 18F-FDG en el diafragma crural de un paciente con EPOC. La captación por parte de los diferentes grupos musculares para los 2 grupos del estudio se puede observar en la figura 2.
Imágenes axiales correspondiente a la fusión de las obtenidas por PET y TAC para cada localización. Se visualiza con claridad la captación del radiotrazador en el diafragma crural (o «crura») derecho e izquierdo (flechas blancas) en uno de los pacientes con EPOC. Otras estructuras, como riñones e hígado, muestran también captación.
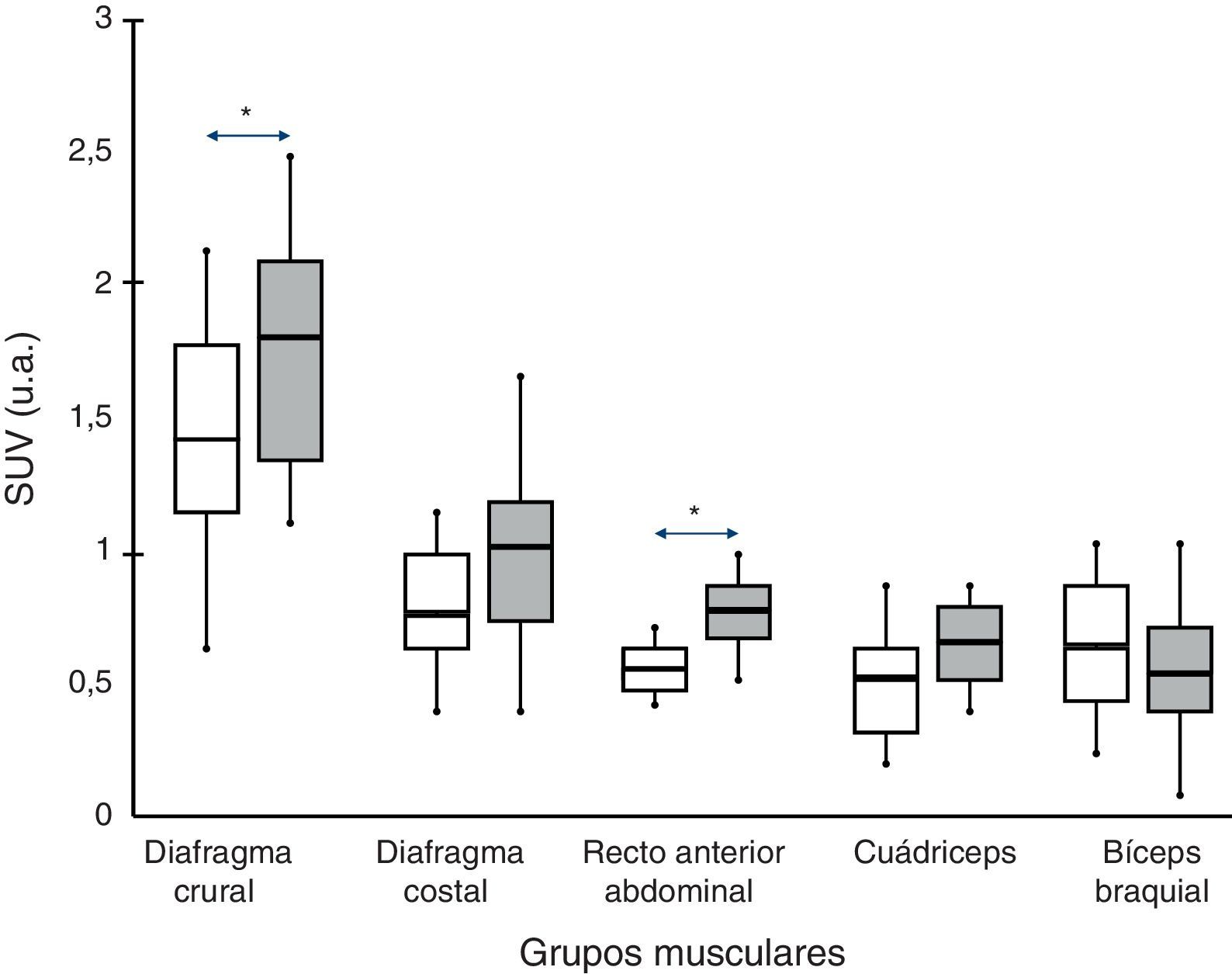
En todos los sujetos, tanto pacientes con EPOC como individuos con función pulmonar normal, se observó una mayor captación del radiotrazador en el diafragma (porciones crural y también costal) respecto del resto de los músculos (recto del abdomen, cuádriceps y bíceps braquial).
Comparaciones intergrupoEn los pacientes con EPOC se observó un valor superior al de los sujetos control en las 2 porciones del diafragma (aunque la diferencia únicamente era significativa para su parte crural, 1,8±0,7 frente a 1,4±08 respectivamente; p<0,05) y recto del abdomen (0,78±0,2 frente a 0,58±0,1 respectivamente; p<0,05). También la porción del recto anterior del cuádriceps mostraba una tendencia en el mismo sentido, aunque sin alcanzar la significación estadística.
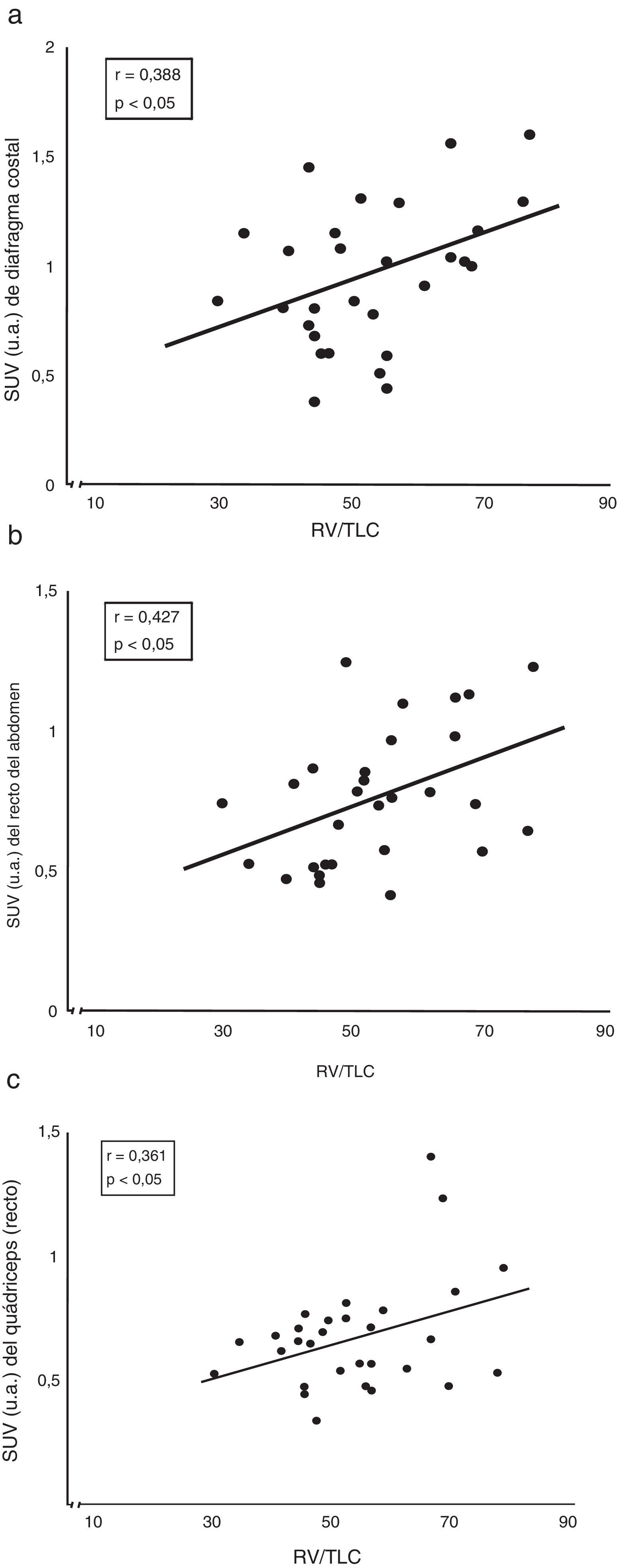
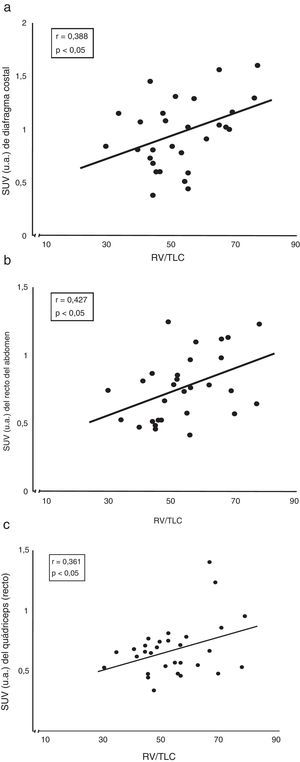
Correlaciones entre captación del radiotrazador y función pulmonarEntre las correlaciones más interesantes destacan la observada entre el atrapamiento aéreo (representado por el cociente entre volumen residual y capacidad pulmonar total) y el grado de captación tanto del diafragma costal como del recto del abdomen y el cuádriceps de los pacientes con EPOC (fig. 3).
Correlación entre el atrapamiento aéreo (expresado por el cociente pletismográfico RV/TLC) de los pacientes con EPOC y la captación de su (a) diafragma costal, (b) recto del abdomen y (c) cuádriceps. RV: volumen residual; SUV: standard uptake value; TLC: capacidad pulmonar total; u.a.: unidades arbitrarias de captación
Los hallazgos más relevantes del presente estudio son: (1) El uso combinado de TAC-PET con 18F-FDG puede ser útil para valorar simultáneamente la actividad metabólica glucídica de diferentes grupos musculares (respiratorios y periféricos) in vivo y en pacientes con EPOC; (2) en reposo y bajo condiciones de respiración tranquila, se constata una captación heterogénea en los diferentes grupos musculares estudiados, siendo mayor en el principal músculo inspiratorio, el diafragma, tanto en sujetos sanos como en pacientes con EPOC; (3) bajo las circunstancias mencionadas se confirma cuantitativamente la ya conocida mayor actividad metabólica de los músculos respiratorios de los pacientes con EPOC en comparación con los de los sujetos control, con tendencia similar en el cuádriceps; y (4) en los pacientes con EPOC, existe una relación directa entre el grado de atrapamiento aéreo y la actividad metabólica tanto de los músculos respiratorios como del cuádriceps.
Los resultados obtenidos confirman que la actividad metabólica en reposo es diferente en los diversos grupos musculares, siendo superior lógicamente en los músculos respiratorios, ya que mantienen su contracción periódica. En este sentido se sabe que el consumo de oxígeno de estos músculos en reposo representa alrededor de un 2-5% del de todo el organismo en los sujetos sanos, aunque aumenta a algo más del doble de este valor en los pacientes con EPOC correctamente nutridos20,21. El uso de ese oxígeno en las vías aeróbicas implica una degradación proporcional de sustratos metabólicos, como la glucosa, para obtener energía. En el mismo sentido, es interesante comprobar cómo los músculos respiratorios de los pacientes con EPOC tienen una actividad metabólica superior a los de los sujetos sanos, y que una tendencia parecida se observa en los periféricos. Además, el nivel de metabolismo muscular es proporcional a variables que son representativas de los cambios que se han producido en la mecánica respiratoria. Todo ello está de acuerdo en diversos aspectos con trabajos anteriores que han utilizado otras técnicas8,20,21. Por un lado, sabemos que las cargas mecánicas del sistema provocan en los enfermos un aumento del trabajo respiratorio, y que esto conduce a un mayor consumo de oxígeno y de energía. El primero se ha calculado que corresponde a unos 1-2ml por cada litro adicional de ventilación en los sujetos sanos y hasta 3-6ml/l en los pacientes con EPOC20,21. Por otra parte, diversos estudios han demostrado que los cambios estructurales y metabólicos que aparecen en los músculos de los pacientes con EPOC no son equivalentes para los diversos grupos contráctiles. Así, todos ellos muestran afectación funcional, pero en diverso grado22. Además, los músculos respiratorios combinan un mayor grado de lesión estructural, con la presencia incrementada de células y citocinas inflamatorias, estrés oxidativo y signos de apoptosis23,24, pero al mismo tiempo presentan cambios más favorables, entre los que destacan los aumentos de capilaridad, de la actividad de enzimas clave en las vías aeróbicas y del porcentaje de fibras de metabolismo predominantemente oxidativo12,25–27. Un hallazgo novedoso y enigmático del presente trabajo es la mayor captación del radiotrazador observada en el diafragma crural, cuya función es de fijación, respecto del costal, que actúa más como un émbolo. No existen trabajos anteriores que hayan medido el consumo energético diferencial entre las distintas porciones del diafragma, pero podría estar en relación con la conocida heterogeneidad de su composición fibrilar, del contenido regional de glucógeno, o de la diferente capacidad oxidativa de sus fibras rápidas28,29.
Respecto de los 2 trabajos anteriores que han utilizado la PET en la evaluación de la actividad metabólica en los músculos de los pacientes13,14, una de las novedades destacables del presente estudio es el uso de una técnica de cuantificación en la captación del radiotrazador, lo que permite una mayor precisión. Es obvio que una valoración meramente cualitativa puede permitir discriminar grandes diferencias entre distintos músculos o individuos, pero no permite apreciar estadísticamente variaciones menores. Otro elemento novedoso es la diferenciación entre las actividades de las porciones costal y crural del diafragma, cuyas funciones son diferentes (émbolo y fijación de estructuras circundantes, respectivamente). Por otra parte, este estudio incluye la evaluación simultánea de los músculos de las extremidades, en los cuales las biopsias utilizadas en trabajos previos han mostrado hallazgos sustancialmente diferentes a los de los músculos respiratorios. La evaluación simultánea de músculos periféricos y respiratorios es además interesante porque ambos grupos contráctiles parecen competir bajo determinadas circunstancias por el flujo sanguíneo y el consiguiente aporte de sustratos metabólicos30.
En el presente trabajo, el músculo cuádriceps ha mostrado una tendencia a una captación incrementada de glucosa en los pacientes con EPOC. En esa misma dirección apunta un trabajo previo en el que se mostró que este músculo posee un consumo energético aumentado en los pacientes con EPOC para cualquier nivel de actividad8, a pesar de una concentración disminuida de elementos estructurales aeróbicos, acompañada de estrés oxidativo, signos de lesión y de apoptosis24,31–37. Este cambio en la eficiencia metabólica (bioenergética) no se revierte con el entrenamiento, por lo que parece indicar la acción de factores ajenos al decondicionamiento.
A su vez, el músculo de las extremidades superiores muestra en el presente trabajo una tendencia contraria a la observada en el cuádriceps. Esto podría explicarse por los escasos cambios estructurales y metabólicos que la EPOC produce en los músculos de dicha región9,38. De forma global podría afirmarse que la conocida heterogeneidad de los hallazgos en las biopsias de los diferentes grupos musculares de los pacientes se refleja también en la diversidad de su captación de glucosa evidenciada en el presente trabajo. Este muestra que la repercusión de la enfermedad ha sido diversa, alejándose de la normalidad en mayor grado en el caso de los músculos respiratorios. Es más, el incremento de actividad metabólica ligada a la glucosa sigue un patrón dosis-respuesta con la carga mecánica (representada aquí por el atrapamiento aéreo) afrontada por los pacientes. Es probable que la relación entre el aumento de volúmenes pulmonares estáticos y la actividad metabólica del músculo inspiratorio (diafragma en este caso) dependa tanto de cambios en el patrón ventilatorio como de la progresiva aparición de presión positiva al final de la espiración, que la contracción muscular debe superar antes de generar flujo aéreo. Esto supondría una mayor demanda, y por tanto, mayor consumo energético. Respecto al músculo espiratorio (recto del abdomen), se sabe que forma parte de un grupo contráctil que actúa incluso en situación de reposo en los pacientes con EPOC, ya que son necesarios para vencer las resistencias espiratorias de la vía aérea. Esta actividad se incrementa más en ejercicio, tanto para aumentar el flujo aéreo espiratorio como para evitar la hiperinsuflación39. En sujetos con espirometría normal, por el contrario, la captación de glucosa fue similar a la observada en los músculos de las extremidades. Este hallazgo es lógico, dada la inactividad de estos últimos durante la exploración y la supuesta pasividad relativa de los primeros durante la respiración en reposo40. Por el contrario, se sabe que durante el ejercicio (incluso ligero) los músculos abdominales son también activamente reclutados en sujetos sanos, con resultados funcionales similares a los mencionados en pacientes con EPOC39.
El presente estudio se ha limitado a la situación de respiración tranquila y a las cargas propias de la enfermedad en fase estable. Se hace necesario evaluar también la distribución de la actividad metabólica muscular y sus cambios en pacientes con EPOC sometidos a diferentes niveles de cargas respiratorias o a actividad física general. En estas situaciones se conjugan diversos factores que pueden influir en la capacidad y actividad metabólicas, como son entre otros la capilaridad y flujo sanguíneo, la concentración de hemoglobina, la difusión tisular de gases y la utilización de los sustratos metabólicos y del oxígeno. Es más, existen estudios que muestran cómo estas variables pueden tener un comportamiento diferenciado en los distintos grupos musculares, ya que se sabe que por ejemplo, durante el ejercicio general a cargas elevadas, se preserva el flujo sanguíneo hacia el cuádriceps pero se restringe la perfusión a los músculos respiratorios de la caja torácica30. Otra situación interesante que debe ser explorada en el futuro es la exacerbación de la enfermedad. Sin duda, tanto la carga mecánica aumentada como el estado inflamatorio pulmonar y sistémico que acompaña a estas situaciones pueden modificar la actividad metabólica de los diversos grupos musculares.
Potenciales implicaciones clínicas. La relación directa y lineal entre carga mecánica y consumo energético muscular observada en los pacientes con EPOC del presente estudio puede tener implicaciones en el manejo de los enfermos. Así, es probable que aquellos pacientes con mayor grado de atrapamiento aéreo sean más susceptibles de presentar fracaso muscular respiratorio en situaciones de estrés ventilatorio. Sin embargo, esta hipótesis, que implicaría una mayor vigilancia de dicha subpoblación durante las exacerbaciones graves, debe ser contrastada con futuros estudios que incluyan cargas ventilatorias instrumentalmente aumentadas.
Por otra parte, el uso combinado de PET/TAC podría llegar a ser útil en identificar pacientes de riesgo o susceptibles de intervenciones terapéuticas (p. ej. entrenamiento muscular selectivo), debido a una bioenergética muscular más o menos alterada en uno u otro músculo, sin necesidad de procedimientos invasivos y técnicamente muy complejos (biopsia, cateterización arterial y venosa con medición del consumo local de oxígeno). Esta caracterización metabólica podría realizarse en un contexto clínico. Por supuesto, la característica de escasa invasividad y fácil manejo de la PET/TAC puede además abrir el camino a trabajos de investigación sobre el metabolismo muscular en enfermedades respiratorias, facilitando la comprensión de los cambios que se asocian a ellas.
Limitaciones y especificidadesUna potencial limitación del presente estudio ha sido la inclusión de pacientes afectos en su mayoría de neoplasia pulmonar localizada, por lo que no podemos descartar de forma absoluta alguna interferencia por dicha patología. No obstante, los pacientes estudiados padecían una enfermedad no diseminada y alejada de las zonas de interés del estudio. Por otro lado, un pequeño porcentaje de pacientes tomaba fármacos cuyo uso puede desencadenar ocasionalmente efectos sobre la estructura y/o función musculares. Los fármacos de estas características utilizados en el estudio fueron corticosteroides (un 5% de los pacientes los habían recibido meses atrás, en exacerbaciones previas), antagonistas del calcio (6%) e insulina (5%).
La segunda limitación es la relacionada con el músculo espiratorio escogido. Es cierto que el recto anterior es probablemente el elemento de la prensa abdominal que menos participa en la generación de presión positiva en esa cavidad. Sin embargo, es el más accesible para la técnica utilizada y los resultados demuestran la coherencia de la elección (diferencias entre controles y pacientes con EPOC, así como relación con la afectación funcional en estos últimos).
Una tercera característica del estudio que pudiera ser considerada como limitación potencial es la que deriva de la necesidad de escoger un determinado radioisótopo. El 18F-FDG es el de utilización habitual en la estadificación de los pacientes con sospecha de cáncer y da una buena idea del uso de glucosa en los tejidos, y por tanto del nivel general de actividad metabólica. Como es conocido, el uso de la glucosa se halla al inicio de las vías habituales de obtención de energía, tanto anaeróbicas como aeróbicas, por lo que supone un punto muy sensible para valorar el metabolismo de forma global. Sin embargo, es poco específico. En estudios encaminados a explorar vías metabólicas o puntos de estas más concretos puede ser útil utilizar otros trazadores complementarios.
Finalmente, en algunos casos la zona explorada puede haber incluido parcialmente algún músculo adicional, debido a la superposición de planos (p. ej. en el abdomen). En todo caso, se trataría de actividad muscular regional y a efectos de clasificación formaría parte de un grupo contráctil considerado como funcionalmente homogéneo.
El presente estudio demuestra que la PET/TAC utilizando el radiotrazador 18F-FDG permite cuantificar la actividad metabólica simultánea de los diversos compartimentos musculares en humanos. Dicha actividad es heterogénea y superior en los músculos respiratorios respecto de los localizados en las extremidades. Como se había descrito (aunque sin cuantificarlo), los pacientes con EPOC muestran en reposo una mayor actividad metabólica en sus músculos respiratorios que los sujetos con función pulmonar normal, pero en nuestro estudio también muestran una tendencia similar los músculos de las extremidades inferiores. La actividad muscular en los pacientes es además proporcional al grado de afectación funcional respiratoria, sugiriendo una relación causa-efecto, con potenciales implicaciones clínicas.
FinanciaciónFinanciado por: SAF2007-62719, SAF2011-26908, 2009SGR393 y CIBERES.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los radiólogos Iván Vollmer y Ángel Gayete por su colaboración en la identificación de las estructuras anatómicas, y a las enfermeras Ángela Roig y Laura Muñoz, por su colaboración en la ejecución de las pruebas funcionales respiratorias.