El principal objetivo de la estadificación en el cáncer de pulmón de células no pequeñas (CPCNP) es la evaluación de la afectación ganglionar mediastínica, y la TC torácica es la principal prueba no invasiva para la evaluación. Sin embargo, dado que hasta un 15% de los pacientes sin afectación ganglionar del mediastino en la TC tienen metástasis ganglionares en la cirugía, son necesarias otras exploraciones. La punción aspirativa con aguja fina guiada por ultrasonografía endoscópica (USE-PAAF) ha demostrado ser capaz de detectar enfermedad avanzada (ganglios mediastínicos metastásicos, metástasis en la suprarrenal, invasión mediastínica por el tumor) en aproximadamente el 25% de los pacientes con TC que sugiere enfermedad no avanzada.
Otra situación en la que la TC tiene un valor muy limitado es en la evaluación de la respuesta a la terapia de inducción, siendo su incapacidad intrínseca para distinguir entre tumor y necrosis el factor más limitante. En este contexto la USE-PAAF ha demostrado tener un buen rendimiento con una sensibilidad, valor predictivo negativo y precisión del 75, 67 y 83% respectivamente.
En consecuencia, la USE-PAAF puede ser considerada una buena alternativa en la estadificación preoperatoria de los pacientes con CPCNP con y sin ganglios mediastínicos patológicos en la TC y podría desempeñar un papel importante en la reestadificación mediastínica de estos pacientes mediante la identificación de un subgrupo de pacientes que se beneficiarían de tratamiento quirúrgico adicional.
The main purpose of staging in non-small cell lung cancer (NSCLC) is to assess mediastinal lymph node involvement, with thoracic CT being the main non-invasive test for this. However, given that up to 15% of patients who show no mediastinal lymph node involvement in the CT have lymph node metastasis during surgery, other examinations are required. Endoscopic ultrasonography guided fine-needle aspiration (EUS-FNA) has shown to be able to detect advanced disease (metastatic mediastinal lymph nodes, adrenal metastasis, mediastinal invasion by the tumour) in approximately 25% of patients with a CT that suggested a non-advanced disease.
Another situation in which CT has a very limited value is in the evaluation of the response to induction therapy, with its most limiting factor being its intrinsic inability to distinguish between a tumour and necrosis. In this context, EUS-FNA has shown to have a good performance, with a sensitivity, negative predictive value and precision of 75%, 67% and 83%, respectively.
In conclusion, EUS-FNA may be considered a good alternative in the pre-operative staging of patients with NSCLC, with and without diseased mediastinal lymph nodes in CT, and could play an important role in the mediastinal re-staging of these patients by identifying a patient sub-group who might benefit from additional surgical treatment.
El objetivo primario de la estadificación en el cáncer de pulmón de células no pequeñas (CPCNP) es la evaluación mediastínica. Una evaluación mediastínica precisa es fundamental para determinar el pronóstico y el tratamiento de estos pacientes, ya que la presencia de afectación ganglionar mediastínica supone un estadio IIIA o IIIB1–3. Esto se traduce en la necesidad de tratamiento neoadyuvante seguido o no de cirugía. Dado que el 30-40% de los pacientes con CPCNP de nuevo diagnóstico tienen afectación mediastínica, la realización de pruebas complementarias que evalúen el mediastino es necesaria.
Hay múltiples opciones para estadificar el mediastino. La TC torácica es la principal prueba diagnóstica en la evaluación mediastínica del carcinoma broncogénico. El criterio diagnóstico para malignidad es la presencia de adenopatías con un diámetro menor de más de 1cm. La precisión de la TC en la identificación de adenopatías mediastínicas patológicas es variable según los diferentes estudios (57 a 95%)4–6. Esta precisión varía según las estaciones ganglionares, siendo la más alta para la región paratraqueal derecha y la menor para la región subcarinal7. Hasta un 15% de los pacientes que no tienen adenopatías mayores de 1cm en la TC presentan metástasis mediastínicas en la cirugía8–10.
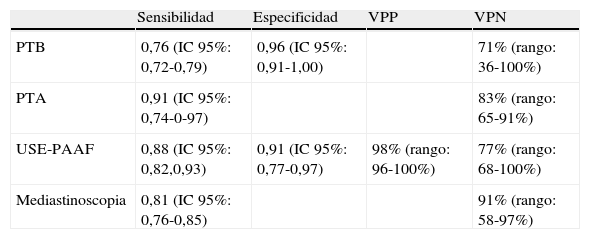
Dado que la presencia o ausencia de adenopatías metastásicas mediastínicas influye en la decisión acerca de la resecabilidad del tumor, la TC por sí misma no puede usarse para la estadificación mediastínica y la confirmación histológica de las adenopatías es imperativa. La punción aspirativa con aguja fina guiada por ultrasonografía endoscópica (USE-PAAF) ha demostrado ser altamente precisa para la valoración de las estaciones ganglionares localizadas en el mediastino medio y posterior (regiones 4L, 5, 7, 8 y 9 y, en ocasiones, las 2 y 4R), así como la glándula suprarrenal izquierda, mientras que las regiones peribronquiales e hiliares y el mediastino anterior no son accesibles a USE-PAAF pero sí a la punción aspirativa (PA) guiada por ultrasonografía endobronquial (USEB)11,12. En una revisión sistemática y un metaanálisis de 18 estudios que incluye 1.201 pacientes publicado por Micames et al13, la USE-PAAF obtuvo una sensibilidad del 83% y una especificidad del 97% para la estadificación mediastínica (N2/N3) en pacientes con cáncer de pulmón. La principal ventaja de la USE-PAAF sobre otros métodos no invasivos es la capacidad de obtener la confirmación histológica de la presencia de enfermedad. Comparada con las técnicas quirúrgicas mínimamente invasivas como la mediastinoscopia, la USE-PAAF (al igual que la PA guiada por USEB) requiere sólo una sedación consciente, puede realizarse de forma rutinaria en pacientes en régimen ambulatorio y ha demostrado ser más coste-eficaz14–17. La eficacia de las diferentes técnicas utilizadas para la estadificación del CPCNP se detalla en la tabla 1.
Rendimiento de las diferentes técnicas invasivas en pacientes con CPCNP. Revisión de la evidencia científica publicada
| Sensibilidad | Especificidad | VPP | VPN | |
| PTB | 0,76 (IC 95%: 0,72-0,79) | 0,96 (IC 95%: 0,91-1,00) | 71% (rango: 36-100%) | |
| PTA | 0,91 (IC 95%: 0,74-0-97) | 83% (rango: 65-91%) | ||
| USE-PAAF | 0,88 (IC 95%: 0,82,0,93) | 0,91 (IC 95%: 0,77-0,97) | 98% (rango: 96-100%) | 77% (rango: 68-100%) |
| Mediastinoscopia | 0,81 (IC 95%: 0,76-0,85) | 91% (rango: 58-97%) |
PTA: punción transtorácica; PTB: punción transbronquial; USE-PAAF: punción con aguja fina guiada por ultrasonografía endoscópica; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Hay dos situaciones clínicas en los pacientes con CPCNP que plantean un especial problema diagnóstico en las que la USE-PAAF es una buena alternativa y ofrece una nueva perspectiva: la evaluación de pacientes con mediastino negativo por TC y la reestadificación después de tratamiento neoadyuvante.
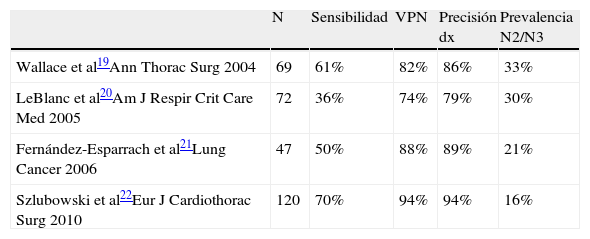
USE-PAAF en cáncer de pulmón en pacientes con mediastino normal en TCEl manejo de los pacientes con CPCNP sin signos de afectación mediastínica en la TC está todavía en discusión. La USE permite detectar nódulos mediastínicos de hasta 2-3mm18. Por lo tanto, la USE es capaz de detectar adenopatías menores de 1cm consideradas irrelevantes por la TC e incluso obtener una muestra de las mismas que confirme o descarte la afectación de estos ganglios. Cuatro estudios prospectivos han evaluado la USE-PAAF en pacientes con CPCNP sin ganglios patológicos por TC demostrando que la USE-PAAF es capaz de detectar enfermedad avanzada (metástasis mediastínicas, metástasis suprarrenal, invasión mediastínica del tumor) en aproximadamente el 25% de los pacientes cuya TC mostraba solamente enfermedad no avanzada19–22 (tabla 2). Wallace et al19 publicaron un estudio en el que la USE-PAAF identificó metástasis ganglionares N2-N3 en 14 de 67 pacientes (21%). Hubo además 9 falsos negativos debido a un error de muestreo (n=5) o a la presencia de metástasis en ganglios pre y paratraqueales que no se visualizaron por USE (n=4). En otro estudio, Leblanc et al20 identificaron metástasis N3 en 5 de 67 pacientes (7%) mediante USE-PAAF. La USE evitó la cirugía en 9 pacientes (13%), no sólo por la afectación N3 (n=5) sino también a través de la detección de adenopatías metastásicas celíacas (n=2), la invasión tumoral (n=1) y la detección de un cáncer esofágico sincrónico (n=1). En otros 9 pacientes, la USE tuvo un impacto en el manejo debido a la detección de lesiones benignas suprarrenales (n=8) y a una lesión hepática (n=1). En total, los hallazgos de la USE cambiaron el manejo de los pacientes en un 25% de los casos. En la estadificación quirúrgica de los restantes 62 pacientes en los que no se diagnosticó enfermedad mediastínica, se encontraron metástasis ganglionares en 17 pacientes más.
La prevalencia de metástasis mediastínicas en estos dos estudios (35 y 36% respectivamente) es superior a la de otras series quirúrgicas, lo cual sugiere un sesgo a favor de la USE por inclusión de pacientes con adenopatías de tamaño «borderline» o porque se realizaron más pases de lo habitual (normalmente 4 o 5 aspirados por lesión en el estudio de Wallace et al). En el estudio de Fernández-Esparrach et al21 la USE-PAAF demostró metástasis en adenopatías N2-3 en 5 de 47 pacientes (11%). Hubo 5 falsos negativos que fueron debidos a micrometástasis (n=1), no realización de PAAF por aspecto morfológico de benignidad (n=3) o a la presencia de metástasis en una adenopatía que no fue visible por USE (n=1). En este estudio, la USE-PAAF se realizó cuando estaba presente uno o más de los criterios ecográficos clásicos de malignidad por USE (hipoecogenicidad, forma redonda, bordes bien definidos, tamaño > 5mm)23,24. En consecuencia, tres adenopatías metastásicas (en dos pacientes) visualizadas por USE no se consideraron tributarias de USE-PAAF.
Por lo tanto, en la estadificación mediastínica del CPCNP el uso de los criterios clásicos de malignidad debería reconsiderarse25. Las razones de la baja sensibilidad de estos criterios no se han investigado específicamente. Sin embargo, dado que es habitual encontrar adenopatías inflamatorias mediastínicas en pacientes sanos, se podría pensar que la infiltración de las adenopatías por células metastásicas no cambiaría necesariamente las características morfológicas de las adenopatías preexistentes. De esta manera, cualquier adenopatía mediastínica sería tributaria de ser puncionada en pacientes con CPCNP. Finalmente, es bien conocido que las adenopatías mediastínicas pueden contener focos de micrometástasis en pacientes con CPCNP. Por tanto, un análisis más exhaustivo de todos los ganglios mediastínicos visibles y la adición de PA guiada por USEB para explorar las regiones no accesibles a la USE mejoraría el rendimiento diagnóstico de la USE-PAAF en estos pacientes22.
Reestadificación mediastínica tras terapia neoadyuvanteLa reestadificación mediastínica en los pacientes con CPCNP tras inducción quimioterápica es un tema controvertido. La TC y la RMN tienen un valor limitado debido a la incapacidad intrínseca de estas técnicas para diferenciar entre tumor y necrosis, siendo por tanto su precisión baja26. Por otro lado, el PET no es un buen predictor de respuesta a la quimioterapia ni del tumor primario ni de las adenopatías27–29. Los resultados de una revisión sistemática reciente desaconsejan el uso único del PET para la reestadificación ganglionar del mediastino ya que la eficacia no es muy buena (sensibilidad 63,8% [IC 95%: 53,3-73,7%] y especificidad 85,3% [IC 95%: 80,4-89,4%]). En cuanto a la respuesta del tumor primario, los resultados son muy variables, siendo la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) del 80-100%; 0-100%; 42,9-100% y 66,7-100%, respectivamente29.
Estudios recientes han demostrado que los pacientes con CPCNP con metástasis en adenopatías ipsilaterales que fueron infraestadificados con inducción quimioterápica tuvieron una supervivencia significativamente mayor tras resección quirúrgica en comparación a aquellos pacientes con persistencia de enfermedad N230–33. La supervivencia a los tres años fue de 59% en los pacientes del primer grupo y del 0% en los pacientes con persistencia de enfermedad N2. Por lo tanto, es necesaria una evaluación precisa de la respuesta a la terapia neoadyuvante para decidir la estrategia terapéutica en función del pronóstico.
La mediastinoscopia continúa siendo una herramienta válida en la reestadificación del CPCNP localmente avanzado tras tratamiento neoadyuvante con una precisión diagnóstica de 85%26,34–37. La mediastinoscopia proporciona evidencia histológica de la respuesta al tratamiento y selecciona aquellos pacientes que se beneficiarán de una posterior toracotomía. Sin embargo, la frecuencia de procedimientos incompletos es elevada (40%) debido a dificultades técnicas secundarias a la presencia de fibrosis mediastínica38.
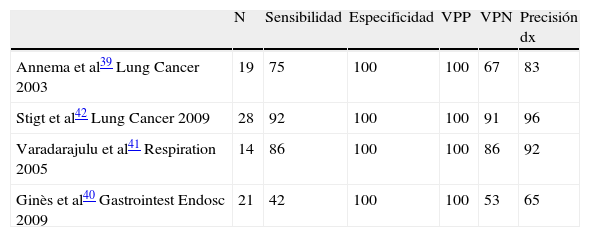
Annema et al39 publicaron el primer estudio con USE-PAAF para la reestadificación mediastínica en 19 pacientes con enfermedad N2 que habían sido tratados con inducción quimioterápica y obtuvieron una sensibilidad, VPN y precisión diagnóstica del 75, 67, 83%, respectivamente. Hubo tres falsos negativos (errores de muestreo en dos casos y un tumor paraesofágico no detectado por USE en un caso). Estos resultados son inferiores a los obtenidos con USE-PAAF en los pacientes que no han sido tratados con quimioterapia, pero muy similares a los publicados por otros autores39–42 (tabla 3). En el estudio de Ginès et al40, las cifras de sensibilidad y VPN son las más bajas publicadas hasta el momento y podría explicarse por la localización de algunas adenopatías en estaciones más difíciles de visualizar por USE, como es el caso de la estación 4R.
Otros autores han comparado la TC-PET con la USE-PAAF. En el estudio realizado por Stigt et al42 en 28 pacientes, la USE-PAAF tuvo un VPN y una precisión diagnóstica del 92%. La concordancia entre los hallazgos de la reestadificación por USE-PAAF y la respuesta metabólica de las adenopatías metastásicas ocurrió en 17 de 27 pacientes. Sin embargo, y debido a que la confirmación histológica es superior y por tanto necesaria, la USE-PAAF es el procedimiento de primera elección para la reestadificación mediastínica.
Las adenopatías de la región paratraqueal derecha no pueden visualizarse correctamente por USE. Esta parte del mediastino podría explorarse por USEB43. Un estudio reciente de 124 pacientes tratados mediante inducción quimioterápica para el estadio IIIA44 obtuvo una sensibilidad de 76% para PA guiada por USEB. Sin embargo, debido al bajo VPN (20%), los autores sugieren que los hallazgos negativos deberían ser confirmados mediante estadificación quirúrgica previa a la toracotomía.
Algunas de las razones de este bajo VPN de la PA guiada por USEB son las siguientes:
- 1.
Después de la quimioterapia, las adenopatías que inicialmente contienen tumor presentan necrosis y fibrosis son más difíciles de biopsiar y la cantidad de material celular para analizar es menor;
- 2.
Las células malignas pueden localizarse focalmente dentro de la adenopatía en el interior de áreas de matriz extracelular densa;
- 3.
La presencia de necrosis dentro del aspirado a menudo dificulta la valoración patológica; y
- 4.
No hubo una evaluación “in situ” por el citólogo, lo cual podría haber incrementado la sensibilidad para la detección de malignidad.
Es importante recordar los diferentes territorios que habitualmente son accesibles a la USE y USEB. USEB permite el acceso a las regiones paratraqueales (estaciones 2, 3p y 4), subcarinal (estación 7), hiliar (estación 10) e interlobar (estación 11). Mediante USE, podemos visualizar las regiones del mediastino posteroinferior (estaciones 4L, 5, 7, 8 y 9 y, en ocasiones, las 2 y 4R)11,12. Dado que estas técnicas son complementarias, la combinación de ambas podría mejorar su precisión. Además, se ha demostrado que la realización secuencial de USEB y USE es bien tolerada por los pacientes cuando se realiza bajo sedación consciente45.
En conclusión, la USE-PAAF debe considerarse en la estadificación mediastínica de pacientes con CPCNP con y sin adenopatías patológicas por TC y en la reestadificación mediastínica después de tratamiento neoadyuvante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.