La donación en asistolia no controlada (DANC) constituye una alternativa al trasplante pulmonar con donantes en muerte encefálica. El objetivo principal del estudio es describir la incidencia de eventos al mes tras el trasplante con pulmones de DANC, y la influencia de los factores dependientes del donante y del proceso de donación.
Pacientes y métodosEstudio de una cohorte histórica de 33 receptores de trasplante pulmonar realizados en los hospitales Puerta de Hierro y Marqués de Valdecilla con 32 DANC procedentes del Hospital Clínico San Carlos durante el periodo 2002-2008. Se estudiaron los siguientes eventos: complicaciones quirúrgicas y médicas, disfunción primaria del injerto, rechazo agudo, neumonía y mortalidad. Se evaluaron las características del donante y los tiempos del proceso de donación (minutos).
ResultadosLa mediana de edad de los receptores fue 50,5 años (rango intercuartílico, 38,5-58); 28 hombres y 5 mujeres. La incidencia acumulada de los eventos al mes fue: neumonía, 10 (31,3%); disfunción primaria del injerto, 15 (46,9%); rechazo, 12 (37,5%); mortalidad, 4 (12,1%); complicaciones médicas, 25 (78,1%), y quirúrgicas, 18 (56,3%). La mediana del tiempo de asistolia fue mayor en los sujetos con neumonía (15 vs. 7,5; p=0,027), la mediana del tiempo de isquemia fría fue superior en los sujetos que presentaron complicaciones quirúrgicas y mortalidad (436 vs. 343,5; p=0,04; 505 vs. 410; p=0,033, respectivamente), y las medianas de los tiempos de isquemia total fueron superiores en los receptores que fallecieron (828 vs. 695; p=0,036).
ConclusionesLos DANC constituyen una alternativa válida para expandir el pool de donantes pulmonares ante la carencia actual de pulmones válidos para el trasplante. La incidencia de complicaciones es comparable con los datos publicados en la literatura.
Uncontrolled donation after cardiac death (DACD) has become an alternative to lung transplantation with encephalic-death donation. The main objective of this study is to describe the incidence of clinically relevant events in the period of thirty days after lung transplant with uncontrolled DACD and the influence of factors depending on the donor and donation process as well.
Patients and methodsHistorical cohort study of 33 lung transplant receivers at Hospital Puerta de Hierro and Hospital Marqués de Valdecilla with 32 DACD from Hospital Clínico San Carlos from 2002 to 2008. We studied surgical and medical complications, primary graft dysfunction, acute rejection, pneumonia and mortality. We made an evaluation of the donor characteristics and donation procedure times (minutes).
ResultsMedian age of recipients was 50.5 years (interquartile range, 38.5-58). There were 28 males and 5 females. Cumulative incidence of events in the first month was: pneumonia 10 (31.3%); primary graft dysfunction 15 (46.9%); rejection 12 (37.5%); mortality 4 (12.1%); medical complications 25 (78.1%); and surgical complications 18(56.3%). Median time of cardiac arrest was higher in those who presented pneumonia (15 vs. 7.5; p=0.027). Median time of cold ischemia was higher in those who presented surgical complications and mortality (436 vs. 343.5; p=0.04; 505 vs. 410; p=0.033, respectively), and median of total ischemia times were longer in the recipients who died (828 vs. 695; p=0.036).
ConclusionsUncontrolled DACD are a valid alternative for expanding the donor pool in order to mitigate the current shortage of lungs that are valid for transplantation. The incidence of complications is comparable with published data in the literature.
Los buenos resultados obtenidos con los programas de trasplante en todo el mundo han permitido consolidarlo como una opción terapéutica válida en multitud de enfermedades. Este aumento en las indicaciones ha hecho que exista una disparidad entre oferta y demanda, pues el número de indicaciones supera el de órganos disponibles, aun a pesar del aumento de las donaciones1. En España, a 31 de diciembre de 2008, había 175 receptores en espera de un pulmón. A lo largo del año 2008, la lista de espera había pasado de 133 a 175 pacientes, con una mortalidad global en próxima al 4,6%, a pesar de haberse realizado 192 trasplantes de pulmón1. Frente a este problema, y por ende a la escasez de órganos, surgen los donantes con criterios expandidos (DCE)2,3.
Entre las diferentes clases de DCE hay un grupo, el de los donantes tras la muerte cardiaca o en asistolia (DA), que está desarrollándose en muchos países por los buenos resultados obtenidos con el trasplante de estos órganos4–7. Dada la escasez de pulmones disponibles para trasplante, se está valorando cada vez con más frecuencia el inicio de programas con pulmones procedentes de DA8–13.
En 1995 en Maastricht, se clasificaron los DA en dos grandes grupos: DA controlados (DAC) y DA no controlados (DANC) (tabla 1)14. El trasplante de pulmón procedente de DANC se hizo posible a partir de los trabajos de Stig Steen en 200115.
Clasificación de Maastricht de donantes tras la muerte cardíaca
| Tipo I. Fallecido antes de llegar al hospital con tiempo de asistolia conocido | Donantes no controlados |
| Tipo II. Fallecido en el hospital tras maniobras de reanimación infructuosas | |
| Tipo III. Fallecido tras retirada de ventilación mecánica en situación vegetativa persistente o deterioro neurológico severo e irreversible | Donantes controlados |
| Tipo IV. Fallecido en muerte cerebral en el que la asistolia se produce antes de proceder a la extracción |
En España los programas de DA son mayoritariamente con donantes «no controlados» (tipos I y II de Maastricht) o con donantes controlados tipo IV (parada cardiaca en el mantenimiento de un donante en muerte encefálica). Las donaciones con órganos procedentes de donantes tipo III aún son escasas; sin embargo, es el donante en asistolia más habitual en el resto del mundo8–10.
El Hospital Clínico y el Hospital Puerta de Hierro desarrollaron un programa específico de trasplante de pulmón, pionero en el mundo, con DANC. El trasplante de pulmón empezó en 2002 y los resultados publicados hasta ahora, tras una valoración de la funcionalidad y viabilidad de estos injertos11, se han centrado en la descripción de la experiencia a medio plazo de los primeros 17 casos12. En el presente trabajo, tras 6 años de experiencia y mayor tamaño muestral de la serie, se presentan los resultados y se describe la incidencia de eventos en los 30 días siguientes al trasplante con pulmones de DANC, y la influencia de los factores dependientes del donante y del proceso de donación.
Pacientes y métodosEstudio de una cohorte histórica de pacientes con trasplante de pulmón, desde enero de 2002 hasta diciembre de 2008 en los hospitales Puerta de Hierro (HPH) de Madrid y Marqués de Valdecilla (HMV) de Santander, con órganos procedentes del Hospital Clínico San Carlos (HCSC) de Madrid.
Los criterios de inclusión del estudio fueron: donantes no controlados a corazón parado de algún órgano y/o tejido en el HCSC, que se convirtieron en donantes reales (aquellos en los que los órganos y/o tejidos son ofertados a la ONT como válidos para el implante en un receptor) y todos los receptores de pulmón de donantes a corazón parado.
Los criterios de exclusión del estudio fueron: DA, durante el período de estudio, en los que sus órganos y/o tejidos fueron desestimados para la donación.
El DANC, piedra angular del programa del Hospital Clínico de Madrid, precisa de un proceso de selección de donantes y obtención de órganos riguroso y complejo que ha sido publicado anteriormente11,12,16. Un resumen de los criterios se expone a continuación:
- 1.
Pacientes fallecidos fuera del hospital, que sufren parada cardíaca (PCR) presenciada con inicio de resucitación cardiopulmonar avanzada (RCP) en menos de 10min.
- 2.
Edad comprendida entre 7 y 50 años.
- 3.
Inicio de las maniobras de preservación (bypass femorofemoral con circulación extracorpórea, oxigenación de membrana [ECMO] e hipotermia profunda a 4°C + maniobras específicas de preservación pulmonar) en menos de 120min desde el inicio de la PCR (tiempo de isquemia caliente).
- 4.
Obtención del asentimiento familiar y consentimiento judicial.
- 5.
Maniobras específicas de preservación de pulmón: tras la instauración de la circulación extracorpórea y el cese de la ventilación mecánica, colocación de cuatro drenajes torácicos y perfusión a través de estos de 4 l de solución de Perfadex® a 4°C en cada hemitórax para lograr el colapso pulmonar. Mantener los pulmones en esta situación un máximo de 240min (tiempo límite de preservación).
- 6.
Validación del órgano mediante: a) vaciamiento de ambos hemitórax y reinicio de la ventilación mecánica (FiO2, 1; PEEP, +5cm de H2O); b) valoración del aspecto macroscópico pulmonar; c) comprobación de la integridad y calidad de la vía aérea mediante broncoscopio; d) canulación de la arteria pulmonar y de cada una de las 4 venas pulmonares; e) lavado desde arteria a venas pulmonares con solución de preservación Perfadex® hasta obtener un efluente limpio en aurícula izquierda y venas pulmonares, y f) circulación de 300ml de sangre obtenida previamente del propio donante (durante la canulación para establecer el bypass) a la que se añade PgE desde arteria a venas pulmonares, realizando determinación gasométrica a ambos niveles (corrección de la PaO2 acorde con la temperatura). Si la diferencia de PaO2 entre arteria y venas pulmonares es superior a 300mmHg, se considera el pulmón válido para el trasplante.
- 7.
Extracción, preservación e implante del órgano según protocolos habituales. Período de isquemia fría, en el que el órgano se mantiene en una solución de preservación fría estéril en una nevera.
- 8.
Como criterios de exclusión se establecieron los referentes a los tiempos de isquemia ya reseñados, así como la radiografía de tórax patológica a la llegada del paciente al hospital; la presencia de sangre o secreciones purulentas en el tubo orotraqueal; la presencia de traumatismo torácico exanguinante y excluida la propia RCP; la sospecha clínica de broncoaspiración o infección respiratoria activa y los criterios generales de exclusión de donantes de pulmón y de donantes tras la muerte cardíaca.
Los protocolos de inmunosupresión y control del rechazo, así como de profilaxis antibiótica, fueron los propios de ambos hospitales, aplicados a los receptores de un trasplante de pulmón.
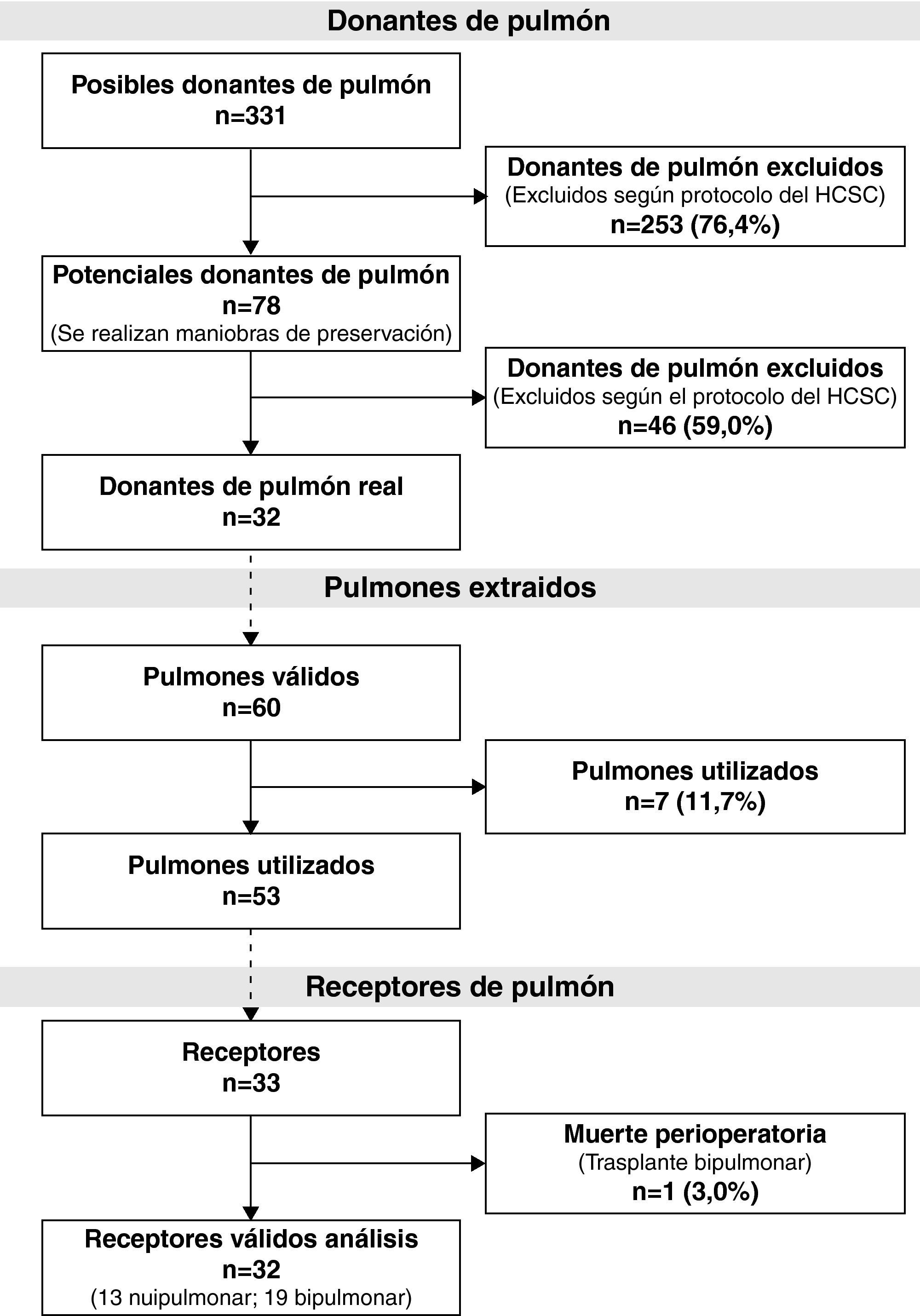
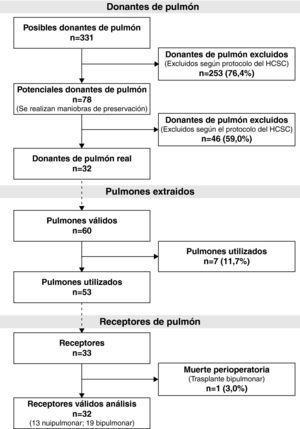
Durante el período de estudio se valoró a 331 posibles donantes de pulmón de los que finalmente 32 fueron donantes reales. Se implantaron 53 pulmones en 33 receptores. Se realizaron 20 trasplantes bipulmonares (16 en el HPH y 4 en el HMV) y 13 unipulmonares (12 en el HPH y 1 en el HMV) (fig. 1).
Las variables de estudio se seleccionaron de manera prospectiva a través de las bases de datos de registro de cada uno de los centros.
Las variables resultado principales del estudio en el receptor, evaluadas al mes de seguimiento, fueron: complicaciones quirúrgicas (presencia de alguna de las siguientes: dehiscencia de sutura bronquial, dehiscencia de sutura esternal, estenosis traqueal, broncomalacia, hemotórax, fístulas bronquiales, neumotórax, parálisis frénica, infección de la herida quirúrgica), complicaciones médicas (presencia de alguna de las siguientes: renales, digestivas, metabólicas, neurológicas, arritmias y leucopenia), disfunción primaria del injerto (DPI; grados G2 y G3)17, rechazo agudo, neumonía y mortalidad.
Se identificaron dos grupos de variables independientes que se relacionaron con cada una de las variables resultado, las características del donante (causa de fallecimiento, edad, sexo, consumo de tabaco, diagnóstico clínico de cardiopatía isquémica, diabetes mellitus e hipertensión arterial [HTA]) y del proceso de donación (tiempo de asistolia [TA], tiempo de parada cardiorrespiratoria [TPCR], tiempo de isquemia caliente [TIC], tiempo de preservación [TP], tiempo de isquemia fría [TIF] y tiempo de isquemia total [TIT]). En el caso de los trasplantes bipulmonares para el cálculo del TIF y el TIT se utilizó el valor máximo entre los dos pulmones.
Se registraron las siguientes características para la descripción de los receptores: edad, sexo, tiempo en lista de espera, necesidad de ventilación mecánica pretrasplante, estancia media en UCI y hospitalaria y enfermedad indicadora del trasplante.
Análisis estadísticoLas variables cualitativas se presentan con su distribución de frecuencias y las variables cuantitativas se resumen con su media y desviación estándar (DE) o con la mediana y el rango intercuartílico (RIC) en caso de presentar distribuciones no normales. Se evaluó la asociación entre variables cualitativas con el test de la χ2, o con la prueba exacta de Fisher en el caso de que más de un 25% de las frecuencias esperadas fueran menores de 5. Se estimó el riesgo relativo (RR) junto a su intervalo de confianza (IC) del 95% para la evaluación de la relación de las características del donante y cada una de las variables de resultado. Se analizó la relación de las variables cuantitativas del estudio con cada una de las variables resultado mediante el test no paramétrico de la U de Mann-Whitney. Para todos estos test el nivel de significación aceptado fue de un 5%. El análisis de los datos fue hecho con el paquete estadístico SPSS versión 15.0 para Windows (SPSS, Chicago, Estados Unidos).
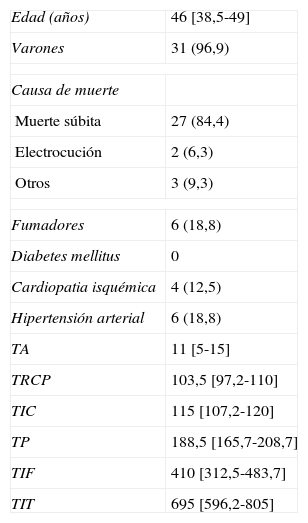
ResultadosDe los 331 posibles donantes de pulmón evaluados en el HCSC, 32 llegaron a ser donantes reales de pulmón, implantándose sus pulmones en 33 receptores. La mediana de edad de los donantes fue de 46 años (RIC, 38,5-49). La causa principal de muerte fue la muerte súbita cardíaca (84,4%). De los 32 donantes, 31 eran hombres y 1, mujer. Las características concretas de los donantes y de los tiempos del proceso de donación se recogen en la tabla 2. Sólo se encontraron patógenos en el pulmón del donante en tres ocasiones, con cultivos positivos para Candida crusei, Haemophilus influenzae y Moraxella catharralis. Se trató sin incidencias al receptor en todos los casos.
Características clínicas de los donantes (n=32) y de los tiempos del proceso de donación (min)
| Edad (años) | 46 [38,5-49] |
| Varones | 31 (96,9) |
| Causa de muerte | |
| Muerte súbita | 27 (84,4) |
| Electrocución | 2 (6,3) |
| Otros | 3 (9,3) |
| Fumadores | 6 (18,8) |
| Diabetes mellitus | 0 |
| Cardiopatia isquémica | 4 (12,5) |
| Hipertensión arterial | 6 (18,8) |
| TA | 11 [5-15] |
| TRCP | 103,5 [97,2-110] |
| TIC | 115 [107,2-120] |
| TP | 188,5 [165,7-208,7] |
| TIF | 410 [312,5-483,7] |
| TIT | 695 [596,2-805] |
TA: tiempo de asistolia; TIC: tiempo de isquemia caliente; TIF: tiempo de isquemia fría; TIT: tiempo de isquemia total; TP: tiempo de preservación; TRCP: tiempo de reanimación cardiopulmonar.
Los datos expresan n (%) o mediana [rango intercuartílico].
En relación con los receptores la mediana de edad fue de 50,5 años (RIC, 38,5-58); 28 eran hombres y 5, mujeres. La mediana de tiempo en lista de espera de los receptores fue de 150 días (RIC, 42-254). Ningún receptor estaba sometido a ventilación mecánica invasiva antes del trasplante, pero el 12,1% sí estaba con ventilación mecánica no invasiva.
Las causas que indicaron el trasplante en los receptores fueron EPOC (45,4%), fibrosis quística (15,1%), fibrosis pulmonar idiopática (33,3%), sarcoidosis (3,1%) y EPOC+fibrosis pulmonar (3,1%).
La mediana de estancia en UCI fue de 10 días (RIC, 7-23), y la mediana de ingreso hospitalario, 34,5 días (RIC, 26,5-59,7). La mediana de tiempo de intubación fue de 48 horas (RIC, 36-144). En 10 se requirió reintubación y en 15 traqueostomía (tiempo en días de permanencia en UCI: 21; RIC, 16-49).
La incidencia de cada una de las variables resultado al mes de seguimiento en los 32 receptores fue la siguiente: neumonía (31,3%; IC del 95%, 16,1-50), disfunción primaria del injerto (46,9%; IC del 95%, 28-65,7), rechazo (37,5%; IC del 95%, 21,1-56,3), complicaciones médicas (78,1%; IC del 95%, 60-90,7), quirúrgicas (56,3%; IC del 95%, 37,7-73,6) y mortalidad (12,1%; IC del 95%, 3,4-28,2). Entre los receptores que desarrollaron DPI, 4 presentaron G1; 6 receptores, G2, y 9 receptores, G3. Para el cálculo de la incidencia de mortalidad se tomó como denominador el número de receptores (n=33).
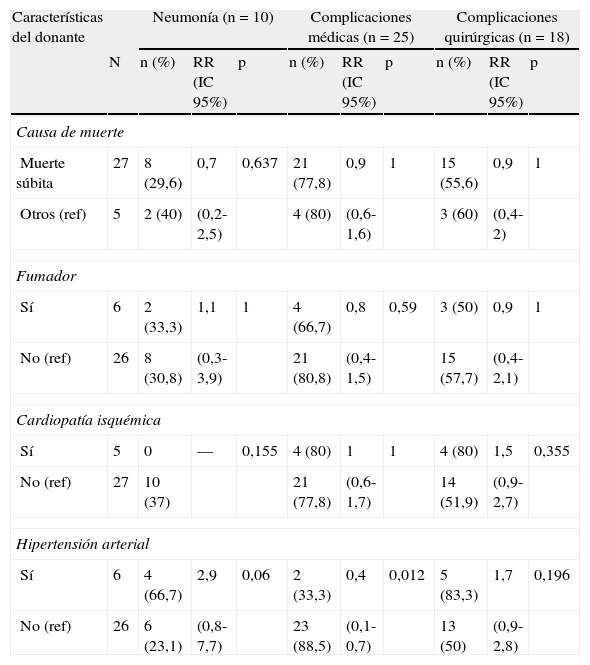
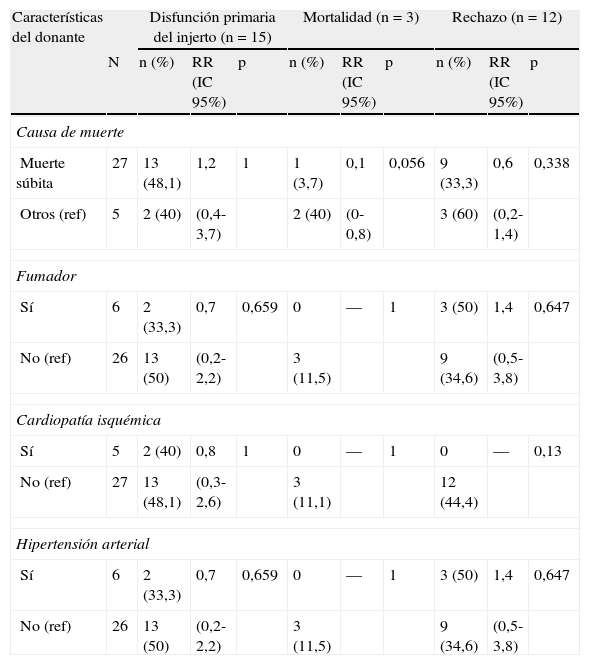
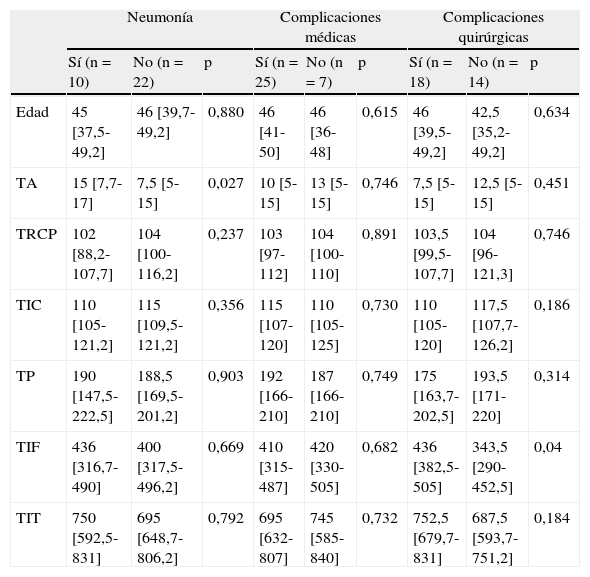
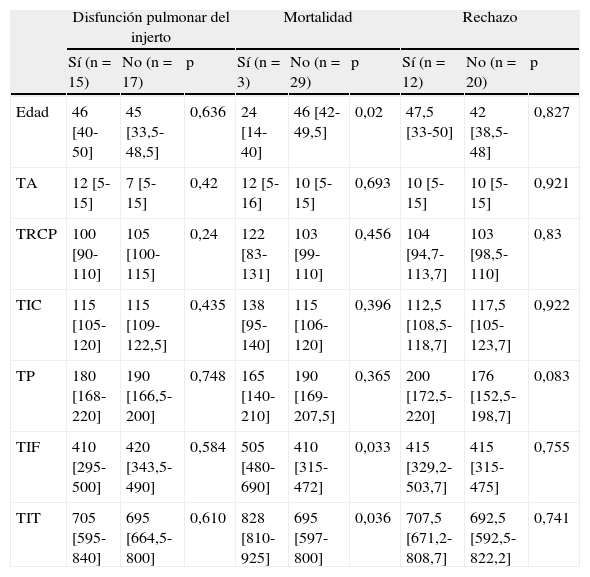
Las tablas 3–6 muestran los resultados del análisis univariado de los factores de estudio del donante y de los tiempos del proceso de donación con cada una de las variables clínicas de resultado evaluadas al mes de seguimiento. Las variables en relación con el análisis de los tiempos que mostraron diferencias estadísticamente significativas fueron la mediana del TA para la variable neumonía (p=0,027) y la mediana del TIF para la variable complicación quirúrgica (p=0,04), siendo superiores en aquellos que desarrollaron neumonía y complicaciones quirúrgicas. Las medianas de TIF (p=0,033) y TIT (p=0,036) fueron mayores en los receptores que fallecieron durante el primer mes tras el trasplante.
Relación de las características del donante con el desarrollo de neumonía, complicaciones médicas y quirúrgicas al mes
| Características del donante | Neumonía (n=10) | Complicaciones médicas (n=25) | Complicaciones quirúrgicas (n=18) | |||||||
| N | n (%) | RR (IC 95%) | p | n (%) | RR (IC 95%) | p | n (%) | RR (IC 95%) | p | |
| Causa de muerte | ||||||||||
| Muerte súbita | 27 | 8 (29,6) | 0,7 | 0,637 | 21 (77,8) | 0,9 | 1 | 15 (55,6) | 0,9 | 1 |
| Otros (ref) | 5 | 2 (40) | (0,2-2,5) | 4 (80) | (0,6-1,6) | 3 (60) | (0,4-2) | |||
| Fumador | ||||||||||
| Sí | 6 | 2 (33,3) | 1,1 | 1 | 4 (66,7) | 0,8 | 0,59 | 3 (50) | 0,9 | 1 |
| No (ref) | 26 | 8 (30,8) | (0,3-3,9) | 21 (80,8) | (0,4-1,5) | 15 (57,7) | (0,4-2,1) | |||
| Cardiopatía isquémica | ||||||||||
| Sí | 5 | 0 | — | 0,155 | 4 (80) | 1 | 1 | 4 (80) | 1,5 | 0,355 |
| No (ref) | 27 | 10 (37) | 21 (77,8) | (0,6-1,7) | 14 (51,9) | (0,9-2,7) | ||||
| Hipertensión arterial | ||||||||||
| Sí | 6 | 4 (66,7) | 2,9 | 0,06 | 2 (33,3) | 0,4 | 0,012 | 5 (83,3) | 1,7 | 0,196 |
| No (ref) | 26 | 6 (23,1) | (0,8-7,7) | 23 (88,5) | (0,1-0,7) | 13 (50) | (0,9-2,8) | |||
IC: intervalo de confianza; ref: categoría de referencia para el cálculo del RR; RR: riesgo relativo.
Relación de las características del donante con la disfunción primaria del injerto, la mortalidad y el rechazo al mes
| Características del donante | Disfunción primaria del injerto (n=15) | Mortalidad (n=3) | Rechazo (n=12) | |||||||
| N | n (%) | RR (IC 95%) | p | n (%) | RR (IC 95%) | p | n (%) | RR (IC 95%) | p | |
| Causa de muerte | ||||||||||
| Muerte súbita | 27 | 13 (48,1) | 1,2 | 1 | 1 (3,7) | 0,1 | 0,056 | 9 (33,3) | 0,6 | 0,338 |
| Otros (ref) | 5 | 2 (40) | (0,4-3,7) | 2 (40) | (0-0,8) | 3 (60) | (0,2-1,4) | |||
| Fumador | ||||||||||
| Sí | 6 | 2 (33,3) | 0,7 | 0,659 | 0 | — | 1 | 3 (50) | 1,4 | 0,647 |
| No (ref) | 26 | 13 (50) | (0,2-2,2) | 3 (11,5) | 9 (34,6) | (0,5-3,8) | ||||
| Cardiopatía isquémica | ||||||||||
| Sí | 5 | 2 (40) | 0,8 | 1 | 0 | — | 1 | 0 | — | 0,13 |
| No (ref) | 27 | 13 (48,1) | (0,3-2,6) | 3 (11,1) | 12 (44,4) | |||||
| Hipertensión arterial | ||||||||||
| Sí | 6 | 2 (33,3) | 0,7 | 0,659 | 0 | — | 1 | 3 (50) | 1,4 | 0,647 |
| No (ref) | 26 | 13 (50) | (0,2-2,2) | 3 (11,5) | 9 (34,6) | (0,5-3,8) | ||||
IC: intervalo de confianza; ref: categoría de referencia para el cálculo del RR; RR: riesgo relativo.
Tiempos del proceso de donación (minutos) y la presencia de neumonía, complicaciones médicas y quirúrgicas al mes
| Neumonía | Complicaciones médicas | Complicaciones quirúrgicas | |||||||
| Sí (n=10) | No (n=22) | p | Sí (n=25) | No (n=7) | p | Sí (n=18) | No (n=14) | p | |
| Edad | 45 [37,5-49,2] | 46 [39,7-49,2] | 0,880 | 46 [41-50] | 46 [36-48] | 0,615 | 46 [39,5-49,2] | 42,5 [35,2-49,2] | 0,634 |
| TA | 15 [7,7-17] | 7,5 [5-15] | 0,027 | 10 [5-15] | 13 [5-15] | 0,746 | 7,5 [5-15] | 12,5 [5-15] | 0,451 |
| TRCP | 102 [88,2-107,7] | 104 [100-116,2] | 0,237 | 103 [97-112] | 104 [100-110] | 0,891 | 103,5 [99,5-107,7] | 104 [96-121,3] | 0,746 |
| TIC | 110 [105-121,2] | 115 [109,5-121,2] | 0,356 | 115 [107-120] | 110 [105-125] | 0,730 | 110 [105-120] | 117,5 [107,7-126,2] | 0,186 |
| TP | 190 [147,5-222,5] | 188,5 [169,5-201,2] | 0,903 | 192 [166-210] | 187 [166-210] | 0,749 | 175 [163,7-202,5] | 193,5 [171-220] | 0,314 |
| TIF | 436 [316,7-490] | 400 [317,5-496,2] | 0,669 | 410 [315-487] | 420 [330-505] | 0,682 | 436 [382,5-505] | 343,5 [290-452,5] | 0,04 |
| TIT | 750 [592,5-831] | 695 [648,7-806,2] | 0,792 | 695 [632-807] | 745 [585-840] | 0,732 | 752,5 [679,7-831] | 687,5 [593,7-751,2] | 0,184 |
TA: tiempo de asistolia; TIC: tiempo de isquemia caliente; TIF: tiempo de isquemia fría; TIT: tiempo de isquemia total; TP: tiempo de preservación; TRCP: tiempo de reanimación cardiopulmonar.
Los datos expresan mediana [rango intercuartílico].
Tiempos del proceso de donación (minutos) y la presencia de disfunción primaria del injerto, la mortalidad y el rechazo al mes
| Disfunción pulmonar del injerto | Mortalidad | Rechazo | |||||||
| Sí (n=15) | No (n=17) | p | Sí (n=3) | No (n=29) | p | Sí (n=12) | No (n=20) | p | |
| Edad | 46 [40-50] | 45 [33,5-48,5] | 0,636 | 24 [14-40] | 46 [42-49,5] | 0,02 | 47,5 [33-50] | 42 [38,5-48] | 0,827 |
| TA | 12 [5-15] | 7 [5-15] | 0,42 | 12 [5-16] | 10 [5-15] | 0,693 | 10 [5-15] | 10 [5-15] | 0,921 |
| TRCP | 100 [90-110] | 105 [100-115] | 0,24 | 122 [83-131] | 103 [99-110] | 0,456 | 104 [94,7-113,7] | 103 [98,5-110] | 0,83 |
| TIC | 115 [105-120] | 115 [109-122,5] | 0,435 | 138 [95-140] | 115 [106-120] | 0,396 | 112,5 [108,5-118,7] | 117,5 [105-123,7] | 0,922 |
| TP | 180 [168-220] | 190 [166,5-200] | 0,748 | 165 [140-210] | 190 [169-207,5] | 0,365 | 200 [172,5-220] | 176 [152,5-198,7] | 0,083 |
| TIF | 410 [295-500] | 420 [343,5-490] | 0,584 | 505 [480-690] | 410 [315-472] | 0,033 | 415 [329,2-503,7] | 415 [315-475] | 0,755 |
| TIT | 705 [595-840] | 695 [664,5-800] | 0,610 | 828 [810-925] | 695 [597-800] | 0,036 | 707,5 [671,2-808,7] | 692,5 [592,5-822,2] | 0,741 |
TA: tiempo de asistolia; TIC: tiempo de isquemia caliente; TIF: tiempo de isquemia fría; TIT: tiempo de isquemia total; TP: tiempo de preservación; TRCP: tiempo de reanimación cardiopulmonar.
Los datos expresan mediana [rango intercuartílico].
En relación con los antecedentes de los donantes, se ha encontrado una relación entre la presencia de complicaciones médicas en el receptor y el antecedente de HTA en el donante (RR=0,4; IC del 95%, 0,1-0,7; p=0,012). La HTA presentó también una asociación con el desarrollo de neumonía (p=0,06), con un riesgo casi 3 veces superior en los receptores de pulmones provenientes de donantes tras la muerte cardíaca con HTA (RR=2,9; IC del 95%, 1,2-7,1).
En cuanto a la mortalidad a los 30 días del trasplante, se encontró relación con la edad (p=0,02) y con la causa de muerte del donante (p=0,056), siendo la muerte súbita un factor protector (RR=0,1; IC del 95%, 0,0-0,8), y la mediana de edad inferior en los donantes de los receptores que fallecieron durante el mes postoperatorio. En el resto de los factores evaluados no se encontraron asociaciones estadísticamente significativas.
DiscusiónUna de las causas más importantes para la baja tasa de obtención de órganos de los DME se debe a la inevitable estancia en la UCI de los pacientes que desarrollan muerte encefálica y de la también inevitable necesidad de ventilación mecánica16. El DANC es un donante que no pasa por un período de ventilación prolongado, sino máximo de 120min, con un riesgo bajo de colonización/infección y barotraumatismo/volutrauma pulmonar. Todo lo anterior favorece que la tasa de obtención de pulmones válidos para el trasplante, una vez realizada la selección de donantes, sea muy alta (el 41% en DANC frente al 10-15% de los DME1.
Los resultados en el primer mes postrasplante, que son los más directamente relacionados con los factores dependientes del propio donante y del método de selección y preservación del órgano, se encuentran dentro de los rangos publicados en la literatura. La incidencia de DPI en DME y DAC varía entre el 10 y el 49%18–21 y entre el 25 y el 40%10,13,22, respectivamente. Las definiciones de DPI en estos estudios no son homogéneas tanto en el tiempo de aparición como en la categorización, lo que dificulta su comparación directa. Los rangos de rechazo agudo oscilan entre el 9 y el 45%20,23 en DME y entre 0 y el 50% en DAC10,13,22,24. En DME la mortalidad varía entre el 10 y el 19%19–21,25, mientras que en los DAC los estudios publicados no refieren ningún fallecimiento al mes. Estos estudios que no presentan eventos de mortalidad y rechazo agudo son series con escaso tamaño muestral.
Tanto las complicaciones médicas como las quirúrgicas presentaron incidencias elevadas; sin embargo, es dificultosa la comparación con la literatura debido a las diferentes formas de categorización de las complicaciones en los diferentes estudios.
A la vista de los resultados del presente estudio, las únicas variables que tienen significación de cara a la presencia de complicaciones quirúrgicas y/o médicas inmediatas del trasplante son la presencia de hipertensión arterial en el donante y el tiempo de isquemia fría. No hemos encontrado referencia en la literatura médica respecto a la influencia de la HTA en las complicaciones postoperatorias; en lo que se refiere al tiempo de isquemia fría, su influencia en las diferentes complicaciones quirúrgicas es controvertida26,27. Se estudió la distribución de los factores de riesgo de desarrollo de neumonía entre los receptores de pulmones de pacientes provenientes de donantes con y sin HTA, obteniéndose un mayor tiempo de intubación en el grupo de HTA. En nuestra serie un mayor tiempo de intubación se relacionó de manera significativa con el desarrollo de neumonía (datos no mostrados). Este hallazgo podría explicar la relación encontrada entre la HTA del donante y el desarrollo de neumonía; sin embargo, sería necesario estudiar esta relación en series con mayor tamaño muestral, donde podamos controlar por potenciales factores de confusión a través de análisis multivariado, y así determinar el efecto independiente de cada uno de ellos.
Resulta significativa la relación entre el tiempo de asistolia (a pesar de una radiología normal y ausencia de sospecha de broncoaspiración) y el desarrollo de neumonía en el receptor en el primer mes, aunque la evolución fue buena en estos casos. Existe una tendencia a la asociación entre la presencia de HTA en el donante y la presencia de neumonía durante el primer mes. El resto de las características específicas del DANC no parece representar un riesgo para el desarrollo de neumonía.
En el presente estudio no hemos encontrado relación entre las características del donante o el proceso de donación y la presencia de rechazo o DPI, lo que es acorde con las series publicadas en lo que se refiere al rechazo28; sin embargo, en la literatura hay descritos factores de riesgo para el desarrollo de DPI como la edad, antecedente de tabaquismo, diabetes y tiempos de isquemia prolongados en DME que no parecen influir en los resultados de los pulmones de DANC20,29.
Respecto a la mortalidad en los 30 días posteriores al trasplante, hemos encontrando una relación estadísticamente significativa entre esta y los tiempos de isquemia fría y total prolongados. En la literatura algunos señalan que el aumento del tiempo de isquemia en el trasplante pulmonar tiene un impacto negativo en la mortalidad del receptor30; sin embargo, en otros estudios esto no se confirma31. Entre los factores del donante que pueden influir en el evento mortalidad al mes, encontramos la edad y la causa de muerte. Los donantes de receptores que fallecen durante el mes postoperatorio presentan edades inferiores frente a los que no fallecen, este dato llama la atención ya que en los diversos estudios donde se asocia la mortalidad del receptor con la edad del donante los intervalos de edades más elevados son los que se asocian a esta32,33. Los pulmones de los donantes más jóvenes presentaron tiempos de isquemia fría e isquemia total superiores, variables que se relacionan en nuestro estudio con la mortalidad al mes postrasplante (datos no mostrados).
La causa de muerte de los donantes presenta una tendencia a la asociación; la muerte súbita parece ser un factor protector para el desarrollo de mortalidad al mes; este hallazgo no se confirma en otras series32. Los resultados de supervivencia a medio-largo plazo ya se han publicado como buenos11,12.
Una de las principales limitaciones del presente estudio es el pequeño tamaño muestral analizado, se trata del seguimiento de una pequeña cohorte clínica de pacientes receptores de trasplante de pulmón. El reducido tamaño muestral nos lleva a una pérdida de potencia estadística, de precisión en las estimaciones analizadas y capacidad de generalización de los resultados. Pensamos que, a pesar del reducido tamaño muestral y debido a que no existen en la actualidad muchas series publicadas y a la baja tasa de obtención de pulmones de DME, los resultados del presente estudio nos ayudarán a conocer la incidencia de eventos al mes tras el trasplante y los posibles factores asociados.
La donación tras la muerte cardíaca constituye una alternativa válida para expandir el pool de donantes pulmonares ante la carencia actual de órganos válidos para el trasplante.