En los últimos años el desarrollo de los denominados fármacos biológicos ha supuesto un avance en el abordaje terapéutico de la enfermedad inflamatoria articular crónica, especialmente de la artritis reumatoide (AR). En este grupo de fármacos se incluyen los inhibidores del factor de necrosis tumoral-α (anti-TNFα), con demostrada eficacia en el tratamiento de esta enfermedad1. Los anti-TNFα en general son fármacos bien tolerados y con un perfil de seguridad aceptable. Sin embargo, la inhibición del TNFα, una citocina esencial en la inflamación y en la respuesta a la infección, se ha relacionado con una mayor probabilidad de complicaciones infecciosas2. Además, en la última década se han descrito también efectos secundarios no infecciosos a nivel sistémico y pulmonar, tanto neoplásicos3 como autoinmunes secundarios4,5.
Se presenta el caso de una mujer de 62 años de edad, exfumadora de 15 paquetes/año, con antecedente de reumatismo palindrómico con posterior progresión a AR erosiva de 10 años de evolución. Recibió tratamiento con distintos fármacos antirreumáticos modificadores de la enfermedad, como sulfato de hidroxicloroquina, metotrexato y sales de oro, así como AINE (indometacina y naproxeno) y prednisona a dosis bajas en función de la sintomatología, en diferentes etapas de su enfermedad.
En mayo de 2010 y hasta marzo de 2012, debido a una falta de respuesta a los fármacos antirreumáticos modificadores de la enfermedad, se inició por primera vez terapia biológica con anti-TNFα (etanercept) con mejoría de la clínica articular. En marzo de 2016, cuando estaba en tratamiento con metotrexato (20mg/semana) y por un nuevo brote de la enfermedad, se reinició etanercept (50mg/semana) objetivándose de nuevo una mejoría clínica.
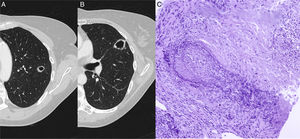
En un control radiológico de su enfermedad, y estando la paciente asintomática, se realizó una radiografía de tórax y una tomografía axial computarizada (TAC) de tórax que evidenciaron la presencia de 2 nódulos sólidos cavitados, uno de 15mm en el segmento apicoposterior del culmen (fig. 1A) y otro de 24mm en el segmento superior de la língula (fig. 1B).
TAC de tórax que muestra una lesión nodular cavitada en culmen (A) y otra en el segmento superior de la língula (B). C) Tinción de fibras elásticas para destacar la pared vascular arterial irregularmente destruida por el proceso inflamatorio. Se aprecia necrosis en el ángulo superior derecho. Orceina 200x.
La analítica, que incluyó hematimetría, pruebas de hemostasia, bioquímica sanguínea y marcadores tumorales, fue normal. Los valores de PCR y VSG fueron de 0,42ng/dl y 27mm/h, respectivamente. Los resultados del perfil de autoinmunidad mostraron valores elevados de anticuerpos antipéptido citrulinado cíclico (381UI) y de factor reumatoide (200UI), con valores similares a determinaciones previas. El perfil básico de orina no mostró alteraciones significativas. Los anticuerpos anticitoplasma de los neutrófilos séricos y por inmunofluorescencia fueron negativos, así como el ElispotTB.
Se realizó una fibrobroncoscopia que no mostró alteraciones endobronquiales, siendo el estudio microbiológico y citológico del broncoaspirado y del lavado broncoalveolar negativos.
Se realizó también una tomografía por emisión de positrones que mostró captación anular e irregular de 18F-fluordesoxiglucosa únicamente en los nódulos pulmonares con un SUVmáx de 2,9 de la lesión localizada en el culmen y de 3,1 en la localizada en língula.
Se decidió realizar biopsia pulmonar con tructut guiada por TAC de la lesión en língula. El estudio histopatológico mostró una lesión inflamatoria granulomatosa asociada a vasculitis compatible con granulomatosis con poliangitis (antes conocida como granulomatosis de Wegener) (fig. 1C).
Ante la sospecha diagnóstica de granulomatosis con poliangitis asociada a la administración de etanercept, se suspendió dicho fármaco y se inició tratamiento con prednisona a dosis de 1mg/kg/día en pauta descendente y se sustituyó la terapia biológica de base de la AR por tocilizumab (8mg/kg/mes). La TAC de tórax realizada 3 meses después mostró resolución de las lesiones.
La exclusión de otras complicaciones pulmonares, la asociación temporal con la administración del fármaco y la completa y rápida resolución de las lesiones pulmonares tras su retirada y el tratamiento con corticosteroides confirman el diagnóstico de vasculitis secundaria al tratamiento con etanercept.
El espectro de manifestaciones pulmonares de la AR es amplio e incluye afectación del parénquima (enfermedad pulmonar intersticial, nódulos pulmonares), de la vía aérea (bronquiolitis obliterante, bronquiectasias), de la pleura (derrame, fístula broncopleural, neumotórax) y de la vasculatura pulmonar (hipertensión pulmonar, enfermedad tromboembólica), pudiendo preceder a la clínica articular en el 10-20% de los casos6. El presente caso demuestra que en el diagnóstico diferencial debemos también incluir los efectos secundarios de la terapia inmunomoduladora utilizada en su tratamiento (toxicidad, infección).
Los mecanismos por los que el tratamiento con anti-TNFα desencadena la formación de anticuerpos y procesos autoinmunes no son del todo conocidos. Existe evidencia de que el tratamiento con anti-TNFα se asocia a una producción mayor de anticuerpos antinucleares, con una frecuencia variable dependiendo del tipo de anti-TNFα empleado. En el caso del etanercept la presencia de anticuerpos antinucleares oscila entre el 11-54%7–9, habiéndose asociado también al desarrollo de otras enfermedades de base autoinmune como la vasculitis leucocitoclástica, la nodulosis reumatoidea acelerada y las vasculitis asociadas a anticuerpos anticitoplasma de los neutrófilos10. Las manifestaciones clínicas son variables. De hecho, y de forma similar a nuestro caso, los pacientes no suelen presentar síntomas sistémicos asociados. Se considera que la vasculitis asociada a la terapia con anti-TNF es una complicación poco frecuente y en la mayoría de los casos se presenta con compromiso exclusivamente cutáneo11, siendo la afectación pulmonar en estos pacientes una complicación rara. Así, Ramos-Casals et al. en una cohorte de 233 pacientes con enfermedades autoinmunes inducidas por el tratamiento con anti-TNFα, describen el desarrollo de vasculitis en 133 casos de los que únicamente 3 presentaron compromiso pulmonar (3%)12. El tratamiento consistió en la retirada del fármaco y la administración de glucocorticoides.
En conclusión, si bien los anti-TNFα ofrecen claras ventajas con relación al abordaje terapéutico de la AR, estos deben utilizarse con precaución y ser monitorizados en especial en pacientes con enfermedad pulmonar preexistente13. El desarrollo de lesiones y/o infiltrados pulmonares durante el tratamiento con anti-TNF obliga, en primer lugar, a descartar procesos infecciosos. Si los resultados no son concluyentes, los infiltrados son persistentes y el índice de sospecha es elevado, es recomendable realizar pruebas invasivas como la biopsia transbronquial, la criobiopsia, la biopsia guiada por tomografía o incluso la biopsia quirúrgica con el fin de obtener una diagnóstico definitivo que nos permita indicar el tratamiento correcto.