No se ha aclarado completamente si se debería realizar una ecocardiografía a los pacientes con tromboembolia de pulmón (TEP) de riesgo bajo.
MétodosRealizamos un metanálisis de estudios observacionales que incluyeron pacientes con TEP de riesgo bajo para determinar el significado pronóstico de la disfunción ecocardiográfica del ventrículo derecho (VD). El evento primario considerado fue la muerte por cualquier causa a corto plazo. El evento secundario fue la muerte por la propia TEP a corto plazo. Utilizamos un modelo de efectos aleatorios para combinar los resultados, la prueba de correlación de rangos de Begg para estimar el sesgo de publicación y la prueba de la I2 para evaluar la heterogeneidad de los estudios incluidos.
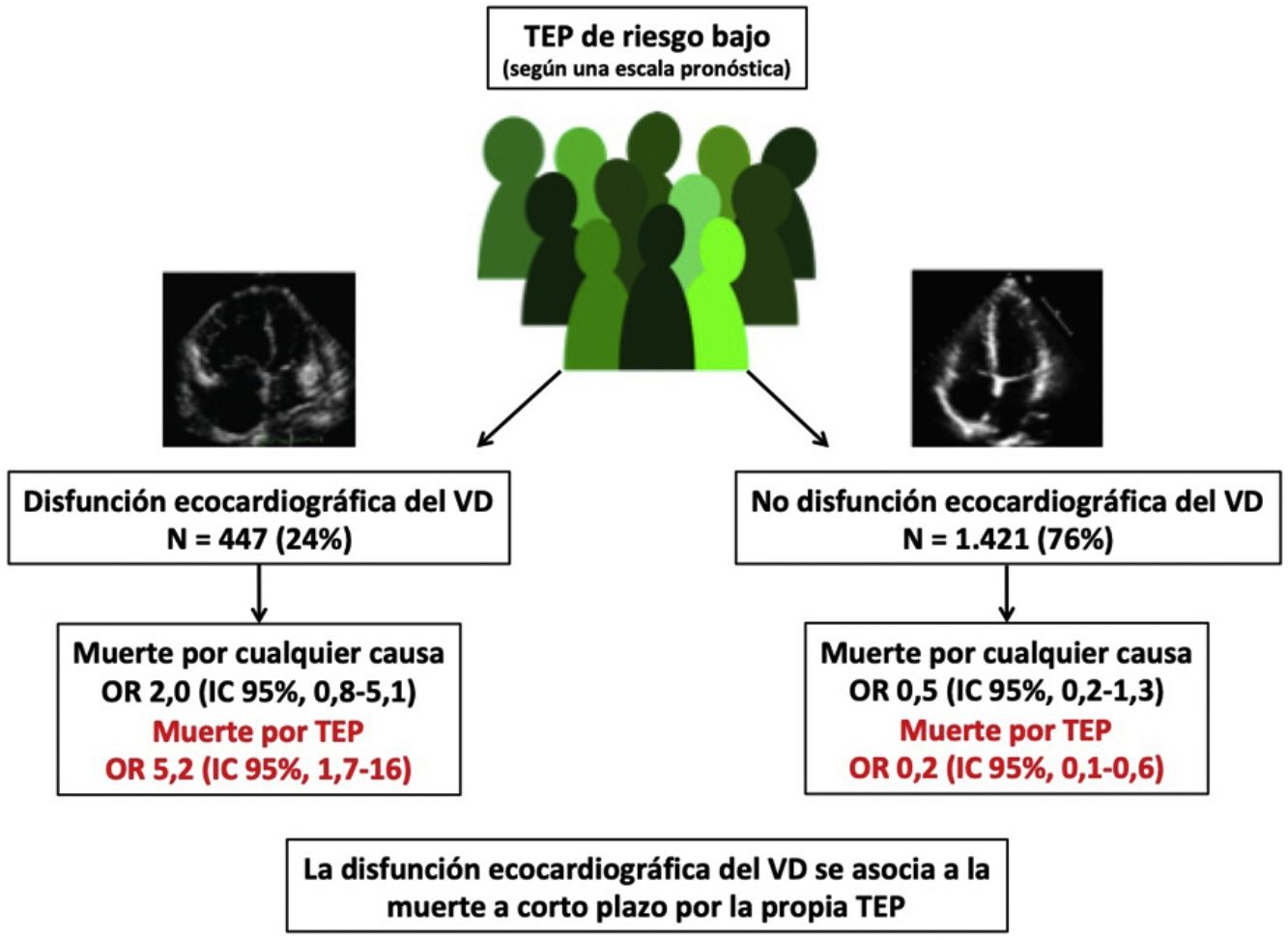
ResultadosIdentificamos once estudios observacionales que incluyeron 1.868 pacientes con TEP de riesgo bajo. Diez de los 447 (2,2%) pacientes con TEP de riesgo bajo y disfunción del VD fallecieron, comparado con 10 de los 1.421 (0,7%) pacientes sin disfunción del VD. La presencia de disfunción ecocardiográfica del VD no se asoció con la mortalidad precoz por cualquier causa (odds ratio 2,0; intervalo de confianza del 95%, 0,8-5,1, P=0,14; I2=8%), pero se asoció de forma significativa con la muerte por la propia TEP (odds ratio 5,2; intervalo de confianza del 95% 1,7-16, P<0,01; I2=0%).
ConclusionesEn pacientes con TEP de riesgo bajo, la disfunción ecocardiográfica del VD no se asocia significativamente a la muerte por cualquier causa pero se asocia de forma significativa a la muerte por la propia TEP.
It is unclear whether low-risk patients with acute symptomatic pulmonary embolism (PE) should undergo echocardiogram.
MethodsWe performed a meta-analysis of studies that enrolled patients with acute low-risk PE to assess the prognostic value of echocardiographic diagnosis of right ventricular (RV) dysfunction for the primary outcome of short-term all-cause mortality, and the secondary outcome of short-term PE-related mortality. We used a random-effects model to pool study results, a Begg rank correlation method to evaluate for publication bias, and I2 testing to assess heterogeneity.
ResultsThe meta-analysis included a total of 11 studies 1,868 patients with low-risk PE. Ten of the 447 (2.2%; 1.1%-4.1%) low-risk patients with echocardiographic RV dysfunction died soon after the diagnosis of PE compared with 10 of 1,421 (0.7%; 0.3-1.3%) patients without RV dysfunction. RV dysfunction was not significantly associated with short-term all-cause mortality (odds ratio 2.0; 95% confidence interval, 0.8-5.1, p=.14; I2=8%). RV dysfunction was significantly associated with short-term PE-related mortality (odds ratio 5.2; 95% confidence interval, 1.7-16, p <.01; I2=0%).
ConclusionsIn patients with low-risk PE, echocardiographic RV dysfunction is not associated with all-cause mortality, but identifies patients with an increased risk for short-term PE-related mortality.
La tromboembolia de pulmón (TEP) constituye una enfermedad con un espectro amplio de manifestaciones clínicas, con diferente pronóstico y tratamiento1. En los últimos años se han validado distintas herramientas pronósticas para pacientes con TEP aguda sintomática, que incluyen escalas clínicas, pruebas de imagen y biomarcadores cardiacos2.
La estratificación pronóstica de los pacientes con TEP permite la identificación de pacientes con TEP aguda sintomática y riesgo bajo de complicaciones a corto plazo, que se podrían beneficiar de una estancia hospitalaria abreviada o incluso del tratamiento domiciliario de su enfermedad3. Las guías de práctica clínica recomiendan el uso de las escalas pronósticas validadas (i.e., escala Pulmonary Embolism Severity Index [PESI]4, escala PESI simplificada5 o criterios de Hestia6) para la identificación de pacientes de riesgo bajo7. Sin embargo, algunos estudios sugieren que dichas escalas, de forma aislada, no son suficientemente sensibles para identificar de forma segura a los pacientes con TEP y un riesgo despreciable de complicaciones a corto plazo8–10.
Un metanálisis reciente analizó el significado pronóstico de la disfunción del ventrículo derecho (VD) en pacientes con TEP de riesgo bajo11. Sin embargo, esta revisión sistemática combinó estudios que habían usado de forma indistinta la angiotomografía computerizada (TC) de tórax o la ecocardiografía para evaluar el tamaño/función del VD. Como la concordancia entre la angio-TC y la ecocardiografía es pobre12,13, este metanálisis no fue capaz de responder a la pregunta de si es necesario solicitar una ecocardiografía transtorácica a los pacientes con TEP aguda de riesgo bajo.
El objetivo de este metanálisis fue evaluar el significado pronóstico de la disfunción ecocardiográfica del VD en pacientes con TEP de riesgo bajo según una escala clínica bien validada.
MétodoBúsqueda de estudiosDos investigadores (IA y DJ) realizaron búsquedas independientes en la literatura de artículos elegibles publicados entre octubre de 2010 y mayo de 2019, para lo que revisaron de forma sistemática las bases de datos PubMed y Web of Science. Las discrepancias entre los dos investigadores se resolvieron con la ayuda de un tercer investigador (EM). Las búsquedas se efectuaron con la siguiente estrategia: («pulmonary embolism»[MeSH Terms] OR «pulmonary embolism»[All Fields]) AND («PESI»[All Fields] OR «sPESI»[All Fields] OR «HESTIA»[All Fields] OR «low risk»[All Fields] OR «low-risk»[All Fields] OR «right ventricular dysfunction»[All Fields] OR «echocardiograph*»[All Fields] OR «risk stratification»[All Fields] OR «predict*»[All Fields]) AND («2008/10/30»[PDAT]: «3000/12/31»[PDAT]), sin restricción de idiomas. La revisión sistemática se completó mediante una búsqueda manual de la bibliografía y de los archivos de los investigadores.
Criterios de selección y medidas de resultadosEl metanálisis incluyó los estudios que cumplían los criterios de selección: 1) estudios observacionales retrospectivos o prospectivos; 2) población: pacientes con diagnóstico objetivo de TEP aguda sintomática de riesgo bajo según una escala pronóstica validada (i.e., PESI, PESI simplificada, criterios de Hestia); 3) intervención: realización de una ecocardiografía transtorácica en la fase aguda de la TEP; 4) variables de resultados: mortalidad precoz (i.e., en los primeros 30 días) por todas las causas como variable principal y mortalidad precoz por la propia TEP como variable secundaria.
Se excluyeron los artículos que no incluían la mortalidad como variable de resultados o en los que no constaban datos exactos para su evaluación. Para las publicaciones duplicadas, solo se incluyó la más reciente.
Extracción de datos y evaluación de la calidadPara cada estudio dos investigadores (IA y DJ) extrajeron datos referidos a las características basales de los pacientes, resultados de la ecocardiografía y número de eventos para cada grupo. Las discrepancias se resolvieron con la ayuda de un tercer investigador (EM). Se utilizó la herramienta Quality in Prognosis Studies para evaluar la calidad de los estudios elegidos14.
Análisis estadísticoEl metanálisis se llevó a cabo de acuerdo con las recomendaciones Meta-analysis Of Observational Studies in Epidemiology (MOOSE)15. Para el análisis de los datos se utilizó el programa informático Review Manager (RevMan) 5.3.5 (Cochrane Collaboration, Copenhague), que ofrece paquetes estadísticos de código abierto para metanálisis. Para la agregación de datos se utilizó un modelo de efectos aleatorios y en el resumen se utilizaron odds ratio (OR) y sus intervalos de confianza (IC) del 95%. La heterogeneidad de los estudios originales se evaluó mediante el estadístico I2. En todos los análisis, los niveles de significación fueron bilaterales y los valores de P <0,05 se consideraron significativos. El sesgo de publicación se examinó mediante la prueba de correlación de rangos de Begg.
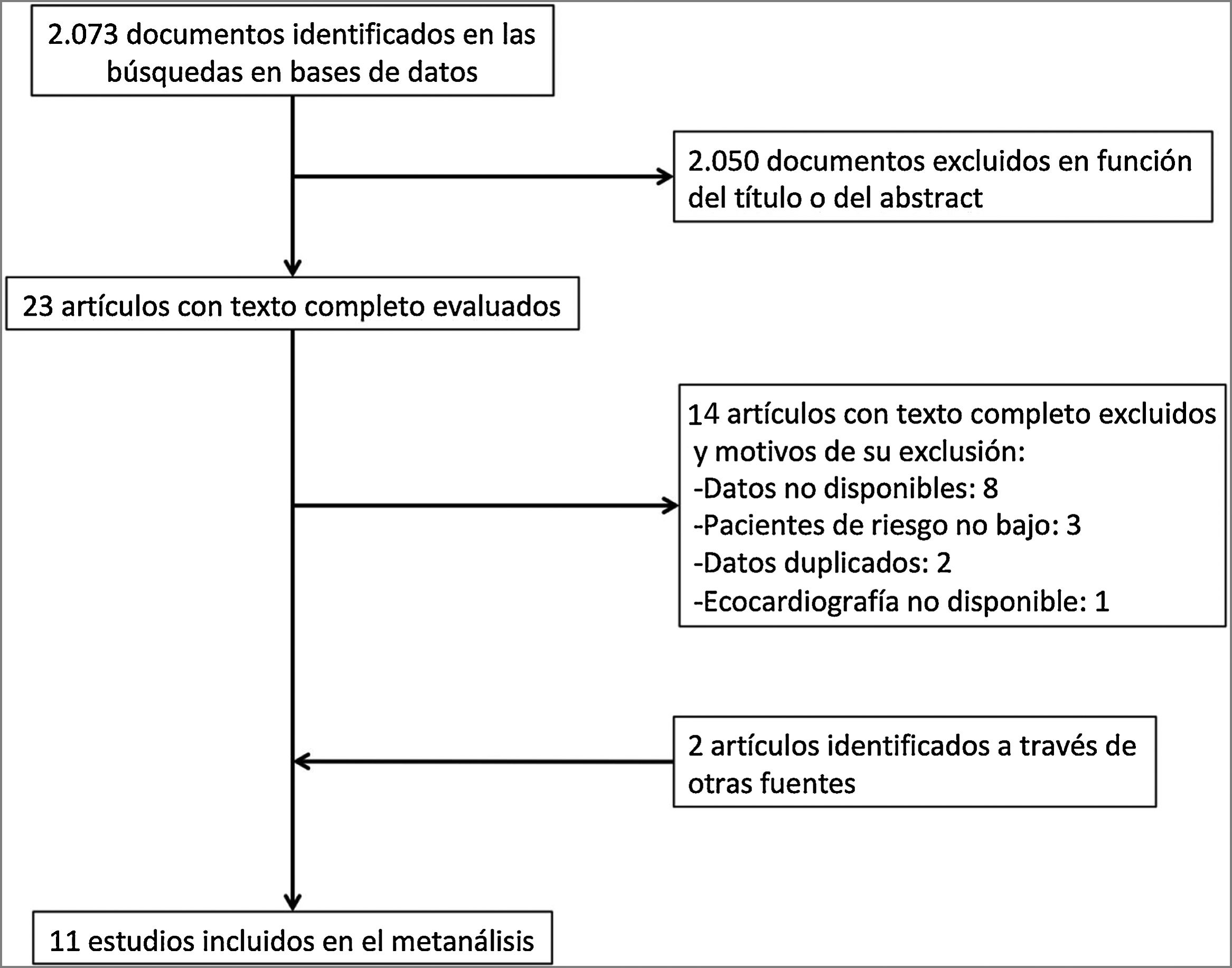
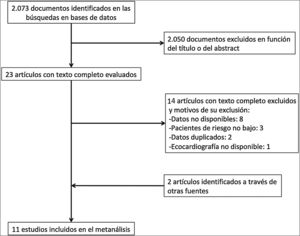
ResultadosDescripción de los estudiosDe 2.073 artículos evaluados, 23 fueron revisados en profundidad y 6 fueron excluidos. La búsqueda manual añadió 2 estudios, por lo que 19 estudios cumplieron los criterios de inclusión (fig. 1). Para 8 de estos estudios16–23, el número de eventos en cada grupo se obtuvo contactando con los autores correspondientes. Ocho estudios fueron excluidos porque los autores no proporcionaron los datos necesarios24–31. Finalmente se incluyeron 11 estudios con 1.868 pacientes con TEP aguda de riesgo bajo a los que se les realizó una ecocardiografía transtorácica16–23,32–34.
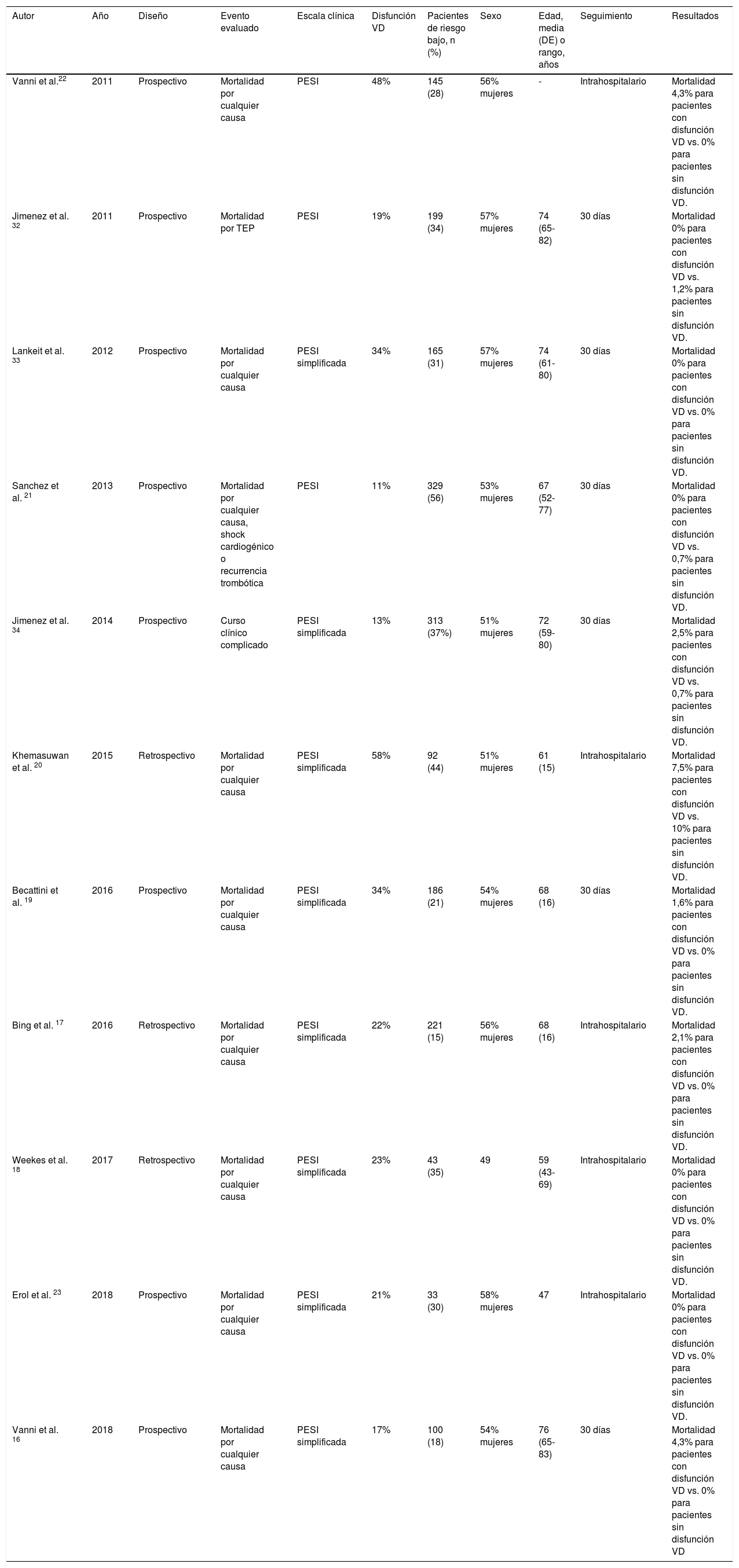
Ocho estudios fueron prospectivos16,19,21–23,32–34 y 3 fueron retrospectivos17,18,20. La edad y el sexo de los pacientes incluidos con diagnóstico de TEP fue similar en todos los estudios (tabla 1). El seguimiento osciló entre la duración de la estancia hospitalaria17,18,20,22,23 y los 30 días después del diagnóstico de la TEP16,19,21,32-34. La prevalencia de disfunción ecocardiográfica del VD osciló entre el 11%21 y el 58%20. Los criterios de disfunción ecocardiográfica del VD aparecen en la tabla 2.
Características de los estudios incluidos
| Autor | Año | Diseño | Evento evaluado | Escala clínica | Disfunción VD | Pacientes de riesgo bajo, n (%) | Sexo | Edad, media (DE) o rango, años | Seguimiento | Resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| Vanni et al.22 | 2011 | Prospectivo | Mortalidad por cualquier causa | PESI | 48% | 145 (28) | 56% mujeres | - | Intrahospitalario | Mortalidad 4,3% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD. |
| Jimenez et al. 32 | 2011 | Prospectivo | Mortalidad por TEP | PESI | 19% | 199 (34) | 57% mujeres | 74 (65-82) | 30 días | Mortalidad 0% para pacientes con disfunción VD vs. 1,2% para pacientes sin disfunción VD. |
| Lankeit et al. 33 | 2012 | Prospectivo | Mortalidad por cualquier causa | PESI simplificada | 34% | 165 (31) | 57% mujeres | 74 (61-80) | 30 días | Mortalidad 0% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD. |
| Sanchez et al. 21 | 2013 | Prospectivo | Mortalidad por cualquier causa, shock cardiogénico o recurrencia trombótica | PESI | 11% | 329 (56) | 53% mujeres | 67 (52-77) | 30 días | Mortalidad 0% para pacientes con disfunción VD vs. 0,7% para pacientes sin disfunción VD. |
| Jimenez et al. 34 | 2014 | Prospectivo | Curso clínico complicado | PESI simplificada | 13% | 313 (37%) | 51% mujeres | 72 (59-80) | 30 días | Mortalidad 2,5% para pacientes con disfunción VD vs. 0,7% para pacientes sin disfunción VD. |
| Khemasuwan et al. 20 | 2015 | Retrospectivo | Mortalidad por cualquier causa | PESI simplificada | 58% | 92 (44) | 51% mujeres | 61 (15) | Intrahospitalario | Mortalidad 7,5% para pacientes con disfunción VD vs. 10% para pacientes sin disfunción VD. |
| Becattini et al. 19 | 2016 | Prospectivo | Mortalidad por cualquier causa | PESI simplificada | 34% | 186 (21) | 54% mujeres | 68 (16) | 30 días | Mortalidad 1,6% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD. |
| Bing et al. 17 | 2016 | Retrospectivo | Mortalidad por cualquier causa | PESI simplificada | 22% | 221 (15) | 56% mujeres | 68 (16) | Intrahospitalario | Mortalidad 2,1% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD. |
| Weekes et al. 18 | 2017 | Retrospectivo | Mortalidad por cualquier causa | PESI simplificada | 23% | 43 (35) | 49 | 59 (43-69) | Intrahospitalario | Mortalidad 0% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD. |
| Erol et al. 23 | 2018 | Prospectivo | Mortalidad por cualquier causa | PESI simplificada | 21% | 33 (30) | 58% mujeres | 47 | Intrahospitalario | Mortalidad 0% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD. |
| Vanni et al. 16 | 2018 | Prospectivo | Mortalidad por cualquier causa | PESI simplificada | 17% | 100 (18) | 54% mujeres | 76 (65-83) | 30 días | Mortalidad 4,3% para pacientes con disfunción VD vs. 0% para pacientes sin disfunción VD |
DE: desviación estándar; PESI: Pulmonary Embolism Severity Index; VD: ventrículo derecho.
Criterios de disfunción del ventrículo derecho
| Estudio | Criterios de disfunción del ventrículo derecho |
|---|---|
| Vanni et al. 22, 2011 | Al menos uno de los siguientes: 1) DEDVD/DEDVI>1 en ventana apical de 4 cámaras, 2) DEDVD>30mm en ventana apical de 4 cámaras, 3) movimiento paradójico del septo interventricular y 4) gradiente de presión entre aurícula y ventrículo derechos>30 mmHg |
| Jimenez et al. 32, 2011 | Al menos dos de los siguientes: 1) DEDVD>30mm en ventana paraesternal o VD mayor que el VI en ventana apical o subcostal, 2) hipoquinesia de la pared libre del VD, y 3) presión sistólica pulmonar>30 mmHg |
| Lankeit et al. 33, 2012 | Al menos dos de los siguientes: 1) DEDVD>30mm en ventana paraesternal o VD mayor que el VI en ventana apical o subcostal, 2) hipoquinesia de la pared libre del VD, y 3) presión sistólica pulmonar>30 mmHg |
| Sanchez et al. 21, 2013 | VD/VI>0,9 |
| Jimenez et al. 34, 2014 | Al menos dos de los siguientes: 1) DEDVD>30mm en ventana paraesternal o VD mayor que el VI en ventana apical o subcostal, 2) hipoquinesia de la pared libre del VD, y 3) presión sistólica pulmonar>30 mmHg |
| Khemasuwan et al. 20, 2015 | No descrito |
| Becattini et al. 19, 2016 | Al menos uno de los siguientes: 1) DEDVD/DEDVI>1 en ventana apical de 4 cámaras, 2) DEDVD/DEDVI>0,6 en ventana paraesternal longitudinal o subcostal de 4 cámaras, y 3) gradiente de presión entre aurícula y ventrículo derechos>30 mmHg |
| Bing et al. 17, 2016 | No descrito |
| Weekes et al. 18, 2017 | Dilatación grave del VD, o disfunción grave del VD, o aplanamiento o desplazamiento del septo interventricular hacia el VI |
| Erol et al. 23, 2018 | No descrito |
| Vanni et al. 16, 2018 | Al menos uno de los siguientes: 1) DEDVD/DEDVI>0,9 en ventana apical de 4 cámaras, 2) hipoquinesia de la pared libre del VD, y 3) gradiente de presión entre aurícula y ventrículo derechos>30 mmHg |
DEDVD: diámetro del ventrículo derecho al final de la diástole; DEDVI: diámetro del ventrículo izquierdo al final de la diástole; VD: ventrículo derecho; VI: ventrículo izquierdo.
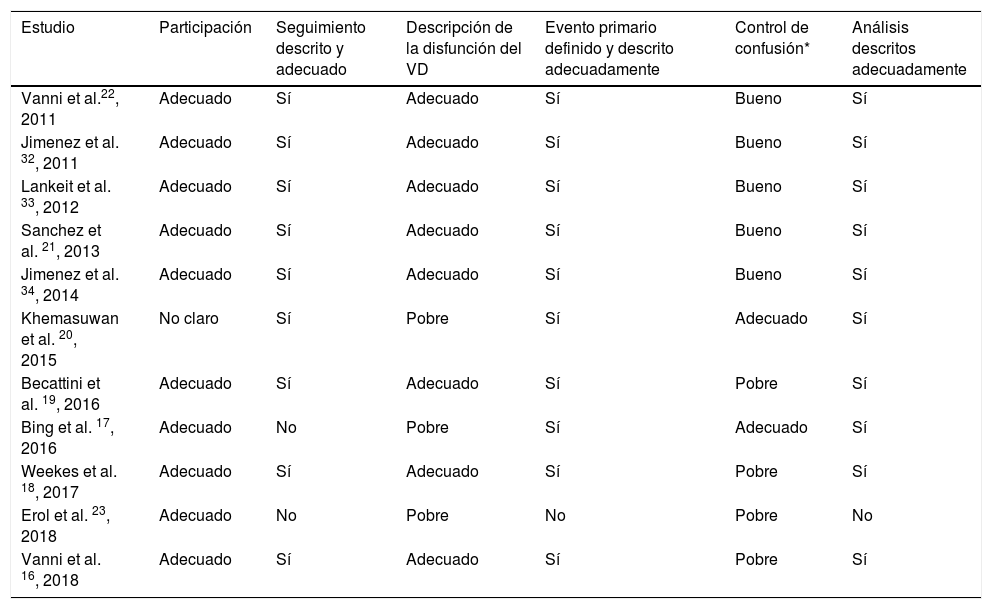
En lo relacionado con la calidad de los estudios incluidos (tabla 3), la participación y las características basales de los pacientes fueron descritas de forma adecuada en la mayoría de los estudios16–19,21–23,32–34. Excepto los estudios de Khemasuwan et al., Bing et al. y Erol et al., el resto describieron adecuadamente los criterios de disfunción del VD. Se realizaron ajustes por posibles confusores en 7 de los estudios incluidos17,20–22,32–34. Solo 3 de los estudios dispusieron de un comité para la asignación de los eventos16,21,34.
Calidad de los estudios incluidos
| Estudio | Participación | Seguimiento descrito y adecuado | Descripción de la disfunción del VD | Evento primario definido y descrito adecuadamente | Control de confusión* | Análisis descritos adecuadamente |
|---|---|---|---|---|---|---|
| Vanni et al.22, 2011 | Adecuado | Sí | Adecuado | Sí | Bueno | Sí |
| Jimenez et al. 32, 2011 | Adecuado | Sí | Adecuado | Sí | Bueno | Sí |
| Lankeit et al. 33, 2012 | Adecuado | Sí | Adecuado | Sí | Bueno | Sí |
| Sanchez et al. 21, 2013 | Adecuado | Sí | Adecuado | Sí | Bueno | Sí |
| Jimenez et al. 34, 2014 | Adecuado | Sí | Adecuado | Sí | Bueno | Sí |
| Khemasuwan et al. 20, 2015 | No claro | Sí | Pobre | Sí | Adecuado | Sí |
| Becattini et al. 19, 2016 | Adecuado | Sí | Adecuado | Sí | Pobre | Sí |
| Bing et al. 17, 2016 | Adecuado | No | Pobre | Sí | Adecuado | Sí |
| Weekes et al. 18, 2017 | Adecuado | Sí | Adecuado | Sí | Pobre | Sí |
| Erol et al. 23, 2018 | Adecuado | No | Pobre | No | Pobre | No |
| Vanni et al. 16, 2018 | Adecuado | Sí | Adecuado | Sí | Pobre | Sí |
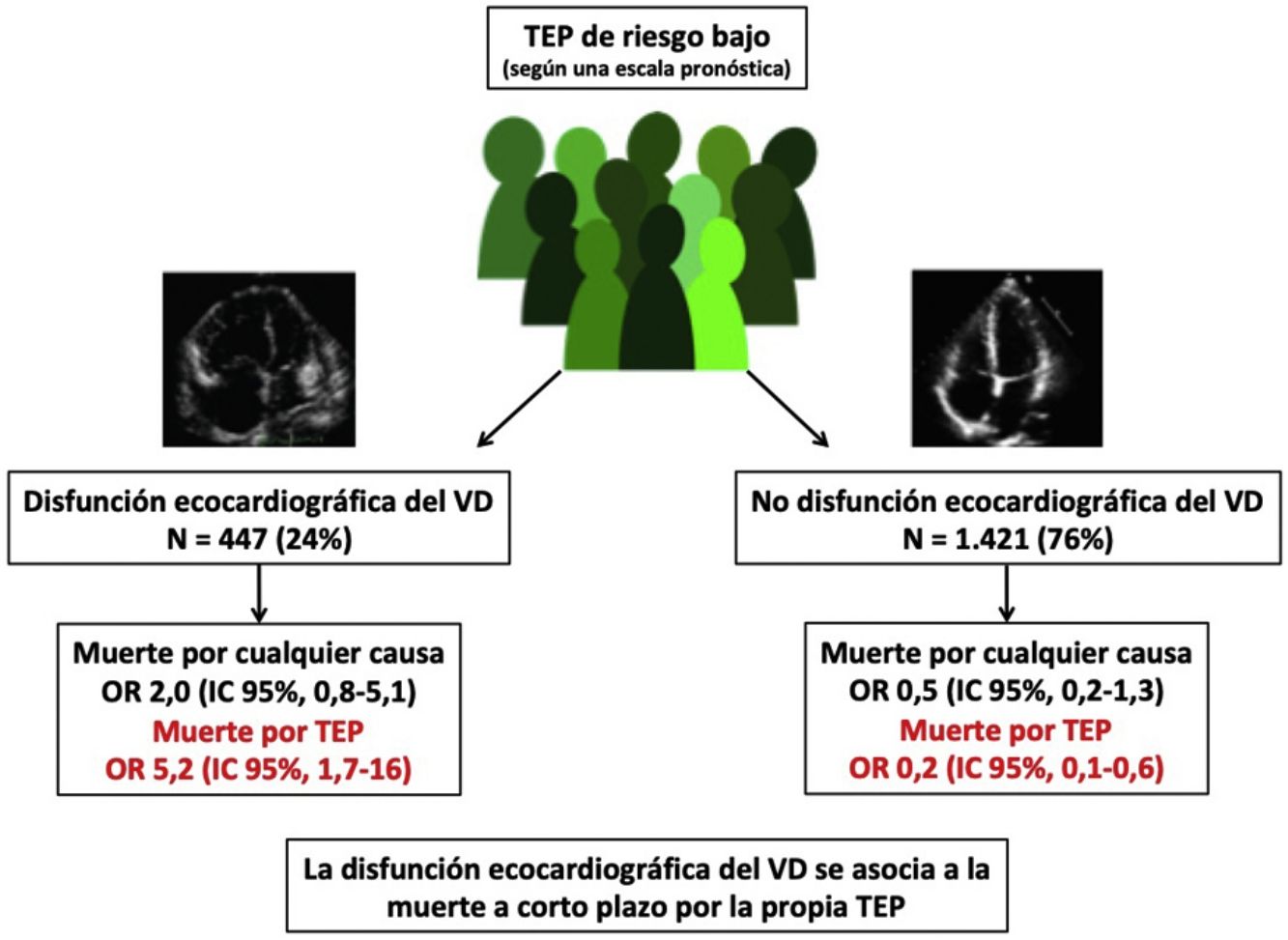
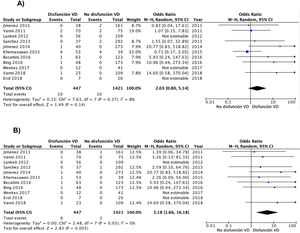
De las 11 cohortes con 1.868 pacientes con TEP de riesgo bajo, 447 (24%; IC del 95%, 22-26%) tenían disfunción ecocardiográfica del VD y 1.421 no (76%; IC del 95%, 74-78%). Diez de los 447 pacientes con TEP de riesgo bajo y disfunción del VD fallecieron (2,2%; IC del 95%, 1,1-4,1%) comparado con 10 de los 1.421 pacientes sin disfunción del VD (0,7%; 0,3-1,3%).
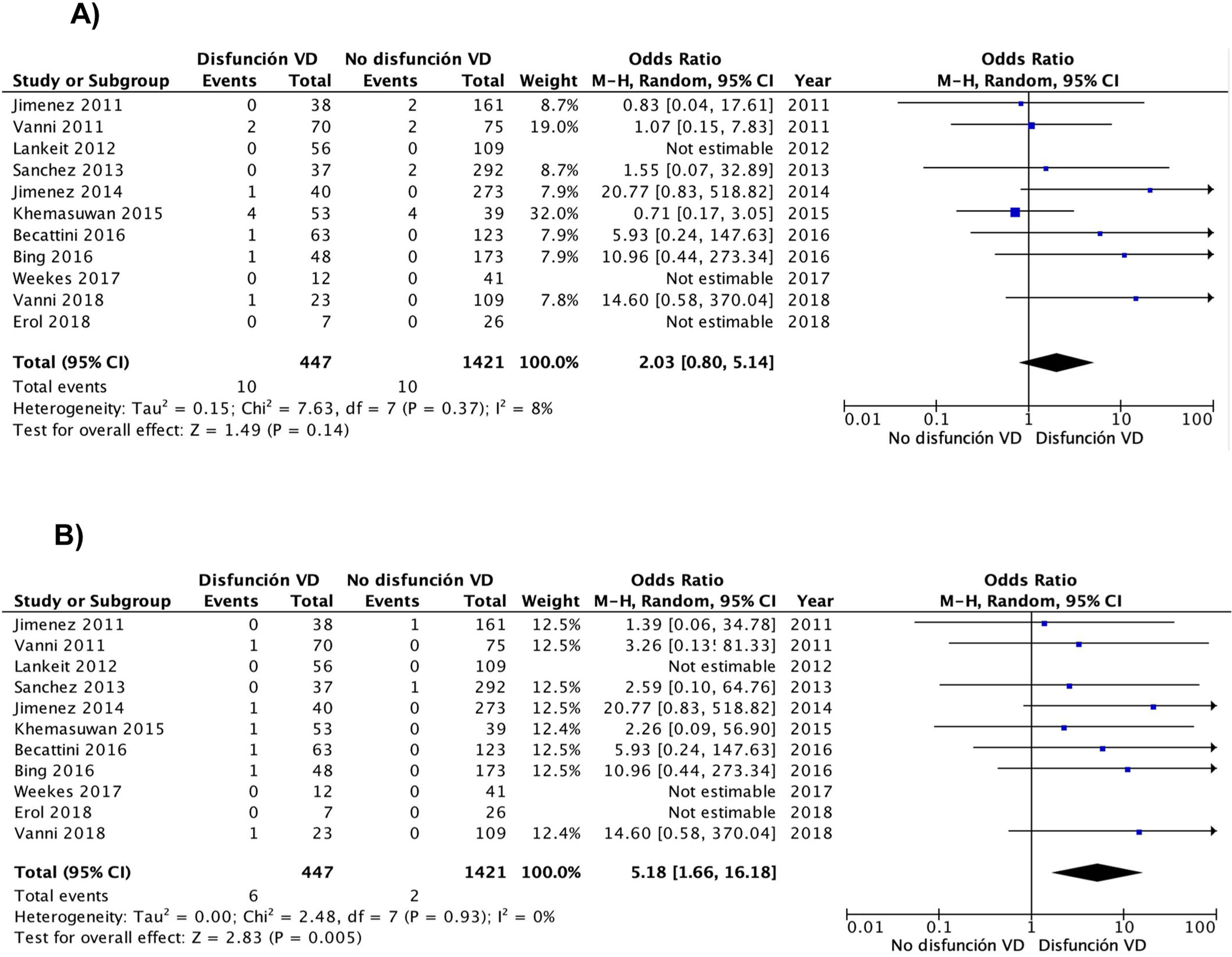
A partir de los resultados de los 11 estudios observacionales se estimó que la OR combinada de la mortalidad por cualquier causa de los pacientes con disfunción del VD era de 2,0 (IC del 95%, 0,8-5,1, P=0,14; I2=8%, P=0,37) (fig. 2A). En ninguno de los estudios hubo hallazgos estadísticamente significativos. Excepto en 2 estudios, en todos los demás se objetivó un peor pronóstico (no significativo) en los pacientes con disfunción del VD. No hubo evidencia de sesgo de publicación cuando se utilizó la prueba de correlación de rangos de Begg.
Todos los estudios proporcionaron información sobre la mortalidad por la propia TEP a corto plazo. La mortalidad por la propia TEP fue de 1,3% (6 de 447 pacientes; IC del 95%, 0,5-2,9%) y 0,1% (2 de 1.421 pacientes; IC del 95%, 0,0-0,5%) en pacientes con y sin disfunción ecocardiográfica del VD, respectivamente. La OR combinada de la mortalidad por la propia TEP de los pacientes con disfunción del VD era de 5,2 (IC del 95%, 1,7-16, P <0,01; I2=0%, P=0,93) (fig. 2B). Se debería realizar una ecocardiografía transtorácica a 83 pacientes con TEP aguda de riesgo bajo para identificar a un paciente que fallece por la propia TEP en los primeros 30 días después del diagnóstico.
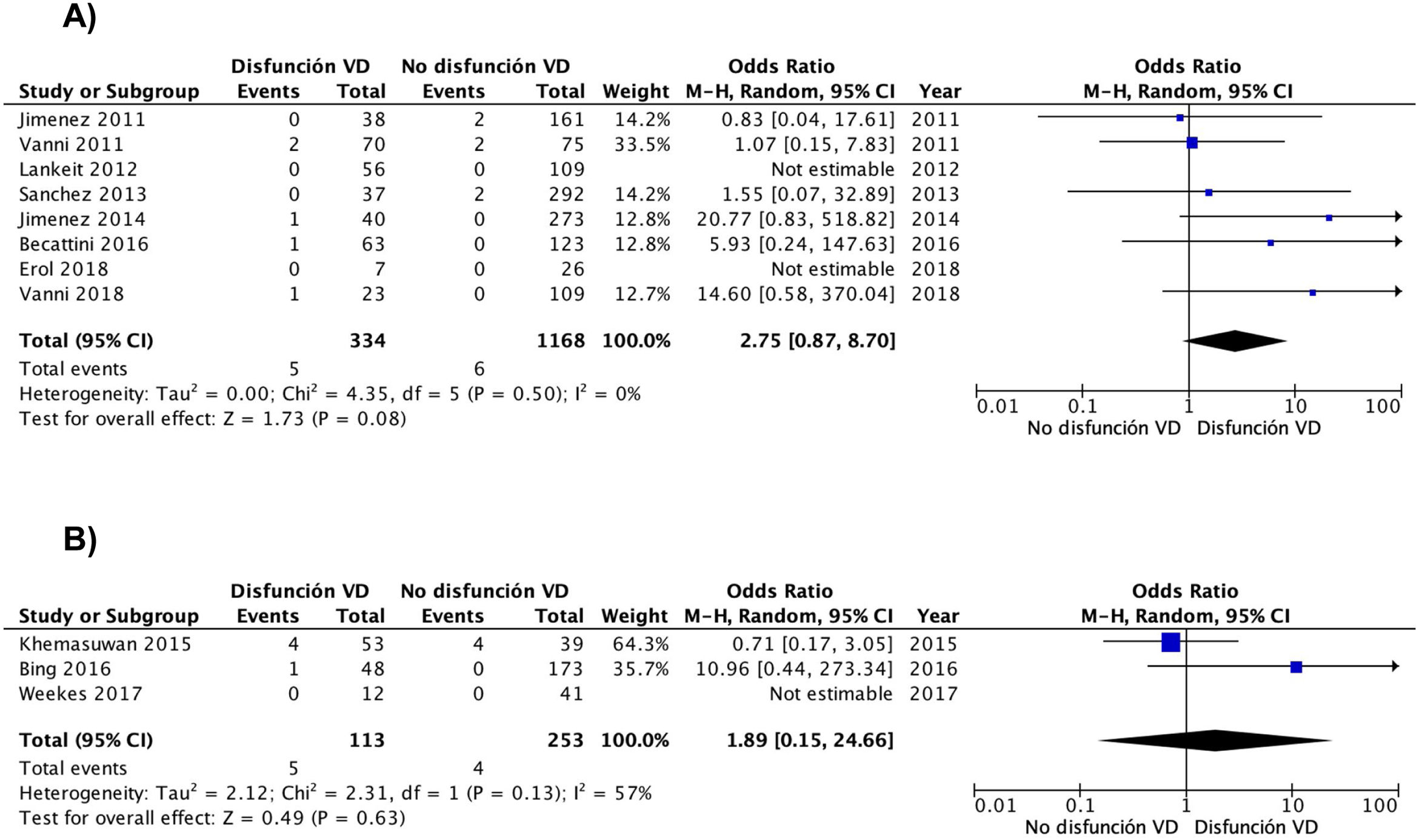
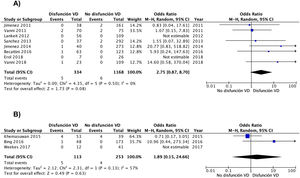
Los resultados fueron similares cuando el análisis se limitó a los 8 estudios (1.502 pacientes) con un diseño prospectivo (OR 2,8; IC del 95%, 0,9-8,7), sin que se evidenciara heterogeneidad (χ=4,4, df=5, P=0,50, I2=0%) (fig. 3A). Los resultados fueron similares para los estudios retrospectivos (OR 1,9; IC del 95%, 0,2-25; heterogeneidad χ=2,3, df=1, P=0,13, I2=57%) (fig. 3B). Cuando el análisis se limitó a los 8 estudios que usaron la escala PESI simplificada, la OR combinada de la mortalidad de los pacientes con disfunción del VD era de 4,4 (IC del 95%, 0,9-21, P=0,07; I2=41%, P=0,15). Para los estudios que usaron la escala PESI, la OR fue de 1,1 (IC del 95%, 0,3-4,8, P=0,90; heterogeneidad χ=0,1, df=2, P=0,96, I2=0%). Se mantuvo una asociación estadísticamente significativa entre la disfunción del VD y la mortalidad por la propia TEP cuando el análisis se limitó a los 3 estudios que dispusieron de un comité de adjudicación de eventos (OR 9,2; IC del 95%, 1,4-59, P=0,02; heterogeneidad χ=0,9, df=2, P=0,63, I2=0%).
DiscusiónEl presente estudio evaluó la utilidad pronóstica de la ecocardiografía transtorácica en pacientes con TEP aguda sintomática de riesgo bajo. No hubo diferencias estadísticamente significativas en la mortalidad por todas las causas entre los pacientes de riesgo bajo con o sin disfunción ecocardiográfica del VD. Sin embargo, la presencia de disfunción ecocardiográfica del VD multiplicó por 5 el riesgo de muerte a corto plazo por la propia TEP.
La estratificación del riesgo de eventos clínicos es un aspecto fundamental en el manejo de los pacientes con TEP aguda sintomática. Los modelos pronósticos clínicos se desarrollaron para identificar a pacientes con TEP y riesgo bajo de complicaciones, que podrían beneficiarse de estancias hospitalarias abreviadas o incluso del tratamiento ambulatorio de su enfermedad. Los resultados de metanálisis previos indican que, de manera general, las escalas clínicas son fiables para identificar a los pacientes con TEP y riesgo bajo de mortalidad en los primeros 30 días después del diagnóstico35. Aun así, no se ha aclarado suficientemente si debería realizar de forma rutinaria una ecocardiografía transtorácica a este subgrupo de pacientes.
¿Cuáles son las implicaciones de estos hallazgos en la práctica clínica? Dado que los resultados de nuestro metanálisis indican que la disfunción ecocardiográfica del VD no se asocia con la mortalidad por todas las causas, y que en muchos centros esta exploración no está disponible de forma continuada, parece razonable no solicitar rutinariamente esta exploración a los pacientes con TEP aguda sintomática de riesgo bajo. No obstante, su realización precoz (i.e., en las primeras horas después del diagnóstico) podría ser útil para los pacientes con TEP de riesgo bajo atendidos en centros con programas de estancia hospitalaria abreviada y/o de tratamiento domiciliario de la TEP, puesto que nuestros resultados indican que el riesgo de muerte por la propia TEP es despreciable si se descarta la disfunción ecocardiográfica del VD.
En un metanálisis previo, Barco et al. encontraron que la disfunción del VD multiplicaba por 4 el riesgo de mortalidad precoz por cualquier causa en pacientes con TEP de riesgo bajo (según una escala clínica pronóstica validada)11. Hay varias razones que podrían explicar esta discrepancia con nuestro estudio. A diferencia de nuestro metanálisis, los autores agregaron los datos de estudios que utilizaron indistintamente la angio-TC de tórax o el ecocardiograma para evaluar el tamaño/función del VD. Además, nuestra revisión sistemática identificó 8 estudios con 1.726 pacientes no incluidos en el metanálisis previo.
Este estudio tiene algunas limitaciones. En primer lugar, no pudimos ajustar la asociación entre la disfunción del VD y la mortalidad por diferentes variables confusoras. Un metanálisis de datos individuales permitiría realizar este tipo de ajustes. En segundo lugar, la validez de los resultados y de las conclusiones del metanálisis depende de la calidad de los estudios individuales de modo que la combinación de estudios sesgados podría haber potenciado aún más el sesgo. En tercer lugar, no hay consenso en la literatura para la definición de disfunción ecocardiográfica del VD. Sin embargo, los estudios incluidos usaron definiciones muy aproximadas y el hecho de que en la mayoría de los estudios se objetivara un peor pronóstico (no significativo) en los pacientes con disfunción del VD, hace poco probable que esta limitación haya influido en los resultados de este metanálisis. Finalmente, solo tres de los estudios dispusieron de un comité para la adjudicación de eventos, lo que podría explicar la diferencia entre los resultados para la variable primaria (mortalidad por cualquier causa) y la variable secundaria (mortalidad por la propia TEP). Sin embargo, se obtuvieron hallazgos similares cuando los análisis se limitaron a estos estudios, lo que refuerza la validez de nuestros resultados.
En conclusión, en pacientes con TEP de riesgo bajo según una escala clínica pronóstica, la disfunción ecocardiográfica del VD no se asocia a un riesgo aumentado de muerte precoz por cualquier causa. Dado que la presencia de disfunción ecocardiográfica del VD se asoció de manera significativa con la muerte por la propia TEP, parece razonable solicitar esta exploración solo a los pacientes de riesgo bajo en los que se considere el tratamiento ambulatorio de su enfermedad. Se requieren estudios bien diseñados para conocer si la evaluación del VD mediante angio-TC de tórax puede proporcionar una información similar a la de la ecocardiografía transtorácica en este grupo de pacientes.
FinanciaciónFinanciado parcialmente por el Instituto de Salud Carlos III (PI15/00207).
Conflicto de interesesD. Jiménez fue investigador principal de dos de los estudios incluidos en este metanálisis.
Agradecemos a los Dres. Becattini, Erol, Khemasuwan, Ng, Sánchez, Vanni y Weekes los datos proporcionados para la realización de este metanálisis.