El trasplante microquirúrgico de pulmón en ratas ha permitido adquirir nuevos conocimientos sobre el trasplante de pulmón. Sin embargo, algunos aspectos de la técnica de trasplante en humanos aún no han sido incluidos en este modelo, lo que podría interferir en la interpretación clínica y en la extrapolación de los resultados.
MétodoSe han realizado 20 trasplantes pulmonares izquierdos con la técnica de manguitos (cuff) incorporando algunas modificaciones técnicas como la inducción de la muerte cerebral, el control del tiempo de isquemia, la perfusión retrógrada en el donante y la reperfusión secuencial controlada del pulmón implantado en el receptor.
ResultadosLa supervivencia ha sido del 80%. Los pulmones trasplantados mostraron una adecuada perfusión y ventilación con buena permeabilidad de las anastomosis. Se han observado signos de isquemia-reperfusión en todos los animales, y de rechazo agudo leve en la mitad de ellos.
ConclusionesEl modelo que presentamos es válido y similar al procedimiento que se realiza en humanos, lo que reduciría el número de posibles variables derivadas de la técnica quirúrgica a la hora de extrapolar los resultados a la clínica.
Microsurgical lung transplantation in rats has allowed us to obtain new knowledge about lung transplantation. However, some aspects in human transplantation technique still have not been included in this model, which could interfere with the clinical interpretation and extrapolation of results.
MethodsTwenty left lung transplantations were performed with a cuff technique and technical modifications, such as brain death induction, the control of ischemia time and retrograde perfusion in the donor and the controlled sequential reperfusion of the implanted lung in the recipient.
ResultsSurvival rate was 80%. The transplanted lungs showed proper perfusion and ventilation with good permeability of the anastomoses. Signs of ischemia-reperfusion injury were observed in all animals while mild acute rejection was seen in half of them.
ConclusionsThe model shown proves valid and is very similar to the procedure carried out in humans, which would reduce the number of possible variables derived from the surgical technique when extrapolating the study results to clinical use.
El trasplante de pulmón (TP) es una alternativa terapéutica para algunas enfermedades respiratorias terminales. Actualmente está indicado en el enfisema pulmonar avanzado, la fibrosis quística, la enfermedad intersticial difusa y la hipertensión pulmonar. La técnica más utilizada es el doble trasplante de pulmón, seguido por la de uno solo. La importancia de mejorar ciertos aspectos tales como la preservación, el tiempo de isquemia, la lesión de isquemia reperfusión (LIR), el rechazo agudo (RA) y crónico (RC) hacen necesario el desarrollo de modelos adecuados de TP experimental1.
Al principio el modelo experimental preferido era el perro2,3, aunque los problemas éticos y económicos hicieron que los investigadores buscaran modelos alternativos, como el conejo4 y las ratas. En 1971, Asimacopoulos5 inició el TP experimental en ratas, y en 1982 Wildevuur6 completó la técnica con éxito, aunque con dificultades para realizar las anastomosis vasculares y bronquiales con suturas.
La complejidad de la técnica microquirúrgica en ratas mejoró en 1989 con la técnica inicial descrita por Mizuta7. Fue la primera vez que los manguitos o cuff de teflón fueron utilizados para realizar las anastomosis. Para su creación se usaron catéteres intravenosos de polietileno cortados en cilindros de 2mm. Inicialmente Mizuta realizó las anastomosis vasculares en el receptor con cuff, mientras que la anastomosis bronquial fue hecha con sutura. Posteriomente, Mizuta8 y Reis9 describieron la realización de todas las anastomosis con cuff. Esta modificación de la técnica redujo significativamente la duración del procedimiento y la mortalidad postoperatoria, lo que permitió introducir un nuevo modelo de estudio del TP y sus complicaciones.
Desde entonces, algunos autores10,11 han descrito modificaciones de la técnica quirúrgica para estudiar diferentes aspectos del TP y mejorar las condiciones experimentales sin incluir aspectos importantes relacionados con el TP clínico como la muerte cerebral (MC), la perfusión retrógrada en el donante o el inicio del tiempo de isquemia en estos modelos.
En nuestro estudio presentamos un nuevo protocolo anestésico y algunas modificaciones en la técnica de preservación e implante pulmonar en ratas con el propósito de reproducir lo que se hace actualmente en la clínica humana, con el objetivo de reducir las posibles variables de la técnica quirúrgica en el momento de interpretar y extrapolar los resultados.
MétodoAnimalesSe utilizaron 40 ratas (20 donantes y 20 receptoras) machos consanguíneos de la cepa Sprague-Dawley con un peso comprendido entre 300-400g bajo óptimas condiciones de estabulación. Todos los animales fueron tratados de acuerdo a la «Guía para el uso y cuidado de los animales de laboratorio» publicada por el Instituto Nacional de la Salud. El estudio fue aprobado por el Comité Ético de Experimentación y Bienestar Animal de nuestro hospital.
Inducción de la muerte cerebralLos animales (n=20) se anestesiaron con 0,25mg/kg por vía subcutánea (sc) de medetomidina (Domtor®, Pfizer, Madrid, España) y 50mg/kg por vía intramuscular (im) de ketamina (Ketolar 500®, Pfizer, Madrid, España). Se rasuró la parte anterior del tórax del animal donante, se realizó una intubación orotraqueal con un Abbocath 14G y se ventiló con un respirador presovolúmetrico (Evita 4,Draeger-Hispania, Madrid, España) con un volumen corriente (VC) de 10ml/kg o presión meseta (Pmeseta) de 12-14cmH2O e índice de inspiración/expiración (I/E) de 1:2, frecuencia respiratoria (FR) de 60rpm, fracción inspirada de oxígeno (FiO2) de 0,21 y presión positiva al final de la expiración (PEEP) de 2cmH2O.
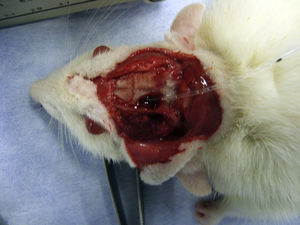
Para la inducción de la MC se realizó una trepanación craneal de 2mm en la zona anterolateral al bregma y se introdujo un catéter de Fogarty 3F (LeMaitre® vascular, Burlington, Massachusetts, EE. UU.). La MC fue inducida gradualmente por el incremento de la presión intracraneal al inyectar una cantidad de 20μl12 de suero salino por minuto hasta alcanzar los 200μl dentro del balón del catéter, lo que produjo la herniación del tronco cerebral (fig. 1). Se mantuvo la temperatura corporal cercana a 36,5°C usando una almohadilla térmica eléctrica. La MC fue confirmada por la presencia de apnea, desaparición de la actividad electroencefalográfica y dilatación de pupilas12,13.
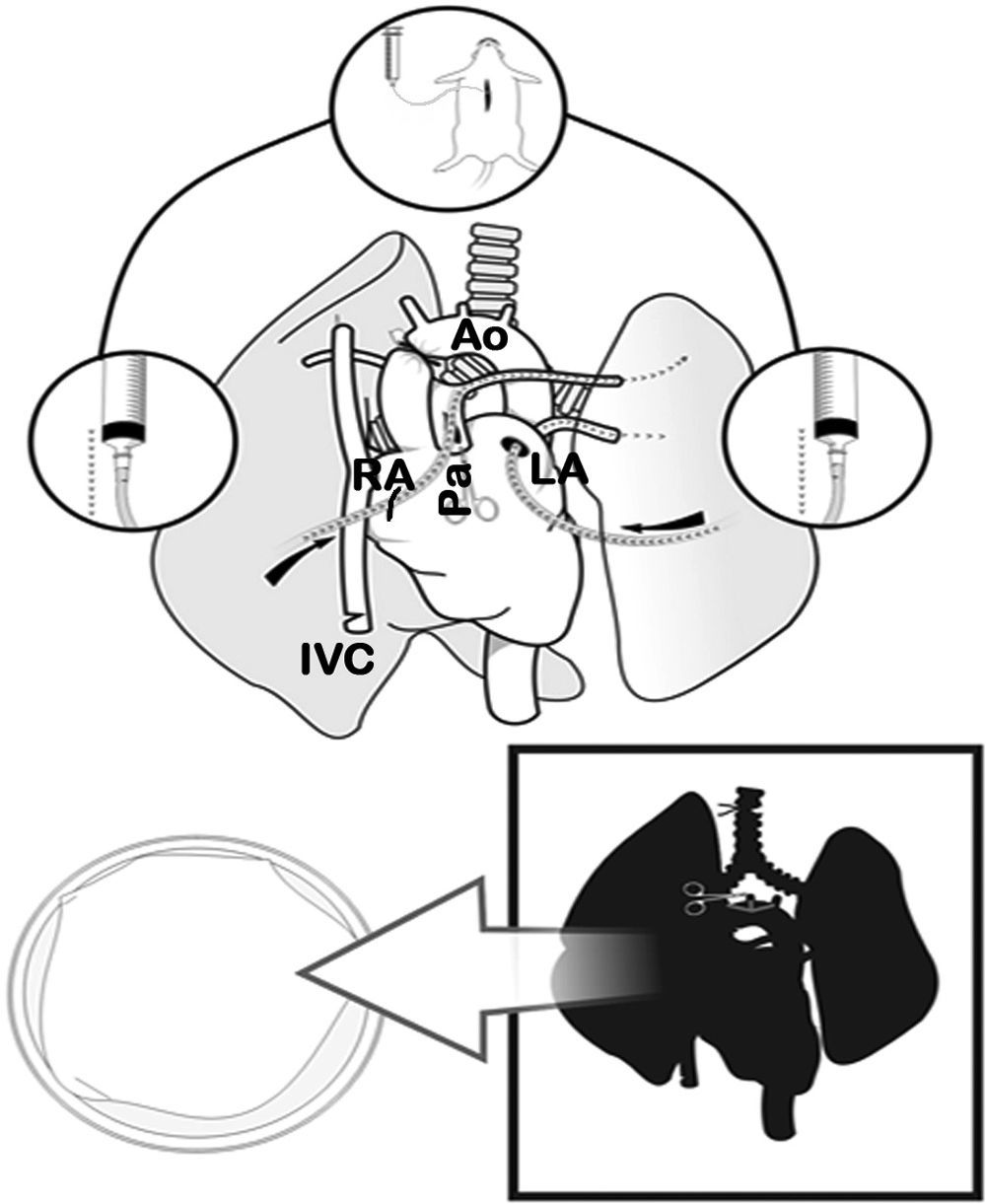
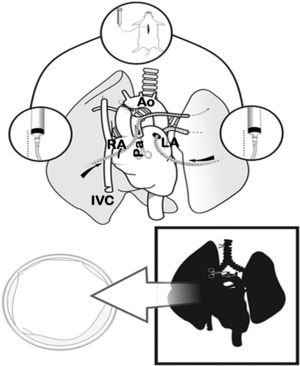
Extracción y preservación pulmonarCon la rata en posición supina, se inyectaron 100UI/100g de heparina sódica intravenosa (Heparina sódica®, Chiesi, Barcelona, España) en la vena yugular. Posteriormente se procedió a la apertura subxifoidea del abdomen y a la esternotomía media, abriendo ampliamente el tórax con dos pinzas de Kocher. Se continuó con la exéresis del timo y la disección de la aorta torácica ascendente. Se cortó la aurícula izquierda y se pinzó la aorta ascendente con un microclamp permanente de 4mm (Yasargil®, Medicom, Alemania), iniciando así el tiempo de isquemia (período comprendido entre la interrupción del flujo sanguíneo al clampar la aorta y la reperfusión sanguínea del pulmón a través de la arteria después de realizar las anastomosis). A continuación se cortó la aurícula derecha, la vena cava torácica inferior y se llenó la cavidad torácica de hielo. Cuando se produjo el paro cardíaco se perfundieron los pulmones de forma anterógrada con solución de preservación fría de glucosa dextrano bajo en potasio (LPDG) (Perfadex®, Kungsbacka, Suecia), con 500μg/l de prostaglandina E1 (Alprostadil®, Pfizer, Madrid, España) diluidos en la bolsa, a través de una incisión en la base del cono de la arteria pulmonar utilizando un catéter Abbocath® de 16G (16-20ml de LPDG a una altura de 30cm). Seguidamente se realizó una perfusión retrógrada a través de la aurícula izquierda (10-12ml de LPDG desde 20cm de altura).
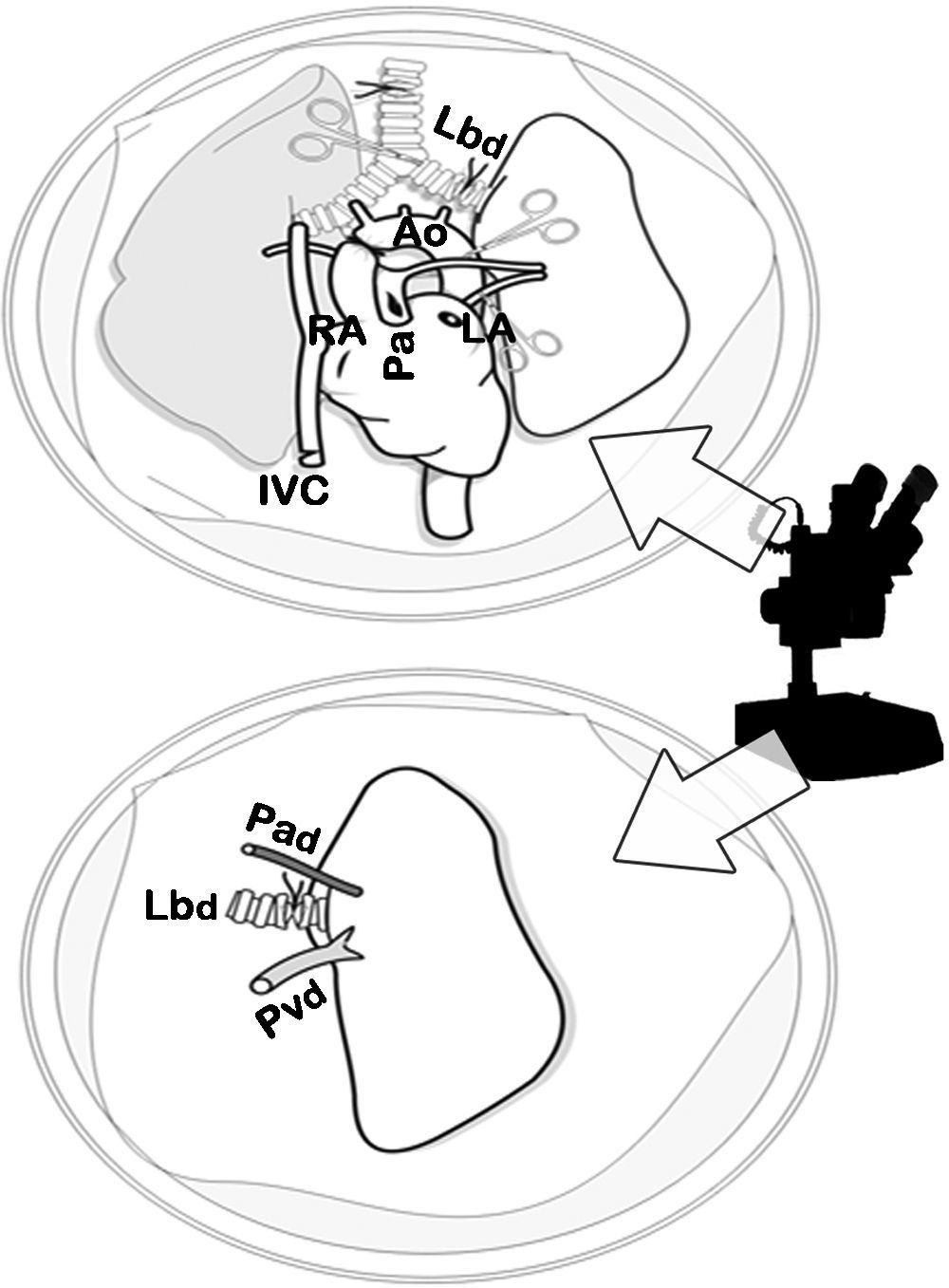
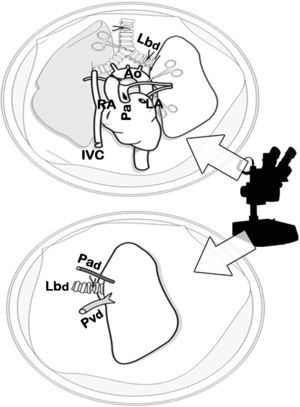
Cuando la perfusión de los pulmones fue homogénea, se procedió a la ligadura y la sección de la tráquea con el pulmón semiinsuflado al 50% de la capacidad pulmonar total (10-15cmH2O), a la extracción del bloque cardiopulmonar por tracción separándolo del esófago, y a la sección de los troncos supraaórticos, de la aorta torácica, de la vena cava y de los ligamentos pulmonares. El bloque cardiopulmonar se colocó sobre una placa de Petri con LPDG frío, y se diseccionó la arteria, la vena y el bronquio izquierdo usando un microscopio óptico 10× (Carl Zeiss®, Alemania) con sección distal al hilio de dichas estructuras para separar el pulmón izquierdo. Se colocó un microclamp en el bronquio para mantener el pulmón en un estado de semiinsuflación (figs. 2 y 3).
Clampaje de la aorta torácica (Ao) y sección de la aurícula izquierda (LA), de la aurícula derecha (RA) y de la vena cava inferior (IVC). Sección de la arteria pulmonar (Pa) y perfusión anterógrada. Posteriormente, perfusión retrógrada por la aurícula y vena pulmonar izquierda, y finalmente ligadura traqueal con pulmones en semiinsuflación y extracción cardiopulmonar.
Disección del bloque cardiopulmonar por microscopia óptica. Disección de la arteria (Pad), de la vena (Pvd) y del bronquio izquierdo (Lbd) del donante y sección de estructuras distal al hilio para la separación del pulmón izquierdo, previo cierre del bronquio con un microclamp para mantener el pulmón en un estado de semiinsuflación.
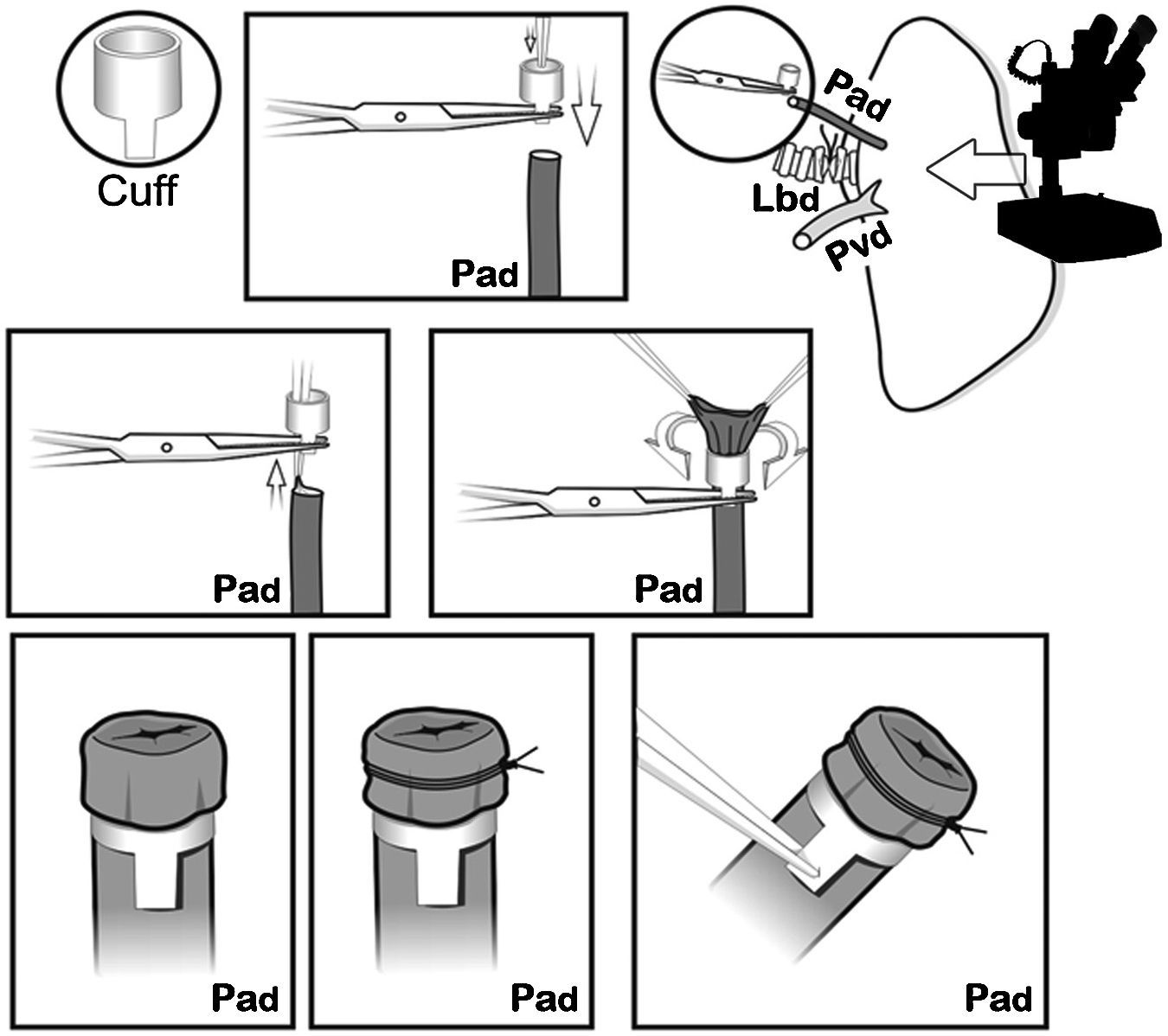
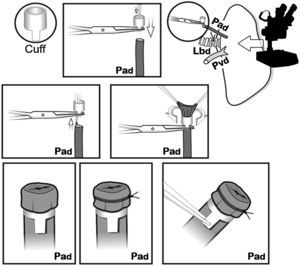
Los cuffs se construyeron con un catéter Abbocath® de 16G (1,7mm de diámetro). Cada manguito presentaba un cuerpo y una lengüeta de 1,5mm de longitud. La lengüeta se usó para fijar el cuff con un clamp durante el implante. Primero, la arteria pulmonar se pasó a través del cuff. El extremo proximal fue evertido sobre el cuff y fijado firmemente mediante una ligadura no absorbible del 7/0 (fig. 4). El mismo procedimiento se realizó con el bronquio y la vena pulmonar, respectivamente, luego el pulmón se almacenó en LPDG frío hasta el momento del implante, en nuestro caso 2h después del clampaje de la aorta torácica.
Implante en el receptorEl animal receptor (n=20) se anestesió con 0,25mg/kg de medetomidina sc, 50mg/kg de ketamina im y 0,7mg/kg de atropina im (Atropina®, Braun, Barcelona, España). Una vez anestesiado, se procedió a la intubación orotraqueal con un Abbocath® de 14G. Los animales receptores fueron ventilados de la misma forma que los donantes.
Tras rasurar el hemitórax izquierdo, se realizó una toracotomía izquierda en el cuarto espacio intercostal y se sacó el pulmón de la cavidad torácica mediante un clip metálico para hojas. Se diseccionó el hilio pulmonar para identificar la arteria, el bronquio y la vena pulmonar. El plexo arteriolar bronquial fue cauterizado junto con la arteriola del ligamento pulmonar, debajo de la vena. Se colocaron ligaduras largas de polipropileno 6/0, así como microclamps (Yasargil® 4mm) en cada una de las estructuras, lo más próximas al corazón. La arteria y la vena se seccionaron proximal y tangencialmente al pulmón y se realizó un lavado intravascular con suero heparinizado. Posteriormente se seccionó también el bronquio.
El pulmón donante se colocó sobre el pulmón nativo del receptor y fue irrigado frecuentemente con solución de preservación fría hasta que las anastomosis fueron completadas con los cuffs. Para ello cada cuff fue introducido en su estructura homóloga correspondiente a través del orificio realizado. Una vez introducido, se fijó transitoriamente el mismo con un microclamp colocado sobre la lengüeta para facilitar la fijación definitiva de la anastomosis con las ligaduras, y luego se retiró el microclamp.
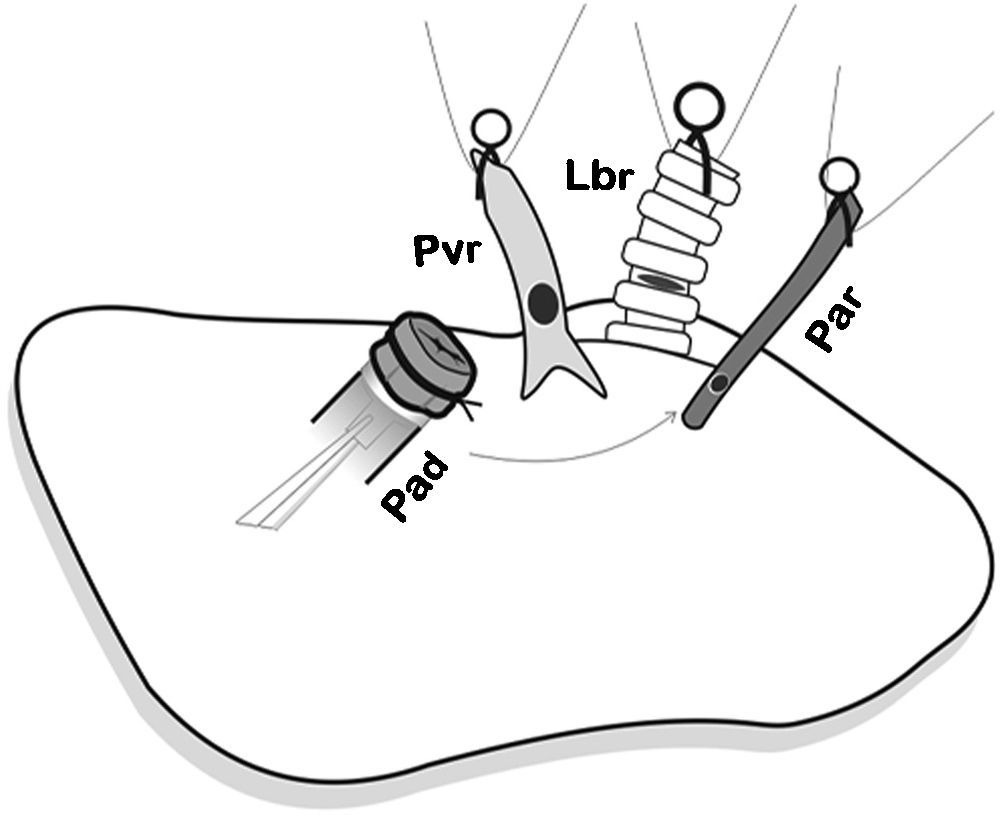
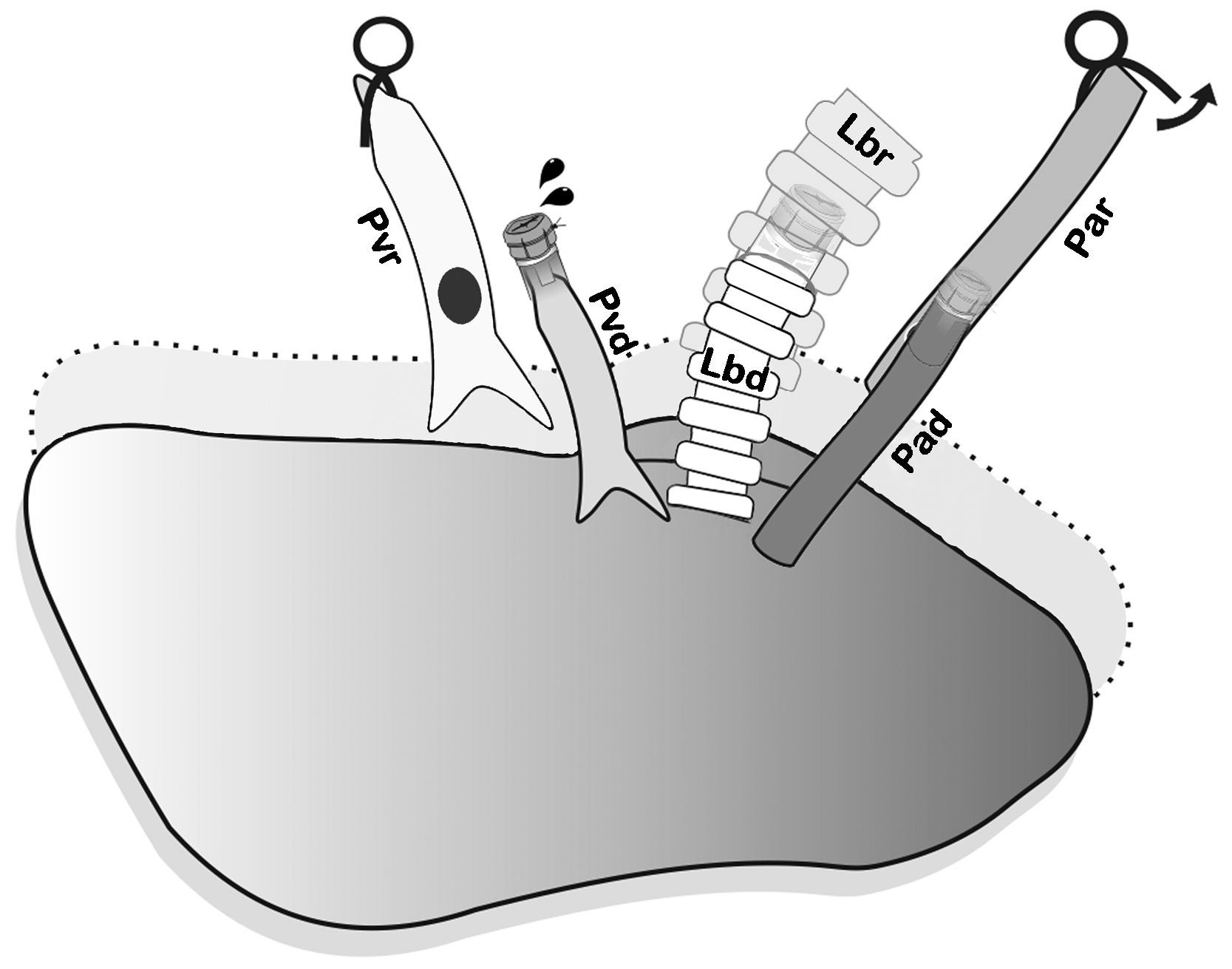
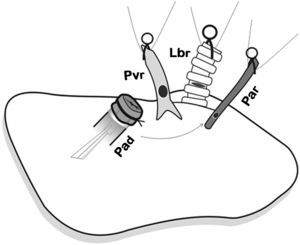
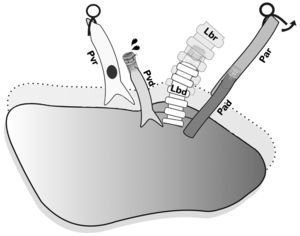
En primer lugar se realizó la anastomosis arterial y luego la bronquial (fig. 5), y se procedió a la reperfusión secuencial del pulmón donante. El microclamp proximal al corazón fue retirado transitoriamente del bronquio para permitir la ventilación del pulmón con una PEEP de 5cmH2O para eliminar atelectasias, luego se reperfundió lentamente la arteria pulmonar abriendo de forma controlada el microclamp proximal de la arteria hasta observar la salida de unas pocas gotas de sangre por la vena pulmonar (fig. 6). Se pinzaron de nuevo la arteria y el bronquio, y se procedió a la anastomosis de la vena. Una lenta y progresiva reperfusión se llevó a cabo mediante la apertura del microclamp de la vena, seguido del bronquio y finalmente de la arteria.
Colocación del pulmón donante sobre pulmón receptor e introducción de los cuff en cada una de las correspondientes estructuras y posterior anastomosis. Primero se realizó la anastomosis arterial. Pad: arteria pulmonar donante; Par: arteria pulmonar receptor; Lbr: bronquio izquierdo receptor; Pvr: vena pulmonar receptor.
Reperfusión secuencial anterior controlada. El clamp ha sido retirado del bronquio y el pulmón fue ventilado transitoriamente con PEEP de 5cmH2O para eliminar atelectasias, luego reperfundido lentamente desde la arteria pulmonar hasta que unas gotas de sangre salgan por la vena pulmonar del donante. Pad: arteria pulmonar donante; Par: arteria pulmonar receptor; Lbd: bronquio izquierdo donante; Lbr: bronquio izquierdo receptor; Pvd: vena pulmonar donante; Pvr: vena pulmonar receptor.
Una vez implantado el pulmón donante, se retiró el pulmón nativo del receptor y se colocó un tubo de drenaje pleural de 8 french conectado a una jeringa para aspirar, y se cerró la toracotomía. Posteriormente se administraron 0,25mg/kgim de atipamezol (Antisedan®, Pizer, Madrid, España), antagonista de la medetomidina, y 0,05mg/kgsc de buprenorfina (Buprex®, Schering-Plough, Madrid, España). Cuando la rata presentó respiración espontánea, se retiraron los tubos torácico y orotraqueal.
Seguimiento postoperatorio y evaluación del trasplanteLas ratas que sobrevivieron a la cirugía fueron sacrificadas bajo anestesia general con 0,25mg/kg de medetomodina sc y 50mg/kg de ketamina im a los 7 (n=8) y 90 días (n=8). Tras pinzar la arteria y el bronquio pulmonar derecho se extirpó el bloque cardiopulmonar con el pulmón insuflado. El bloque se fijó con formaldehido a través la tráquea y se incluyó en parafina para el estudio histológico. En nuestro caso, durante el período de estudio no se administró a los animales ningún tratamiento inmunosupresor.
Las muestras obtenidas del pulmón trasplantado fueron teñidas con hematoxilina-eosina. Se evaluaron los signos de LIR como edema alveolointersticial, congestión vascular, hemorragia alveolar e infiltración neutrofílica, y la LIR se clasificó como leve, moderada y severa; de RA como la distribución del infiltrado mononuclear perivascular y peribronquial de acuerdo a la Clasificación Internacional de Rechazo, y de RC como dilatación bronquial y bronquiolar, áreas de vasculitis y fibrosis. También se inspeccionaron visualmente las anastomosis para determinar su permeabilidad macroscópica.
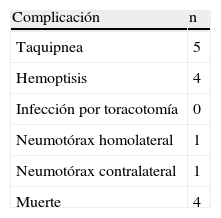
Desde el punto de vista clínico se evaluó la presencia de taquipnea, hemoptisis, insuficiencia respiratoria e infecciones posquirúrgicas durante el período postoperatorio. En todos los casos se realizó una radiografía de tórax con 55 Kv y 3,2mA (Siemens Mobilett II®, Siemens España, Madrid, España) inmediatamente después de la cirugía, a los 7 y 90 días antes del sacrifico del animal.
ResultadosEl tiempo quirúrgico medio fue de 48,5±2,0min para la extracción y de 59,2±4,2 para el implante. El tiempo medio para el procedimiento completo fue de 107±6,2min.
No se observaron infecciones postoperatorias. Cuatro de los animales receptores —dos del grupo de 7 días y dos del grupo de 90 días— presentaron taquipnea y hemoptisis debido a edema severo y murieron antes de las 48h. Un animal presentó taquipnea durante las primeras 24h. Los otros animales no presentaron problemas clínicos, y el índice de supervivencia fue del 80% (tabla 1).
En el estudio histológico se observaron signos de LIR a los 7 días en todos los pulmones trasplantados (n=8): leve (n=5), moderada (n=2) y severa (n=1), y signos de RA en 6 animales (A1=3 y A2=3). A los 90 días se observó en todos los animales (n=8) un muñón de pulmón fibrótico y microscópicamente se apreció dilatación bronquial con áreas de vasculitis y fibrosis acompañada de un RA severo (A4), que indican la presencia de un RC activo. No se observaron cambios histológicos en el pulmón no trasplantado. La inspección de los cuffs mostró en todos los animales una adecuada luz bronquial y vascular sin signos de estenosis o trombosis.
La radiografía de tórax mostró una adecuada expansión pulmonar con un incremento en la densidad del pulmón trasplantado en relación con la presencia de LIR a los 7 días y de RC a los 90 días. Un animal presentó un ligero neumotórax izquierdo y otro uno contralateral inmediatos a la cirugía, sin repercusiones clínicas.
DiscusiónEl TP continúa siendo un desafío para los pacientes y los equipos médicos de trasplante, con importantes áreas para la investigación básica y clínica. Para afrontar estos retos, el Instituto Nacional Americano del Corazón, Pulmón y Sangre14 (NHLBI) recomienda considerar los siguientes puntos: a) identificar biomarcadores esenciales, basados en estudios proteómicos y genómicos que puedan predecir la presencia del RC, b) desarrollar modelos animales relevantes que reproduzcan mejor las enfermedad humana, para investigar la patogénesis de la lesión pulmonar después del trasplante, y c) respaldar y promover la investigación a lo largo de toda la gama de disfunción del injerto, incluido el RC.
En este sentido, siguiendo las recomendaciones del NHLBI, el modelo experimental que hemos desarrollado en este estudio se basa en los descritos previamente con técnicas de cuff7–9 con modificaciones en las técnicas de preservación e implante como la inducción a la MC, control en el tiempo de isquemia y perfusión retrógrada en el donante y reperfusión secuencial controlada en el pulmón del receptor, además de una mejora en el porcentaje de supervivencia del 80% frente a otros modelos de trasplante de pulmón en rata11. Este es un intento de desarrollar modelos animales que reflejen lo que sucede en las enfermedades humanas según las recomendaciones internacionales antes mencionadas.
Los órganos utilizados para trasplante son, principalmente, derivados de donantes en MC15. La mayoría de los donantes sufren un daño considerable en el sistema nervioso central debido a hemorragia subaracnoidea o lesión cerebral traumática, antes de ser declarados en MC16. La MC induce alteraciones autonómicas, hemodinámicas y del estado neurohormonal del donante17,18 que pueden inducir un edema pulmonar y hemorragia intraalveolar y que deben ser tenidas en cuenta en los modelos experimentales de TP para simular una modelo más real.
Se han descrito diferentes modelos animales que valoran los efectos causados en los órganos donantes por la MC de inicio rápido y de inicio lento13,16,18,19 usados en estudios de trasplante de riñón20, de hígado21 y muy escasamente en el TP22 (tabla 2). En nuestro caso, hemos usado el modelo de MC de inicio lento, con incremento gradual de la presión intracraneal para reducir la inestabilidad hemodinámica del donante13 y el subsecuente grado de edema pulmonar, que en el caso de las ratas se agrava por labilidad de la permeabilidad vascular pulmonar. De hecho, en las ratas donantes en MC se produce un edema pulmonar severo con frecuencia tras más de 2h desde la inducción de la MC; esta es la razón de que realicemos el TP con 2h de tiempo de isquemia22.
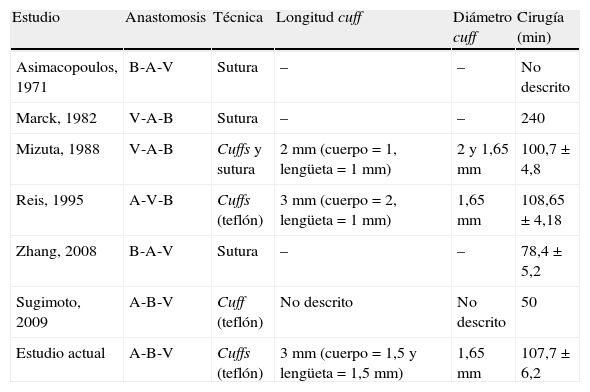
Evolución del trasplante pulmonar en ratas
| Estudio | Anastomosis | Técnica | Longitud cuff | Diámetro cuff | Cirugía (min) |
| Asimacopoulos, 1971 | B-A-V | Sutura | – | – | No descrito |
| Marck, 1982 | V-A-B | Sutura | – | – | 240 |
| Mizuta, 1988 | V-A-B | Cuffs y sutura | 2mm (cuerpo=1, lengüeta=1 mm) | 2 y 1,65 mm | 100,7±4,8 |
| Reis, 1995 | A-V-B | Cuffs (teflón) | 3mm (cuerpo=2, lengüeta=1 mm) | 1,65 mm | 108,65±4,18 |
| Zhang, 2008 | B-A-V | Sutura | – | – | 78,4±5,2 |
| Sugimoto, 2009 | A-B-V | Cuff (teflón) | No descrito | No descrito | 50 |
| Estudio actual | A-B-V | Cuffs (teflón) | 3mm (cuerpo=1,5 y lengüeta=1,5 mm) | 1,65 mm | 107,7±6,2 |
La columna de anastomosis muestral el orden de las anastomosis en la cirugía (B: bronquio; A: arteria pulmonar; V: vena pulmonar). El tiempo de la cirugía está expresado en minutos (promedio±desviación estándar).
En nuestro modelo, la intubación orotraqueal con Abbocath® 14 G minimiza la pérdida peritraqueal de aire y asegura una mejor ventilación de la rata durante la cirugía, ya que no existen tubos endotraqueales para ratas. La extracción del pulmón donante mediante una esternotomía media9,23, a diferencia de Mizuta7, facilita la extracción de los órganos torácicos y minimiza las posibles lesiones en estos. Similar al trasplante en humanos, el clampaje de la aorta permitió el control preciso de la duración de la isquemia, el cual no es controlado en otros modelos propuestos7,9. Esto también actúa como un factor mecánico que favorece el paro cardíaco, similar a lo que ocurre en la clínica humana. En nuestro modelo, como en el de Reis9, preferimos cuff de 16G para minimizar el riesgo de desgarrar las estructuras hiliares, especialmente la vena pulmonar. La reperfusión y la permeabilidad han demostrado ser buenas, por lo que los consideramos adecuados para animales de entre 300 y 400g.
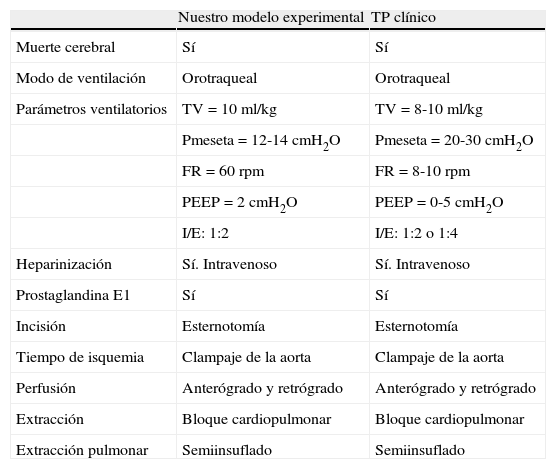
Una parte importante del proceso de extracción en humanos es la preservación anterógrada y retrógrada del órgano. Durante la extracción, el volumen y la velocidad del flujo deben garantizar una perfusión homogénea del pulmón por ambas vías. Esto debe ser llevado a cabo con los pulmones ventilados para evitar zonas de atelectasias y de mala perfusión24. En nuestro modelo conseguimos una óptima perfusión con un Abbocath® de 16G usando solución fría de dextrano bajo en potasio, que actualmente es el más usado en la clínica. La introducción de la perfusión retrógrada, que no ha sido descrita en otros modelos en ratas, es importante, pues la anterógrada ha demostrado ser incompleta, ya que obvia la circulación bronquial25. La preservación retrógrada puede realizarse con seguridad con una presión y volumen más bajos que los usados en la perfusión anterógrada, debido a la labilidad vascular pulmonar de este tipo de animales. Esto permite que nuestro modelo se asemeje más a lo que sucede en la clínica (tabla 3).
Comparaciones técnicas entre la preservación pulmonar en nuestro modelo experimental y el trasplante pulmonar en la clínica
| Nuestro modelo experimental | TP clínico | |
| Muerte cerebral | Sí | Sí |
| Modo de ventilación | Orotraqueal | Orotraqueal |
| Parámetros ventilatorios | TV=10 ml/kg | TV=8-10 ml/kg |
| Pmeseta=12-14 cmH2O | Pmeseta=20-30 cmH2O | |
| FR=60 rpm | FR=8-10 rpm | |
| PEEP=2 cmH2O | PEEP=0-5 cmH2O | |
| I/E: 1:2 | I/E: 1:2 o 1:4 | |
| Heparinización | Sí. Intravenoso | Sí. Intravenoso |
| Prostaglandina E1 | Sí | Sí |
| Incisión | Esternotomía | Esternotomía |
| Tiempo de isquemia | Clampaje de la aorta | Clampaje de la aorta |
| Perfusión | Anterógrado y retrógrado | Anterógrado y retrógrado |
| Extracción | Bloque cardiopulmonar | Bloque cardiopulmonar |
| Extracción pulmonar | Semiinsuflado | Semiinsuflado |
En nuestro caso, la extracción del bloque cardiopulmonar es similar a la que se realiza en humanos, a diferencia de lo descrito en otros modelos experimentales donde se extrae solo el pulmón izquierdo, lo que nos permite mantener la ventilación del pulmón con FiO2 de 0,21 y una PEEP de 2cmH2O24,26 hasta la ligadura de la tráquea y extraer ambos pulmones semiinsuflados al 50% de la capacidad total, lo que se consigue con una presión de aire de 12-15cm de agua. La disección del hilio izquierdo con un microscopio permite minimizar los riesgos de lesión vascular y facilita que los vasos y el bronquio se corten lo más largos posible para la colocación de los cuff y el posterior implante. El pinzado del bronquio principal izquierdo antes de su sección a nivel de la carina permite mantener el pulmón ventilado durante su almacenamiento previamente al implante27.
El protocolo anestésico, sobre todo en el receptor, permite despertar al animal en cualquier momento sin que sea necesario que se metabolice el anestésico, o añadir dosis extra o tener que usar anestésicos inhalatorios. Los efectos de la medetomidina pueden fácilmente revertirse con su antagonista, el atipamezol28. En nuestro caso, la asociamos con la ketamina para conseguir las adecuadas sedación, relajación e hipnosis. Además, la administración de atropina disminuye las secreciones del árbol bronquial y tiene efectos paliativos de los efectos secundarios debidos a la medetomidina29. Por efecto de los anestésicos puede aparecer hipotermia, que se controla con una manta eléctrica bajo el animal; si no se corrige, puede provocar su fallecimiento. La administración de estos tres fármacos ha constituido en nuestra experiencia un rápido, eficiente y seguro protocolo anestésico para el TP en estos animales.
El abordaje de la cavidad torácica por el cuarto espacio intercostal en el receptor —a diferencia de otros autores, que usan el quinto espacio intercostal9— nos permite una mejor manipulación del hilio pulmonar para su disección. Además, la sección de los vasos pulmonares y del bronquio principal lo más lejos posible del corazón y en su cara anterior7, sin seccionar por completo la estructura, facilita mucho las anastomosis, de la misma forma que usar ligaduras largas detrás de los miroclamps facilita la introducción del cuff y el cierre de la anastomosis, a diferencia de lo descrito por Reis9.
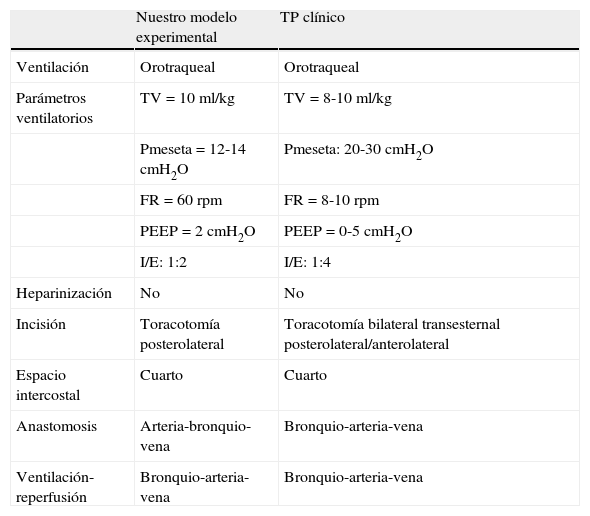
La reperfusión secuencial controlada24,30 es un paso crítico en el trasplante humano, no descrita en otros modelos experimentales propuestos. En nuestro modelo realizamos una reperfusión anterógrada con el pulmón ventilado que permite una distribución homogénea del flujo sanguíneo del pulmón con salida de la solución de preservación a través de la vena, de forma similar a lo que ocurre durante el trasplante en la clínica. Además, se evita la entrada de cantidades masivas de solución de preservación dentro del flujo venoso vascular con un aumento de la presión capilar pulmonar y un subsiguiente edema pulmonar no relacionado con LIR, el cual puede causar artefactos en los resultados (tabla 4).
Comparaciones técnicas entre el implante pulmonar en nuestro modelo experimental y el trasplante pulmonar en la clínica
| Nuestro modelo experimental | TP clínico | |
| Ventilación | Orotraqueal | Orotraqueal |
| Parámetros ventilatorios | TV=10 ml/kg | TV=8-10 ml/kg |
| Pmeseta=12-14 cmH2O | Pmeseta: 20-30 cmH2O | |
| FR=60 rpm | FR=8-10 rpm | |
| PEEP=2 cmH2O | PEEP=0-5 cmH2O | |
| I/E: 1:2 | I/E: 1:4 | |
| Heparinización | No | No |
| Incisión | Toracotomía posterolateral | Toracotomía bilateral transesternal posterolateral/anterolateral |
| Espacio intercostal | Cuarto | Cuarto |
| Anastomosis | Arteria-bronquio-vena | Bronquio-arteria-vena |
| Ventilación-reperfusión | Bronquio-arteria-vena | Bronquio-arteria-vena |
Para finalizar concluimos que, con estas modificaciones descritas, la técnica de TP con cuffs en ratas se aproxima más a lo que ocurre en la clínica humana. Ello podría facilitar la interpretación y la extrapolación clínica de los resultados obtenidos al trabajar con estos modelos experimentales tan necesarios en la investigación del TP.
FinanciaciónEste proyecto ha sido financiado por el Fondo de Investigación Sanitaria Español (FIS 07/01145) y por la Fundación MM de Madrid. El Dr.Norberto Santana Rodríguez (INT 07/172) y el Dr. Bernardino Clavo (INT 07/030) han estado bajo el Programa de Intensificación de la Investigación (I3SNS) del Instituto de Salud Carlos III. Este trabajo ha servido de base y continúa gracias a una beca del Instituto de Salud Carlos III: FIS PI 10/01485.
Agradecemos a D. Juan Verona y D. Ramón Saavedra su ayuda técnica.