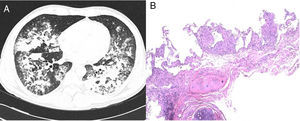
Se trata de un varón de 42 años, holandés, con 11 años de residencia en España. Fumador activo con un índice acumulado de 15 paquetes-años, sin otros hábitos tóxicos. No utiliza saunas ni jacuzzis. Diagnosticado de pitiriasis liquenoide, tratada con 7,5mg semanales de metotrexato durante los 5 años previos. Acudió al Servicio de Urgencias por fiebre de 38°C, mialgias, tos, expectoración mucosa y disnea de moderados esfuerzos de dos semanas de evolución. En el análisis inicial presentaba 11.190 leucocitos/mm3 (70% neutrófilos, 19% linfocitos, 9% monocitos), proteína C reactiva 11,2mg/dl y procalcitonina 0,56 ng/mL. La gasometría arterial con FiO2 0,24 mostró pH 7,48, PaCO2 37mmHg, PaO2 87mmHg y HCO3 27 mmol/l. En la radiografía de tórax se objetivaron consolidaciones bilaterales que afectaban campos medios e inferiores. Los antígenos en orina para Streptococcus pneumoniae y Legionella pneumophila serogrupo-1 resultaron negativos; así como el frotis nasofaríngeo para virus H1N1, la baciloscopia de esputo y la serología para el VIH. Con la orientación diagnóstica de neumonía adquirida en la comunidad Fine-III1 en paciente inmunodeprimido, se instauró antibioticoterapia empírica con ceftriaxona y levofloxacino y se solicitó ingreso en Neumología. Tras tres días de ingreso el paciente persistía con fiebre sin mejoría clínica por lo que se realizó una primera fibrobroncoscopia que mostró recuento celular de predominio mononuclear en el lavado broncoalveolar (LBA): 58% macrófagos, 60% linfocitos, 3% neutrófilos. Únicamente, se identificó adenovirus por reacción en cadena de la polimerasa (PCR), por lo que se añadió cidofovir al tratamiento. A la semana de hospitalización, por falta de mejoría clínica y radiológica, se solicitó una tomografía computarizada (TC) torácica que confirmó un patrón consolidativo en ambas bases (fig. 1A) por lo que se decidió realizar una segunda fibrobroncoscopia con biopsia transbronquial. Además, se determinaron anticuerpos antinucleares, anticitoplasma de los neutrófilos, factor reumatoide y enzima convertidora de la angiotensina, que resultaron negativos. Dos días más tarde, el paciente presentó empeoramiento clínico con progresión del patrón consolidativo y con altas necesidades de oxígeno (PaO2/FiO2:97mmHg) por lo que se trasladó a la Unidad de Cuidados Intensivos para monitorización y administración de oxigenoterapia de alto flujo. El cultivo convencional, tanto del aspirado bronquial como del LBA, mostró crecimiento de flora saprófita, con baciloscopia, galactomanano y estudio de virus y parásitos negativos. En la citología del LBA persistía un recuento celular de predominio mononuclear. En la biopsia transbronquial se observaron granulomas no necrotizantes (fig. 1B). Ante la sospecha de micobacteriosis, sin poder excluir otras etiologías como sarcoidosis o neumonitis por metotrexato, se inició tratamiento antituberculoso convencional y metilprednisolona (1mg/kg/día). Se solicitó detección de Mycobacterium tuberculosis por PCR (MTBC-Real Cycler, Progenie Molecular) en el LBA y la biopsia que resultaron negativas. Una vez descartada la tuberculosis, se decidió realizar PCR para micobacterias no tuberculosas (MNT) (INNO-LIPA Mycobacteria v2, Innogenetics) sobre el primer LBA que identificó Mycobacterium intracellulare (M. intracellulare) y Mycobacterium simiae (M. simiae). Se reajustó el tratamiento a rifampicina, etambutol, azitromicina y moxifloxacino y se inició el descenso rápido de los corticoides. Se objetivó mejoría clínica y radiológica, con saturaciones del 94% respirando aire ambiente al alta. No se obtuvo la confirmación microbiológica en los cultivos para micobacterias en ninguna de las muestras respiratorias que se analizaron. El paciente completó el tratamiento durante un año, manteniéndose asintomático con práctica resolución de las alteraciones radiológicas.
La incidencia y la prevalencia de enfermedad pulmonar por MNT están aumentando en todo el mundo. Afectan tanto a individuos inmunodeprimidos como inmunocompetentes2, en nuestro caso, a un paciente en tratamiento crónico con metotrexato.
En relación con las micobacterias identificadas, M. simiae se asocia raramente a enfermedad pulmonar, lo que sugiere que su aislamiento se debe a contaminación ambiental3. De hecho, se han comunicado pseudobrotes en el laboratorio por agua caliente sanitaria4. La mayoría de los casos han sido descritos en el sur de Estados Unidos, Cuba e Israel3–5. Los pacientes afectados son principalmente inmunocompetentes de edad avanzada, con enfermedad pulmonar subyacente, pero también puede producir infección diseminada en pacientes con infección por VIH avanzada (sida)6. El tratamiento es complicado por la falta de correlación de la sensibilidad in vitro con la respuesta in vivo; pero debe incluir claritromicina asociada a otros antimicrobianos, como fluoroquinolonas y cotrimoxazol3,6. M. intracellulare, por su parte, se incluye dentro del grupo Mycobacterium avium (M. avium) complex. Dicha especie, a diferencia del M. avium, se aísla más frecuentemente en pacientes no infectados por el VIH y se presenta con dos patrones radiológicos principales: fibrocavitario y bronquiectasias nodulares3. Se han comunicado casos en Estados Unidos, Japón, Europa y Sudáfrica7. Es resistente al cloro y sobrevive a temperaturas elevadas, por lo que se asocia a brotes en jacuzzis8. El tratamiento debe incluir un macrólido, rifampicina, etambutol y, si existen lesiones cavitarias o diseminadas, un aminoglicósido inyectable durante la fase de inducción3.
Respecto al metotrexato, es un fármaco, que posee actividad antiproliferativa e inmunosupresora, que se encuentra dentro de las opciones terapéuticas de la pitiriasis liquenoide9. Su uso crónico puede causar una alteración en la inmunidad que favorece infecciones oportunistas10–12.
Este caso sería el primero en la bibliografía en describir una micobacteriosis por M. simiae y M intracellulare durante el tratamiento crónico con metotrexato. Nuestro paciente cumplía los criterios ATS/IDSA3 para el diagnóstico de enfermedad pulmonar por MNT, dada la presencia de lesiones granulomatosas en la biopsia y su identificación por técnicas de biología molecular. Además, el paciente mejoró clínica y radiológicamente con el tratamiento dirigido para ambas. Sin embargo, el papel patógeno del M. simiae sería cuestionable ya que estudios previos han sugerido que únicamente un 20% de los aislamientos en muestras respiratorias son relevantes clínicamente13. Desconocemos el impacto que pudo tener el tratamiento inicial, que incluía levofloxacino, sobre la ausencia de crecimiento de M. simiae y M. intracellulare en los cultivos de micobacterias, sin embargo, objetivamente, las técnicas de biología molecular resultaron más sensibles para el diagnóstico.
En conclusión, las infecciones por MNT deben considerarse en el diagnóstico diferencial de la neumonía en pacientes en tratamiento inmunodepresor.
A la Dra. Lara Pijuan del Servicio de Anatomía Patológica del Hospital del Mar y a la Dra. Ana C. Siverio Parés del Servicio de Microbiología del Laboratorio de Referencia de Cataluña.