Introducción
Además de su importante relevancia sociosanitaria, condicionada por su elevada prevalencia y por el coste sanitario que ocasiona, la trascendencia clínica de la enfermedad pulmonar obstructiva crónica (EPOC) viene determinada, sobre todo, por la incapacidad que origina en el paciente y por su carácter progresivo. Este último, que está incluido en la propia definición de la entidad1, encaja con el clásico esquema de deterioro progresivo de la función pulmonar relacionado con la edad, que lleva a la incapacidad y puede originar el fallecimiento2. Este deterioro es más acusado en los pacientes con EPOC que en personas sanas o fumadores sin limitación al flujo aéreo (fumadores "no susceptibles").
Desde este punto de vista, cada vez resulta más importante definir cómo evaluar la progresión de la EPOC y establecer intervenciones dirigidas a enlentecerla. Un grupo de trabajo de la European Respiratory Society3 reunido hace algunos años estableció como parámetros para valorar la progresión de la enfermedad: el declinar anual del volumen espiratorio forzado en el primer segundo (FEV1); la pérdida de densidad de atenuación del parénquima pulmonar, medido mediante tomografía computarizada; el deterioro progresivo de la capacidad de ejercicio; la pérdida de calidad de vida relacionada con la salud, y la creciente utilización de los servicios de salud, así como el coste ocasionado. Por la información generada en los últimos años, parece evidente la necesidad de incorporar otros parámetros de evaluación. Entre ellos destacan especialmente las exacerbaciones, puesto que contribuyen al deterioro funcional y a la propia progresión de la enfermedad4.
De todos los indicadores de progresión de la enfermedad, sobresalen especialmente el declinar anual del FEV1 y el número de exacerbaciones. Quizá sean las variables más sencillas y uniformes, además de presentar una estrecha relación con un objetivo principal de máxima relevancia, como es la mortalidad. A modo de ejemplo, después de un seguimiento de 22 años, la cohorte de 5.542 adultos de la primera Nacional Health and Nutrition Examination Survey (NHANES I) muestra supervivencias claramente diferentes entre pacientes con EPOC leve, moderada o grave5. Por otra parte, la cohorte de 304 varones con EPOC de Soler-Cataluña et al6, seguida durante 5 años, demuestra que las curvas de supervivencia son diferentes en función del número de exacerbaciones al año. Por lo tanto, no es de extrañar que, al margen de la mortalidad, muchas intervenciones terapéuticas en la EPOC se hayan centrado en estos 2 objetivos como principales indicadores de progresión.
A continuación se revisarán de forma crítica la relevancia y el impacto de los datos disponibles en relación con el efecto de los fármacos sobre el declinar anual del FEV1 y sobre el desarrollo de exacerbaciones. También se pretende evaluar las limitaciones metodológicas más destacadas que puedan condicionar la interpretación de los ensayos clínicos desarrollados con estos objetivos.
Intervenciones en el deterioro anual del volumen espiratorio forzado en el primer segundo
Relevancia clínica
Muchos de los ensayos clínicos realizados en los últimos años han pretendido evaluar el efecto de los corticoides inhalados, de la asociación de corticoides inhalados con agonistas adrenérgicos β2 de larga duración y del bromuro de tiotropio en la progresión de la limitación al flujo aéreo en pacientes con EPOC.
Dado que los corticoides inhalados reducen la inflamación de la vía aérea, la limitación al flujo aéreo y los síntomas en pacientes con asma persistente, parecía necesario determinar su eficacia en la EPOC. Para ello, desde la década pasada se han llevado a cabo diversos ensayos clínicos. El Lung Health Study (LHS)7 evaluó a 1.116 pacientes con un FEV1 medio del 68% del valor predicho y fumadores activos en su mayoría (91%). Después de ser tratados con triamcinolona o placebo durante 40 meses, el deterioro del FEV1 resultó similar en los 2 grupos. No obstante, los pacientes que recibieron triamcinolona experimentaron una atenuación de la hiperrespuesta bronquial, así como de los síntomas respiratorios y del número de consultas médicas por problemas respiratorios. En el Copenhagen City Heart Study (CCHS)8, que incluyó a 290 pacientes evaluables con EPOC leve y sin reversibilidad bronquial, se comparó la budesonida inhalada con placebo durante 36 meses. No se detectaron diferencias en el deterioro anual del FEV1 entre la budesonida y el placebo (45,1 frente a 41,8 ml/año) ni en los síntomas respiratorios.
La comparación entre budesonida y placebo se repitió en el estudio EUROSCOP9, que evaluó su efecto a los 3 años en 1.277 fumadores activos, de 52 años de edad media, con EPOC leve-moderada y sin reversibilidad bronquial. El grupo tratado con budesonida experimentó un incremento del FEV1 equivalente a 17 ml/año en los primeros 6 meses. Sin embargo, a partir de los 9 meses alcanzó un ritmo de deterioro similar al del grupo placebo (57 frente a 65 ml/año). Al final de los 3 años de tratamiento, la pérdida global del FEV1 fue similar en el grupo tratado con budesonida y en el que recibió placebo: 140 ml (4,3%) frente a 180 ml (5,3%). En la misma línea, el estudio ISOLDE10 incluyó a 751 pacientes con EPOC moderada-grave y sin reversibilidad bronquial, un 36% de los cuales era fumador activo. Después de 36 meses de tratamiento aleatorizado con fluticasona o placebo, tampoco se detectó efecto alguno en el deterioro anual del FEV1.
Los resultados globales de los principales ensayos clínicos sobre la eficacia de los corticoides inhalados para disminuir el deterioro funcional de la EPOC se analizaron en 2 metaanálisis casi simultáneos. Sutherland et al11, tras seleccionar 8 ensayos clínicos de más de 2 años de duración, observaron que, con respecto al placebo, los corticoides reducen el descenso anual del FEV1 en 7,7 ml (intervalo de confianza [IC] del 95%, 1,3-14,2 ml/año). No obstante, el efecto positivo del metaanálisis viene condicionado principalmente por 2 ensayos clínicos de muy pocos pacientes. Además, se comprueba que el mayor beneficio de los corticoides inhalados se observa en los ensayos que utilizan las dosis más altas y que existe un probable sesgo de publicación a favor de los resultados positivos.
De hecho, el metaanálisis de Highland et al12, realizado el mismo año, proporciona un resultado diferente. Los autores seleccionan 6 ensayos clínicos de más de 2 años de duración, con una adecuada exclusión de asmáticos, en los que la variable principal fue el declinar anual del FEV1, con lo que incluyen a un total de 3.571 pacientes con EPOC, de los que 1.784 pertenecían al grupo de tratamiento. El análisis global identifica una diferencia media (± desviación estándar) en el deterioro del FEV1 de -5,0 ± 3,2 ml/año (IC del 95%, -11,2 a 1,2 ml/año) entre el grupo tratado con corticoides inhalados y el de placebo, por lo que los autores concluyen que los corticoides inhalados carecen de efecto en la función pulmonar a largo plazo.
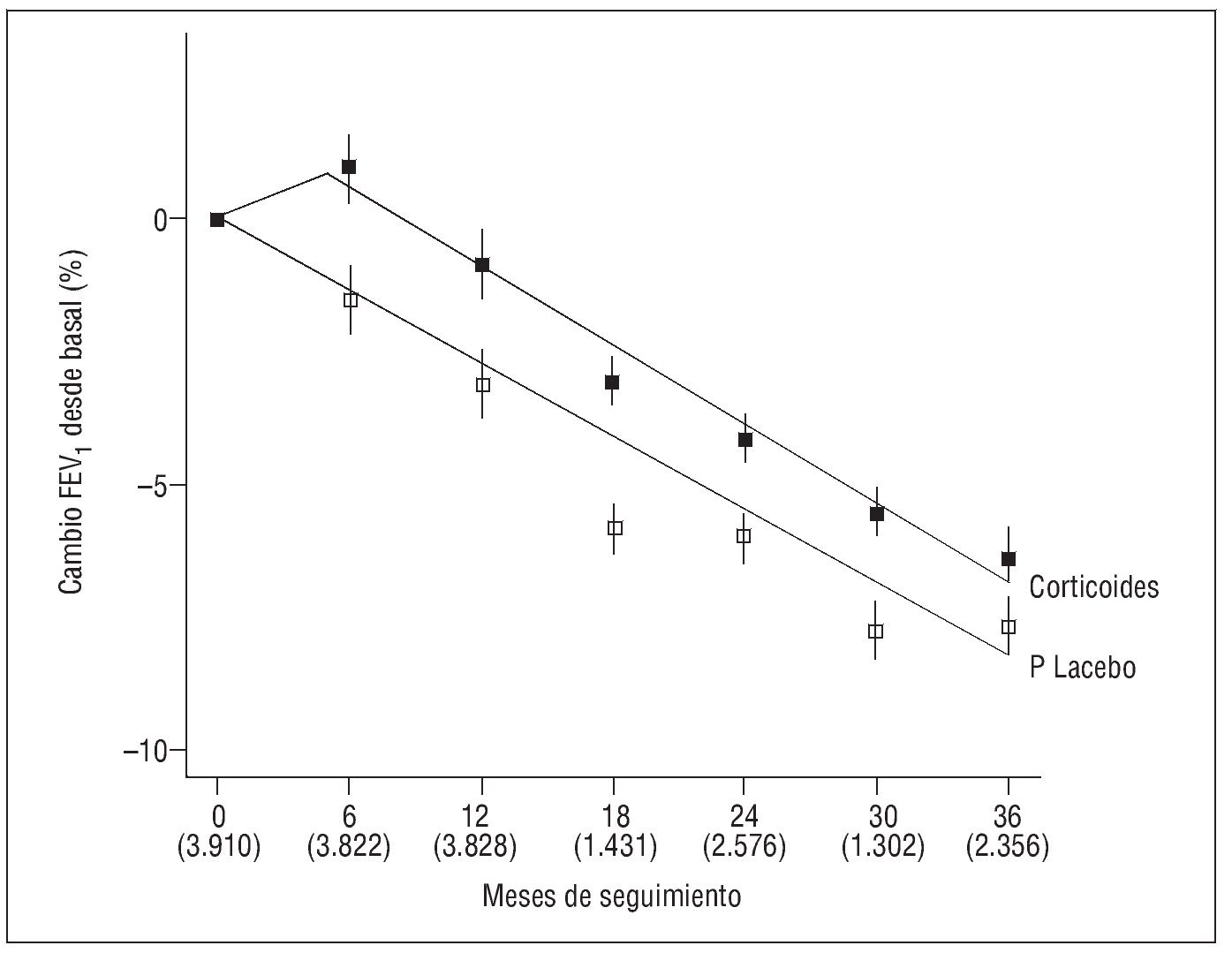
Una información más actual sobre el efecto de los corticoides inhalados en los pacientes con EPOC proviene del estudio de Soriano et al13, quienes, mediante una nueva modalidad de análisis, aglutinan los datos de los pacientes incluidos en los ensayos clínicos más importantes y los analizan conjuntamente. Fusionan las bases de datos de los ensayos LHS7, CCLS8, EUROSCOP9 e ISOLDE10, que comparaban corticoides inhalados frente a placebo, y de los 3 ensayos en que se evaluó la combinación de corticoides inhalados y agonistas adrenérgicos β2 de larga duración frente a placebo: TRISTAN14 (salmeterol-fluticasona), Szafranzki et al15 y Calverley et al16 (formoterol-budesonida en ambos). Sobre un total de 3.911 pacientes aleatorizados, demuestran que en los 6 primeros meses se produce un incremento significativo del FEV1 del 2,4% en el grupo tratado con corticoides inhalados, lo que supone un aumento de 42 ml en varones y de 29 ml en mujeres. Sin embargo, en el período de 6-36 meses restantes, no detectan diferencias significativas entre corticoides inhalados y placebo (fig. 1)13. Un análisis de subgrupos demuestra que el transitorio incremento inicial del FEV1 resulta más acusado en ex fumadores y en mujeres, aunque a partir de los 6 meses experimentan un descenso similar a los restantes grupos. Esta mayor respuesta en mujeres ex fumadoras, que ya se había apuntado anteriormente, podría justificarse por la existencia de una mayor susceptibilidad de las mujeres al tabaco, de modo que al abandonarlo deja de empeorar la función pulmonar, así como por una relación más estrecha entre la hiperrespuesta bronquial y el declinar del FEV1, que se ve atenuada por los corticoides13.
Fig. 1. Descenso progresivo del volumen espiratorio forzado en el primer segundo (FEV1) en pacientes con enfermedad pulmonar obstructiva crónica tratados con corticoides inhalados o con placebo. El eje horizontal representa meses, con el número de pacientes en cada visita entre paréntesis. (Modificada de Soriano et al13.)
En los últimos meses se han publicado algunos ensayos clínicos que, obviamente, no han podido incluirse en estos análisis globales de eficacia. De todos ellos, el más destacado es el estudio TORCH17, que aleatorizó a 6.112 pacientes con EPOC en 4 grupos de tratamiento (placebo, salmeterol, fluticasona y salmeterol + fluticasona) durante 3 años. Aunque el objetivo principal de este ensayo es el efecto del tratamiento sobre la mortalidad de la EPOC, contempla otros objetivos secundarios, entre los que se encuentra la pérdida de función pulmonar. Refiere que el deterioro medio ajustado del FEV1 en los 3 años de seguimiento fue menor en los 3 grupos de tratamiento que en el grupo placebo, aunque la diferencia neta entre el grupo de tratamiento combinado y el placebo también resultó muy discreta (9,2 ml; IC del 95%, 7,5-10,8 ml)17.
Puesto que el deterioro funcional de la EPOC viene condicionado por la limitación al flujo espiratorio y el desarrollo de atrapamiento aéreo e hiperinsuflación dinámica y estática, y que el bromuro de tiotropio ha demostrado su eficacia para disminuir estas alteraciones, diversos ensayos clínicos han tratado de evaluar su capacidad para evitar el deterioro anual del FEV1. Sus resultados más relevantes se resumen en un reciente metaanálisis18 que seleccionó ensayos clínicos, de al menos 12 semanas de duración, en que se comparó bromuro de tiotropio con placebo, bromuro de ipratropio o salmeterol. Se incluyeron 9 ensayos clínicos, con un total de 8.002 pacientes aleatorizados, aunque sólo 2 de ellos tenían una duración de al menos un año. En ausencia de datos comparativos con salmeterol, se comprobó que el bromuro de tiotropio induce un deterioro más lento del FEV1 valle que el bromuro de ipratropio o que el placebo (30 ml/año; IC del 95%, 7-53 ml/año)18.
Este efecto beneficioso del tiotropio en el declinar anual del FEV1, que resulta más intenso que el descrito para los corticoides inhalados, es concordante con un análisis post hoc de uno de los ensayos clínicos de un año de duración. En él se comprueba que la tasa de declinar del FEV1 valle en el grupo tratado con placebo fue de 58 ml/año, mientras que en el grupo que recibió tiotropio resultó ser de 12 ml/año19. Esta diferencia, que alcanzó significación estadística, parece indicar que el tiotropio podría enlentecer el deterioro anual del FEV1 y constituye la base para el ensayo clínico UPLIFT20, que, como se describe en otro artículo de este suplemento, pretende analizar el efecto del bromuro de tiotropio en el declinar anual del FEV1 en un elevado número de pacientes con EPOC seguidos durante 4 años.
En definitiva, el efecto de los corticoides inhalados en el declinar anual del FEV1 en pacientes con EPOC parece poco relevante y escasamente predecible21. Quizá la única excepción podría ser el mayor beneficio registrado a corto plazo en mujeres ex fumadoras. En cuanto al bromuro de tiotropio, habrá que esperar a los resultados del estudio UPLIFT para ver si se confirman las expectativas creadas con los ensayos clínicos de un año de seguimiento.
Limitaciones metodológicas
Hasta el momento, diversos problemas metodológicos limitan la relevancia clínica de los resultados de los ensayos clínicos en eficacia de intervenciones terapéuticas para el control de la pérdida de función pulmonar en la EPOC.
Uno de ellos es la elevada variabilidad del deterioro anual del FEV1, que resulta muy alta en la mayoría de los ensayos clínicos. Por ejemplo, la desviación estándar del descenso del FEV1 oscila entre los 58 ml/año del LHS7 y los 75 ml/año del estudio ISOLDE10, hasta alcanzar los 100 ml/año en el estudio EUROSCOP9. En muchas ocasiones, la desviación estándar descrita resulta superior a la media del declinar anual del FEV1. Esta considerable variabilidad de la variable principal de evaluación requiere la inclusión de un elevado número de pacientes. Así, si se tiene en cuenta que una reducción de 20 ml/año en el deterioro anual del FEV1 podría considerarse clínicamente relevante, una estimación del tamaño muestral con una potencia del 80% y un nivel de significación del 5% exigiría que entre 200 y 800 pacientes completasen el estudio en cada grupo de tratamiento3. Como ya se ha comentado, no todos los ensayos clínicos realizados hasta la fecha alcanzan dicho tamaño muestral. Lo óptimo, considerando las desviaciones estándar obtenidas, sería que los ensayos clínicos sobre intervención en el declinar del FEV1 se desarrollasen con un mínimo de 3 años de seguimiento y al menos 4 determinaciones espirométricas por año22. También son importantes otros esfuerzos encaminados a reducir la variabilidad de los parámetros espirométricos, como limitar el número de centros participantes, el entrenamiento previo de los técnicos que participen en el ensayo, utilizar los mismos espirómetros, efectuar las determinaciones en el mismo horario para evitar la variabilidad diurna y llevar a cabo las espirometrías después de la administración de una dosis estandarizada de broncodilatadores.
Los límites de exactitud y precisión en la medida del FEV1 también pueden plantear problemas en la interpretación de los resultados. A modo de ejemplo, si se asume un valor medio del FEV1 de 1,60 l y una exactitud del 5%, el volumen mínimo que puede medirse sería 80 ml. En la mayoría de los ensayos clínicos realizados sobre este aspecto el declinar anual del FEV1 obtenido resulta inferior al mínimo volumen medible con exactitud. Como muestra, el estudio ISOLDE describe que, en pacientes con un FEV1 de 1,42 ± 0,47 l, el grupo tratado con corticoides inhalados experimenta un descenso anual del FEV1 de 50 ml/año, que resulta menor que el límite de exactitud alcanzado en la medida del FEV1 (71 ml)10. Para obviar dicho problema y lograr que el declinar anual del FEV1 supere los límites de exactitud y precisión, resultaría recomendable que los ensayos clínicos tuvieran un mínimo de 2 años de seguimiento3. No obstante, esto conllevará una elevada tasa de abandonos.
Y precisamente el elevado número de abandonos es otro aspecto limitante que requiere un control específico. Dado que los pacientes que evolucionan peor tienen más riesgo de abandonar prematuramente los ensayos clínicos, sobre todo cuando se les asigna al grupo de placebo, los análisis sobre pacientes que completaron el estudio pueden aportar resultados diferentes de los análisis realizados en pacientes aleatorizados (análisis por intención de tratar). En los ensayos clínicos sobre progresión de la EPOC también parece seguirse el esquema anterior, que origina la existencia de más abandonos en el grupo de placebo que en el de tratamiento. En una revisión de los principales ensayos clínicos de más de un año de duración sobre este tema, Decramer et al3 obtienen una tasa media de abandonos del 27% en el grupo de fármaco activo y del 37% en el grupo placebo. Por lo tanto, sería importante analizar también la situación de los pacientes que abandonan el estudio y no perder su seguimiento. Además, teniendo en cuenta esta elevada tasa de abandonos, el cálculo del tamaño muestral realizado en función de la variabilidad del FEV1 exigiría la inclusión de al menos 1.000-1.500 pacientes3, cifra que no alcanza la mayoría de los ensayos clínicos realizados hasta el momento.
Por último, aun sin cuestionar la importancia del FEV1, podría ser útil disponer de otras medidas de función pulmonar que permitan conocer la progresión de la enfermedad en relación con la pérdida de retracción elástica, el grado de hiperinsuflación o el deterioro del intercambio gaseoso. De hecho, alguna de ellas, como el grado de hiperinsuflación, ha demostrado tener una elevada capacidad pronóstica23. No obstante, se dispone de relativamente poca información sobre el deterioro anual de la capacidad vital lenta, de la capacidad inspiratoria y de la capacidad de difusión de monóxido de carbono.
Intervenciones sobre las exacerbaciones
Frente a la visión clásica, que contempla la progresión de la EPOC como un deterioro lineal y progresivo del FEV1, se ha desarrollado una visión alternativa, que propone un deterioro escalonado, en relación con el desarrollo de sucesivas exacerbaciones de la enfermedad.
Sin embargo, pese a que el declinar del FEV1 es mayor en pacientes con más exacerbaciones4, llama la atención que el efecto de diversos fármacos en ellas parece muy superior al logrado en el deterioro del FEV1.
Relevancia clínica
Durante las últimas décadas, la eficacia de los corticoides inhalados en la disminución de las agudizaciones de pacientes con EPOC se ha considerado el objetivo principal o secundario de diversos ensayos clínicos. En 2002 se publicó un metaanálisis de 9 ensayos clínicos con una duración mínima de 9 meses, en los que las exacerbaciones se consideraron objetivos secundarios24. El análisis global demostró que los corticoides inhalados disminuían la tasa de exacerbaciones en un sorprendente 30% (IC del 95%, 16-42%). Sin embargo, pronto se destacaron diversos aspectos que parecían condicionar la interpretación de estos resultados. En 4 de los ensayos clínicos analizados se realizó un tratamiento previo con corticoides sistémicos. Se emplearon diferentes definiciones de exacerbación, algunas muy poco contrastadas. En conjunto, los tamaños muestrales eran reducidos y el tiempo de seguimiento, escaso. Además, también se identificaron problemas en el análisis de los datos individuales de los distintos ensayos25. A modo de ejemplo, mientras que el LHS7 describió un valor de p de 0,07, que no se consideró significativo, en el metaanálisis se le asignó un valor de p de 0,005. De igual modo, el estudio ISOLDE describió una tasa media de exacerbaciones de 0,75 (IC del 95%, 0,6-1,0)10, mientras que en el metaanálisis se contabilizó como 0,67 (IC del 95%, 0,63-0,71).
No obstante, otra revisión sistemática posterior, que incluyó 10 ensayos clínicos y evitó los problemas metodológicos planteados, también mostró un efecto beneficioso de los corticoides inhalados, aunque de menor magnitud26. Con respecto al placebo, hubo un 22% de reducción del porcentaje de pacientes tratados con corticoides inhalados que experimentaron una o más exacerbaciones (riesgo relativo [RR] = 0,78; IC del 95%, 0,70-0,80), lo que supuso una reducción global del riesgo de exacerbación del 5% (IC del 95%, -8 a -3). Además, no se identificaron diferencias entre los distintos fármacos empleados (fluticasona, budesonida o beclometasona)26.
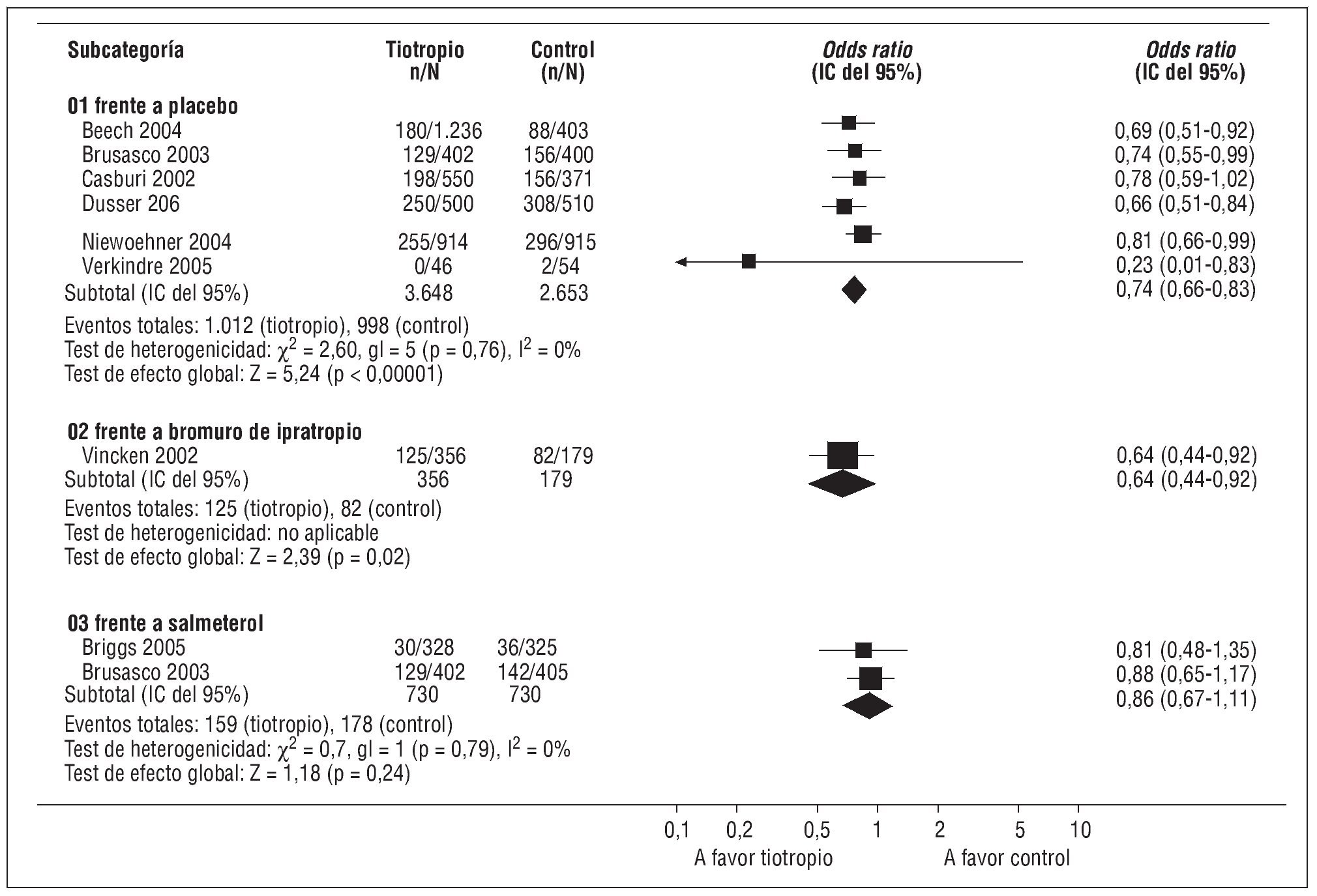
La eficacia del bromuro de tiotropio para disminuir las exacerbaciones de la EPOC también se ha analizado en diversos ensayos clínicos frente a placebo, bromuro de ipratropio o salmeterol27-30. Un metaanálisis reciente18 seleccionó 9 ensayos clínicos de más de 12 semanas de duración, en los que se analizó el efecto del bromuro de tiotropio en las exacerbaciones comparado con placebo, bromuro de ipratropio o agonistas adrenérgicos β2 de larga duración. Sobre exacerbaciones globales, demuestra que el bromuro de tiotropio tiene un efecto superior al placebo (odds ratio [OR] = 0,74; IC del 95%, 0,66-0,83) y al bromuro de ipratropio (OR = 0,64; IC del 95%, 0,44-0,92), pero similar al salmeterol (OR = 0,86; IC del 95%, 0,67-1,11) (fig. 2)18. Con respecto a las exacerbaciones graves que requieren hospitalización, el tiotropio también es superior al placebo (OR = 0,69; IC del 95%, 0,55-0,87), pero no alcanza la significación estadística con respecto al bromuro de ipratropio (OR = 0,59; IC del 95%, 0,32-1,09) ni al salmeterol (OR = 0,54; IC del 95%, 0,29-1,01)18.
Fig. 2. Resumen de los efectos globales del tiotropio sobre las exacerbaciones de la EPOC. gl: grados de libertad; IC: intervalo de confianza. (Modificada de Barr et al18.)
Tres ensayos clínicos muy recientes aportan información adicional a la obtenida en los metaanálisis referidos. En el estudio TORCH17 se demostró que, con respecto al placebo, el tratamiento con fluticasona logró reducir las exacerbaciones moderadas-graves (RR = 0,82; IC del 95%, 0,76-0,89) y las que requirieron corticoides sistémicos (RR = 0,65; IC del 95%, 0,71-0,98), pero no las exacerbaciones graves que precisaron hospitalización (RR = 0,88; IC del 95%, 0,74-1,03). El tratamiento combinado con salmeterol y fluticasona sí resultó superior a placebo en la reducción de las exacerbaciones moderadas-graves (RR = 0,75; IC del 95%, 0,69-0,81), de las que requirieron corticoides sistémicos (RR = 0,57; IC del 95%, 0,51-0,64) y de las que precisaron hospitalización (RR = 0,83; IC del 95%, 0,71-0,98). Sin embargo, en exacerbaciones graves que requirieron hospitalización no se detectaron diferencias entre el tratamiento combinado y la monoterapia con salmeterol (RR = 1,02; IC del 95%, 0,87-1,20) o con fluticasona (RR = 0,95; IC del 95%, 0,82-1,12)17.
El estudio OPTIMAL31 es un ensayo clínico canadiense, en el que se aleatorizó a 449 pacientes en 3 grupos de tratamiento (tiotropio + placebo; tiotropio + salmeterol, y tiotropio + salmeterol + fluticasona), de un año de duración, para evaluar el desarrollo de exacerbaciones como objetivo principal. No se detectaron diferencias en la tasa de exacerbaciones anuales entre los 3 grupos ni en el tiempo transcurrido hasta la primera exacerbación. En definitiva, frente a la monoterapia con tiotropio no se evidenció una disminución significativa del riesgo de exacerbaciones por la adición del salmeterol (-2,0; IC del 95%, -12,8 a 8,8]) ni de la combinación salmeterol y fluticasona (2,8; IC del 95%, -8,2 a 13,8)31.
Por último, el INSPIRE32, un ensayo clínico de 2 años de seguimiento, comparó tiotropio frente a salmeterolfluticasona en 1.323 pacientes con EPOC, siendo el objetivo principal su efecto sobre la tasa de exacerbaciones. No se detectaron diferencias en la utilización de recursos sanitarios por agudizaciones de la EPOC entre ambos grupos de tratamiento. Con respecto al grupo de pacientes tratados con tiotropio, los que recibieron salmeterol-fluticasona presentaron menos riesgo de exacerbaciones que requirieron corticoides orales (0,81; IC del 95%, 0,67-0,99), pero más riesgo de exacerbaciones que precisaron antibióticos (1,19; IC del 95%, 1,02-1,38)32.
Limitaciones metodológicas
La interpretación de la información disponible sobre resultados de la intervención terapéutica en las exacerbaciones que presentan los pacientes con EPOC requiere la consideración de algunos aspectos metodológicos críticos, que pueden suponer un obstáculo para la generalización de sus conclusiones.
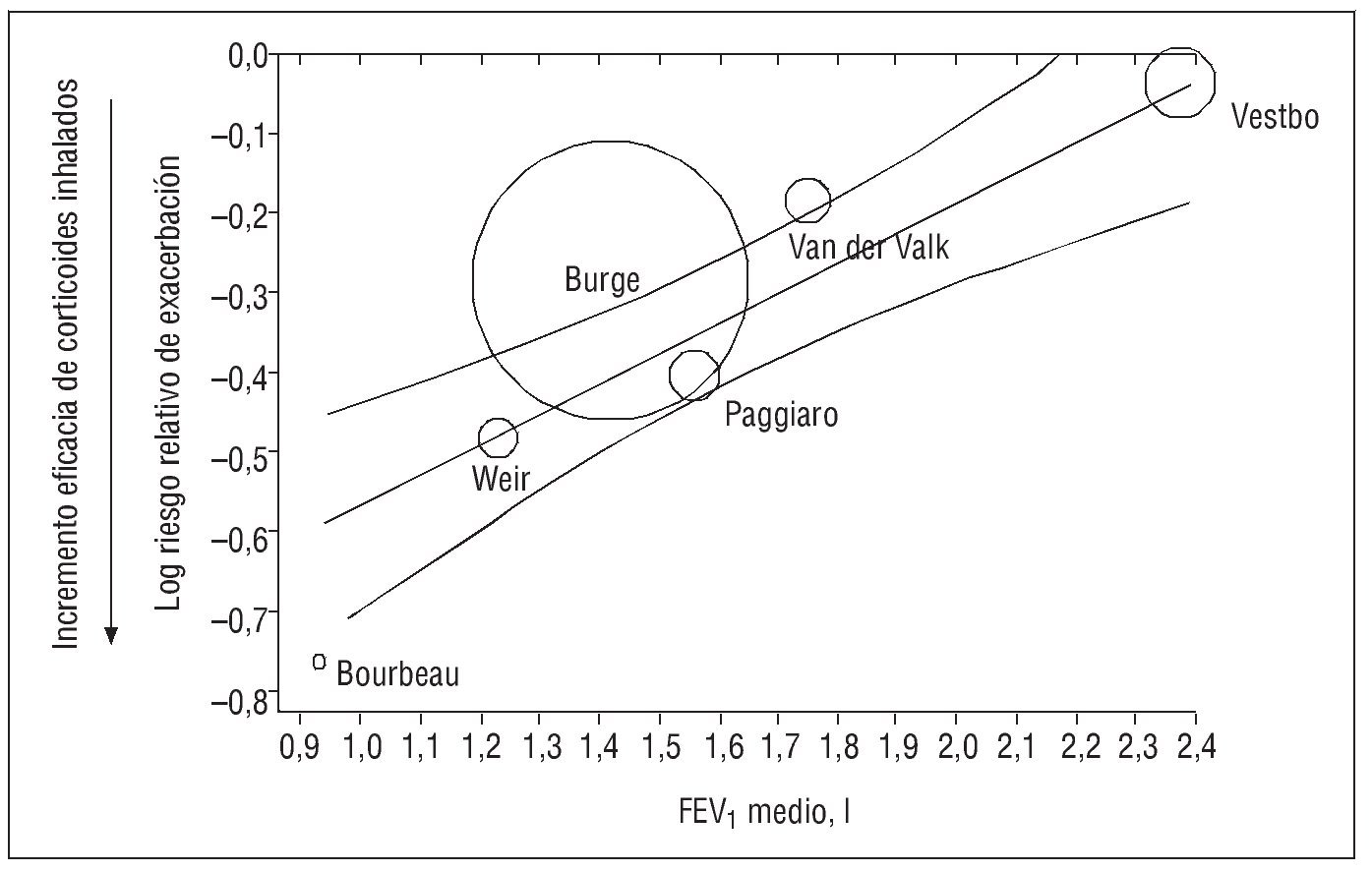
Dependencia de la situación basal. Sin et al33 demostraron que la mayor reducción del riesgo de exacerbaciones atribuible a los corticoides inhalados se produjo en los ensayos clínicos que seleccionaron a pacientes con un menor FEV1 basal (fig. 3)33. En ensayos clínicos individuales, también se obtienen datos similares. En un ensayo sobre el tiempo hasta la primera exacerbación tras la retirada de los corticoides inhalados, el resultado fue mucho más acusado entre los pacientes con un FEV1 menor del 50% del predicho (razón de riesgo [HR, de hazard ratio] = 2,1; IC del 95%, 1,1-3,6) que entre los que tenían un FEV1 superior al 50% del predicho (HR = 1,2; IC del 95%, 0,8-2,0)34. En un análisis secundario del estudio ISOLDE también se obtiene un mayor efecto de la fluticasona sobre la disminución de las exacerbaciones en los pacientes con mayor deterioro funcional35.
Fig. 3. Relación entre los valores basales del volumen espiratorio forzado en el primer segundo (FEV1) y el efecto de los corticoides inhalados sobre las exacerbaciones de la enfermedad pulmonar obstructiva crónica. (Modificada de Sin et al33.)
Efecto de la retirada de la medicación previa. Se ha analizado particularmente en el caso de los corticoides inhalados, aunque es posible que también sea aplicable a los ensayos con tiotropio en que se retira el fármaco o se sustituye por bromuro de ipratropio. En los ensayos clínicos en que se aleatoriza a pacientes con EPOC a un grupo de tratamiento con corticoides inhalados frente a otro de placebo, se producen 2 situaciones diferenciadas: entre los pacientes que no recibían previamente corticoides, algunos continuarán con su medicación habitual y otros recibirán estos fármacos; por el contrario, entre los que utilizaban con anterioridad corticoides inhalados, algunos seguirán haciéndolo, mientras que otros dejarán de tomarlos. Esto supone que en el grupo de placebo se incluirá a un subgrupo de pacientes en los que, además de no utilizar el fármaco activo, se inducirá un proceso de supresión esteroidea. Este subgrupo, que puede tener una contribución negativa en los resultados del grupo placebo, es relativamente numeroso en algunos ensayos. Por ejemplo, en el estudio TRISTAN un 52% de los pacientes del grupo placebo utilizaban previamente corticoides inhalados14, un 51% en el estudio TORCH17, un 57% en el estudio ISOLDE10 y un 77% en el estudio OPTIMAL31. En algunos casos este efecto todavía puede verse potenciado por la realización de un ciclo de corticoides sistémicos durante la fase de lavado del ensayo, como en el estudio INSPIRE32.
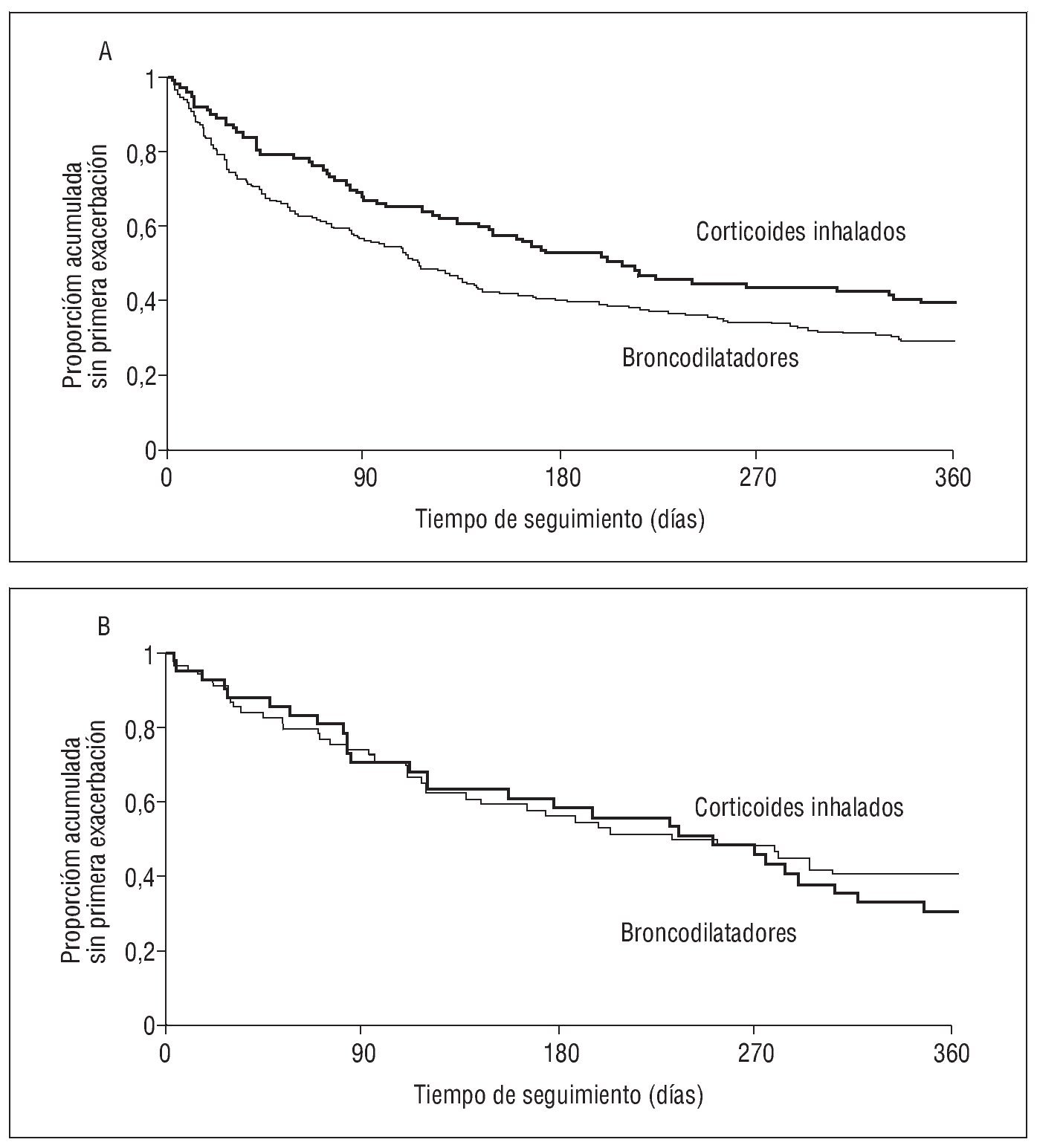
Muy recientemente Suissa et al36 han realizado, mediante un análisis de los datos del estudio OPTIMAL, una evaluación directa del efecto que podría tener la supresión esteroidea en algunos pacientes del grupo placebo. Para ello, tras reagrupar a los pacientes de dicho ensayo en un grupo de broncodilatadores (tiotropio + placebo y tiotropio + salmeterol) y otro de corticoides inhalados (tiotropio + salmeterol + fluticasona), analizaron la proporción de pacientes sin exacerbaciones tanto entre los que antes utilizaban corticoides inhalados como entre los que no lo hacían36. Al analizar ambos grupos por separado, quienes no habían recibido tratamiento previo con corticoides inhalados no mostraron un efecto beneficioso por su prescripción (HR = 1,11; IC del 95%, 0,69-1,79), mientras que sí se observó en los pacientes que antes de su inclusión en el estudio utilizaban corticoides inhalados (HR = 0,71; IC del 95%, 0,53-1,79) (fig. 4)36. Por tanto, parece que la diferencia observada entre los 2 grupos de fármacos se debe más al perjuicio ocasionado por la retirada de los corticoides que al beneficio originado por su prescripción.
Fig. 4. Curvas de Kaplan-Meier del tiempo hasta la primera exacerbación comparando los pacientes aleatorizados a recibir corticoides inhalados o broncodilatadores entre aquéllos con enfermedad pulmonar obstructiva crónica que previamente utilizaban corticoides inhalados (A) y los que no los habían consumido (B). (Modificada de Suissa et al36.)
En definitiva, los ensayos clínicos que incluyen a un mayor porcentaje de usuarios de corticoides inhalados antes de la aleatorización identifican un mayor beneficio de estos fármacos. Se estima que, por cada incremento del 25% en el uso previo de corticoides inhalados, la tasa de respuesta a estos fármacos mejorará en un 8%36.
Definición de exacerbación. La considerable disparidad en las definiciones de exacerbación de EPOC utilizadas en los ensayos clínicos se pone de manifiesto en una reciente revisión que incluye 22 ensayos clínicos sobre el tema (7 con agonistas adrenérgicos β2 de acción prolongada, 7 con tiotropio y 8 con alguna combinación de agonistas adrenérgicos β2 de acción prolongada y corticoides sistémicos)37. En 17 de los 22 ensayos, la definición de exacerbación se basaba en la realización de una intervención, que podía ser la prescripción de antibióticos o corticoides sistémicos o la hospitalización (11 ensayos), o bien el aumento de la medicación de rescate sobre su media diaria (6 ensayos). En otros 4 ensayos clínicos la definición de exacerbación de la EPOC se basó en síntomas (episodios de incremento de los síntomas basales de al menos 3 días de duración). Por último, en el restante ensayo la definición de exacerbación consideró simultáneamente los criterios de síntomas e intervención37. Sea cual sea el criterio empleado, las definiciones más estrictas plantean el problema de perder las exacerbaciones leves. Además, no siempre mantienen una deseable concordancia con los datos etiológicos y microbiológicos de las exacerbaciones, que, en su mayoría, provienen de estudios que utilizaron otras definiciones.
Además de la propia definición, también es importante considerar la calidad del recuento de las exacerbaciones. Ninguno de los 22 ensayos clínicos incluidos en la revisión mencionada estableció criterios de independencia de las exacerbaciones, esto es, el tiempo mínimo exigible de estabilidad clínica entre una exacerbación y la siguiente, para considerarlas 2 episodios diferenciados37.
Tampoco se realizó un control de la adjudicación de las exacerbaciones por parte de un comité externo que verificase la corrección en su definición. Aaron et al37 analizaron el impacto que podría tener la verificación de la adjudicación de las exacerbaciones sobre el resultado de una intervención. Para ello utilizaron los datos del estudio OPTIMAL, que sí tenía un comité de asignación de exacerbaciones, y comprobaron que, de las 288 exacerbaciones declaradas en el grupo que recibió tiotropio y placebo, y de las 250 del grupo tratado con tiotropio, salmeterol y fluticasona, se descartaron 66 y 62 episodios, respectivamente. Esto supone que la tasa media ajustada de exacerbaciones por paciente y año pasó de 2,09 a 1,61 en el primer grupo y de 1,82 a 1,37 en el segundo, por lo que la reducción del RR de exacerbaciones al recibir corticoides inhalados pasaría del 13 al 15%37.
Contabilización de las exacerbaciones. La forma de analizar el impacto de un tratamiento sobre las exacerbaciones también resulta variable. Nueve de los 22 ensayos clínicos revisados contabilizan el porcentaje de pacientes que presentan una exacerbación, 7 la media de exacerbaciones por paciente y año, y los 6 restantes consideran ambos indicadores37. Esto también puede dar lugar a errores. En cualquier caso, parece aceptarse que la tasa de exacerbaciones por paciente y año es un indicador más robusto y coherente, por lo que debería ser la variable principal, mientras que la proporción de pacientes que experimentan al menos una exacerbación durante el tiempo de seguimiento o el tiempo hasta la primera exacerbación deberían considerarse variables secundarias38.
En este sentido, es interesante considerar que, más que el tiempo hasta la primera exacerbación, sería importante conocer el patrón y comportamiento de las exacerbaciones siguientes. Este aspecto también se ha contemplado en un subanálisis de datos del estudio OPTIMAL36. En el subgrupo de pacientes que presentaron al menos una exacerbación, se analizó el tiempo desde el fin de la primera exacerbación hasta el inicio de la segunda, y no se detectaron diferencias inducidas por la medicación36.
Análisis estadístico. Hay 2 enfoques posibles para determinar la tasa de exacerbaciones por paciente y año. Uno es la estimación no ponderada, que se calcula a partir de la media de la tasa individual de cada paciente o del número de eventos en cada grupo. Frente a ello, la tasa de exacerbaciones ponderada ajusta cada tasa individual en función del tiempo de seguimiento y elimina el sesgo que podría ocasionar que se produjera una exacerbación en un paciente con un tiempo de seguimiento muy breve, por ejemplo, un día38.
Suissa25 analizó el impacto que podrían tener las diferentes formas de cálculo de las tasas de exacerbación por paciente y año sobre una cohorte de pacientes con EPOC. Mediante un sistema de asignación automática, comparó 2 grupos homogéneos de 1.137 pacientes cada uno, representativos del tratamiento activo y del control con placebo. El RR de exacerbaciones con el tratamiento fue de 0,75 con el enfoque ponderado, frente a 0,57 y 0,63 con los 2 enfoques no ponderados25. Se demuestra, por lo tanto, que el enfoque no ponderado tiende a exagerar el beneficio del tratamiento. Esta diferencia viene condicionada, sobre todo, por los tiempos de seguimiento de los pacientes, que nunca son exactamente iguales en los 2 grupos debido a las diferentes tasas de abandono. Por ejemplo, en el estudio ISOLDE un 43% de los pacientes del grupo de corticoides y un 53% del grupo control no completaron los 3 años de seguimiento, y más de un 20% fueron evaluados durante menos de un año. Los enfoques ponderados y no ponderados sólo proporcionarían las mismas tasas de exacerbación cuando el tiempo de seguimiento sea igual en todos los pacientes.
De los 13 ensayos clínicos recogidos en la revisión de Aaron et al37 que analizaron el impacto del tratamiento sobre la tasa de exacerbaciones por paciente y año, 9 analizaron las tasas no ponderadas y en sólo 4 de ellos se estimaron las tasas de exacerbaciones ponderadas.
En el análisis de la tasa ponderada existen, a su vez, 2 posibles enfoques estadísticos para determinar el IC y estimar su significación: la distribución de Poisson y la variabilidad extra-Poisson25. La primera asume que las exacerbaciones se producen de forma aleatoria, pero que los pacientes son homogéneos para su tasa de exacerbaciones. La comparación se establece por el modelo de regresión de Poisson, que requiere la conversión logarítmica de la variable dependiente (logaritmo de la tasa de exacerbaciones) y, para controlar las diferentes duraciones del seguimiento, también utiliza el logaritmo del tiempo de seguimiento. El problema de los análisis basados en la distribución de Poisson radica en que los pacientes con EPOC no son homogéneos para su tasa de exacerbaciones38. Frente a ello, el análisis de variabilidad extra-Poisson pretende controlar la heterogeneidad de los pacientes. Para los cálculos suma 2 componentes de la varianza: la variabilidad intrapaciente, por el modelo estándar anterior, y la variabilidad entre pacientes, estimada y cuantificada mediante un parámetro de sobredispersión como una medida de la desviación estándar de las diferencias adicionales en las tasas de exacerbación entre pacientes38.
En el mismo modelo de Suissa25 antes comentado, también se puede apreciar la importancia del control de la heterogeneidad entre sujetos para la tasa de exacerbaciones. Para un mismo efecto de la intervención (0,79), el valor de significación puede resultar muy elevado cuando no se controla la variabilidad entre sujetos (p = 0,0007), o irrelevante cuando se controla (p = 0,12)25. Este error resulta especialmente importante cuando las tasas de exacerbación son elevadas y hay más disparidad entre los pacientes. Por el contrario, en estudios con tasas de exacerbación muy bajas resultan menos importantes.
Sólo 2 de los 22 ensayos clínicos recogidos en la revisión de Aaron et al37 utilizaron el enfoque estadístico que controla la variabilidad entre sujetos, y son precisamente los que no hallan diferencias significativas inducidas por la intervención15,16.
Con respecto a los recientes ensayos clínicos TORCH17, OPTIMAL31 e INSPIRE32, cabe mencionar que en todos ellos se realiza un análisis ponderado con corrección de la variabilidad entre sujetos, pero que sólo el OPTIMAL cuenta con una comisión específica para la adjudicación de las exacerbaciones.
Tratamiento de los abandonos prematuros. Ya se ha mencionado la importancia de realizar análisis por intención de tratar, no por pacientes que finalizan el ensayo en cada grupo de tratamiento, pues en general se acepta que los pacientes mal controlados pueden abandonar el ensayo y esto modificaría los resultados. El estudio OPTIMAL31 proporciona una excelente oportunidad para evaluar este efecto, puesto que realizó un seguimiento de los pacientes que abandonaron la medicación activa hasta la finalización del período de observación del ensayo. De hecho, cuando se comparó el RR de exacerbaciones del grupo tratado con corticoides inhalados frente a broncodilatadores hasta la salida del estudio, se apreció un efecto favorable a los corticoides (0,78; IC del 95%, 0,61-0,99). Sin embargo, cuando se analizó el período total de observación del ensayo incluyendo a los pacientes que abandonaron el tratamiento activo, este efecto desapareció (0,83; IC del 95%, 0,66-1,04)36. Las discrepancias obtenidas entre el análisis por intención de tratar (con seguimiento de los abandonos) y el análisis con retiradas por abandono de la medicación son más acusadas cuando se comparan las tasas ponderadas de exacerbación por paciente y año sin corrección por la variabilidad entre sujetos o cuando se comparan los porcentajes de pacientes con una o más exacerbaciones37.
Identificación de sinergias. Cuando se emplean diseños que contemplan placebo, fármacos aislados y la combinación de ambos, como es el caso de los estudios OPTIMAL y TORCH, sería conveniente tratar de identificar si hay alguna sinergia entre la combinación o la monoterapia. La aplicación de un modelo de análisis factorial permitiría evaluar por separado el efecto de cada fármaco y diferenciar si existe algún indicio de potenciación entre ellos.
Conclusiones
Dado el carácter progresivo de la EPOC, resulta cada vez más importante concebir intervenciones terapéuticas dirigidas a frenar su progresión. Sin embargo, el diseño de ensayos clínicos para evaluar dichos tratamientos requiere una detenida consideración de diversos aspectos metodológicos que pueden inducir sesgos o errores de interpretación, que limitarían la extrapolación de sus resultados a la práctica clínica convencional. En concreto, los datos actuales muestran que tanto los corticoides inhalados como el bromuro de tiotropio son eficaces para disminuir las exacerbaciones de la enfermedad, aunque todavía parece aconsejable precisar la magnitud del efecto obtenido. En cuanto a la intervención sobre el deterioro de la función pulmonar, se precisa más información de elevada y contrastada calidad.
Declaración de conflicto de intereses
El autor ha declarado no tener ningún conflicto de intereses.
Correspondencia:
Dr. F. García Río.
Servicio de Neumología. Hospital Universitario La Paz. Paseo de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: fgr01m@gmail.com