Introducción
La primera normativa mundial sobre la enfermedad pulmonar obstructiva crónica (EPOC), la Global Initiative for Obstructive Lung Disease (GOLD), supuso un punto de inflexión en la atención dispensada a esta enfermedad1. Esta primera iniciativa señaló diferentes objetivos estratégicos. Uno de los más destacados, sino el principal, fue tratar de reducir la mortalidad. Desde entonces se han hecho diversos progresos, aunque ciertamente el escenario general sigue siendo preocupante. En la actualidad la EPOC produce cerca de 18.000 muertes al año en España, con una tasa anual de mortalidad de 60 por cada 100.000 habitantes entre los varones y 17 por cada 100.000 habitantes entre las mujeres2. Estas cifras colocan a la enfermedad como la quinta causa de muerte en los registros españoles y la cuarta en el mundo, únicamente por detrás de las enfermedades coronarias, las cerebrovasculares y las neoplasias, siendo la única enfermedad de este grupo que está aumentando en frecuencia3,4. Para 2020 se espera que la EPOC ocupe el tercer lugar en el escalafón mundial de mortalidad y el quinto en incapacidad5. La Organización Mundial de la Salud indica que en 2030 la EPOC seguirá siendo la causa del 7,8% de todos los fallecimientos y representará el 27% de las muertes relacionadas con el tabaco, sólo superada por el cáncer, con el 33%, y por las enfermedades cardiovasculares, con el 29%6. Este escenario está propiciando un enorme caudal investigador en el que se trata de conocer, entre otros elementos, las causas específicas de muerte, los diferentes factores pronósticos y el papel de las distintas intervenciones terapéuticas. Todos estos estudios aportan conocimiento, que puede contribuir a revertir la tendencia observada. No obstante, también introducen matices metodológicos que conviene conocer para poder interpretar de manera adecuada la información generada. El presente artículo trata de revisar y actualizar la información derivada de los estudios de mortalidad en la EPOC, evaluando su posible impacto clínico y revisando algunos aspectos metodológicos que en mayor o menor medida condicionan su interpretación. Con fines didácticos, el manuscrito se estructura en 3 apartados: a) estudios relativos al análisis de la causa específica de muerte; b) estudios de factores pronósticos, y c) estudios de intervención farmacológica.
Estudios de causa específica de mortalidad
Conocer el motivo específico que conduce a la muerte en los pacientes con EPOC es una premisa necesaria para tratar de identificar posibles dianas terapéuticas. Diversos estudios han revisado este aspecto y todos ellos coinciden en señalar la dificultad que supone especificar la causa última de muerte. Jensen et al7, sobre una población basal de 12.979 personas procedentes del Copenhagen City Heart Study, revisaron las causas de muerte de 6.709 sujetos, de los que 243 fallecieron con EPOC. Entre los pacientes fallecidos con EPOC muy grave (estadio IV de la clasificación GOLD), únicamente en el 21,7% figuraba la EPOC como causa principal de muerte en los correspondientes certificados de defunción, mientras que en el 54,5% no se mencionaba este diagnóstico. Por el contrario, en casi la mitad de los casos donde la EPOC constaba como causa de muerte, el paciente tenía un cociente entre el volumen espiratorio forzado en el primer segundo (FEV1) y la capacidad vital forzada dentro de la normalidad. Estos datos alertan sobre la escasa fiabilidad de los registros oficiales de mortalidad, un problema que es general para todas las enfermedades, pero que alcanza límites superlativos en la EPOC. Identificar la causa específica de muerte en la EPOC es especialmente dificultoso porque estos pacientes con frecuencia tienen otras enfermedades graves, cuya presentación final es a menudo similar a la EPOC, y porque además no hay una definición estandarizada que establezca cuándo la muerte se produce por EPOC o cuándo está relacionada con ésta. El estudio TORCH (Toward a Revolution in COPD Health)8 ha proporcionado recientemente una oportunidad para desarrollar y evaluar métodos de adjudicación de causa de muerte en estos pacientes. Este estudio es un ensayo clínico aleatorizado que comparó un agonista β2 de acción prolongada inhalado (salmeterol, 50 μg 2 veces al día), un corticoide inhalado (fluticasona, 500 μg 2 veces al día), la combinación de ambos en un dispositivo fijo (salmeterol/fluticasona, 50/500 μg 2 veces al día) y placebo, en pacientes con EPOC moderada-grave (FEV1 prebroncodilatador < 60% del valor teórico) durante un período de seguimiento de 3 años. Como variable principal se contempló por primera vez la mortalidad por todas las causas, y se consideró la mortalidad por causa específica como variable secundaria del estudio. Además, incorporó para el análisis un comité específico (Clinical Endpoint Committee [CEC]) formado por 3 miembros independientes. Con un total de 6.184 participantes en el estudio, se produjeron 911 muertes (14,7%) durante los 3 años de seguimiento. Únicamente en el 52% la causa específica de muerte establecida por el CEC coincidió con la indicada por los investigadores que participaron en cada uno de los 44 centros que intervinieron en el estudio. El grado de concordancia entre los miembros del CEC fue elevado, con un índice kappa para causa específica de muerte de 0,80 (intervalo de confianza [IC] del 95%, 0,71-0,89). La causa más frecuente de muerte fue la de origen respiratorio (35%), produciéndose aproximadamente el 75% de ellas después de una exacerbación. La muerte por neumonía se produjo en un 8% de los casos. Las muertes cardiovasculares ocurrieron en el 26% de los casos, y la muerte súbita fue la etiología más frecuente en este subgrupo (un 16% del total de fallecimientos). La mortalidad por cáncer supuso el 21% y aproximadamente las dos terceras partes correspondieron al cáncer de pulmón. En un 8% de los casos el CEC no pudo establecer la causa del fallecimiento.
Otros estudios, menos rigurosos metodológicamente a la hora de establecer la causa específica de muerte, han señalado que ésta puede cambiar en función del grado de obstrucción al flujo aéreo9,10. Por ejemplo, el Lung Health Study9 mostró cómo en pacientes con EPOC leve la principal causa de muerte era el cáncer, seguido de la mortalidad de origen cardiovascular. Recientemente se ha publicado el INSPIRE (Investigating New Standards for Prophylaxis in Reducing Exacerbations)11, un estudio aleatorizado en pacientes con EPOC grave e historia previa de exacerbaciones, donde se compara la capacidad para reducir las agudizaciones de 2 opciones farmacológicas para la EPOC: el tiotropio a dosis de 18 μg una vez al día, frente a salmeterol/fluticasona a dosis de 50/500 μg 2 veces al día. Como variable de seguridad los autores también analizaron la mortalidad por todas las causas, y se estableció un comité específico de seguridad. Con un total de 1.323 pacientes aleatorizados, se produjeron 59 fallecimientos (4,4%) durante un período de seguimiento de 2 años. Contrariamente a lo esperado, la principal causa de muerte en estos pacientes no fue de origen respiratorio (un 19% del total), sino la mortalidad de origen cardiovascular (el 51% del total). El 15% de los pacientes murió por cáncer y un 7% por infección.
El análisis conjunto de estos estudios señala variaciones en el motivo final de muerte dependiendo de las circunstancias específicas de la muestra analizada. Este hecho podría tener implicaciones metodológicas capaces de condicionar los resultados de diversas intervenciones. Por ejemplo, un determinado fármaco capaz de actuar en la mecánica respiratoria podría potencialmente mejorar la supervivencia en fases avanzadas de la enfermedad, mientras que este efecto tendría poco impacto en la supervivencia de los casos más leves. En pacientes con historia de exacerbaciones, los datos del estudio INSPIRE11 indican que la comorbilidad cardiovascular puede ser una diana terapéutica de primera magnitud. Esta idea se ha señalado en la reciente normativa GOLD5, donde se subraya el destacado papel que puede tener la comorbilidad tanto para la gravedad de la enfermedad como para su pronóstico. Mancini et al12, han señalado que la utilización combinada de determinados fármacos de la esfera cardiovascular, como los inhibidores de la angiotensina, los antagonistas del receptor de la angiotensina y las estatinas, puede reducir la mortalidad. Concretamente, la mortalidad por todas las causas se redujo un 58% al combinar estos fármacos (razón de riesgo [HR, de hazard ratio] = 0,42; IC del 95%, 0,33-0,52; p < 0,0001). Estos datos son observacionales y retrospectivos, por lo que deben interpretarse con precaución. No obstante, abren nuevas posibilidades y subrayan la importancia de la atención integral en la EPOC.
Factores pronósticos en la EPOC
La literatura médica sobre las variables que pueden condicionar el pronóstico en la EPOC es extensa y el lector puede acudir a distintas revisiones realizadas al respecto13,14. Este tipo de estudios se consideran estratégicos porque permiten identificar las posibles dianas terapéuticas. Entre los múltiples factores identificados, los datos actuales siguen señalando a la función pulmonar como uno de los principales dominios pronósticos. Sin embargo, la tolerancia al ejercicio15,16, las exacerbaciones17, la comorbilidad18 y las manifestaciones sistémicas19,20, especialmente las resultantes de la esfera cardiovascular, son nuevas dimensiones que en los últimos años se han revelado como potentes predictores de muerte. Actualmente no existe consenso para definir cuáles de todos estos factores pronósticos son los más relevantes y, por lo tanto, se desconoce cuál es la mejor aproximación terapéutica o sobre qué aspectos debemos priorizar la investigación.
La potencia de los programas estadísticos actuales ha contribuido a la proliferación e identificación de variables predictoras de mortalidad. Sin embargo, las técnicas estadísticas multivariadas están sujetas a algunos condicionantes metodológicos que pueden limitar los resultados. Interacción y confusión son 2 conceptos básicos en los modelos multivariados de regresión. Existe interacción cuando la asociación entre 2 variables varía según el valor (diferentes niveles) de otra u otras variables, mientras que se producirá confusión cuando la asociación entre 2 variables difiere de forma significativa según se considere, o no, una tercera variable, que comúnmente se denomina "variable de confusión". Este último aspecto está sujeto potencialmente al sesgo de no consideración. Por ejemplo, la medida que mejor refleja la limitación al flujo aéreo, principal característica de la EPOC, es el FEV1, y por lo tanto no es de extrañar que múltiples estudios hayan demostrado que tanto los valores basales del FEV1 como su descenso anual son poderosos predictores de mortalidad y también de morbilidad21-23. Sin embargo, cuando se revisan las variables incluidas en alguno de los estudios de referencia que avalan este marcador pronóstico21, se advierte que relevantes variables de confusión, como la comorbilidad, las exacerbaciones o el atrapamiento aéreo, no se contemplan. Recientemente Gunen et al24, en una cohorte retrospectiva de pacientes con EPOC dados de alta tras una hospitalización, en quienes se consideraban, entre otros, la comorbilidad, algunas manifestaciones extrapulmonares o las propias exacerbaciones, no encontraron que el FEV1% fuera predictor independiente de mortalidad. Del mismo modo, Casanova et al25 han señalado que la hiperinsuflación pulmonar, evaluada mediante el cociente entre la capacidad inspiratoria y la capacidad pulmonar total, puede ser una variable pronóstica relevante, independiente incluso de escalas multidimensionales como el índice BODE26. Sin embargo, de nuevo los autores no analizaron las exacerbaciones como potencial variable de confusión. En los estudios que recogen la influencia pronóstica de las agudizaciones tampoco se realizan ajustes por atrapamiento aéreo17. Todos estos condicionantes invitan a pensar que el estudio "ideal" donde se examinen todos los factores pronósticos relevantes, de forma simultánea y con suficiente potencia estadística, está por realizar. Hasta entonces, será difícil señalar cuál de todas las potenciales dianas terapéuticas es la más relevante para el objetivo final de reducir la mortalidad. De momento los objetivos más frecuentemente recogidos en la literatura médica son: a) frenar la caída del FEV1; b) reducir el atrapamiento aéreo; c) disminuir el número y la gravedad de las exacerbaciones; d) actuar de forma integral sobre las distintas comorbilidades, y e) prevenir y tratar las manifestaciones sistémicas de la enfermedad.
Estudios de intervención farmacológica
Desde el punto de vista etiopatogénico, hay 2 enfoques farmacológicos capaces, al menos en potencia, de influir en la mortalidad de la EPOC: uno se fundamenta en el tratamiento antiinflamatorio, hipotéticamente capaz de reducir la progresión de la enfermedad, disminuir las exacerbaciones y/o actuar sobre la comorbilidad, y el otro, más mecanicista, se sustenta en la mejora del grado de obstrucción, el atrapamiento aéreo, la tolerancia al ejercicio y/o la disminución de las exacerbaciones como elementos claves para prolongar la supervivencia. Ambos enfoques no se consideran excluyentes y, de hecho, el tratamiento combinado con agonistas β2 de acción prolongada (ABAP) y corticoides inhalados (CI) representa un enfoque pragmático del problema. No obstante, las estrategias son conceptualmente diferentes y quizá por ello están generando controversia, que casi siempre camina paralela a la discusión de determinados matices metodológicos.
Estudios observacionales
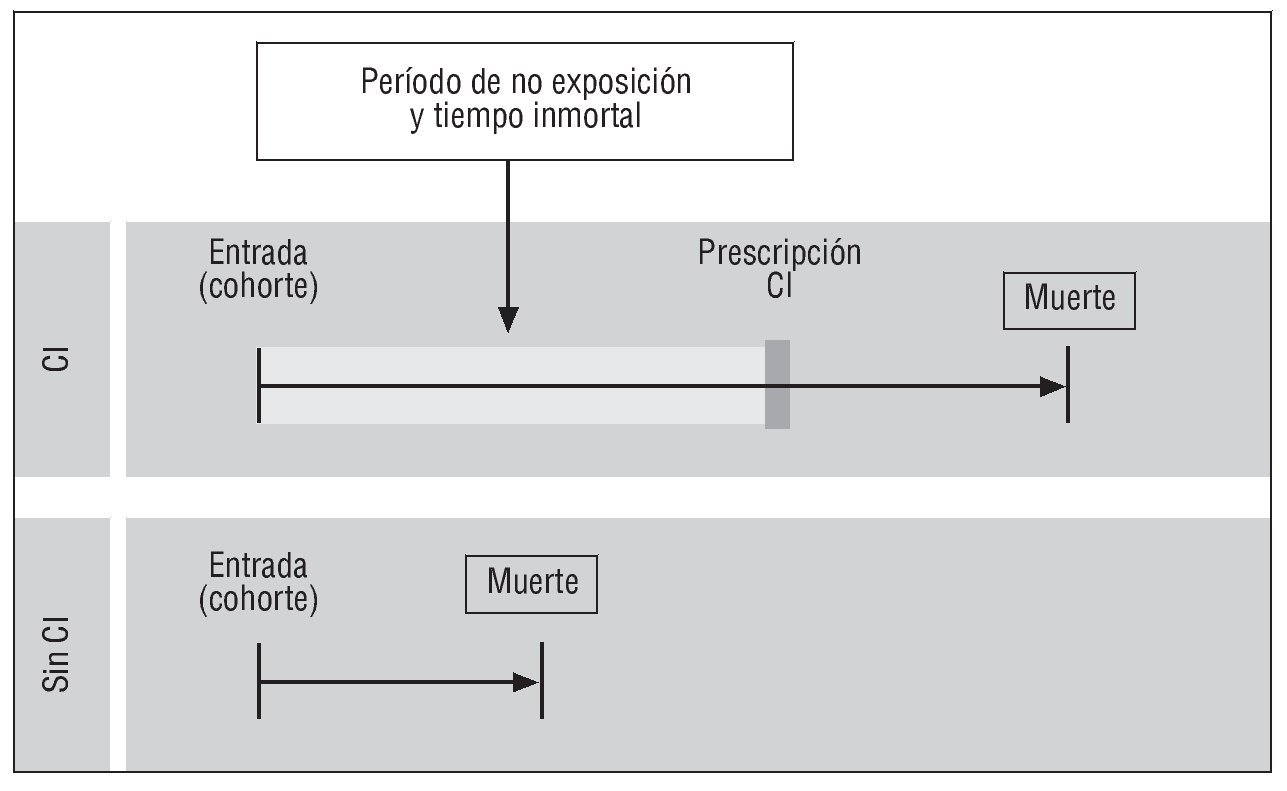
De todas las intervenciones farmacológicas posibles, los CI, solos o en combinación con ABAP, han sido los fármacos más analizados. La mayoría de los estudios han descrito un descenso del riesgo relativo de mortalidad por todas las causas entre los pacientes en tratamiento con CI, descenso que oscila entre el 16 y el 54%, y un beneficio adicional cuando los CI se asocian a ABAP, que varía entre el 35 y el 66%27-33. Estos resultados potencialmente justificarían el empleo del tratamiento antiinflamatorio para prolongar la supervivencia de la EPOC. Sin embargo, existe controversia sobre todo por lo que respecta a la presencia o ausencia del denominado "sesgo de tiempo inmortal". El tiempo de no exposición o tiempo inmortal se refiere a un período de seguimiento durante el cual el evento -en este caso, la muerte- no puede ocurrir y, sin embargo, el tiempo transcurrido se computa como tiempo de supervivencia (fig. 1). Diversos autores han discutido la presencia o ausencia de este sesgo en estudios observacionales29,34,35. Sin y Tu27 evaluaron a una cohorte de 22.000 pacientes seguidos durante un año después de haber sido hospitalizados por exacerbación de EPOC. Los pacientes se clasificaron como expuestos a CI si durante los primeros 90 días tras la hospitalización los recibían. Sin embargo, se consideró "inicio del estudio" el alta hospitalaria, por lo que el tiempo transcurrido entre la entrada en el estudio y el comienzo de la administración de los CI se imputó como tiempo de supervivencia en el grupo de CI, aunque el paciente no recibiera tratamiento (tiempo de no exposición o tiempo inmortal). El estudio concluyó con una reducción del 29% en la mortalidad por todas las causas (HR = 0,71; IC del 95%, 0,65-0,78). Este resultado propició una serie de artículos de opinión a favor y en contra de la presencia del sesgo de tiempo inmortal, fenómeno que también se ha descrito en estudios observacionales que describen un potencial beneficio del tratamiento combinado (CI/ABAP) sobre la mortalidad de la EPOC31. En contestación a las críticas derivadas de la potencial presencia del sesgo de tiempo inmortal, Kiri et al29 evaluaron los efectos de los CI sobre la mortalidad comparando 2 series que, según los autores, no presentaban este sesgo. En la primera, donde se evaluó a una cohorte de 786 pacientes sin tiempo de espera, se encontró una reducción significativa del riesgo en el grupo que utilizó CI (HR = 0,69; IC del 95%, 0,52-0,93). Un segundo análisis del tipo casos y controles con 2.222 pacientes sin sesgo de tiempo inmortal ofreció resultados similares, con una HR de 0,71 (IC del 95%, 0,56-0,90). Este doble planteamiento metodológico también se ha criticado36, por lo que la controversia continúa. Como solución se plantea contemplar estudios donde la exposición al fármaco coincida con el inicio del período de observación.
Fig. 1. Representación esquemática del sesgo de tiempo inmortal en pacientes expuestos o no al tratamiento con corticoides inhalados (CI) en estudios observacionales. El tiempo entre la entrada en la cohorte y la primera prescripción de CI es un tiempo inmortal puesto que el sujeto debe sobrevivir para poder así recibir el fármaco. Esto genera un sesgo al imputar ese tiempo de no exposición como tiempo de supervivencia en el grupo expuesto a CI. (Tomada y modificada de Suissa34.)
Metaanálisis de ensayos clínicos
Hasta hace poco los ensayos clínicos que evaluaban el papel de los CI en la EPOC no tenían suficiente potencia para estudiar la mortalidad. Individualmente estos ensayos fueron incapaces de detectar diferencias en mortalidad por todas las causas frente a placebo. Recientemente el estudio ISEEC (Inhaled Steroid Effects Evaluation in COPD)37 ha revisado de nuevo el tema obteniendo datos individuales procedentes de 7 ensayos clínicos donde se utilizaron CI con un período de seguimiento de al menos 12 meses. Cuatro de ellos evaluaron el papel de los CI en monoterapia y otros 3 incluían la combinación de CI y ABAP. Los autores del metaanálisis encontraron una reducción significativa del riesgo relativo de muerte del 27% (HR = 0,73; IC del 95%, 0,55-0,96), con una disminución del riesgo absoluto del 1% y un número de pacientes que era necesario tratar para evitar una muerte de 50.
La ventaja de este tipo de análisis reside en poder analizar de forma conjunta la mortalidad a partir de datos individuales en los que claramente coincide la administración del fármaco con el inicio del período de seguimiento, con lo que se evitan el sesgo de tiempo inmortal. Sin embargo, la principal limitación estriba en la ausencia de un seguimiento adecuado tras la retirada del estudio, por lo que la exactitud de los datos de mortalidad de los abandonos no puede garantizarse35. La solución pasaría, por lo tanto, por realizar ensayos clínicos capaces de comparar la mortalidad por todas las causas de las distintas intervenciones mediante un análisis por intención de tratar y con seguimiento exhaustivo de los abandonos.
Ensayos clínicos
Hasta la fecha el único ensayo clínico específicamente diseñado para comparar la eficacia de un fármaco en la mortalidad por todas las causas en la EPOC ha sido el estudio TORCH38. Este estudio, ya comentado, cumple con varios de los requisitos metodológicos citados con anterioridad. Contempla como variable principal la mortalidad por todas las causas y como variable secundaria, la mortalidad por causa específica. Además, establece un comité específico para revisar las causas de muerte y realiza un seguimiento exhaustivo de todos los pacientes, analizando los datos de supervivencia por intención de tratar. Finalmente, por motivos de seguridad, el estudio incorpora 2 evaluaciones intermedias o interinas, por lo que el resultado final tuvo que ser ajustado. El análisis de supervivencia se realizó mediante la prueba de rangos logarítmicos estratificada por tabaquismo, y se efectuó un análisis estadístico secundario de refuerzo mediante la aplicación del modelo de regresión logística de Cox con la intención de ajustar los resultados por diversas variables de confusión.
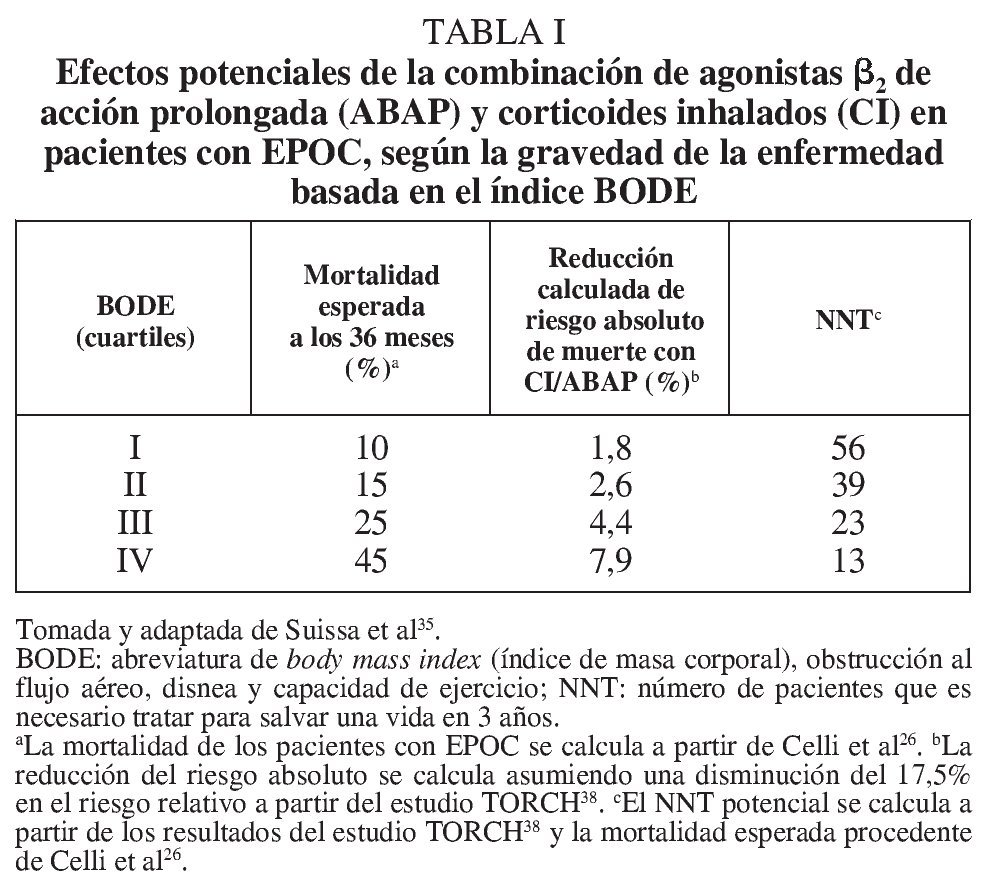
A diferencia de lo señalado por los estudios observacionales y el metaanálisis de Sin et al37, el estudio TORCH no mostró diferencias significativas en la mortalidad a los 3 años para el grupo que recibió fluticasona en monoterapia frente a placebo (riesgo relativo = 1,06; IC del 95%, 0,89-1,27). Sin embargo, el objetivo principal del estudio no fue evaluar este aspecto, sino comparar la mortalidad del grupo que recibió salmeterol/fluticasona (SFC) frente a placebo, y aquí se encontró una reducción no significativa del riesgo relativo de muerte del 17,5% (HR = 0,825; IC del 95%, 0,681-1,002)38. Este dato ha abierto un fuerte debate entre aquellos que rechazan el beneficio del fármaco y otros que aprecian una tendencia a la mejoría, aunque quizá de menor magnitud de la esperada. Entre los argumentos a favor se cita la presencia de unos criterios de inclusión demasiado restrictivos, que potencialmente podrían limitar el beneficio en una población menos seleccionada y más próxima a la práctica clínica. De hecho, los autores excluyeron los casos con reversibilidad significativa tras broncodilatador en un intento de incluir a pacientes exclusivamente con EPOC. La reversibilidad al broncodilatador se había interpretado previamente como un cierto componente asmatiforme y, por lo tanto, como un indicador de mejor respuesta a los CI. Sin embargo, estudios recientes indican que la respuesta al broncodilatador no sólo no está presente entre los pacientes con EPOC, sino que además es muy variable a lo largo del tiempo en un mismo individuo39. En segundo lugar se ha señalado la existencia de una tasa de abandonos cercana al 40%. Estos abandonos se han descrito en otros estudios de larga duración y ciertamente son un problema metodológico que condiciona la interpretación de los resultados. En el estudio TORCH la tasa de abandonos fue significativamente superior en el grupo que recibió placebo frente al que recibió tratamiento combinado (el 34 frente al 44%)38. Las retiradas del estudio pueden producirse esencialmente por efectos secundarios del fármaco o bien por efectos beneficiosos de éste. El análisis categorizado de los motivos de abandono indica que las exacerbaciones y la insatisfacción del paciente con el tratamiento fueron las principales causas de retirada, por lo que se señala que este aspecto debe contemplarse como marcador indirecto de beneficio40. En tercer lugar, se ha apuntado que el análisis por intención de tratar, necesario desde el punto de vista metodológico, también puede penalizar el estudio por cuanto los pacientes que se retiran del grupo placebo pueden recibir cualquier tipo de medicación, incluso la que es motivo de estudio. Finalmente, el análisis estadístico principal (test de rangos logarítmicos) se acompañó de un análisis secundario multivariado en que se empleó el modelo de regresión de Cox. Este segundo estudio, en el que pueden ajustarse los resultados en función de diversas variables de confusión, sí mostró diferencias significativas entre el grupo de SFC y el placebo (HR = 0,811; IC del 95%, 0,670-0,982; p = 0,03)38. Todos estos aspectos apoyan la existencia de un potencial beneficio, aunque quizá éste no se produzca en todos los pacientes. Suissa et al35, que han proyectado el efecto potencial de la combinación de SFC en función de la gravedad de la EPOC evaluada mediante el índice BODE, han apuntado que el beneficio puede ser mayor a medida que aumenta la gravedad de la enfermedad (tabla I).
Entre los autores que no aceptan el beneficio de la intervención, la ausencia de significación estadística y la falta de efecto del grupo de fluticasona son los principales argumentos. Los pacientes aleatorizados al grupo que recibió CI en monoterapia no sólo no mostraron beneficios en la supervivencia, sino que además presentaron una mayor tasa de neumonías, un hallazgo que en la actualidad están siendo motivo de investigación. Este hecho ha contribuido a plantear si realmente el beneficio potencial de la intervención es debido al efecto broncodilatador del ABAP y no tanto al efecto antiinflamatorio del CI. Con la intención de evaluar esta hipótesis, La Vecchia y Fabbri41 realizaron un análisis factorial 2 × 2. Este tipo de análisis asume que cada tratamiento tiene el mismo efecto aditivo en ausencia y presencia de otro tratamiento, de tal suerte que a partir de los 4 grupos del estudio estos autores pudieron analizar por separado a los pacientes que habían recibido salmeterol y a los que recibieron fluticasona. En el grupo que recibió salmeterol se observó una reducción del riesgo relativo de muerte del 19% (HR = 0,81; IC del 95%, 0,70-0,94; p = 0,004). Por el contrario, el grupo que había recibido CI no mostró ningún beneficio (HR = 1,00; IC del 95%, 0,87-1,15; p = 0,99). Estos datos apoyarían la teoría mecanicista, según la cual el beneficio en la supervivencia guardaría relación con la mejora en la mecánica pulmonar del broncodilatador de acción prolongada y no tanto con el efecto antiinflamatorio del CI. Sin embargo, como hemos comentado anteriormente, el análisis factorial asume que el tratamiento combinado puede analizarse por separado. Esto es cuestionable, porque combinar un ABAP y CI ha demostrado beneficios sinérgicos tanto en la función pulmonar como en la calidad de vida, la tolerancia al ejercicio o las exacerbaciones38,42-44. Aceptar esta sinergia desautorizaría el análisis factorial, por lo que se mantiene la discusión sobre si el beneficio observado es debido al broncodilatador o al tratamiento antiinflamatorio.
Recientemente Wedzicha et al11 han presentado un ensayo clínico donde se compara el efecto del tratamiento combinado con SFC frente a tiotropio en pacientes con EPOC grave o muy grave e historia de exacerbaciones previas. El objetivo principal del estudio era comparar el efecto sobre la tasa global de exacerbaciones, sin que se apreciaran diferencias significativas entre ambos fármacos. Curiosamente, los pacientes que recibieron SFC presentaron menor número de exacerbaciones tratadas con corticoides sistémicos, mientras que los que recibieron tiotropio presentaron menos exacerbaciones tratadas con antibióticos, lo que indicaría que es posible que no todas las agudizaciones tengan un mismo perfil fisiopatológico. El estudio también añade como variable terciaria un análisis de supervivencia. Sorprendentemente, los autores encuentran una reducción del riesgo relativo del 52% en el grupo que recibió tratamiento combinado (HR = 0,476; IC del 95%, 0,267-0,848; p = 0,012). En el grupo de SFC se produjeron en total 21 fallecimientos (3,2%), mientras que en el grupo de tiotropio hubo 38 (5,7%), lo que supone una reducción del 2,5% en el riesgo absoluto de muerte. Estos resultados potencialmente abren nuevas hipótesis. Sin embargo, la interpretación definitiva debe ser muy cautelosa, puesto que metodológicamente existen varias limitaciones. En primer lugar, el estudio no tenía potencia para estudiar la mortalidad, ya que ésta era una variable terciaria y, por lo tanto, no pueden descartarse definitivamente desequilibrios entre los grupos comparados. En segundo lugar, el estudio, aunque realiza un análisis por intención de tratar para las exacerbaciones, no lo hace para la mortalidad y, por consiguiente, no evita el sesgo de seguimiento incompleto. Finalmente, el análisis de supervivencia difiere del estudio TORCH al no plantear un ajuste por los análisis interinos realizados ni llevar a cabo una comparación mediante el test de rangos logarítmicos, empleando únicamente el modelo multivariado de Cox, ajustado en esta ocasión por abandonos.
En la actualidad se está a la espera de los resultados de otro estudio que también ha despertado muchas expectativas: el UPLIFT (Understanding the Potentital Long-term Impacts on Function with Tiotropium)45. Este estudio evalúa el papel del tiotropio en la pendiente de caída del FEV1 durante 4 años en cerca de 6.000 pacientes con EPOC y FEV1 inferior al 70% del valor teórico tras broncodilatador. Como variable secundaria, también pretende conocer la mortalidad por todas las causas. Los resultados se esperan para el último trimestre de 2008, pero a buen seguro contribuirán a mantener el debate científico, que es absolutamente deseable y necesario para seguir avanzando.
Conclusiones
Durante los últimos años se ha acumulado un número considerable de estudios de mortalidad en la EPOC, gracias a los cuales hemos pasado de mantener una posición nihilista a encarar el futuro con un moderado optimismo. A medida que se han ido planteando estudios, hemos incorporado aspectos metodológicos capaces de perfilar mejor nuestro conocimiento. Los estudios que revisan la causa específica de muerte nos han enseñado la dificultad que entraña precisarla y como puede diferir en función de la gravedad basal de la enfermedad. La comorbilidad, especialmente la cardiovascular, y las neoplasias se han destapado como causas frecuentes de mortalidad, lo que obliga a enfocar el problema desde una óptica integral. Los estudios de factores pronósticos nos han permitido identificar una serie de potenciales dianas terapéuticas, como la reducción de las exacerbaciones, el atrapamiento aéreo o la capacidad de ejercicio. No obstante, metodológicamente necesitamos considerar de forma adecuada las variables de confusión y las posibles interacciones. Por último, los estudios de intervención farmacológica nos han permitido saber más sobre el sesgo de tiempo inmortal o el análisis por intención de tratar. De estos estudios puede inferirse que los CI empleados en monoterapia no son útiles para modificar la historia natural de la enfermedad. Sin embargo, su combinación con ABAP parece tener un efecto suplementario, que, si bien no muestra diferencias significativas en cuanto a la mortalidad frente placebo, sí apunta a una mejoría para determinados pacientes. Este hecho, lejos de la controversia metodológica que pueda plantear, se antoja un paso fundamental en la estrategia terapéutica de la EPOC, ya que permite mantener la esperanza de conseguir más vida y de mejor calidad. El estudio UPLIFT a buen seguro contribuirá a mantener esa ilusión, fomentando en última instancia la formulación de nuevos interrogantes, siempre necesarios para el progreso de la medicina.
Declaración de conflicto de intereses
Los autores han declarado tener los siguientes conflictos de intereses:
J.J. Soler-Cataluña ha recibido ayudas a la investigación en los últimos 5 años por parte de Almirall, AstraZeneca, Boehringer-Ingelheim, Dr. Esteve, Gasmedi 2000, GlaxoSmithKline, FAES, Merck Sharp & Dohme y Pfizer. También ha participado como asesor científico para AstraZeneca y Novartis. También ha recibido honorarios por ponencias de Almirall, AstraZeneca, Bayer Schering Pharma, Boehringer-Ingelheim, Esteve, GlaxoSmith-Kline, Merck Sharp & Dohme y Pfizer.
M.A. Martínez García ha recibido ayudas a la investigación en los últimos 5 años por parte de Almirall, Astra-Zeneca, Boehringer-Ingelheim, Dr. Esteve, Gasmedi 2000, GlaxoSmithKline, FAES, Merck Sharp & Dohme y Pfizer. También ha recibido honorarios por ponencias de AstraZeneca, Bayer Schering Pharma, Boehringer-Ingelheim, Chiesi, Dr. Esteve, Gasmedi 2000, Glaxo-SmithKline, Merck Sharp & Dohme y Pfizer.
Correspondencia:
Dr. J.J. Soler Cataluña.
Unidad de Neumología. Servicio de Medicina Interna. Hospital General de Requena. Paraje Casablanca, s/n. 46340 Requena. Valencia. España.
Correo electrónico: jjsoler@telefonica.net